Сера применяется в производстве спичек пороха в борьбе с вредителями
Добавил пользователь Дмитрий К. Обновлено: 18.09.2024
Порох и спичечная сера — многокомпонентные горючие смеси, легко воспламеняющиеся, но предназначенные для разных целей.
Любознательные люди наверняка задавались вопросом, а можно ли заменить порох в патроне на зажигательную смесь от спички? Произойдет ли выстрел?
Такой разных порох
В современном унитарном патроне используется нитроцеллюлозный (бездымный) порох, который пришел на смену чёрному (дымному) пороху (применялся в оружии до конца XIX века )
Сейчас будет немного химии. В основе бездымного пороха лежат нитраты целлюлозы с различным содержанием азота.
Их получают из растительной клетчатки (как правило, из хлопковой целлюлозы) с помощью обработки нитрирующей смесью (азотной и серной кислотой в определенных пропорциях). В дальнейшем их переводят в коллоидное состояние при помощи растворителей.
Сортов такого взрывчатого вещества довольно много. В большинстве патронов для ручного огнестрельного оружия используется сорт пироксилинового пороха. Считается, у него достаточная мощность, хорошая устойчивость к механическим и тепловым импульсам, он равномерно и предсказуемо горит, меньше засоряет ствольную коробку оружия и, наконец, экономически выгоднее других сортов.
Конечно, есть альтернатива — нитроглицериновый порох. Он отличается способом перевода в коллоидное состояние. В нитроцеллюлозном порохе в качестве растворителей используются смеси этилового эфира и этилового спирта. В нитроглицериновом — нитроглицерин или нитрогликоль.
Не углубляясь в состав, разновидности и другие подробности подытожим, что это специально разработанные для патронов взрывчатые вещества, обладающий всеми необходимыми для боевого оружия свойствами.
Непростая сера
Маленькая, невзрачная, заурядная спичка, на самом деле, является шедевром научной мысли, прочно вошедшей в жизнь европейцев только к середине XIX века.
Серная головка являет собой взвесь порошкообразных веществ в растворе клея.
46% порошка — это бертолетова соль (отдает кислород при высокой температуре), 15% — свинцовый сурик, 11% — костный клей (топливо), 17% молотого стекла (для управления скорости горения), немного парафина (именно он переносит пламя на спичечную палочку) и некоторые другие компоненты.
Понятное дело, использовать спичечные головки в качестве заряда для патронов никто не предусматривал.
Будет выстрел или нет?
Минусы — спичечные головки обладают куда меньшей мощностью, не стабильны, подвержены коррозии и очень сильно засоряют канал ствола оружия.
Кто и когда открыл серу? Сера широко распространена в природе и человеку известна с древнейших времен. Однако серу как химический элемент первым охарактеризовал французский химик Антуан Лоран Лавуазье: сжигая вещества, он обнаружил выделение газа; как мы теперь знаем, это был сернистый газ. Позже Лавуазье изучил свойства и природу химического элемента, породившего газ. Сегодня нам известно, что атомы серы обладают уникальной способностью формировать устойчивые цепи, которые достигают большой длины или, наоборот, смыкаются в кольца. Поэтому у серы есть несколько десятков как кристаллических, так и аморфных модификаций, отличающихся формой цепей и способом их упаковки. При нормальном давлении и температуре до 98,38°C стабильна альфа-модификация серы, образующая лимонно-желтые кристаллы. Аморфную серу и резиноподобную пластическую серу получают при резком охлаждении расплава серы, выливая его в холодную воду. Эти модификации состоят из нерегулярных зигзагообразных цепей. Длительное выдерживание при температуре 20—95°C превращает все модификации серы в альфа-серу.
Почему сера служит символом нечистой силы? Сера во все времена не случайно ассоциировалась у людей с подземной жизнью: горячие потоки расплавленной серы вытекают из кратеров вулканов, а ее желтые кристаллы осаждаются в местах выходов вулканических газов — фумаролах, причем в воздухе вокруг разлит неприятный аромат серы и ее соединений, прежде всего сероводорода. Сероводород выделяется и еще в одном страшном для человека месте — болоте. Кроме того, в древности курения с серой использовали жрецы при проведении различных обрядов. Бытовали верования, что сера создана сверхчеловеческими существами мира духов и что подземные боги в виде серного дыма возникают среди людей и манипулируют ими.
Как серу используют в сельском хозяйстве? На борьбу с вредителями сельскохозяйственных культур (главным образом винограда и хлопчатника) идет 10—15% годовой добычи серы. А применяют ее в этом качестве с древнейших времен. Это и окуривание садов серным дымом, и опрыскивание коллоидной серой. Используют также медный купорос в виде чистого раствора или в смеси с известью (так называемую бордоскую жидкость). Серу вводят в почву вместе с фосфоритной мукой. Почвенные бактерии окисляют ее, образующиеся серная и сернистая кислоты реагируют с фосфоритами, и получаются фосфорные соединения, хорошо усваиваемые растениями.
Как сера может побороть ртуть? Ртуть из-за своей летучести — опасное для здоровья человека вещество, однако в некоторых приборах без нее не обойтись. Поэтому иногда ртуть оказывается на открытом воздухе, например вытекая из разбитого ртутного градусника. Сотрудники МЧС первым делом собирают крупные шарики ртути, а те места, из которых маленькие серебристые капли не извлекаются, засыпают порошкообразной серой. Между серой и ртутью проходит реакция, и образуется кирпично-красная киноварь — сульфид ртути. Это соединение совершенно безопасно для человека.
Зачем организму нужна сера? Сера играет одну из важнейших ролей в организме человека, это незаменимый элемент, входящий в состав аминокислот — метионина и цистеина, а стало быть, и многих белков. Остатки цистеина образуют дисульфидные мостики между участками белковых цепочек, скрепляя их вместе, — это важный элемент трехмерной структуры белка.
Много серы в хрящевой, костной и нервной тканях, в ногтях, коже и волосах, всего же в теле человека содержится около полутора килограммов серы, а дневная потребность — 4 грамма. Лучшей усвояемости серы способствуют соединения железа и фтора, а ухудшают ее усвоение такие элементы, как селен, барий, молибден, свинец и мышьяк. Сера присутствует в любых растениях и животных (в морских обитателях ее больше). Поэтому при гниении выделяются неприятные запахи — это выходят содержащие серу газы, сероводород и меркаптаны. Именно из-за того, что эти газы — индикатор опасного для здоровья процесса гниения, их запах и стал для человека столь мерзким.
Почему лук вызывает слезы? Когда мы берем обычный нож и надрезаем луковицу, то тем самым нарушаем целостность луковых клеток. В итоге вещества, хранящиеся в различных клетках и отличающиеся по составу, смешиваются, между ними идет реакция, и получается содержащий серу луковый газ — 1-сульфинилпропан, C3H6SO. Именно этот газ и вызывает слезы, но не только. Когда луковый газ смешивается со слезами, образуется жгучая серная кислота. А жжение еще сильнее стимулирует слезотечение. Получается замкнутый круг, разрушить который может либо прекращение выделения лукового газа, либо прекращение выделения слез. Впрочем, слезы от лука приносят организму пользу: они обладают бактерицидными свойствами.
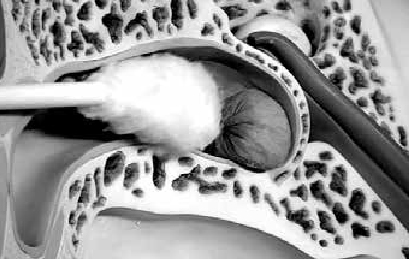
Зачем сера в ушах? Многие думают, что ушная сера — это грязь, но такое мнение ошибочно: сера защищает кожу слухового прохода от повреждений и загрязнений. Однако порой серы скапливается слишком много, и получается серная пробка, из-за которой человек плохо слышит внешние звуки, но хорошо — внутренние: в голове возникает постоянный шум. Из чего состоит эта пробка? Помимо серы в ней есть вырабатываемые железами жиры и белки, слущенный эпителий, чешуйки кератина, ферменты, иммуноглобулины, холестерин. Получается густое липкое вещество, обладающее защитной функцией. Многие стараются чистить слуховые проходы от серы ватными палочками, что не очень правильно. Двигаясь в узком пространстве, ватная палочка только сдвигает скопления серы к барабанной перепонке и утрамбовывает их, а это лишь способствует образованию пробки. Для удаления пробки ее нужно размягчить, а затем промыть с помощью специального шприца. Лучше всего это сделает врач.
Как серу применяют в медицине? Сера входит в арсенал медиков с незапамятных времен: ее пламенем издавна окуривали больных для дезинфекции, ее включали в состав различных мазей для лечения кожных заболеваний. И ныне серные аппликации и другие виды компрессов наносят на кожу, чтобы лечить псориаз, экзему, перхоть, фолликулит (инфицированные волосяные фолликулы), бородавки, разноцветный лишай. Исследования в Израиле, где серосодержащую грязь добывают из Мертвого моря, показали, что такая бальнеотерапия может помочь в лечении различных видов артрита, включая остеоартроз, ревматоидный артрит и псориатический артрит. Люди, которые принимали серные ванны и использовали другие подобные методы лечения, чувствовали меньшую скованность по утрам, лучше ходили, у них уменьшались воспалительные процессы, отеки и боль в суставах, особенно в шее и спине. Грязи и соли Мертвого моря, растворенные в обычной ванне, также снижали симптомы артрита, но не так эффективно, как отдых на самом Мертвом море.
Одно из соединений серы — диметилсульфоксид — предложили как средство от боли и воспаления при опоясывающем лишае, но для точного понимания механизма действия требуются дополнительные исследования. Медики также полагают, что диметилсульфоксид хорош при лечении интерстициального цистита, хронического воспаления мочевого пузыря; врач вводит жидкий раствор препарата непосредственно в этот орган, а также в составе мазей — для увеличения переноса действующих веществ сквозь кожу.
Зачем нужны серобактерии? Серобактерии осуществляют круговорот серы в природе. Они разделяются на две группы: бесцветные хемосинтетики и пурпурные, способные к фотосинтезу. В естественных условиях серобактерии находятся в тех местах, где сероводород образуется постоянно и где есть свободное поступление кислорода. Например, в Черном море слой серобактерий располагается на глубине около 200 метров.

Окисление сероводорода и других восстановленных форм серы у таких бактерий может происходить в два этапа. Вначале они окисляют его до элементарной серы, которая отлагается либо снаружи, либо в протоплазме клеток и используется в качестве запасного энергетического материала. Затем, если в среде не хватает сероводорода, постепенно окисляется и запасенная сера. В результате образуется серная кислота. Частично ее нейтрализуют клеточные бикарбонаты, и тогда наружу выходят сернокислые соли. Однако часть кислоты может выходить в чистом виде; она закисляет почву и делает ее непригодной для жизни растений. Бактерии способны превратить в поток кислоты целую реку, как, например, Рио-Тинто в Испании (см. фото).
Метод окисления сероводорода до элементарной серы был впервые разработан в Великобритании, где значительные количества серы научились получать из сульфида кальция — отхода производства соды по методу Леблана. Очищая природный газ от сероводорода, также получают элементарную серу. Теперь, когда все заботятся о качестве воздуха, во многих странах растет производство технической серы как побочного продукта переработки и очистки нефти, природных и топочных газов. Сегодня газовая и нефтяная сера составляет примерно 60%, а получают ее практически на всех нефте- и газоперерабатывающих заводах.
Так как современная техника нуждается в сере высокой чистоты, разработаны эффективные методы ее рафинирования. При этом используют, в частности, различия в химическом поведении серы и примесей. Так, мышьяк и селен удаляют, обработав серу смесью азотной и серной кислот.

Добывают серу и из вулканов. Например, на острове Итуруп сохранились развалины японского предприятия по извлечению серы из склонов вулканов. В восточной части острова Ява есть удивительное по красоте, но очень опасное место — вулкан Кавах Иджен. Вулкан находится на высоте около 2400 метров над уровнем моря, диаметр его кратера 175 метров, а глубина — 212 метров. В жерле расположено странное и пугающее озеро прекрасного яблочно-изумрудного цвета: оно заполнено раствором серной и соляной кислот объемом 40 млн. тонн, берега же усыпаны чистой серой. И озеро, и сам кратер используют не только для привлечения туристов, но и для сбора этого вещества. В одном из кратеров вулкана ночью видно синее пламя: это горит сернистый газ. Часть газа конденсируется, и образуются сталактиты из чистой серы, которые продают туристам как сувениры.
Как готовят серу для применения? Сера, независимо от ее вида, трудно совмещается с другими веществами и плохо растворяется в большинстве растворителей. Поэтому готовят ее препаративные формы: смачивающиеся водой либо смеси серы с углеводородными партнерами для совмещения с гидрофобными материалами. Наибольшее применение получили 80%-ные и 90%-ные смачивающиеся порошки. Их получают измельчением серы в среде диспергатора и смачивателя с последующей сушкой суспензии распылением в потоке инертного газа. Такую серу легко наносить распылителем, что и делают в сельском и лесном хозяйстве для защиты растений от вредителей. Гидрофобные формы применяют для вулканизации — такой порошок лучше смешивается с углеводородами.
Готовят и более сложные препарированные формы, в которых сера взаимодействует с компонентами не только физически, но и химически. Примером может служить расплав серы в смеси высокомолекулярных полиизобутилена и полиэтилена с добавкой малорастворимого эмульгатора. При нанесении препарата тонким слоем образуется покрытие, сочетающее бактерицидные свойства серы и липкость углеводородного полимерного слоя — это развитие известных в фармацевтической и ветеринарной практике средств. Новые возможности применения серы открывает препарирование ее полиолефинами, в частности полиэтиленом.
Такая форма улучшит эластичность резиновой кровли или может служить бактерицидной добавкой в составе пропитывающих растворов для защиты древесных материалов.
Что такое вулканизация? В 1844 году американский изобретатель Чарльз Гудьир запатентовал процесс, с помощью которого каучук превращается в гораздо более прочную резину. Суть его в том, что отдельные молекулы каучука сшивают сетку с помощью серных мостиков.
Зачем сера в порохе? Она цементирует крупинки пороха, а кроме того, возгораясь при меньшей температуре, нежели уголь, облегчает процесс горения.

Как серу применяют в современной промышленности? За год в мире добывают около 40 млн. тонн серы. Около половины ее идет на производство серной кислоты, четверть — на производство сульфитов, примерно 10% требуется резиновой промышленности для вулканизации. Серу применяют при производстве красителей и пигментов, взрывчатых веществ (она до сих пор входит в состав пороха), искусственных волокон, люминофоров, спичек. В целом же внешне непритязательный, давно известный элемент — сера остается необходимым людям, без ее использования не обходится производство огромного количества материалов.
Какой вред от серы? Основной источник загрязнения серой — сжигание каменного угля и других видов топлива, содержащих серу. При этом около 96% серы попадает в атмосферу в виде сернистого газа SO2. В атмосфере он постепенно окисляется до SO3. Оба оксида взаимодействуют с парами воды, образуя растворы кислот, которые выпадают в виде кислотных дождей. В результате создаются неблагоприятные условия для развития растительности, особенно в северных регионах, где химическое загрязнение добавляется к суровому климату: гибнут леса, нарушается травяной покров, ухудшается состояние водоемов. Кислотные дожди разрушают изготовленные из мрамора и других материалов памятники, ускоряют коррозию металлов. Поэтому приходится принимать разнообразные меры, чтобы предотвратить попадание соединений серы из топлива в атмосферу. Это очистка газа и бензина, а также отказ от угля на тепловых станциях, ведь концентрация серы в угле очень высока — 1—1,5%. Не все тут идет гладко. Так, до кризиса 2008 года в странах ЕС от угольных ТЭЦ быстро избавлялись, а после резкого подорожания газа опять стали использовать дешевый уголь. Серьезное загрязнение серой наблюдают в местах плавки цветных металлов, например меди и никеля, поскольку эти металлы получают обжигом серосодержащих руд. Защитники природы не раз упрекали никелевые комбинаты в Мончегорске и Норильске в отравлении окрестных лесов и тундры.
Как используют серные отходы? Поскольку растет производство серы как побочного продукта при переработке и очистке нефти, природных и топочных газов, возникает задача ее использования. Одна из важных идей — строительство зданий и дорог с применением серобетона, в котором сера играет роль вяжущего вещества, то есть заменяет цемент. Прочность в этом случае достигается не за счет химической реакции, а просто при затвердевании расплава, стало быть, такие материалы можно использовать несколько раз. Сегодня во многих странах из серобетона делают сваи, химически стойкие емкости, фундаменты и полы, а также дорожные покрытия. Так, Франция, Польша, Канада и США применяют серобетон в дорожном строительстве. Он долговечнее, крепче, а главное, дешевле обычного бетона и решает проблему утилизации многотоннажного отхода основного производства. Конструкции из серных бетонов можно армировать стеклопластиковыми деталями, стекловолокнами или стержнями растительного происхождения.
Изучение сероасфальтобетонов показывает: создав специализированные производства, можно рассчитывать на то, что ценные свойства серных стройматериалов проявят себя в полной мере — снизят затраты как на строительные работы, так и на эксплуатацию сооружений, а вложенные средства быстро окупятся.
Важная особенность серобетона — отсутствие в его составе калийсодержащих компонентов, которые всегда есть в цементном бетоне. Важно это потому, что калий-40 — основной источник естественного радиоактивного облучения. Здания, построенные из серобетона, излучают гораздо меньше, чем цементно-бетонные, и это важно при сооружении специальных объектов, где есть ограничения на уровень радиационного фона, например нейтринных обсерваторий.
Как с помощью серы можно изменить климат? Для борьбы с глобальным потеплением некоторые специалисты, например академик РАН Ю.А.Израэль, предлагают не сокращать выбросы парниковых газов, а создать в верхних слоях атмосферы экран для отражения света, что обойдется несравнимо дешевле. Оптимальна, по их мнению, сернокислотная аэрозоль. Не все в восторге от этого предложения, однако если иные средства не помогут, создание аэрозольного слоя может оказаться крайней мерой для стабилизации температуры планеты.

Сера – химический элемент и простое вещество

Сера – химический элемент главной подгруппы VI группы периодической системы элементов.
Кислород и сера – это элементы, которые входят в состав многих руд металлов.
Сера с древних времён использовалась жрецами храмов при проведении обрядов – она считалась произведением существ из мира духов.

Алхимики считали серу отцом всех металлов – и теперь мы с вами знаем причину: большинство металлических руд представляют собой именно сульфиды.
На внешнем электронном слое серы шесть электронов, из них два – неспаренных, поэтому сера может принимать два электрона, проявляя степень окисления –2, выступая окислителем.
Но за счёт распаривания остальных четырех электронов на 3d-подуровень максимальная степень окисления серы в соединениях с более сильными окислителями (фтором, кислородом, хлором) +6.

Химически сера очень активна, но всё же встречается в природе в виде простого вещества (самородная сера).
Основной источник самородной серы – вулканический пепел и горные породы вулканического происхождения.
В большинстве случаев сера в природе встречается в виде соединений:
У меня есть дополнительная информация к этой части урока!

Много серы содержится в морской воде в виде английской соли MgS04 , именно она придаёт морской воде горький привкус.

Сера образует три простых вещества (аллотропные модификации):
- ромбическую
- моноклинную
- пластическую
Ромбическая сера
Наиболее устойчивая, хрупкое вещество желтого цвета.
Это именно та сера, которую мы все привыкли видеть. Сера часто встречается в домашних аптечках (применяется как пищевая добавка, а также как наружное средство при лечении кожных заболеваний), а также она используется в сельском хозяйстве для окуривания растений от паразитов и грибков.
Моноклинная сера
Менее устойчивая модификация, образуется при медленном охлаждении расплавленной серы.
Пластическая сера
Неустойчива, получить её можно, если расплавленную серу охладить резко (например, вылить в холодную воду).
Моноклинная и пластическая модификации с течением времени самопроизвольно переходят в ромбическую.
У меня есть дополнительная информация к этой части урока!

Явление аллотропии обусловлено различным составом молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы).

Пройти тест и получить оценку можно после входа или регистрации
Химические свойства и применение серы
Сера – активный неметалл.
В химических реакциях она может быть как окислителем, так и восстановителем.
Окислителем сера выступает в реакциях с металлами, водородом и некоторыми неметаллами.
При комнатной температуре сера реагирует со всеми щелочными и щёлочно-земельными металлами, ртутью, медью, серебром, образуя сульфиды:

Эту реакцию используют в лабораториях для удаления разлитой ртути, пары которой очень токсичны.
Щели, в которые могла попасть разлитая ртуть, посыпают порошком серы.
С серебром способна реагировать не только сера, но и сероводород в присутствии кислорода воздуха, образуя черный налет сульфида серебра:


Хотя с химической точки зрения в данной реакции окислителем является не сера, а кислород.
Человеческий пот содержит небольшое количество сероводорода (продукт разложения белков, в которых содержится сера).
Именно поэтому серебряные украшения со временем чернеют.
С большинством металлов и водородом сера реагирует при нагревании.
Сера является окислителем по отношению к углероду и фосфору, проявляя степень окисления –2, а восстановителем – по отношению ко фтору, кислороду, хлору, проявляя степень окисления +4 и +6.
Многие соединения серы с неметаллами токсичны.
Интересен фторид серы SF6 , называемый элегаз, – тяжелый газ без цвета и без запаха, почти не токсичный из-за большой химической устойчивости.
Интересен он тем, что его используют для демонстрации вытеснения более легких газов, а также влияния тяжелых газов на голосовые связки: эффект после вдыхания элегаза прямо противоположен эффекту от вдыхания гелия.
Сера находит широкое применение и в качестве простого вещества и в виде соединений (в основном в виде серной кислоты).
Элементная сера применяется в производстве:
в медицине как наружное средство в составе мазей (об этом уже говорилось чуть ранее)
как средство для защиты растений; горящей серой окуривают посевы: токсичный оксид серы (IV) SO2 убивает грибки и паразитов
в производстве бетона, пищевых красителей, серной кислоты.
Серу используют в производстве резины – она образуется при реакции каучука с серой.
В процессе реакции длинные полимерные цепочки каучука соединяются между собой мостиками из атомов серы.
Этот процесс называется вулканизацией.

Кроме того, сера – жизненно важный химический элемент.
Она входит в состав белков – основных компонентов клеток растительных и животных организмов.
При недостатке серы в организме наблюдаются хрупкость и ломкость костей и выпадение волос.
Из пищевых продуктов серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца – все продукты, содержащие много белка.

Пройти тест и получить оценку можно после входа или регистрации
Сероводород
При взаимодействии с водородом сера образует летучее соединение — сероводород H2S.
Это газ без цвета, пахнет тухлыми яйцами.
Точнее говоря, это тухлые яйца пахнут сероводородом, потому что он образуется при разложении белков.

Немного растворим в воде: при комнатной температуре в одном объёме воды растворяется 2,5 объёма сероводорода.
Сероводород в больших количествах содержится в вулканических газах, воде многих минеральных источников, а также в водах мирового океана, в частности, его очень много в Чёрном море на глубинах более 150 м.
У меня есть дополнительная информация к этой части урока!

Чёрное море получило своё название из-за того, что во время шторма его воды имеют на самом деле чёрный цвет.
Объясняется это явление большой концентрацией в воде сероводорода и сульфидов.

В лаборатории сероводород получают действием соляной кислоты на сульфид железа:

Сероводород во всех реакциях является активным восстановителем за счёт атома серы в низшей степени окисления (–2).
Он легко горит: на воздухе с образованием серы и воды:

В чистом кислороде сероводород преобразуется до оксида серы (IV) SO2.

При растворении в воде сероводород диссоциирует, поэтому такой раствор проявляет кислотные свойства.
В больших количествах сероводород ядовит – он разрушает гемоглобин.
Однако вода минеральных источников, содержащая сероводород, издавна применяется в медицине в виде сероводородных ванн для лечения ревматизма и кожных заболеваний.

Большинство природных минералов серы представляют собой именно сульфиды.
Они используются не только для выплавки металлов, но и для получения серы.
Пройти тест и получить оценку можно после входа или регистрации
Серная кислота
Серная кислота H2SO4 – важный ресурс для химической промышленности и её продукт.

Купоросное, потому что сульфаты тяжелых металлов издавна называют купоросами.
А масло, потому что чистая серная кислота:
- тяжелая (в 2 раза тяжелее воды) маслянистая жидкость
- без запаха
- не летучая
- гигроскопичная (быстро поглощает пары воды из воздуха)
Она смешивается с водой в любых отношениях, причем при смешении выделяется большое количество тепла.
Например, если в концентрированную серную кислоту влить немного воды, то выделяющегося тепла достаточно для её закипания, и вода может тут же разбрызгаться вместе с кислотой.

Поэтому при разбавлении серной кислоты никогда не льют воду в кислоту, а только кислоту в воду, небольшими порциями при постоянном перемешивании.
Вспомните об этом, если вам придется разбавить электролит для аккумулятора.
Серная кислота образуется при реакции оксида серы (VI) с водой.
![]()
Оксид серы (VI) SO3– бесцветная летучая жидкость, ниже 17 °С превращается в прозрачную хлопьевидную массу, кипит при 44 °С.
Это типичный кислотный оксид и проявляет все свойства кислотных оксидов, реагирует с основными и амфотерными оксидами, с основаниями, образуя сульфаты – соли серной кислоты.
Свойства разбавленной и концентрированной серной кислоты различаются.
За счет того, что сера находится в максимальной степени окисления +6, серная кислота – окислитель.
Однако её окислительные свойства проявляются только в концентрированном виде.
Разбавленная серная кислота является сильной кислотой, хорошо растворяет большинство металлов с выделением водорода, реагирует с основными и амфотерными оксидами, основаниями с образованием сульфатов.
Концентрированная серная кислота является окислителем и растворяет гораздо больше металлов, чем разбавленная, но уже с выделением оксида серы (IV) SO2, серы S или сероводорода H2S (чем активнее металл, тем меньше степень окисления серы в продукте реакции).
Но также концентрированная серная кислота реагирует и с неметаллами (серой, фосфором, углеродом), окисляя их до оксидов или кислот.

Концентрированная серная кислота гигроскопична, то есть поглощает пары воды, поэтому её используют как осушитель.
Газы, которые не вступают с ней в реакцию, сушат пропусканием через склянки с концентрированной серной кислотой.
Этот способ подходит для осушения углекислого газа CO2, хлороводорода HCl, хлора Cl2, водорода H2.
А, например, аммиак NH3 с серной кислотой немедленно образует сульфат аммония:

Гигроскопичность серной кислоты проявляется в том, что она обугливает органические вещества.
Например, если её добавить к истолчённому сахару, смесь сразу же чернеет – кислота отнимает от сахара воду, оставляя углерод.

Это свойство серной кислоты объясняет то, что при попадании на кожу она вызывает сильные ожоги.
В лабораториях, где часто работают с концентрированной серной кислотой, под рукой всегда держат раствор питьевой соды. Именно этим раствором и большим количеством воды и смывают кислоту с кожи.
Серная кислота относится к продуктам основного химического производства.
С ней вы наверняка сталкиваетесь почти каждый день: электролит в свинцово-кислотных аккумуляторах представляет собой 30 % серную кислоту.
Но, кроме этого, она также используется при производстве удобрений, при обработке руд для получения редкоземельных металлов, в химическом производстве красителей, взрывчатых веществ, в легкой промышленности для обработки тканей, восстановления наполнителей фильтров для воды.
Развитие управляющих функций мозга ребёнка: полезные советы и упражнения для педагогов
Сертификат и скидка на обучение каждому участнику

Описание презентации по отдельным слайдам:

Бедному А совсем неудобно в своей квартире: сверху его грозится сжечь Б, справа – отравить ядовитый Д, а живущий слева тихий Е иногда начинает буянить и уж совсем не ясно чего от него ждать – либо отравит, либо подожжёт квартиру (он ведь входит в состав спичек). Но когда Е успокаивается, то начинает светиться бледно-зеленым светом и всех этим радует. Кто такой А и кто его соседи?



Физические свойства Сера S8 хрупкое вещество желтого цвета. Пластическая сера S- коричневого цвета. В воде сера нерастворима, некоторые её модификации растворяются в органических растворителях, например сероуглероде. Природный сросток серы

кристаллическая пластическая ромбическая моноклинная Лимонно-желтый кристаллы Темно-желтые кристаллы Резиноподобная массатемно-коричневого цвета tплавлен.=112,80С плотность= 2,06 г/см3 tплавления=119,30С плотность=1,957 г/см3 Образуется при резком охлаждении расплава плотность= 2,046 г/см3

1. Положение серы в ПСХЭ (порядковый номер, период, группа, подгруппа, Ar ) порядковый номер 16, III период, 6 группа главная подгруппа относительная атомная масса 32. 2. Строение атома Заряд ядра + 16, 16p 16n 16ē, + 16 )2)8 )6 Характеристика химического элемента - S степень окисления -2, 0, +2, +4, +6

Химические свойства При комнатной температуре сера реагирует со фтором, хлором и концентрированными кислотами-окислителями (HNO3, H2SO4), проявляя восстановительные свойства: S + 3F2 = SF6 S + Cl2 = SCl2 S + 6HNO3(конц.) = H2SO4 + 6NO2 ↑ + 2H2O S + 2H2SO4(конц.) = 3SO2 ↑ + 2H2O На воздухе сера горит, образуя сернистый ангидрид — бесцветный газ с резким запахом: S + O2 = SO2 При взаимодействии с металлами образует сульфиды. S + Hg = HgS S + Fe = FeS2 S + Zn = ZnS При нагревании сера реагирует с углеродом, кремнием, фосфором, водородом: C + 2S = CS2 (сероуглерод) Сера при нагревании растворяется в щелочах — реакция диспропорционирования 3S + 6KOH = K2SO3 + 2K2S + 3H2O

Нахождение серы в природе Самородная сера Сульфидная сера Сульфатная сера Киноварь HgS PbS Галенит CuFeS2 Халькопирит Сфалерит ZnS Гипс CaSO4•2H2O

Сера относится к числу весьма распространенных элементов: содержание ее в земной коре составляет 0,037 %. В природе она встречается в свободном состоянии (самородная сера), в виде сульфидов и сульфатов. Важнейшими сульфидными природными соединениями являются пирит, или железный колчедан (FеS), цинковая обманка (ZnS), свинцовый блеск (РbS), медный блеск (Сu2S), халькопирит (СuFеS2), киноварь (НgS) и сульфиды многих тяжелых металлов, которые входят в состав так называемых полиметаллических сульфидных руд. Важнейшими природными сульфатами являются сульфат натрия (Nа2SO4), кристаллогидрат которого (Nа2SO4 * 10Н2О) называется глауберовой солью, сульфат кальция (СаSO4), образующий минерал гипс (СаSО4 * 2Н2О), и сульфат магния, или горькая соль (МgSO4 * 7Н2О). В СНГ основные месторождения самородной серы встречаются в пустыне Кара-Кум и Поволжье. Крупные месторождения серы есть также в Италии, Японии и США. Сера входит в состав животных и растительных белков и при их разложении выделяется в виде сероводорода. Природные соединения серы

Применение серы S производство спичек производство лекарств и косметических препаратов для борьбы с вредителями растений производство резины производство черного пороха, красителей, бенгальских огней производство серной кислоты

Сера в отраслях промышленности Серу применяют для производства серной кислоты, вулканизации каучука, как фунгицид в сельском хозяйстве и как коллоидная сера — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента - для получения серобетона. Также сера применяется для производства бумаги, краски, удобрений, бензина и многого другого.

Применение серной кислоты

входит в состав аминокислот (метионин, цистеин) Синтез белков, витаминов (биотин, тиамин) участие в синтезе коллагена, кератина, входит в состав меланина Поддержание эластичности, упругости кожи, активация роста волос и ногтей участие в синтезе гормона - инсулина Нормализация углеводного обмена участие в ОВР организма
Читайте также:

