Посев методом серийных разведений
Добавил пользователь Alex Обновлено: 19.09.2024
Общим и крайне важным для всех методов серийных разведений этапом является приготовление растворов антибиотиков.
Различают основные растворы антибиотиков (пригодные для хранения) и рабочие, т.е. те, которые необходимо использовать ex tempore для приготовления питательных сред.
Для приготовления основных растворов антибиотиков используют субстанции препаратов с известной активностью, лекарственные формы не пригодны. Для приготовления навесок антибиотиков пользуются аналитическими весами или другими равного класса точности.
Основные растворы антибиотиков готовят в концентрации 1000 мкг/мл и выше. Навески антибиотиков для приготовления основных растворов готовят с учетом их активности. Расчет навески антибиотика проводят по формуле:
Вес (мг) = Объем растворителя (мл) х Необходимая концентрация (мкг/мл) / Активность субстанции (содержание антибиотика в мкг/мл).
В связи с тем, что антибактериальные препараты существенно различаются по растворимости, в ряде случаев возникает необходимость использовать разные вещества для первичной солюбилизации препаратов (растворители) и для доведения их до заданной концентрации (разбавители). В тех случаях, когда растворители и разбавители являются разными веществами, для солюбилизации антибиотика необходимо использовать минимально возможное количество растворителя.
Отличные от воды растворители и разбавители для отдельных антибиотиков приведены в таблице 11.7. Основные растворы необходимо хранить при температуре не выше -20 °С (сроки хранения отдельных антибиотиков при этой температуре существенно различаются). Оптимальными условиями для хранения основных растворов антибиотиков является температура -60 °С и ниже, длительность не более 6 мес. При этом необходимо иметь в виду, что основные растворы бета-лактамных антибиотиков могут терять активность и в более ранние сроки.
После извлечения из холодильника флаконов с основными растворами необходимо довести до комнатной температуры для предотвращения конденсации влаги и только после этого открыть. Размороженные основные растворы используют для приготовления рабочих растворов, повторное замораживание не допускается.
Готовят рабочие двукратные концентрации антибиотиков. За основу берется конечная концентрация антибиотика в питательной среде, равная 1,0 мкг/мл (более высокие — 8, и т.д. либо более низкие — 0,5, 0,25, 0,125 и т.д.). При этом реальные концентрации рабочих растворов требуют учета фактора разбавления раствора антибиотика в питательной среде (обычно 1:10). Для приготовления рабочих растворов используется дистиллированная вода. Диапазон концентраций зависит от целей исследования.
а) Метод серийных разведений в агаре:
Чашки оставляют при комнатной температуре для застывания. Приготовленные указанным образом чашки Петри предпочтительнее использовать немедленно. Допускается хранение в запаянных полиэтиленовых пакетах при +4 — +8°С в течение 5 сут. При этом необходимо иметь в виду, что некоторые бета-лактамные антибиотики (прежде всего ампициллин, цефаклор, имипенем), особенно при низких концентрациях, не выдерживают даже указанный срок хранения. В этой связи стабильность антибиотиков в приготовленных в лаборатории чашках Петри целесообразно устанавливать экспериментально с использованием референтных штаммов.
Параллельно с чашками Петри, содержащими растворы антибиотиков, для контроля роста готовят чашки Петри без антибиотиков.
2. Инокуляция, инкубация и учет результатов. Конечная посевная доза исследуемого микроорганизма на поверхности питательной среды должна составлять 10 4 КОЕ. Поскольку при помощи коммерческих инокуляторов или стандартной бактериологической петли диаметром 3 мм можно перенести 1-2 мкл жидкости, концентрация микроорганизмов в исходной суспензии должна быть 10 7 КОЕ/мл. Такую концентрацию можно получить при разведении суспензии 0,5 по стандарту Мак-Фарланда в 10 раз. Полученную суспензию необходимо инокулировать на поверхность агара в течение 15 мин после приготовления, при этом образуется пятно диаметром 5-8 мм.
После инокуляции чашки оставляют при комнатной температуре для подсыхания, далее переворачивают и инкубируют при 37 °С в течение 16-20 ч.
Для контроля качества приготовления суспензий периодически рекомендуется проводить подсчет реальных колониеобразующих единиц путем высева на неселективные питательные среды. Важнейшим требованием контроля качества проведения метода оценки антибиотикочувствительности является высев использованной для инокуляции суспензии на плотную неселективную среду (например, МПА) для контроля чистоты культуры.
Результат оценки антибиотикочувствительности имеет смысл учитывать только при подтверждении чистоты культуры. Для учета результатов чашку помещают на темную не отражающую поверхность. За МПК принимают концентрацию, вызвавшую полную ингибицию видимого роста. Для дифференцировки нежного роста и налета, оставшегося после инокулята, в ряде случаев целесообразно использовать увеличение. Появление единственной колонии на чашке с концентрацией на одно разведение выше, чем явная МПК, можно не учитывать.
б) Методы серийных разведений в бульоне. Различают два основных варианта метода серийных разведений в бульоне: макрометод (пробирочный) и микрометод (при величине конечного объема 0,2 мл и меньше).
Рабочие растворы антибиотиков для макро- и микрометодов готовят по одинаковой схеме, аналогичной той, которая была описана для метода серийных разведений в агаре. Отличие заключается в том, что для приготовления используется не дистиллированная вода, а жидкая питательная среда. Необходимо также рассчитать концентрацию рабочего раствора антибиотика так, чтобы после инокуляции конечная концентрация антибиотика была равна заданной. Жидкую питательную среду, прошедшую предварительный контроль качества, готовят в соответствии с инструкцией изготовителя.
При постановке методов серийных разведений необходимо проводить контроль роста культуры в среде без антибиотика, а также контролировать качество с использованием референтных штаммов. Выбор референтного штамма определяется видом исследуемого микроорганизма.
Необходимо также контролировать чистоту суспензии микроорганизма, используемой для инокуляции, путем высева на неселективные среды.
Метод серийных макроразведений в бульоне. Наиболее распространенным способом постановки метода серийных макроразведений в бульоне является следующий. Рабочие растворы антибиотиков в жидкой среде готовят в асептических условиях, в концентрациях, в 2 раза превышающих заданные, и вносят по 1 мл в пробирки.
Суспензию исследуемого микроорганизма в концентрации 0,5 стандарта МакФарланда готовят из бульонной или агаровой культуры на стерильном изотоническом растворе. Затем ее разводят в жидкой питательной среде до концентрации 10 6 КОЕ/мл и вносят по 1 мл в пробирки с растворами антибиотиков. Таким образом, конечная концентрация микроорганизмов в инкубационной среде будет равна 5х10 5 КОЕ/мл.
Пробирки закрывают стерильными ватно-марлевыми пробками или металлическими колпачками и инкубируют при 37 °С в течение 16-20 ч.
Метод серийных микроразведений в бульоне легко поддается модификациям для разработки коммерческих тест-систем. При использовании коммерческих тест-систем следует пользоваться инструкциями изготовителей.
Постановка метода в системах, изготовленных в лабораторных условиях, во многом сходна с постановкой метода серийных макроразведений. Наиболее удобной посудой для постановки метода в лабораторных условиях являются 96-луноч-ные планшеты для иммунологических исследований. Значительным преимуществом метода микроразведений является возможность одновременного изготовления достаточно большого количества планшет, их хранения и использования по мере необходимости. Соответственно первым этапом является изготовление планшет, пригодных для хранения. Концентрацию рабочих растворов антибиотиков, вносимых в лунки планшет, рассчитывают исходя из схемы последующей инокуляции, которая должна основываться на необходимости создания в лунке конечной концентрации исследуемого микроорганизма 5х10 5 КОЕ/мл. После внесения рабочих растворов антибиотиков в лунки, запаянные в полиэтилен, планшеты могут храниться при температуре ниже —60 °С до момента использования. Повторное замораживание-оттаивание не допускается.
Для проведения исследования планшеты после извлечения из холодильника выдерживают до достижения ими комнатной температуры. Суспензию исследуемого микроорганизма готовят из агаровой или бульонной культуры по стандарту Мак-Фарланда и доводят до заданной концентрации.
Инокуляцию необходимо провести в течение 15 мин после приготовления суспензии. Ее осуществляют при 37 °С в течение 16-20 ч. Для предотвращения высыхания содержимого лунок планшета должна быть закрыта крышкой. Учет результатов при постановке макро- и микрометодов проводят визуально по появлению видимой мутности или спектрофоторметрически. За МПК принимают минимальную концентрацию, обеспечивающую полное подавление видимого роста.
Общие замечания по методам серийных разведений. Несмотря на то, что методы серийных разведений являются наиболее точными и информативными, их постановка в практических лабораториях сопряжена со значительными методическими трудностями. Прежде всего это необходимость использования антибиотиков с четко известным уровнем активности, соблюдения жестких низкотемпературных режимов хранения, контроля качества питательных сред, трудоемкость приготовления рабочих растворов антибиотиков. В то же время использование коммерческих тест-систем на основе метода серийных микроразведений позволяет избегать трудоемких процедур по стандартизации подготовительных этапов и обеспечивает получение достоверных количественных результатов по уровню антибиотикочувствительности.
Весьма экономичным и простым в исполнении является также вариант метода серийных микроразведений, основанный на использовании двух пороговых концентраций.
Общим и крайне важным для всех методов серийных разведений этапом является приготовление растворов антибиотиков.
Различают основные растворы антибиотиков (пригодные для хранения) и рабочие, т.е. те, которые необходимо использовать ex tempore для приготовления питательных сред.
Для приготовления основных растворов антибиотиков используют субстанции препаратов с известной активностью, лекарственные формы не пригодны. Для приготовления навесок антибиотиков пользуются аналитическими весами или другими равного класса точности.
Основные растворы антибиотиков готовят в концентрации 1000 мкг/мл и выше. Навески антибиотиков для приготовления основных растворов готовят с учетом их активности. Расчет навески антибиотика проводят по формуле:
Вес (мг) = Объем растворителя (мл) х Необходимая концентрация (мкг/мл) / Активность субстанции (содержание антибиотика в мкг/мл).
В связи с тем, что антибактериальные препараты существенно различаются по растворимости, в ряде случаев возникает необходимость использовать разные вещества для первичной солюбилизации препаратов (растворители) и для доведения их до заданной концентрации (разбавители). В тех случаях, когда растворители и разбавители являются разными веществами, для солюбилизации антибиотика необходимо использовать минимально возможное количество растворителя.
Отличные от воды растворители и разбавители для отдельных антибиотиков приведены в таблице 11.7. Основные растворы необходимо хранить при температуре не выше -20 °С (сроки хранения отдельных антибиотиков при этой температуре существенно различаются). Оптимальными условиями для хранения основных растворов антибиотиков является температура -60 °С и ниже, длительность не более 6 мес. При этом необходимо иметь в виду, что основные растворы бета-лактамных антибиотиков могут терять активность и в более ранние сроки.
После извлечения из холодильника флаконов с основными растворами необходимо довести до комнатной температуры для предотвращения конденсации влаги и только после этого открыть. Размороженные основные растворы используют для приготовления рабочих растворов, повторное замораживание не допускается.
Готовят рабочие двукратные концентрации антибиотиков. За основу берется конечная концентрация антибиотика в питательной среде, равная 1,0 мкг/мл (более высокие — 8, и т.д. либо более низкие — 0,5, 0,25, 0,125 и т.д.). При этом реальные концентрации рабочих растворов требуют учета фактора разбавления раствора антибиотика в питательной среде (обычно 1:10). Для приготовления рабочих растворов используется дистиллированная вода. Диапазон концентраций зависит от целей исследования.

а) Метод серийных разведений в агаре:
Чашки оставляют при комнатной температуре для застывания. Приготовленные указанным образом чашки Петри предпочтительнее использовать немедленно. Допускается хранение в запаянных полиэтиленовых пакетах при +4 — +8°С в течение 5 сут. При этом необходимо иметь в виду, что некоторые бета-лактамные антибиотики (прежде всего ампициллин, цефаклор, имипенем), особенно при низких концентрациях, не выдерживают даже указанный срок хранения. В этой связи стабильность антибиотиков в приготовленных в лаборатории чашках Петри целесообразно устанавливать экспериментально с использованием референтных штаммов.
Параллельно с чашками Петри, содержащими растворы антибиотиков, для контроля роста готовят чашки Петри без антибиотиков.
2. Инокуляция, инкубация и учет результатов. Конечная посевная доза исследуемого микроорганизма на поверхности питательной среды должна составлять 10 4 КОЕ. Поскольку при помощи коммерческих инокуляторов или стандартной бактериологической петли диаметром 3 мм можно перенести 1-2 мкл жидкости, концентрация микроорганизмов в исходной суспензии должна быть 10 7 КОЕ/мл. Такую концентрацию можно получить при разведении суспензии 0,5 по стандарту Мак-Фарланда в 10 раз. Полученную суспензию необходимо инокулировать на поверхность агара в течение 15 мин после приготовления, при этом образуется пятно диаметром 5-8 мм.
После инокуляции чашки оставляют при комнатной температуре для подсыхания, далее переворачивают и инкубируют при 37 °С в течение 16-20 ч.
Для контроля качества приготовления суспензий периодически рекомендуется проводить подсчет реальных колониеобразующих единиц путем высева на неселективные питательные среды. Важнейшим требованием контроля качества проведения метода оценки антибиотикочувствительности является высев использованной для инокуляции суспензии на плотную неселективную среду (например, МПА) для контроля чистоты культуры.
Результат оценки антибиотикочувствительности имеет смысл учитывать только при подтверждении чистоты культуры. Для учета результатов чашку помещают на темную не отражающую поверхность. За МПК принимают концентрацию, вызвавшую полную ингибицию видимого роста. Для дифференцировки нежного роста и налета, оставшегося после инокулята, в ряде случаев целесообразно использовать увеличение. Появление единственной колонии на чашке с концентрацией на одно разведение выше, чем явная МПК, можно не учитывать.
б) Методы серийных разведений в бульоне. Различают два основных варианта метода серийных разведений в бульоне: макрометод (пробирочный) и микрометод (при величине конечного объема 0,2 мл и меньше).
Рабочие растворы антибиотиков для макро- и микрометодов готовят по одинаковой схеме, аналогичной той, которая была описана для метода серийных разведений в агаре. Отличие заключается в том, что для приготовления используется не дистиллированная вода, а жидкая питательная среда. Необходимо также рассчитать концентрацию рабочего раствора антибиотика так, чтобы после инокуляции конечная концентрация антибиотика была равна заданной. Жидкую питательную среду, прошедшую предварительный контроль качества, готовят в соответствии с инструкцией изготовителя.
При постановке методов серийных разведений необходимо проводить контроль роста культуры в среде без антибиотика, а также контролировать качество с использованием референтных штаммов. Выбор референтного штамма определяется видом исследуемого микроорганизма.
Необходимо также контролировать чистоту суспензии микроорганизма, используемой для инокуляции, путем высева на неселективные среды.
Метод серийных макроразведений в бульоне. Наиболее распространенным способом постановки метода серийных макроразведений в бульоне является следующий. Рабочие растворы антибиотиков в жидкой среде готовят в асептических условиях, в концентрациях, в 2 раза превышающих заданные, и вносят по 1 мл в пробирки.
Суспензию исследуемого микроорганизма в концентрации 0,5 стандарта МакФарланда готовят из бульонной или агаровой культуры на стерильном изотоническом растворе. Затем ее разводят в жидкой питательной среде до концентрации 10 6 КОЕ/мл и вносят по 1 мл в пробирки с растворами антибиотиков. Таким образом, конечная концентрация микроорганизмов в инкубационной среде будет равна 5х10 5 КОЕ/мл.
Пробирки закрывают стерильными ватно-марлевыми пробками или металлическими колпачками и инкубируют при 37 °С в течение 16-20 ч.
Метод серийных микроразведений в бульоне легко поддается модификациям для разработки коммерческих тест-систем. При использовании коммерческих тест-систем следует пользоваться инструкциями изготовителей.
Постановка метода в системах, изготовленных в лабораторных условиях, во многом сходна с постановкой метода серийных макроразведений. Наиболее удобной посудой для постановки метода в лабораторных условиях являются 96-луноч-ные планшеты для иммунологических исследований. Значительным преимуществом метода микроразведений является возможность одновременного изготовления достаточно большого количества планшет, их хранения и использования по мере необходимости. Соответственно первым этапом является изготовление планшет, пригодных для хранения. Концентрацию рабочих растворов антибиотиков, вносимых в лунки планшет, рассчитывают исходя из схемы последующей инокуляции, которая должна основываться на необходимости создания в лунке конечной концентрации исследуемого микроорганизма 5х10 5 КОЕ/мл. После внесения рабочих растворов антибиотиков в лунки, запаянные в полиэтилен, планшеты могут храниться при температуре ниже —60 °С до момента использования. Повторное замораживание-оттаивание не допускается.
Для проведения исследования планшеты после извлечения из холодильника выдерживают до достижения ими комнатной температуры. Суспензию исследуемого микроорганизма готовят из агаровой или бульонной культуры по стандарту Мак-Фарланда и доводят до заданной концентрации.
Инокуляцию необходимо провести в течение 15 мин после приготовления суспензии. Ее осуществляют при 37 °С в течение 16-20 ч. Для предотвращения высыхания содержимого лунок планшета должна быть закрыта крышкой. Учет результатов при постановке макро- и микрометодов проводят визуально по появлению видимой мутности или спектрофоторметрически. За МПК принимают минимальную концентрацию, обеспечивающую полное подавление видимого роста.
Общие замечания по методам серийных разведений. Несмотря на то, что методы серийных разведений являются наиболее точными и информативными, их постановка в практических лабораториях сопряжена со значительными методическими трудностями. Прежде всего это необходимость использования антибиотиков с четко известным уровнем активности, соблюдения жестких низкотемпературных режимов хранения, контроля качества питательных сред, трудоемкость приготовления рабочих растворов антибиотиков. В то же время использование коммерческих тест-систем на основе метода серийных микроразведений позволяет избегать трудоемких процедур по стандартизации подготовительных этапов и обеспечивает получение достоверных количественных результатов по уровню антибиотикочувствительности.
Весьма экономичным и простым в исполнении является также вариант метода серийных микроразведений, основанный на использовании двух пороговых концентраций.
Метод серийных разведений заключается в том, что антибиотическое вещество или культуральную жидкость разбавляют питательной средой в 2, 4, 8, 16 и более раз или в другом любом разведении, которое выбирают в зависимости от предполагаемой концентрации испытываемого антибиотика. Практически это осуществляется следующим образом. В стерильные пробирки одинакового диаметра стерильно разливается питательный бульон по 1 мл в каждую, после чего пробирки помещают на 1 сутки в термостат для проверки стерильности. Пробирки, в которых начался рост бактерий, выбрасывают. Затем 1 мл испытуемого раствора вносят в первую пробирку и тщательно перемешивают. Получается разведение 1 : 2. Из первой пробирки с разведением 1 : 2 один миллилитр жидкости переносят во вторую пробирку, где получается разведение 1 : 4, и т. д.
Для получения больших разведений готовят исходное разведение 1: 100. Затем 1 мл этого раствора смешивают с 1, 2, 3, 4, 5, 6, 7, 8 мл бульона. Получаются разведения 1 : 200, 1 : 300, 1 : 400, 1 : 500, 1 : 600, 1 : 700, 1 : 800. Для получения дальнейших разведений, последовательно отличающихся на 100,
0,5 мл раствора с разведением 1 : 100 смешивают с 4, 4,5, 5 и 5,5 мл бульона, получая соответственно разведение 1 : 900, 1 : 1000 1 : 1100 и 1 : 1200. В практической работе можно использовать самые разнообразные сочетания разведений.
Очень удобной является следующая схема титрования антимикробных веществ. Готовят раствор препарата (I) на воде или спирте в разведении 1 : 100 и ряд пробирок, содержащих по 2,5 мл стерильной жидкой питательной среды. Затем в первую пробирку вносят 0,25 мл раствора 1 и получают разведение 1 : 1000, во вторую — 0,1 мл, получая разведение 1 : 2500. Далее готовят раствор II из 0,1 мл раствора 1 с добавлением 0,9 мл воды. 0,5 мл полученного раствора вносят в третью пробирку, 0,25 мл в четвертую, 0,1 мл в пятую, получая соответственно разведения 1 : 5000, 1 : 10 000, 1 : 25 000. Затем снова готовят раствор III и поступают, как указано.
Тест-объект надо вносить в пробирки в определенном количестве, постоянном для данной серии опытов, в виде вегетативных клеток или спор. Тест-объект можно вносить в питательный бульон в определенном количестве и перед разливом его в пробирки. В литературе описаны различные способы подготовки тест-объекта для его внесения в пробирки с бульоном. Наиболее простой из них заключается в том, что одна петля тест-организма с твердого субстрата засевается в стерильный питательный бульон, инкубируется при температуре, оптимальной для развития этого организма. Затем одну каплю суточной культуры вносят в пробирку с 9 мл стерильной водопроводной воды.
В клинической практике чувствительными к антибиотикам считают те микроорганизмы, на которые антибиотики оказывают бактериостатическое или бактерицидное действие.
При любом лабораторном исследовании критерием чувствительности микроорганизмов к антибиотикам является минимальная концентрация антибиотика, ингибирующая (задерживающая) рост возбудителя заболевания при стандартных условиях постановки опыта.
Для определения лекарственной чувствительности оптимальным является использование чистой культуры возбудителя. Выделять культуры микробов из организма для исследования на чувствительность следует до начала лечения антибиотиками, так как под их воздействием рост возбудителя заболевания может быть полностью угнетен. Чувствительность микроорганизмов к антибиотикам определяют методом диффузии в агар с применением стандартных дисков или методом серийных разведений в жидких и плотных питательных средах.
Методы определения
Метод дисков. Взвесь изучаемой культуры засевают "газоном" (см. главу 7). В качестве посевного материала можно использовать суточную бульонную культуру или 1 миллиардную микробную взвесь, приготовленную по оптическому стандарту мутности № 10 (см. ниже). Засеянные чашки подсушивают 30-40 мин при комнатной температуре. Затем на поверхность засеянного агара пинцетом накладывают бумажные диски, пропитанные растворами различных антибиотиков. Каждый диск слегка прижимают браншами пинцета, чтобы он плотно прилегал к поверхности агара. Диски накладывают на равном расстоянии друг от друга и на расстоянии 2 см от края чашки. Одну чашку можно использовать для изучения чувствительности одного штамма к 4-5 антибиотикам.
Учет результатов. Действие антибиотиков оценивают по феномену задержки роста вокруг диска (рис. 25). Диаметр зон задержки роста микробов вокруг дисков определяют с помощью линейки, включая диаметр самого диска. Между степенью чувствительности микроба к антибиотикам и величиной зоны отсутствия роста имеются следующие соотношения (табл. 10).
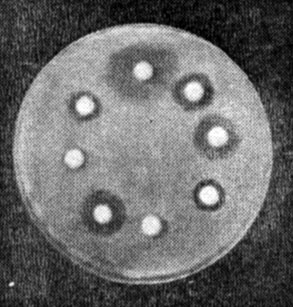
Рис. 25. Определение чувствительности бактерий к антибиотикам (метод дисков)

Таблица 10. Определение степени чувствительности микроорганизмов к антибиотикам по величине зоны отсутствия роста
В ответе указывают, какой чувствительностью обладает исследуемый штамм, а не размер зоны задержки роста.
В ряде случаев определяют чувствительность микроорганизмов к антибиотикам в нативном материале (гной, раневое отделяемое и др.). При этом материал наносят на поверхность питательного агара и равномерно растирают по поверхности стерильным стеклянным шпателем * , а потом накладывают диски. Метод дисков для определения чувствительности микроорганизмов вследствие простоты и доступности широко применяют в практических лабораториях и расценивают как качественный метод.
* (Для тех видов микроорганизмов, которые не растут на мясопептонном агаре, как, например, стрептококки, пневмококки и другие, применяют агар с кровью или сывороткой.)
Метод серийных разведений в жидкой питательной среде. Этот метод является точным количественным методом, его применяют в научной работе и в особо важных случаях в лабораториях больниц и профилактических учреждений.
Для постановки опыта необходимо иметь чистую культуру испытуемого микроорганизма, основной раствор антибиотика, мясопептонный бульон на переваре Хоттингера, содержащий 1,2-1,4 г/л аминного азота.
Активность антибиотиков выражают в ЕД/мл или мкг/мл. Для приготовления основного раствора антибиотика используют антибиотики, имеющиеся в продаже с указанием количества их во флаконе.
Если на этикетке вместо количества единиц во флаконе дозировка указана в единицах массы, то следует иметь в виду, что 1 г активности для большей части антибиотиков соответствует 1 млн. ЕД. Из этого раствора и должны быть приготовлены требуемые разведения антибиотиков. Указания для приготовления основного раствора антибиотиков на примере пенициллина приведены в табл. 11.

Таблица 11. Получение основного раствора пенициллина
Готовят взвесь культуры микроорганизмов, выросшей на плотной питательной среде. Полученную взвесь сравнивают с оптическим стандартом мутности № 10 (см. ниже), а затем разводят стерильным изотоническим раствором натрия хлорида до 10 6 микробных тел в 1 мл. Для получения соответствующего разведения микробной взвеси готовят ряд последовательных десятикратных разведений (см. ниже).
Учет результатов проводят при наличии роста в контроле культуры и отсутствии роста в контроле среды. Затем отмечают последнюю пробирку с полной видимой задержкой роста микробов. Количество антибиотика в этой пробирке является минимальной ингибирующей концентрацией для испытуемого штамма и определяет степень его чувствительности к данному антибиотику. В ответе, выдаваемом лабораторией, указывают минимальную ингибирующую концентрацию.
Метод серийных разведений на плотной питательной среде. Готовят двукратные разведения антибиотика, как и при методе серийных разведений в жидкой питательной среде. Затем берут 1 часть каждого разведения антибиотика и 9 частей питательного агара, расплавленного и охлажденного до 42° С (из расчета 1 мл антибиотика + 9 мл МПА), хорошо перемешивают и наливают в чашки Петри.
Густоту (концентрацию) культуры определяют по оптическому стандарту мутности № 10 и разводят стерильным изотоническим раствором до 10 7 микробных тел в 1 мл. Бактериальной петлей наносят испытуемые культуры на поверхность питательного агара с антибиотиком. На одну чашку делают посев 20-25 штаммов. Засеянные чашки ставят в термостат при 37° С на 16-20 ч для большинства видов микроорганизмов. Чашка с питательным агаром без антибиотика, на которую наносят испытуемые культуры, является контрольной.
Учет результатов проводят при наличии роста в контрольной чашке, а минимальную ингибирующую концентрацию антибиотика определяют по последней чашке Петри, где отмечают полную задержку роста бактерий.
Учет результатов. Чувствительные к препарату культуры начинают расти лишь на некотором расстоянии от дорожки, нечувствительные растут до самого края.
Лекарственная устойчивость. Определение активности антибиотиков и чувствительности бактериальных культур к антибиотикам.
Механизмы развития устойчивости микробов к антибиотикам.
Помимо побочного действия антибиотиков на макроорганизм человека, антибиотики оказывают нежелательное воздействие и на микроорганизмы: 1) изменяются свойства микробов, что затрудняет их распознавание и диагностику заболеваний; 2) формируется приобретенная антибиотикоустойчивость (резистентность). Различают также врожденную или видовую устойчивость к антибиотикам. Она обусловлена видовыми свойствами, которые определяются геномом клетки (пенициллин не действует на микроорганизмы, у которых отсутствует пептидогликан в клеточной стенке). Циркуляция в природе антибиотикорезистентных бактерий создает трудности в лечении инфекционных заболеваний.
Для того, чтобы антибиотик оказал свое действие на микроорганизм необходимо следующее:
1) антибиотик должен проникнуть в клетку;
3) антибиотик должен сохранять свою активную структуру.
Если какое-либо из этих условий не будет выполнено, антибиотик не сможет оказать свое воздействие и у бактерий или других микробов развивается устойчивость к данному антибиотику.
Генетические процессы связаны с изменениями в геноме бактерий в результате мутаций и с наличием R-плазмид. В связи с этим различают:
1) хромосомную устойчивость - возникает в результате мутаций в геноме (хромосоме) и обычно бывает к одному антибиотику; такая устойчивость может передаваться по наследству при всех видах генетического обмена;
2) внехромосомную устойчивость (наблюдается значительно чаще) - связана с наличием в цитоплазме бактерий R–плазмиды, которая определяет множественную лекарственную устойчивостью (к нескольким антибиотикам); она может передаваться другим бактериям при конъюгации и трансформации.
Биохимические механизмы:
1) изменение проницаемости мембраны для антибиотика; например, снижение проницаемости наружной мембраны у грамотрицательных бактерий обеспечивает их устойчивость к ампициллину;
3) нарушение специфического транспорта антибиотика в бактериальную клетку; например, устойчивость к тетрациклину может быть связана с подавлением транспорта этого антибиотика в клетку;
4) превращение активной формы антибиотика в неактивную (основной биохимический механизм) при помощи ферментов; образование таких ферментов связано с R-плазмидами и транспозонами (отрезками ДНК). Важное значение имеют ферменты пептидазы, которые вызывают гидролиз антибиотиков. Например, ферменты лактамазы, разрушающие –лактамное кольцо. К этим ферментам относится индуцибельный фермент пенициллиназа. 98% стафилококков образуют пенициллиназу, разрушающую пенициллин, поэтому они обладают устойчивостью к пенициллину. У E.coli и протея пенициллиназа является конститутивным ферментом, чем и объясняется их естественная резистентность к пенициллину. E. сoli образует фермент стрептомициназу, которая разрушает стрептомицин. Имеются бактерии, образующие ферменты, которые вызывают ацетилирование, фосфорилирование и другие изменения структуры антибиотиков, что приводит к потере их активности;
5) возникновение у микробов другого пути метаболизма вместо того пути, который нарушен антибиотиком.
Распространению антибиотикорезистентности способствуют следующие условия:
1) широкое бесконтрольное применение антибиотиков для лечения (самолечение) и профилактики заболеваний, что способствует отбору резистентных форм, возникших в результате генетических процессов;
2) применение одних и тех же антибиотиков для лечения человека и животных (или в качестве консервантов пищевых продуктов).
Для предупреждения развития устойчивости к антибиотикам и для правильного лечения необходимо соблюдать следующие принципы.
1. Микробиологический: антибиотики применять по показаниям, предварительно определять антибиотикограмму.
2. Фармакологический: при назначении антибиотика необходимо определить правильную дозировку препарата, схему лечения, по возможности сочетать различные средства, чтобы предупреждать формирование резистентных форм.
3. Клинический: учитывать общее состояние больных, возраст, пол, состояние иммунной системы, сопутствующие заболевания, наличие беременности.
4. Эпидемиологический: знать, к каким антибиотикам устойчивы микроорганизмы в среде, окружающей больного (отделение, больница, географический регион).
5. Фармацевтический: необходимо учитывать срок годности, условия хранения препарата, так как при длительном и неправильном хранении образуются токсические продукты деградации антибиотика.
Методы определения чувствительности бактерий к антибиотикам.
Так как одним из важнейших принципов правильного лечения инфекционных заболеваний является выбор антибиотика, к которому возбудитель наиболее чувствителен, перед назначением антибиотиков проводится определение чувствительности возбудителя заболевания к антибиотикам, т.е. устанавливается антибиотикограмма.
Наиболее известны 3 метода:
Биологическая активность антибиотиков.
Биологическая активность антибиотика – это его способность убивать или тормозить рост и развитие микроорганизмов. Активность выражают в единицах действия (ЕД). 1 ЕД - минимальное количество антибиотика, которое задерживает рост стандартного штамма тест-микроба в определенных условиях. Так, для пенициллина 1 ЕД является минимальное количество, способное задержать рост золотистого стафилококка штамма 209-р в 50 мл МПБ. Для стрептомицина 1 ЕД должна задерживать рост E.coli в 1 мл МПБ.
В настоящее время активность большинства антибиотиков измеряется в мкг. Обычно 1мкг химически чистого препарата соответствует 1 ЕД. Для бензилпенициллина 1мг содержит 1670 ЕД, в 1 мг нистатина содержится 4000 ЕД.
Методы определения активности антибиотиков.
Активность антибиотиков определяют:
1) методом серийных разведений;
2) методом диффузии в агар.
Для определения активности антибиотиков в качестве тест - культуры используют непатогенные или условно-патогенные микробы, проявляющие наибольшую чувствительность к данному веществу. Так, для определения активности пенициллина используют S. аureus 209-р.
1 . Определение активности антибиотиков методом серийных разведений. Берут ряд пробирок с одинаковым объемом МПБ (1-10 мл). Количество пробирок определяется количеством разведений (степенью разведения) антибиотика. В первую пробирку вносят определенное количество антибиотика, перемешивают, определенный объем раствора переносят из первой пробирки во вторую, перемешивают, из второй пробирки – в третью и т.д. Из последней пробирки такой же объем выливают, чтобы во всех пробирках содержался одинаковых объем жидкости. Контроль – пробирка без антибиотика. Во все пробирки с разведениями антибиотика и контрольную пробирку вносят 0,1 мл взвеси тест культуры (2,5 10 6 клеток в 1 мл). На следующий день определяют разведение антибиотика, при котором в пробирке нет роста - среда осталась прозрачной (если нет роста, следовательно антибиотик подействовал). Эта наименьшая концентрация и есть минимальная активная доза антибиотика.
Можно использовать этот метод с применением плотной среды, в том случае, если микробы не растут на жидких средах (для туберкулезных палочек – свернутую сыворотку). Разведения антибиотика в среде готовят следующим образом. Вначале готовят различные разведения антибиотика в растворителе, а затем по 1 мл каждого разведения вносят в пробирку с 4 мл расплавленного и охлажденного до 45-50С МПА. Пробирки скашивают для застывания агара, а на поверхность среды петлей засевают тест-культуру.
2 . Определение активности антибиотика методом диффузии в агар.
Питательный агар (ПА) по 15 мл разливают в чашки Петри. После застывания и подсушивания агара в каждую чашку наливают по 5 мл ПА, смешанного с тест культурой (20 млн. клеток на 1 мл среды). После застывания второго слоя агара на его поверхность наносят по трафарету 6 цилиндров и делают 6 лунок. В 3 лунки вносят по 0,1 мл испытуемого раствора антибиотика, в другие 3 лунки – по 0,1 мл стандартного раствора. Через 16-18 часов термостатирования при 37С цилиндры удаляют и измеряют диаметр зон задержки роста. Активность антибиотика устанавливается с помощью расчетной таблицы ГФК или по стандартной кривой на основе диаметра задержки роста.
Читайте также:

