Посев крови из сердца
Обновлено: 30.06.2024
Классическими признаками инфекционного эндокардита (ИЭ) являются: поражение клапанов сердца, бактериемия или фунгемия, эмболии и аутоиммунные поражения сосудов. Не все эти симптомы могут присутствовать одновременно, часть их может быть слабо выражена или отсутствовать вовсе, что значительно осложняет проведение диагностики и лечения заболевания [1].
Клиническая диагностика ИЭ предполагает использование алгоритма, предложенного исследователями из Duke University [2]. Основными критериями Duke являются морфологические признаки ИЭ, полученные при операции на сердце или аутопсии, достоверные микробиологические при знаки (гемокультура) и дан ные эхокардиограммы (ЭхоКГ). Шесть менее специфических признаков ИЭ составляют дополнительные критерии: длительная бактериемия, лихорадка, массивная эмболия, неэмболические поражения сосудов, предрасполагающие заболевания клапанов, внутривенная наркомания и признаки на ЭхоКГ (нетипичная картина функционирования клапанов и вегетаций на них, признаки абсцессов). Клиническая диагностика требует либо наличия 2 основных критериев, либо 1 главного и 3 дополнительных, либо 5 дополнительных.
Критерии Duke при диагнозе “определенно ИЭ” имеют предсказательный уровень 98%, специфичность составляет 99%, а эффективность диагностики – 72–70% по сравнению с клинической оценкой экспертов-инфекционистов [3, 4]. Применение новых дополнительных критериев (спленомегалии, микрогематурии, СОЭ, уровня С-реактивного белка) позволило дополнительно диагностировать ИЭ в 10% случаев.
Эхокардиография (ЭхоКГ), не являясь обязательным скрининговым тестом у пациентов с лихорадкой и позитивной гемокультурой, должна проводиться при подозрении на ИЭ. Характерные вегетации, абсцессы, вновь появляющиеся изменения искусственных клапанов и признаки недостаточности клапанов являются 4 основными признаками ИЭ (см. определение терминологии).
Трансторакальная ЭхоКГ (ТЭхоКГ) является важнейшим методом диагностики и эффективно выявляет 98% вегетаций более 2 мм в диаметре. Однако чувствительность ТЭхоКГ в отношении выявления всех вегетаций составляет менее 60%. Результаты могут оказаться неадекватными у 20% взрослых больных из-за избыточной массы тела, хронических обструктивных заболеваний легких, деформации грудной клетки. При низком риске ИЭ (энтерококковая бактериемия с первичным фокусом без других признаков ИЭ) проведенная на должном уровне ТЭхоКГ позволяет исключить наличие ИЭ [5].
В отсутствие эффекта антибактериальной терапии и при подозрении на развитие осложнений показано проведение трансэзофагеальной ЭхоКГ (ТЭЭхоКГ). Преимущества ТЭЭхоКГ определяются высокой чувствительностью (76–100%) и специфичностью (94%) выявления инфекций клапанного кольца. Расположение датчика в пищеводе позволяет лучше визуализировать ИЭ искусственных клапанов с чувствительностью 86–94% и специфичностью 88–100%. Недостаточность искусственных клапанов значительно лучше выявляется из-за отсутствия интерференции их структур с допплеровским сигналом. При использовании ТЭЭхоКГ из двух проекций увеличивается выявление растущих вегетаций и их подвижности. Причинами ложноотрицательных результатов ТЭЭхоКГ могут быть вегетации и абсцессы меньше предела разрешения метода и предшествующая эмболия вегетациями.
Многопозиционные комбинации ТЭЭхоКГ и ТЭхоКГ позволяют повысить достоверность исследования в сложных ситуациях. При отрицательном результате одновременного применения обоих видов исследований вероятность ИЭ составляет не более 5%. Считается, что ТЭЭхоКГ должна рассматриваться как часть раннего обследования пациентов с бактериемий S.aureus [6].
Если вероятность ИЭ остается высокой, а результаты ТЭЭхоКГ оказались отрицательными, повторное исследование необходимо проводить через 7–10 дней, когда могут проявиться не видимые ранее вегетации. Повторная ЭхоКГ в процессе терапии способствует дополнительному выявлению вегетаций в 59% случаев. Увеличение размера вегетаций на фоне лечения указывает на высокую вероятность развития осложнений.
Длительная бактериемия и высокая частота выделения гемокультур являются типичными для ИЭ. В крупном исследовании было показано, что из 95% посевов крови был выделен возбудитель. Интенсивность бактериемии не всегда бывает высокой, у большинства пациентов обнаружено менее 50 колониеобразующих единиц в 1 мл крови. Наиболее частыми возбудителями ИЭ были стрептококки, энтерококки, стафилококки и грибы [7].
Бактериологического подтверждения не получено у 5% пациентов с диагнозом “определенно ИЭ” по критериям Duke. Это может быть связано с применением антибиотиков до сбора крови, нарушением правил сбора и хранения образцов, погрешностями микробиологической техники, инфицированностью бактериями, требующими необычных условий культивирования, или небактериальными возбудителями. Посев крови необходимо проводить в течение 1 ч трижды в 2 флакона (1 флакон для аэробов и 1 – для анаэробов при каждом посеве). Кровь должна быть внесена во флакон по крайней мере в отношении 1:5 (или согласно инструкции), с указанием в сопроводительном документе и предполагаемого диагноза – “ИЭ”. При указании этого диагноза необходимо удлинить период микробиологического исследования. При отсутствии роста через 48–72 ч инкубация образцов должна продолжаться не менее 2–3 нед.
Применение антибиотиков до взятия посевов крови снижает частоту выявления бактериемии до 35–45%. Прекращение антибактериальной терапии в первые дни лечения для проведения повторных посевов крови в течение 2–4 дней не ухудшало состояния пациентов с ИЭ и не увеличивало показателей летальности. Однако это можно рекомендовать при отсутствии тяжелой интоксикации, прогрессирующего поражения клапанов и застойной сердечной недостаточности.
Выделение некоторых возбудителей ИЭ затруднительно проводить в обычной клинической микробиологической лаборатории. Это связано с необходимостью применения специального оборудования, селективных сред, тканевых культур и методов выращивания (HACEK, Bartonella spp., Brucella spp., Coxiella burnetti). Некоторые гри бы, возбудители ИЭ, почти никогда не выделяются из крови (род Aspergillus), другие выделяются спорадически (Candida, Сryptococcus neoformans и др.). Для ряда возбудителей ИЭ (бруцеллы, бар тонеллы и хламидии) серологическая диагностика остается важнейшим методом подтверждения этиологии [8].
В дополнение к микробиологическому и серологическому исследованию крови, посев тканей клапанов или эмболизированных сосудов также может помочь в выделении возбудителя. Световая и электронная микроскопия с флюоресцентными антительными метками, молекулярная диагностика специфических фрагментов ДНК и РНК являются перспективными диагностическими методами. Использование полимеразной цепной реакции (ПЦР) позволяет проводить диагностику таких возбудителей ИЭ, как Tropherema whipelli и Bartonella sp. [9].
Этиология и антибиотикотерапия
Стрептококки вызывают до 55% всех случаев ИЭ. Примерно 35% из них составляет зеленящий стрептококк. Из-за низкой вирулентности зеленящий стрептококк вызывает ИЭ уже поврежденных клапанов, процесс принимает подострое или хроническое течение, разрушение клапанов происходит медленно. Учитывая высокую чувствительность стрептококков к пенициллину, уже в течение многих лет общепринятой схемой лечения является применение высоких доз пенициллина (12 000 000 – 18 000 000 ЕД/сут в виде 4 внутривенных инфузий в течение 4–6 нед). Имеются сведения о применении комбинации пенициллина с аминогликозидами (1 мг/кг гентамицина через 8 ч внутримышечно в течение 2 нед). Целесообразность такой комбинации вызывает сомнения, особенно у пациентов после 3 мес терапии пенициллином и при наличии противопоказаний к применению аминогликозидов. В случаях неосложненного течения ИЭ доказана эффективность цефтриаксона (2 г внутривенно или внутримышечно 1 раз в сутки в течение 4 нед).
Энтерококки (стрептококки группы D) являются причиной 10% ИЭ, такой же “вклад” вносят другие негемолитические стрептококки. Обычно энтерококки чувствительны к пенициллину и лечение проводится по указанной выше схеме.
Стафилококки
Стафилококки являются этиологической причиной 35% всех ИЭ. Острый ИЭ с генерализованным воспалением и быстрым разрушением клапанов обычно вызывают S. aureus. Стандартным лечением является применение оксациллина (по 2 г через 4 ч внутривенно в течение 4 нед). В случае резистентности к оксациллину или метициллину рекомендуется применять рифампицин (по 400–600 мг внутривенно капельно через 12 ч в течение 4 нед) или ванкомицин (по 1 г в виде 60–90-минутной внутривенной инфузии через 12 ч в течение 4 нед).
До недавнего времени коагулазонегативные стафилококки (CNS) считались наиболее частыми возбудителями ИЭ искусственных клапанов, однако в последнее десятилетие показано первичное поражение клапанов у пациентов с пролапсом митрального клапана. Среди CNS важную роль играет S.lugdunensis, однако его идентификация затруднительна в условиях обычной лаборатории и требует направления образцов в референтную лабораторию. Этот возбудитель способен вызывать более острые формы ИЭ с поражением клапанного кольца и метастатическими очагами в другие органы. Большинство экспертов рекомендуют лечить эти ИЭ стандартными схемами антибиотиков с учетом чувствительности штаммов in vitro. Другим частым возбудителем ИЭ из группы CNS является S.epidermidis. Учитывая результаты мониторинга, эмпирическую терапию рекомендуют проводить ванкомицином (по 1 г в виде 60-минутной внутривенной инфузии через 12 ч) до определения чувствительности к антибиотикам и выбора целенаправленной терапии.
Синегнойная палочка
Большинство случаев ИЭ, вызываемых Pseudomonas spp., приходится на P.aeruginosa и возникает у наркоманов, при внутривенном введении наркотических средств, или при внутрибольничной инфекции. Как правило, ИЭ клапанов правого сердца не требует хирургического лечения. Обычно используют комбинации высоких доз пенициллинов с антисинегнойной активностью (например, пиперациллин 18 г/сут) с аминогликозидами (тобрамицин 5–8 мг/кг/сут) курсом до 6 нед. Однако недостаточная эффективность такой комбинации может выявляться в течение 7–10 сут лечения при отсутствии снижения активности воспаления и позитивной динамики процесса на клапанах (по данным ЭхоКГ). В этих случаях необходимо применять карбапенемы, доза которых зависит от тяжести инфекции и составляет от 500 мг 2 раза в сутки внутримышечно до 500 мг 3–4 раза в сутки внутривенно (имипенем). Применение карбапенемов особенно актуально при ИЭ клапанов левого сердца, так как именно недостаточная эффективность антибактериальной терапии приводит к быстрому разрушению клапанов и требует хирургического лечения. Карбапенемы эффективны против широкого спектра патогенных микроорганизмов (грамотрицательных аэробных бактерий, грамотрицательных анаэробных бактерий, грамположительных аэробных и анаэробных бактерий), что делает их особенно полезными при лечении полимикробных и смешанных аэробных/анаэробных инфекциях.
Candida и Aspergillus является наиболее частыми возбудителями грибковых ИЭ. Наркоманы, принимающие наркотики внутривенно, реципиенты искусственных клапанов сердца и пациенты с длительной катетеризацией центральных вен составляют группу высокого риска в отношении развития ИЭ. Эта этиология ИЭ должна быть заподозрена при отрицательных посевах крови, наличии крупных вегетаций, инфекционных метастатических очагов, поражения клапанного кольца, эмболии крупных сосудов. Амфотерицин В является единственным препаратом фунгицидного действия, однако из-за плохого проникновения в вегетации часто требуется имплантация искусственных клапанов и одновременная терапия амфотерицином В (5 мг/кг/сут внутривенно капельно, продолжительность применения не определена). Эффективность имидазолов (флюконазол и итраконазол) в лечении ИЭ пока еще не доказана, хотя имеются описания случаев эффективной длительной терапии у взрослых пациентов при невозможности хирургического лечения.
Количество больных ИЭ возрастает, ежегодно выявляют 15–20 тыс. новых случаев. ИЭ занимает 4-е место по летальности после сепсиса, пневмонии и абдоминального хирургического сепсиса. Оптимизация диагностики, антимикробной терапии и хирургической тактики позволила достигнуть некоторого снижения заболеваемости и летальности от ИЭ, тем не менее ИЭ остается жизнеугрожающим заболеванием.
Использование критериев Duke в сочетании с ЭхоКГ позволяет улучшить диагностику ИЭ и его осложнений. Эффективная антибактериальная терапия ИЭ позволяет предупреждать развитие основных осложнений этого заболевания (сердечная недостаточность, инфекции клапанного кольца и окружающих тканей, абсцессы селезенки и микотические аневризмы), играет важную роль в улучшении исходов заболевания в целом. Увеличение частоты случаев ИЭ и связанной с ними летальности делает необходимым разработку прогностических критериев, совершенствование лечения и определение финансовых затрат, связанных с ИЭ.
1. Bayer A.S., Bolger A.F., Taubert K.A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation. 1998; 98: 2936–48.
2. Durack D.T., Lukes A.S., Bright D.K. New criteria for diagnosis of infective endocarditis: utilisation of specific echocardiographic findings: Duke Endocarditis Service. Am J Med 1994; 96: 200–9.
3. Hoen B., Selton-Suty C., Danchin N. et al. Evaluation of the Duke criteria versus the Beth Israel criteria for the diagnosis of infective endocarditis. Clin Infect Dis. 1995; 21: 905–9.
4. Heiro M., Nikoskelainen J., Hartiala J.J., et al. Diagnosis of infective endocarditis: sensitivity of the Duke vs. von Reyn criteria. Arch Intern Med. 1998; 158: 18–24.
5. Daniel W.G., Mugge A., Grote J. et al. Comparison of transthoracic and transesophageal echocardiography for detection of abnormalities of prosthetic and bioprosthetic valves in the mitral and aortic positions. Am J Cardiol. 1993; 71: 210–5.
6. Birmingham G.D., Rahko P.S., Ballantyne F. III. Improved detection of infective endocarditis with transesophageal echocardiography. Am Heart J. 1992; 123: 774–7 S 1.
7. Ali A.S., Trivedi V., Lesch M. Culture-negative endocarditis: a historical review and 1990s update. Prog Cardiovasc Dis. 1994; 37: 149–60.
8. Shapiro D.S., Kenney S.C., Johnson M. et al. Brief report: Chlamydia psittaci endocarditis diagnosed by blood culture. N Engl J Med. 1992; 326: 1192–5.
9. Hamed K.A., Dormitzer P.R., Su C.K., Relman D.A. Haemophilus parainfluenzae endocarditis: application of a molecular approach for identification of pathogenic bacterial species. Clin Infect Dis. 1994; 19: 677–83.
Определенно ИЭ
Лабораторные критерии
• позитивный посев крови
• позитивный посев внутрисердечного абсцесса
• данные гистологического исследования вегетаций
• данные гистологического исследования эмболов.
• вегетации или внутрисердечные абсцессы, подтвержденные гистологически картиной активного эндокардита
Клинические критерии:
• 2 основных критерия, или
• 1 основной и 3 дополнительных критерия, или
• 5 дополнительных критериев
Признаки, которые не соответствуют ни “определенно ИЭ”, ни “нет ИЭ”.
• наличие альтернативного объяснения признакам ИЭ – изменение диагноза
• разрешение проявлений ИЭ на фоне кратковременной (менее 4 дней) терапии антибиотиками
• отсутствие морфологических доказательств ИЭ во время операции или аутопсии после кратковременной (менее 4 дней) терапии антибиотиками.
Основные критерии
1. Положительная гемокультура, характерная для ИЭ
А. Типичный для ИЭ микроорганизм, выделенный из двух флаконов
• Streptococcus viridans, Streptococcus bovis, Haemophilus spp, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella spp, Kingella kingae
• Внебольничный штамм Staphylococcus aureus или энтерококка в отсутствие определенного гнойного очага или
Б. Повторный высев культуры, способной вызывать ИЭ
• В образце крови, взятой позже 12-часового промежутка после предыдущего
• Во всех 3 или в большинстве из 4 или более образцах крови, взятой на посев после более чем часового промежутка
2. Доказательства вовлечения эндокарда
А. Характерные данные ЭхоКГ
• Наличие вегетации на клапанах или других структурах, или по ходу потоков регургитации крови, или на имплантированных материалах в отсутствие других анатомических отклонений или
• Наличие абсцессов, или
• Наличие измененных искусственных клапанов
Б. Появление новых признаков регургитации крови через клапаны (увеличение или изменение предшествующих шумов не учитывается).
Дополнительные критерии
• Предшествующие заболевания сердца или внутривенное введение наркотиков.
• Лихорадка больше 38О С.
• Сосудистые проявления: крупные артериальные эмболы, септические инфаркты легких, микотическая аневризма, внутричерепные кровоизлияния, геморрагии в конъюнктиву.
• Иммунологические нарушения: гломерулонефрит, узелки Osler’а, пятна Roth’а, положительная проба на ревматоидный фактор.
• Микробиологические подтверждения: позитивный посев крови с выделением флоры, не соответствующей основным критериям, или серологическое подтверждение активной инфекции в отсутствие микроорганизма, обычно вызывающего ИЭ.
• ЭхоКГ: данные, напоминающие ИЭ, но не соответствующие основным критериям.

Далеко не каждый пациент знает, для чего врачи в клиниках выписывают направления на разные обследования, в том числе это касается анализа крови на стерильность. Медики уверяют, что данное тестирование назначается для выявления у пациента бактериемии, которая свидетельствует о наличие патогенных процессов в организме. Чтобы получить достоверный результат и возможность начать грамотное лечение, пациенту необходимо знать правила забора крови и строго соблюдать некоторые рекомендации в течение нескольких дней.
Посев крови на стерильность – что это такое и почему так называется? Данное обследование является одним из важнейших, поскольку дает медикам возможность выявить присутствие микроорганизмов в крови, которые свидетельствуют о развитии различных патологий, внутреннего воспалительного процесса. У здорового человека кровь и другие биологические жидкости должны быть стерильными, и если тестирование показывает обратный результат, это свидетельствует о наличии какого-то заболевания. Чтобы определить нарушение стерильности, чаще всего назначается гематологический посев на различные питательные среды.
Показания к проведению
Основная цель анализа – выявить наличие вредоносных микроорганизмов, провоцирующих воспалительный процесс.Диагност может назначить пациенту сдать кровь на микробиологическое исследование в следующих случаях
- если пациент страдает от специфической симптоматики, но медики длительное время не могут определить, что служит первоисточников патологического процесса;
- медик предполагает наличие септической инфекции у обследуемого;
- наличие осложнений, вызванных неграмотным хирургическим вмешательством;
- постановка катетера во внутренние органы на длительное время;
- человек периодически страдает от высокой температуры тела, но врачи не могут определить, что служит причиной такой реакции организма;
- наличие в организме импланта, напрямую контактирующего с биологическими средами организма.
Абсолютным показанием к поведению тестирования является наличие искусственных клапанов миокарда. Чтобы получить достоверный результат анализа, придется выждать не менее 10 суток, поскольку для прорастания патогенных микроорганизмов потребуется несколько дней.
Специалисты предупреждают, что скорость этого процесса зависит от типа возбудителя. Стоит отметить, что после забора биоматериала многим пациентам назначают прием антибиотиков (исходя из присутствующей симптоматики), но подобрать более грамотную и оптимальную схему лечения возможно только после получения данных гемотеста.
Что позволяет выявить тестирование В большинстве случаев бакпосев на стерильность назначается для обнаружения в крови вредоносных бактерий и микробов, таких как:
- стафилококки;
- стрептококки;
- дрожжевые грибки;
- плесневые споры;
- энтеробактерии.
Данное исследование является необходимым для пациентов, у которых снижены защитные силы организма, а также для людей, страдающих от опасных патологий, таких как ВИЧ, туберкулез, острые инфекционные заболевания. Кроме того, тестирование зачастую назначается, если медики не могут определиться с оптимальной схемой лечения.
Какие заболевания помогает выявить посев. Тестирование на присутствие патогенных микроорганизмов позволяет определить наличие следующих патологий:
- Менингит.
- Пиодермия.
- Эндокардит.
- Остеомиелит.
Чтобы обнаружить тип гемокультуры, требуется провести тщательный анализ предполагаемого возбудителя. Если исследование покажет присутствие его в организме, медикам потребуется выяснить, насколько серьезную опасность обнаруженные микробы представляют для различных систем и внутренних органов.
Где можно провести тестирование Если человеку необходимо провести подобное исследование, лучше записаться на прием в частный диагностический центр. Главное условие – наличие там лаборатории для микробиологических исследований.Как показывает практика, в подобных учреждениях расшифровка результатов проводится в кратчайший срок. Стоимость процедуры может отличаться в зависимости от типа клиники, но обычно цена тестирования варьируется в пределах 400-700 рублей.
Особенности подготовки Поскольку бакпосев – микробиологическое исследование, на достоверность результата могут повлиять внутренние и внешние факторы.Чтобы предотвратить получение ложного результата, пациенту требуется выполнить определенную подготовку:
за трое суток до сдачи биологического материала категорически запрещено употреблять алкогольную продукцию и медикаменты (вне зависимости от фармкатегории);
- в течение 72 часов до анализа не рекомендуется употреблять жирную, пережаренную пищу и блюда с большим количеством приправ, специй;
- за 3 часа до забора крови запрещено курить.
Если пациент будет игнорировать правила, вероятность получения неправильного результата анализа увеличивается в несколько раз, что может стать причиной необходимости вторичного тестирования. Есть противопоказания. Посоветуйтесь с врачом.Запись на ПЭТ-КТ диагностику!
Осуществление процедуры у взрослых Алгоритм действий очень простой, но важнейшим моментом является соблюдение техники забора. Биоматериал требуется забирать строго из вены локтевого сгиба. Медик должен следить, чтобы в кровь не попали внешние загрязнители.
Чтобы предотвратить порчу биоматериала, забор крови осуществляется одноразовой стерильной иглой.Прежде чем приступить к нему, участок эпидермиса необходимо обработать антисептическим раствором. В большинстве случаев у пациента забирают около 10 мл биоматериала, после чегопомещают во флакон с питательной средой, которая предотвращает изменение структуры крови.
Чтобы снизить риск заражения, кровь из шприца переливают во флакон, находящийся над пламенем горелки. После этих действий пузырек закупоривают плотной крышкой и помещают в специальный контейнер до осуществления дальнейших исследований. В редчайших случаях пациенту перед забором крови вводят адреналин, поскольку вещество увеличивает точность анализа и помогает проявить максимальное количество возбудителей.
Анализ у детей У ребенка манипуляции с кровью осуществляются иначе. Изъятие биоматериала проводится только из пальца либо пятки. У детей для бакпосева на стерильность забирают не более 5 мл крови.
Как долго ждать результата?
Сколько времени готовится анализ, интересует всех пациентов. Если процедура осуществлялась в современном диагностическом центре, первые данные можно получить уже через пару суток, но бланк с окончательными результатами пациенту отдадут на руки не ранее чем через 10 дней. Это обусловлено тем, что кровь будет подвергаться различным исследованиям, в биоматериал будут добавлять различные реагенты и вещества.
Врачи уверяют, что данное тестирование дает гарантированно правильный результат и возможность оценить общее состояние пациента, выявить наличие определенных патологий. Недостоверные данные могут появиться только в том случае, если пациент игнорировал врачебные рекомендации и правила подготовки перед сдачей биоматериала. При соблюдении всех требований вероятность того, что человек получит достоверные сведения о своем состоянии, достигает 95%.
Какие выводы можно сделать после анализа
На сегодняшний день тестирование на стерильность является незаменимым, поскольку дает возможность оценить гемокультуру крови и провести исследование с применением различных патогенных организмов. Кроме того, в ходе исследования можно узнать, как организм отреагирует на потребление тех или иных препаратов, благодаря чему врачи смогут подобрать наилучшую схему лечения. Если у человека периодически повышается температура тела без видимых причин, необходимо не раздумывая записаться на прием к специалисту, который после проведения физиологического осмотра и сбора анамнеза выпишет направление на дальнейшую диагностику. Нельзя исключать вероятность, что одним из первых в списке будет значиться исследование крови на стерильность, поскольку на основании этого тестирования можно сделать выводы об общем состоянии пациента и назначить грамотную схему терапии.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
Сепсис – это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок – это различные формы выраженности воспалительной реакции организма на инфекционный процесс.

Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.

Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
В ответ на внедрение возбудителя вырабатываются цитокины – особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) – развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический – развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) – развивается в результате первичной инфекции в полости рта;
- оториногенный – развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный – при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный – развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) – сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) – системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или 10%.
3. Тяжелый сепсис – сепсис, сочетающийся с полиорганной дисфункцией по двум и более органам, снижением артериального давления № 1700 Маркёры воспаления
Прокальцитонин – высокочувствительный и высокоспецифичный маркер развития бактериальной инфекции и сепсиса.
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
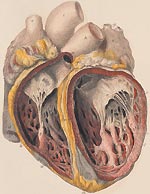
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническая характеристика и особенности течения ИЭ
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Лечение больных ИЭ
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
Литература
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Читайте также:

