Лаборатория микроклонального размножения картофеля
Добавил пользователь Morpheus Обновлено: 21.09.2024
Изобретение относится к биотехнологии растений, в частности к получению безвирусного и продуктивного исходного материала для дальнейшего семеноводства картофеля.
Картофель - вегетативно-размножаемая культура, относительно слабая по устойчивости к вирусам, важнейший продукт питания населения. Россия занимает одно из последних мест по урожайности культуры картофеля. Низкая урожайность связана с резкими температурными колебаниями, инфицированностью почвы возбудителями болезней и низким качеством семенного материала. Зараженность патогенами семенного материала является одной из основных причин снижения урожайности картофеля.
Известен способ микроклонального размножения картофеля, включающий культивирование оздоровленных растений картофеля in vitro путем черенкования на питательную среду, содержащую макро- и микроэлементы по прописи Мурасиге-Скуга, сахарозу, Fe-хелат, глицерин, ИУК, агар-агар, витамины по Уайту, получение меристемных растений-регенерантов и высадку растений в грунт, при этом перед высадкой в грунт меристемные растения-регенеранты подвергаются ежесуточному воздействию температурой +4-+5°C в течение 2 ч продолжительностью 6-7 дней [патент RU №2487532 (13) С1, МПК А01Н 4/00, А01G 7/00, 20.07.2013 (аналог)].
Указанный технический результат достигается тем, что в способе микроклонального размножения картофеля, включающем стерилизацию питательной среды, культивирование растений картофеля in vitro путем микрочеренкования исходных растений на питательную среду, содержащую макро- и микроэлементы по прописи Мурасиге-Скуга, Fe-хелат, агар-агар, витамины по Уайту и сахарозу, аскорбиновую кислоту, получение растений-регенерантов, получение микроклубней картофеля in vitro с использованием питательной среды, согласно заявляемому изобретению осуществляют предварительное оздоровление исходных растений картофеля от вирусной инфекции стерилизацией в 0,3%-ном растворе диацида в течение 3-5 минут с последующей трехкратной промывкой стерильной дистиллированной H2O, причем для культивирования оздоровленных растений и получения микроклубней картофеля используют питательную среду, содержащую дополнительно аденин 1-1,5 мг/л, кинетин 1-2 мг/л, индолилуксусную кислоту (ИУК) 0,5-1,5 мг/л, а тиамин, аскорбиновая кислота, Fe-хелат и сахароза берутся в следующей концентрации: 1-1,2 мг/л; 2,1-4 мг/л; 374-390 мг/л и 81000-85000 мг/л, получение микроклубней картофеля осуществляют при температуре 19-20°C, при условии светового дня 8 часов (5000 лк) и полной темноты 16 часов и относительной влажности воздуха 70-80%.
Стерилизацию питательной среды для культивирования оздоровленных растений и получения микроклубней картофеля осуществляют с использованием автоклавов в стеклянных банках с металлической герметичной крышкой и вырезанным отверстием в крышке для внесения эксплантов.
Способ осуществляют следующим образом.
Оздоровление картофеля от вирусной инфекции осуществлялось вычленением апикальных этиолированных проростков, разделением их на кусочки (1-1,5 см с одной почкой), стерилизацией в 0,3%-ном растворе диацида в течение 3-5 минут с последующей трехкратной промывкой стерильной дистиллированной H2O.
Использование 0,3%-ного раствора диацида с целью стерилизации выделенных этиолированных проростков в течение 3-5 минут с последующей трехкратной промывкой стерильной H2O позволяет полностью ингибировать развитие бактериальной и вирусной инфекции.
Экспериментально было доказано, что использование диацида менее 0,3%-ного раствора не позволяет полностью стерилизовать растительные экспланты от бактериальной и вирусной инфекции. Использование диацида более 0,3%-ного раствора приводит к частичному замедлению процессов регенерации или гибели растений.
После стерилизации растительных эксплантов из них вычленяют апикальные меристемы и вносят их на стерильную питательную среду (табл. 1), содержащую макро- и микроэлементы по прописи Мурасиге-Скуга, Fe-хелат, агар-агар, витамины по Уайту, сахарозу 20000 мг/л, кинетин 1-2 м г/л, ИУК 1-2 мг/л для морфогенеза и образования меристемных оздоровленных растений-регенерантов.

Питательная среда в контрольном варианте готовилась по прототипу, в опытном - с добавлением 374-390 мг/л Fe-хелата, 0,5-1,5 мг/л ИУК, 1-2 мг/л кинетина, 1-1,5 мг/л аденина, 1,0-1,2 мг/л тиамина, 2,1-4 аскорбиновой кислоты, 81000-85000 мг/л сахарозы.
Для культивирования растений-регенерантов используют стеклянные банки с металлической герметичной крышкой, с вырезанным отверстием в крышке для внесения эксплантов, которые выдерживают условия автоклавирования. После внесения в банку питательной среды отверстие закрывают ватно-марлевой пробкой и обворачивают фольгой, помещают в медицинские бюксы и автоклавируют 20 мин при давлении 1 атм и температуре 120°C.
При использовании стеклянных банок с металлической крышкой и отверстием для внесения эксплантов снижается себестоимость оздоровленных растений и микроклубней, увеличивается выход и размер микроклубней, упрощается способ размножения. Следует отметить, что использование пробирок - дорогой, громоздкий, трудоемкий процесс, а микроклубни, полученные в пробирках, имеют меньшие размеры и менее жизнеспособны.
Также следует отметить, что применение стеклянных банок с металлической крышкой для культивирования растений-регенерантов и микроклубнеобразования экономически выгоднее контейнерной технологии, т.к. позволяет использовать банки многократно, подвергать их автоклавированию, в отличие от пластиковых контейнеров и громоздких пробирок. Себестоимость стеклянных банок гораздо дешевле пробирок и пластиковых контейнеров.
Размножение оздоровленных растений-регенерантов проводили микрочеренкованием in vitro в условиях ламинар-бокса. Микрочеренки помещали в стерильные стеклянные банки со стерильной питательной средой, содержащей макро- и микроэлементы по прописи Мурасиге-Скуга, агар-агар, витамины: тиамин 1-1,2 мг/л и аскорбиновую кислоту 2,1-4 мг/л; Fe-хелат 374-390 мг/л, сахарозу 81000-85000 мг/л, аденин 1-1,5 мг/л, кинетин 1-2 мг/л, индолилуксусную кислоту (ИУК) 0,5-1,5 мг/л.
Повышение содержания витаминов тиамина до 1-1,2 мг/л и аскорбиновой кислоты 2,1-4 мг/л способствует более интенсивному росту и здоровому развитию растения, более мощному развитию корневой системы, стимулированию ростовых процессов, влиянию на обмен веществ в растении.
В результате проведенных исследований установлено, что повышение содержания эссенциального элемента Fe-хелат с 374 до 390 мг/л оказывает положительное влияние на процессы фотосинтеза и дыхание растений картофеля, т.к. элементы Fe-хелат являются переносчиками электронов, а как кофактор Fe-хелат у растений картофеля входит в состав многих антиоксидантных ферментов (Fe-супероксиддисмутаза, пероксидазы, каталаза).
Введенный в состав питательной среды аденин - аминопроизводное пурина - содержится в ферментах и коферментах растений картофеля, очень важен для клеток растений как составляющая нуклеиновых кислот (ДНК и РНК), и в культуре тканей имеет цитокининовый эффект, т.е. стимулирует образование побегов растений (дифференциацию), резко усиливает процессы клеточного деления (цитокинез), повышает интенсивность фотосинтеза у растений картофеля, а также участвует во многих физиологических процессах.
Комплексное использование в питательной среде ИУК, аденина и кинетина и взаимовлияние их друг на друга способствует более интенсивному стимулированию ростовых процессов, ризогенезу, геморизогенезу, морфогенезу и приживаемости растений. Учитывая, что соотношение ауксинов к цитокининам является ключевым фактором деления клеток и дифференцировки тканей растения картофеля, поэтому экспериментальным путем было установлено оптимальное соотношение и концентрации внесения в питательную среду ауксинов и цитокининов (ИУК 0,5-1,5 мг/л, аденина 1-1,5 мг/л и кинетина1-2 мг/л).
На следующем этапе банки с черенками подписывали и выставляли на стеллажи с освещением 5000-лк люминесцентными лампами при фотопериоде: 16-часовом освещении (день) и 8 часов полной темноты (ночь), при температуре 22-25°C, влажности воздуха 70% для дальнейшего получения растений-регенерантов, которые могут быть реализованы для высадке в грунт.
Для получения микроклубней картофеля использовали ту же питательную среду, которая использовалась выше для микрочеренкования, содержащую макро- и микроэлементы по прописи Мурасиге-Скуга, агар-агар, витамины: тиамин 1-1,2 мг/л и аскорбиновую кислоту 2,1-4 мг/л; Fe-хелат 374-390 мг/л, сахарозу 81000-85000 мг/л, аденин 1-1,5 мг/л, кинетин 1-2 мг/л, индолилуксусную кислоту (ИУК) 0,5-1,5 мг/л, однако режимы культивирования были следующие: 8 часов освещения (5000-7000 лк), 16 часов полной темноты, при пониженной температуре 19-20°C и относительной влажности воздуха 70-80%.
Полученные микроклубни отделяли от растений и переносили в условия пониженных температур (4±2)°C на 2-3 месяца для дальнейшей реализации или высадки в грунт.
Полученные предлагаемым способом оздоровленные микроклубни картофеля были физиологически зрелыми, хорошо хранились и при последующем выращивании in vivo формировали здоровые растения. Предлагаемый способ прост в использовании, экологически безопасен и может быть использован на картофелевыращивающих предприятиях.
Пример 1. Оздоровление картофеля от вирусной инфекции осуществлялось вычленением апикальных этиолированных проростков исходных растений, разделением их на кусочки (1-1,5 см с одной почкой), стерилизацией в 0,3%-ном растворе диацида в течение 3-5 минут, с последующей трехкратной промывкой стерильной дистиллированной H2O.
После стерилизации растительных эксплантов из них вычленяют апикальные меристемы и вносят их на стерильную питательную среду, содержащую макро- и микроэлементы по прописи Мурасиге-Скуга, Fe-хелат, агар-агар, витамины по Уайту, сахарозу 20000 мг/л, кинетин 1,5 мг/л, ИУК 1,5 мг/л для морфогенеза и образования меристемных оздоровленных растений-регенерантов.
Для культивирования растений-регенерантов используют стерильные стеклянные банки с металлической герметичной крышкой и вырезанным отверстием в крышке для внесения эксплантов. После внесения оздоровленных эксплантов в стерильную банку со стерильной питательной средой отверстие закрывают ватно-марлевой пробкой, банки с эксплантами подписывают и выставляют на стеллажи с освещением 5000-лк люминесцентными лампами при фотопериоде: 16-часовом освещении (день) и 8 часов полной темноты (ночь), при температуре 22-25°C, влажности воздуха 70% для дальнейшего получения растений-регенерантов. Полученные растения-регенеранты, имеющие 12-15 листьев, извлекают из банок и черенкуют в условиях ламинар-бокса, и черенки помещают в стерильные банки со стерильной питательной средой, содержащей макро- и микроэлементы по прописи Мурасиге-Скуга, агар-агар, тиамин 1,2 мг/л, аскорбиновую кислоту 3 мг/л; Fe-хелат 380 мг/л, сахарозу 85000 мг/л, аденин 1,5 мг/л, кинетин 2 мг/л, индолилуксусную кислоту (ИУК) 1,5 мг/л.
На следующем этапе банки с черенками подписывают и выставляют на стеллажи с освещением 5000-лк люминесцентными лампами при фотопериоде: 16-часовом освещении (день) и 8 часов полной темноты (ночь), при температуре 22-25°C, влажности воздуха 70% для дальнейшего получения растений-регенерантов, которые могут быть реализованы для высадки в грунт.
Для получения микроклубней картофеля использовали ту же питательную среду, что и для микрочеренкования при условиях культивирования: 8 часов освещения (5000-7000 лк), 16 часов полной темноты, при пониженной температуре 19-20°C и относительной влажности воздуха 70-80%.
Полученные микроклубни отделяют от растений и переносят в условия пониженных температур (4±2)°C на 2-3 месяца для дальнейшей реализации или высадке в грунт.
По окончании культивирования микроклубни отделяются и направляются на реализацию потребителям для высадки семенного картофеля в грунт или переносятся на хранение в холодильные камеры при температуре (4±2)°C сроком на 2-3 месяца до момента реализации.
Пример 2. Осуществляется аналогично примеру 1 за исключением того, что для культивирования оздоровленных растений и получения микроклубней картофеля используется питательная среда, содержащая компоненты в следующем количестве: тиамин 1,0 мг/л, аскорбиновую кислоту 4 мг/л; Fe-хелат 390 мг/л, сахарозу 84000 мг/л, аденин 1,0 мг/л, кинетин 1,5 мг/л, индолилуксусную кислоту (ИУК) 1,0 мг/л.
Пример 3. Осуществляется аналогично примеру 1 за исключением того, что для культивирования оздоровленных растений и получения микроклубней картофеля используется питательная среда, содержащая компоненты в следующем количестве: тиамин 1,1 мг/л, аскорбиновую кислоту 2,5 мг/л; Fe-хелат 375 мг/л, сахарозу 82000 мг/л, аденин 1,3 мг/л, кинетин 1,0 мг/л, индолилуксусную кислоту (ИУК) 0,5 мг/л.
Полученные предлагаемым способом оздоровленные микроклубни картофеля были физиологически зрелыми, хорошо хранились и при последующем выращивании in vivo формировали здоровые растения.
Предлагаемый способ прост в использовании, экологически безопасен и может быть использован на картофелевыращивающих предприятиях.
Похожие патенты RU2637361C1
- Артюхова Светлана Ивановна
- Киргизова Ирина Васильевна
- Паршина Светлана Александровна
- Лукаткин Александр Степанович
- Разумкова В.Н.
- Маслов И.Л.
- Чережанова Л.В.
- Овчинникова В.Н.
- Мелик-Саркисов О.С.
- Матвеева Елизавета Михайловна
- Сысоева Марина Ивановна
- Шерудило Елена Георгиевна
- Котова Зинаида Петровна
- Лаврова Виктория Витальевна
- Данилова Светлана Алексеевна
- Баранова Екатерина Николаевна
- Халилуев Марат Рушанович
- Гулевич Александр Анатольевич
- Шахлина Татьяна Алексеевна
- Диловарова Татьяна Анатольевна
- Мешков Валерий Васильевич
- Халилуева Надежда Михайловна
- Шахлин Евгений Григорьевич
- Вайсфельд Любовь Павловна
- Сибиряткин Сергей Васильевич
- Эдельгериев Абубакар Сайд-Хасанович
- Баматов Ибрагим Мусаевич
- Шаипов Адлан Нажмутдинович
- Гамбург Ким Захарович
- Кунах Виктор Анатольевич
- Шестибратов Константин Александрович
- Салмова Маргарита Анатольевна
- Алпатова Анна Александровна
- Азарова Анна Борисовна
Реферат патента 2017 года СПОСОБ МИКРОКЛОНАЛЬНОГО РАЗМНОЖЕНИЯ КАРТОФЕЛЯ IN VITRO СОРТА КАРТОФЕЛЯ АЛЕНА
Изобретение относится к биотехнологии. Изобретение представляет собой способ микроклонального размножения картофеля, при котором выделяют апикальные этиолированные проростки (1-1,5 см), стерилизуют в 0,3%-ном растворе диацида в течение 3-5 минут с последующей трехкратной промывкой стерильной H2O, культивируют меристемы, получают оздоровленные растения, проводят микрочеренкование, черенки вносят в стеклянные банки с металлической крышкой. Для микрочеренкования и образования микроклубней в питательную среду дополнительно вносят тиамин 1-1,2 мг/л, аскорбиновую кислоту 2,1-4 мг/л, Fe-хелат 374-390 мг/л, сахарозу 81000-85000 мг/л, аденин 1-1,5 мг/л, кинетин 1-2 мг/л, индолилуксусную кислоту (ИУК) 0,5-1,5 мг/л, получение микроклубней картофеля осуществляют при температуре 19-20°C, при условии светового дня 8 часов (5000 лк) и полной темноты 16 часов при относительной влажности воздуха 70-80%. Полученные микроклубни отделяют от растений и переносят в условия пониженных температур (4±2)°C на 2-3 месяца для дальнейшей реализации или высадки в грунт. Изобретение позволяет возродить и получить в короткие сроки оздоровленный сибирский сорт картофеля “Алена”, повысить коэффициент размножения растений-регенерантов, размер и количество микроклубней, ускорить рост эксплантов, обеспечить техническую простоту культивирования и снизить трудоемкость работы. 1 з.п. ф-лы, 1 табл., 3 пр.
Формула изобретения RU 2 637 361 C1
1. Способ микроклонального размножения картофеля, включающий стерилизацию питательной среды, культивирование растений картофеля in vitro путем микрочеренкования исходных растений на питательную среду, содержащую макро- и микроэлементы по прописи Мурасиге-Скуга, Fe-хелат, агар-агар, витамины по Уайту и сахарозу, аскорбиновую кислоту, получение растений-регенерантов, получение микроклубней картофеля in vitro с использованием питательной среды, отличающийся тем, что осуществляют предварительное оздоровление исходных растений картофеля от вирусной инфекции стерилизацией в 0,3%-ном растворе диацида в течение 3-5 минут, с последующей трехкратной промывкой стерильной дистиллированной H2O, причем для культивирования оздоровленных растений и получения микроклубней картофеля используют питательную среду, содержащую дополнительно аденин 1-1,5 мг/л, кинетин 1-2 мг/л, индолилуксусную кислоту (ИУК) 0,5-1,5 мг/л, а тиамин, аскорбиновая кислота, Fe-хелат и сахароза берутся в следующей концентрации: 1-1,2 мг/л; 2,1-4 мг/л; 374-390 мг/л и 81000-85000 мг/л, получение микроклубней картофеля осуществляют при температуре 19-20°C при условии светового дня 8 часов (5000 лк) и полной темноты 16 часов и относительной влажности воздуха 70-80%.
2. Способ по п. 1, отличающийся тем, что стерилизацию питательной среды для культивирования оздоровленных растений и получения микроклубней картофеля осуществляют с использованием автоклавов в стеклянных банках с металлической герметичной крышкой и вырезанным отверстием в крышке для внесения эксплантов.

Микроклональное размножение растений

Микроклональное размножение растений
ЦО: описать методы микроклонального размножения растений
Эксплант Группа клеток, отделенная от материнского организма

Группа клеток, отделенная от материнского организма. Используется в биологических исследованиях, связанных с микроклональным размножением растений. У двудольных растений, эксплантами могут являться, например, части гипокотилей, стеблей, корней, семядоли, пыльники и прочее. При культивировании эксплантов на питательных средах различного состава, можно наблюдать каллусогенез или органогенез (образование корней, побегов и пр.)
Области применения клонального микроразмножения в селекции для поддержания и размножения растений с уникальными генотипами; для быстрого размножения новых и уже существующих сортов; массового получения оздоровленного…

Области применения клонального микроразмножения
в селекции для поддержания и размножения растений с уникальными генотипами;
для быстрого размножения новых и уже существующих сортов;
массового получения оздоровленного посадочного материала у растений, подверженных вирусным заболеваниям;
для быстрого размножения некоторых гетерозиготных садовых культур, обычно размножающихся семенами и расщепляющихся при скрещивании;
для быстрого клонального размножения in vitro лучших экземпляров взрослых древесных растений, разведение и селекция которых осуществляется медленно вследствие длительности процесса полового размножения;
для сохранения редких и исчезающих видов.
Каллус Недифференцированные клетки, являющиеся тотипотентными и способными поэтому дать начало целому растению

Недифференцированные клетки, являющиеся тотипотентными и способными поэтому дать начало целому растению. Являются объектом генетической инженерии.
Тотипотентность клетки Свойство клетки под влиянием экзогенных воздействий давать начало целому растительному организму

Свойство клетки под влиянием экзогенных воздействий давать начало целому растительному организму
Адвентивные побеги Адвентивные побеги — побеги, которые образуются на любом участке стебля, корня или листа
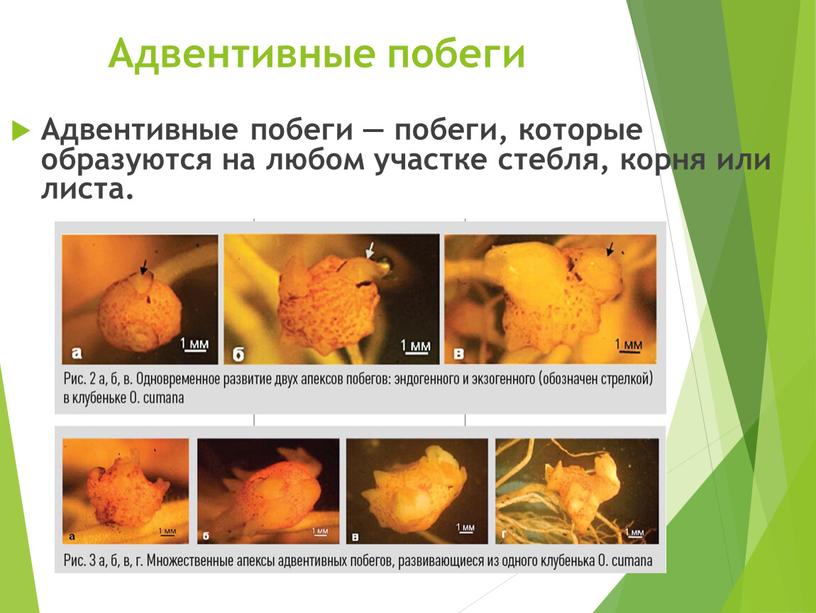
Адвентивные побеги — побеги, которые образуются на любом участке стебля, корня или листа.
Индукция соматического эмбриогенеза
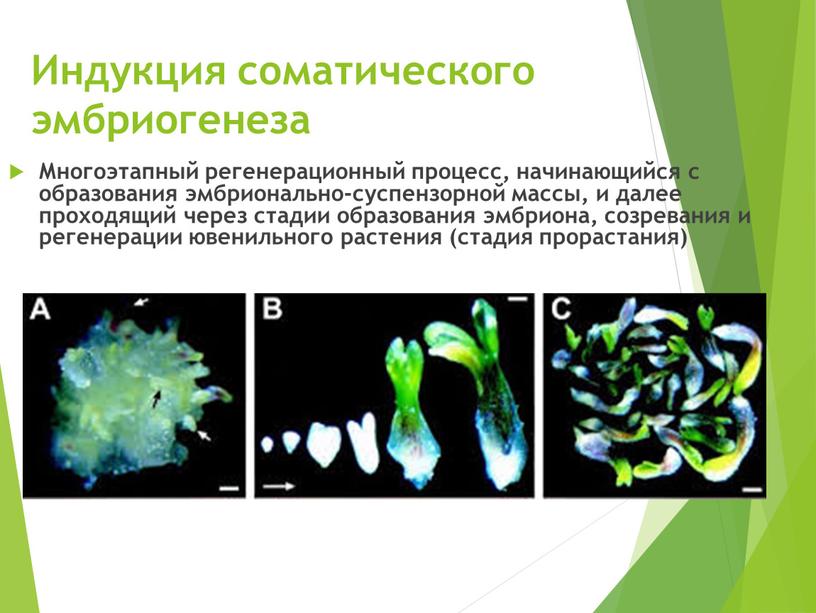
Индукция соматического эмбриогенеза
Многоэтапный регенерационный процесс, начинающийся с образования эмбрионально-суспензорной массы, и далее проходящий через стадии образования эмбриона, созревания и регенерации ювенильного растения (стадия прорастания)
Методы микроклонального размножения

Методы микроклонального размножения
Клональным микроразмножением называют неполовое размножение растений с помощью метода культуры тканей, позволяющее получать растения идентичные исходному.
В основе получения таких растений лежит способность соматических клеток растений полностью реализовать свой потенциал развития, т.е. свойство тотипотентности.
Первый и основной метод – активизация пазушных меристем
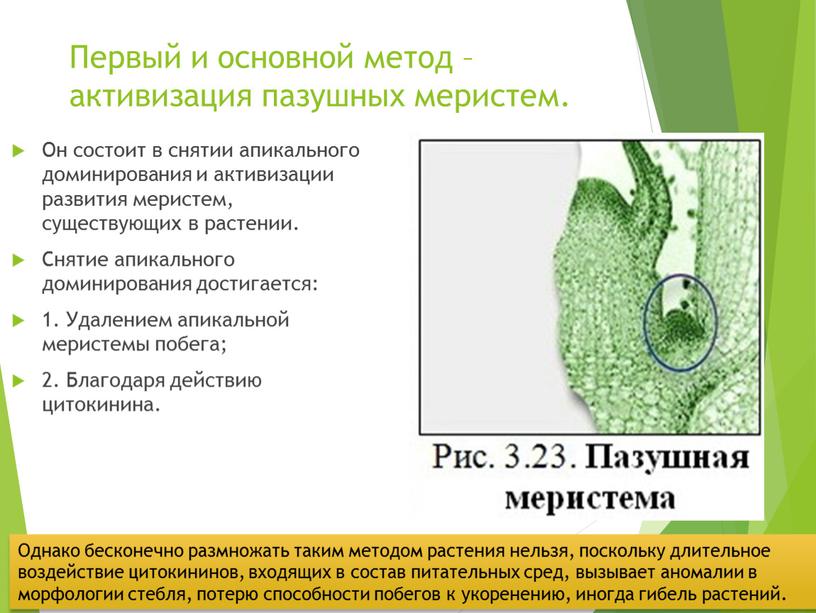
Первый и основной метод – активизация пазушных меристем.
Он состоит в снятии апикального доминирования и активизации развития меристем, существующих в растении.
Снятие апикального доминирования достигается:
1. Удалением апикальной меристемы побега;
2. Благодаря действию цитокинина.
Однако бесконечно размножать таким методом растения нельзя, поскольку длительное воздействие цитокининов, входящих в состав питательных сред, вызывает аномалии в морфологии стебля, потерю способности побегов к укоренению, иногда гибель растений.
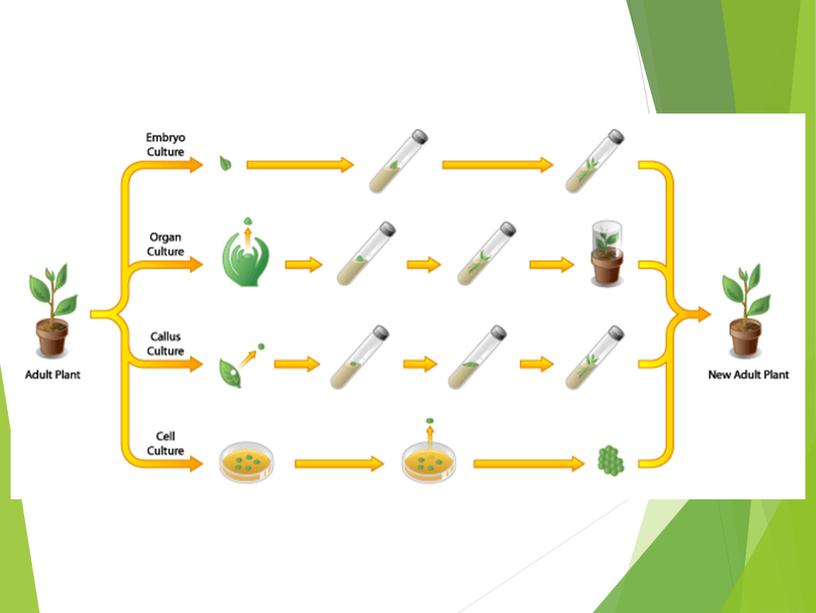
Метод клонального микроразмножения, основанный на использовании таких меристематических тканей, как меристемы верхушечные (1) стебля (2) и корня (3), камбий (4) представлены на рис

Метод клонального микроразмножения, основанный на использовании таких меристематических тканей, как меристемы верхушечные (1) стебля (2) и корня (3), камбий (4) представлены на рис. 3.24.
Презентация микроклональное размножение
Презентация микроклональное размножение
Преимущества получение генетически однородного посадочного материала; освобождение растений от вирусов за счет использования меристемной культуры; высокий коэффициент размножения сокращение продолжительности селекционного процесса; ускорение перехода растений…

получение генетически однородного посадочного материала;
освобождение растений от вирусов за счет использования меристемной культуры;
высокий коэффициент размножения
сокращение продолжительности селекционного процесса;
ускорение перехода растений от ювенильной к репродуктивной фазе развития;
размножение растений, трудно размножаемых традиционными способами;
возможность проведения работ в течение всего года;
возможность автоматизации процесса выращивания.
Этот метод имеет ряд преимуществ перед существующими традиционными способами размножения: высокий коэффициент размножения (105–106 – для травянистых, цветочных растений, 104–105 – для кустарниковых древесных, 104…

Этот метод имеет ряд преимуществ перед существующими традиционными способами размножения:
высокий коэффициент размножения (105–106 – для травянистых, цветочных растений, 104–105 – для кустарниковых древесных, 104 – для хвойных);
возможность проведения работ в течение года и экономия площадей, необходимых для выращивания посадочного материала;
получение генетически однородного посадочного материала;
освобождение растений от вирусов за счет использования меристемной культуры;
ускорение перехода растений от ювенильной к репродуктивной фазе развития;
сокращение продолжительности селекционного процесса;
получение растений, трудно размножаемых традиционными способами;
возможность автоматизации процесса выращивания.
Процесс клонального микроразмножения можно разделить на несколько этапов: 1 – й этап 2–й этап 3–й этап 4–й этап
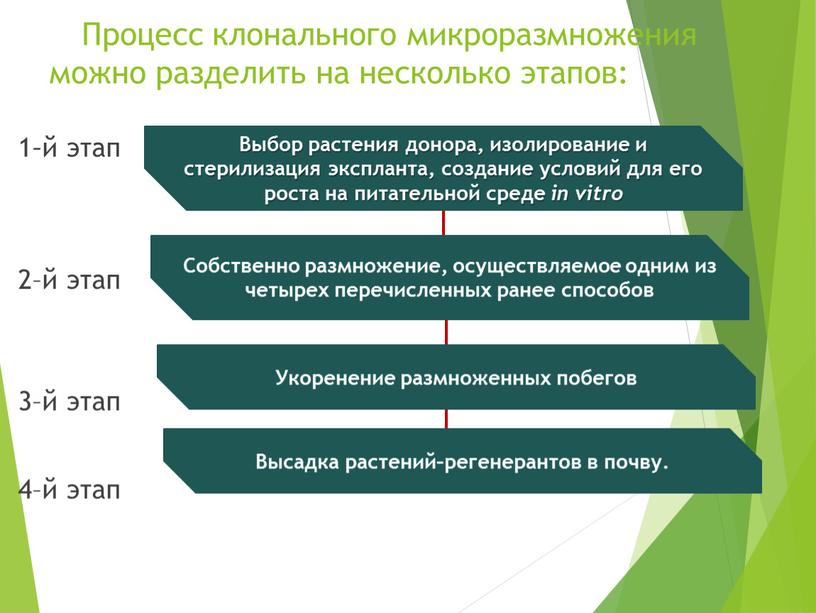
Процесс клонального микроразмножения можно разделить на несколько этапов:
Выбор растения донора, изолирование и стерилизация экспланта, создание условий для его роста на питательной среде in vitrо
Собственно размножение, осуществляемое одним из четырех перечисленных ранее способов
Укоренение размноженных побегов
Высадка растений–регенерантов в почву.
Выбор растения донора, изолирование и стерилизация экспланта, создание условий для его роста на питательной среде in vitrо

Выбор растения донора, изолирование и стерилизация экспланта, создание условий для его роста на питательной среде in vitrо
Требования
Получения хорошо растущей стерильной культуры.
Используют среду МС, с различными биологически активными веществами и стимуляторы роста (ауксины, цитокинины) в различных сочетаниях в зависимости от объекта. Продолжительность первого этапа – от 1 до 2 месяцев.
Собственно размножение, осуществляемое одним из четырех перечислен-ных ранее способов

Собственно размножение, осуществляемое одним из четырех перечислен-ных ранее способов
Требования
Используют питательную среду МС с оптимальным соотношением и концентраций цитокининов (БАП - 1 - 10 мг/л) и ауксинов (ИУК и НУК - до 0,5 мг/л).
Не допускается культивирование растительных тканей в питательных средах с повышенным содержанием цитокининов (10 мг/л), т.к. происходит постепенное накопление их в тканях выше необходимого физиологического уровня, что приводит к формированию растений с измененной морфологией.
Укоренение размножен-ных побегов

Укоренение размножен-ных побегов
Требования
Замена основного состава среды. Уменьшение в 2-4 раза концентрации минеральных солей в среде МС, снижение концентрации сахара до 0,5–1 % и полное исключение цитокининов (оставляют лишь ауксины). В качестве стимулятора корнеобразования используют ИМК, ИУК или НУК.
Укоренение микропобегов проводят двумя способами:
- выдерживание микропобегов в течение 2–24 ч в стерильном концентрированном растворе ауксина (20–50 мг/л) с последующим их культивированием на агаризованной среде без гормонов или непосредственно в подходящем почвенном субстрате (импульсная обработка);
- культивирование микропобегов в течение 3–4 недель непосредственно на питательной среде, содержащей ауксин в невысоких концентрациях (1–5 мг/л).
Высадка растений–регенерантов в почву

Высадка растений–регенерантов в почву.
Требования
Время для пересадки пробирочных растений – весна или начало лета. Растения с двумя–тремя листьями и хорошо развитой корневой системой вынимают из колб или пробирок пинцетом.
Корни отмывают от остатков агара и высаживают в почвенный субстрат, предварительно простерилизованный при 85–90 °С в течение 1–2 ч. Горшочки с растениями помещают в теплицы с регулируемым температурным режимом (20–22 °С), освещенностью не более 5 тыс. лк и влажностью 65–90 %.
Для лучшего роста растений создают условия искусственного тумана или горшочки с растениями накрывают стеклянными банками или полиэтиленовыми пакетами.

Для каждого огородника, хоть профессионала, хоть любителя, важно знать, каким образом можно размножать свои посадки. Способов существует достаточно много, и одним из наиболее интересных и действенных является метод микроклонального размножения. Что это такое, как работает и все основные его премудрости - в нашем материале.
Что же это?
Начнем сразу с самого главного. В словосочетании "микроклональное размножение" второе слово понятно всем, а вот первое - только избранным. Проясним ситуацию. Что же есть такое "микроклональное"?
Если говорить "умным" научным языком, то это особый подвид вегетативного размножения с использованием техники под названием "инвитро" (in vitro), который дает возможность получить растения в более короткие сроки. Понятнее и подробнее будем разбираться дальше, и для этого сначала напомним о том, что представляет собой вегетативное размножение, и поясним, что означает термин "инвитро".
В научных дебрях
Из курса школьной биологии нам известно, что размножать растения можно двумя путями: семенным (когда мы разбрасываем в почву семена) и вегетативным. Вегетативное размножение является бесполым, оно происходит с помощью отделения некой части от растения-родителя. Почкование, укоренение молодых побегов, пересадка луковиц - все это вегетативное размножение.
Казалось бы, с помощью семян увеличивать численность растений гораздо проще - нет такой мороки. Однако у этого метода есть немало минусов; в отдельных случаях воспользоваться семенами вообще невозможно - и вегетативный способ, неоспоримое преимущество которого перед первым состоит в сохранении совокупности генов растения-родителя, остается единственно доступным и удобным. Но к сожалению, недостатков хватает и у него. Например, отсутствие нужной эффективности (у таких, допустим, растений, как дуб, сосна и так далее), "пожилые" древесные породы (которым больше 15 лет) не способны размножаться черенкованием, подобные процедуры довольно трудоемки и энергозатратны, не всегда полученные растения соответствуют норме и образцу (могут быть зараженными) - ну и так далее.

И именно для этих случаев существует технология микроклонального размножения растений, которая, как Чип и Дейл, спешит на помощь. Как уже говорилось выше, она осуществляется в технике "инвитро", что с латинского языка переводится как "в пробирке". Таким образом, данная методика позволяет "клонировать" в "пробирке" растение с генами точь-в-точь такими, как и у родительской особи. Это происходит благодаря тому, что клетка способна давать жизнь новому организму под влиянием внешних факторов.
У технологии микроклонального размножения есть, бесспорно, целый ряд достоинств и преимуществ. О них далее и поговорим.
Чем метод микроклонального размножения лучше
Многим! И в первую очередь отсутствием вирусов и инфекций у выведенных растений (потому, что для этого используются особые клетки - они называются меристемными, особенность их заключается в непрестанном делении и наличии физиологической активности на протяжении всей жизни). Также у растений, "добываемых" таким способом, присутствует достаточно высокий объем размножения, а весь селекционный процесс проходит гораздо быстрее. С помощью технологии микроклонального размножения возможно осуществить эту процедуру и для тех растений, для которых обычными, "традиционными" методами это сделать крайне проблематично. Наконец, в технике "инвитро" выращивать растения можно в течение всего года, не ограничиваясь каким-либо одним промежутком. Так что плюсов у подобной методики действительно много. И прежде чем углубляться в суть микроклонального размножения растений, коснемся немного истории возникновения данного способа. Кому и как пришла в голову такая идея?
История метода
Первым успешный опыт над орхидеями произвел ученый-француз еще в пятидесятых годах прошлого столетия. При этом не он стал изначально заниматься техникой "инвитро" - ее разрабатывали и до него, и вполне успешно. Однако именно Жан Морель - таково имя француза-экспериментатора - решился на подобный опыт и осуществил его вполне удачно. Работы же, рассказывающие про данную технику, появились еще на несколько десятилетий до него - в двадцатых годах прошлого же столетия.

"Пробирочный клон" древесного растения - конкретно осины - был получен в шестидесятых годах. Работать с деревом оказалось труднее, нежели с цветами и иными видами растений, однако и эти трудности через определенный промежуток времени были преодолены. В настоящее время более 200 видов деревьев из более чем сорока семейств можно получать "пробирочным" способом. Технология микроклонального размножения растений оправдывает себя и дает свои плоды.
Подробнее о методе
Как уже можно было догадаться, в разработке и применении микроклонального размножения растений существует много своих тонкостей. Так, например, есть особые этапы у данной технологии, соблюдать которые для получения желаемого результата просто необходимо. Нужно понимать, что пренебрежение последовательностью действий или каким-то этапом может принести абсолютно не тот итог, на который рассчитывает селекционер. Итак, об этапах данной методики мы и поговорим далее.
Этапы микроклонального размножения растений
Подобная технология предполагает четыре "ступеньки" на пути к получению заветных "клонов". Постараемся рассказать о них как можно более ненаучно, поскольку термины биотехнологии - вещь все же не самая понятная для широкой аудитории. И, кстати, один из этих терминов тут же и поясним: эксплант - так ученые в данной области именуют отделенный от родительского организма новый организм. То есть тот самый "подопытный", который и будут выращивать далее.
Итак, перейдем к нашим "ступенькам". Первый шажок - это выбор собственно родителя - или донора. К этому вопросу следует подойти с максимальной серьезностью и ответственностью, потому что для получения хорошего, крепкого, здорового растения мы и "оригинал" должны подобрать такой же. Яблоко-то от яблони, как известно, недалеко падает.
На этом же этапе необходимо изолировать и стерилизовать экспланты, после чего организовать такие условия, чтобы рост этих самых эксплантов в технике "инвитро" происходил максимально комфортно.
Вторая "ступенька" проще некуда - это само размножение. Оно возможно через месяц-полтора, когда мини-череночки уже достигли размера горошинок и имеют зачатки всех вегетативных органов. За ним, в свою очередь, следует укоренение побегов, которые получились на предыдущем этапе. Его проводят, когда растение уже образовало хорошую корневую систему.

Последний шаг - помощь растениям в адаптации к "жизни" в почве, выращивание их в теплице, последующая пересадка в землю либо реализация - так сказать, "отправление в большой мир". Этот этап, как это ни странно, наиболее трудоемкий и многозатратный, поскольку очень часто, к сожалению, бывает такое, что, оказавшись в почве, растение начинает терять листья, останавливаться в росте – а затем и вовсе оно может погибнуть. Все это происходит потому, что пробирочные растения при пересадке в грунт теряют очень много воды. Следовательно, необходимо в процессе пересаживания предотвратить подобную возможность – для чего рекомендуется опрыскивать листья 50-процентным водным раствором глицерина или смесью парафина. Делать это необходимо на протяжении всего акклиматизационного периода. Кроме того, в некоторых случаях целесообразной является намеренная микоризация – то есть искусственное внедрение в ткани растения грибов, которые заражают его. Проводится это для того, чтобы растение получило как можно больше полезных питательных и органических веществ, а также было защищено от различных патогенов.
Вот и все этапы микроклонального размножения, в которых, как мы видим, нет ничего глобально сложного или сверхъестественного, однако, повторим еще раз, все это мероприятие требует большой ответственности и внимания.
Влияющие факторы
- Сортовые, видовые и физиологические особенности растения-родителя – оно должно быть здоровым, интенсивно расти, при необходимости обработано температурным воздействием.
- Возраст, строение и происхождение экспланта.
- Длительность культивирования.
- Эффективность стерилизации.
- Удачная питательная среда.
- Гормоны, минеральные соли, углеводы, витамины.
- Температура и освещение.
Что нужно для микроразмножения
К растениям, которые будут размножать вышеуказанным образом, предъявляется одно очень важное требование - помимо того, что они должны быть здоровы. Это непременное сохранение генетической стабильности на протяжении всех вышеупомянутых этапов. Такому требованию лучше всего отвечают апикальные меристемы, а также пазушные почки стеблевого происхождения, поэтому именно их и предпочитают использовать для интересующей нас процедуры.
Вышеупомянутые термины должны быть непонятны простому обывателю. Ниже попробуем растолковать, что это за звери такие и с чем их подавать к столу.
Апикальные меристемы
Выше мы уже упоминали о существовании особых меристемных клеток - иначе говоря, образовательных. Это клетки, которые непрестанно делятся, всегда находятся в состоянии физической активности - благодаря чему нарастает масса растения и образуется особая ткань этого самого растения. Она и называется меристемой. Видов меристем бывает много разных. В целом их можно поделить на общие и специальные. В понятие общих меристем входят три группы, которые как бы вытекают одна из другой. Самая первая меристема у растения - меристема зародыша, из которой как раз-таки и берет начало интересующая нас апикальная меристема.
Слово "апикальный" произошло от латинского "апикс" и переводится оно как "вершина". Таким образом, это верхушечная система тканей, находящаяся на самом кончике зародыша - и именно из нее впоследствии формируется побег и начинается его рост и развитие. Значит, говоря об апикальной меристеме как об объекте для микроклонирования, мы должны понимать, что берем для наших нужд верхушечку зародыша.

С пазушными почками немного проще. Что такое почки, знают все. Пазушная почка - та, что родилась из пазухи листа. Пазуха листа, в свою очередь, это угол между листом и его стеблем; оттуда будет как раз и расти почка либо же побег. Вот эту самую часть, то есть будущий боковой побег, и берут тоже для последующего микроразмножения.
Теперь, когда свет над завесой тайны немного пролит, можно перейти, наконец, и к методам микроклонального размножения растений.
Способы размножения микро-образом
Микроклональное размножение тем еще хорошо, что предполагает в своей основе возможность использования сразу нескольких различных техник. Постараемся как можно проще осветить каждую из них. Всего насчитывается четыре метода микроклонального размножения растений.
Первый. Активация уже существующих в растении меристем
Что это значит? В растении, даже таком крошечном микрокусочке, уже заложены определенные меристемы. Это верхушка стебля и пазушные его почки. Для того чтобы микроклонировать растение, можно "в пробирке" "разбудить" эти спящие доселе меристемы. Достигается это либо удалением верхушечной меристемы микроросточка, вернее, его стебля, а затем черенкованием побега в технике "инвитро" либо же внедрением в питательную среду растения особых веществ, которые активизируют рост и развитие пазушных побегов. Метод активации "спящих" меристем является основным, наиболее популярным и действенным, а разработан он был еще в семидесятых годах минувшего столетия. Первым "подопытным кроликом" в применении микроклонального размножения растений подобного типа стала земляника. Важно заметить, впрочем, что бесконечно размножать культуры подобным образом запрещено, поскольку это чревато потерей способности к укоренению, а в некоторых случаях – гибелью растения.
Второй. Появление адвентивных почек силами самого растения
У любой изолированной части растения есть поистине волшебная способность, своя суперсила. Если при микроклональном размножении питательная среда растения и все прочие условия жизни благоприятны и комфортны, то оно может восстанавливать недостающие части. Происходит своеобразная регенерация - ткани растения образуют адвентивные, или придаточные почки - то есть такие, что возникают как бы "из старых запасов", а не из новых тканей. Такие почки необычны тем, что появляются, как правило, в тех местах, откуда их возникновения никак не ждешь - на корнях, к примеру. Именно подобным способом часто размножают многие цветы, опять же - землянику. Это второй по популярности и действенности метод микроклонального размножения растений.
Третий. Соматический эмбриогенез
Активно подобным методом микроклонального размножения растений пользуются при размножении масличной пальмы. Все дело в том, что, поскольку у нее нет ни побегов, ни боковых ростков, вегетативное размножение ее невозможно (ну или, во всяком случае, весьма и весьма затруднительно), как невозможно и черенкование. Таким образом, вышеуказанная методология единственная из всех наиболее доступна и оптимальна при работе с данным растением.
Четвертый. Работа с каллусной тканью
Данный метод из всех четырех вышеприведенных является, пожалуй, наименее востребованным. В первую очередь, это связано с тем, что слишком частое разделение клеток каллусной ткани способно привести к генным нарушениям и мутациям разного уровня. Поскольку сохранение генотипа очень важно для микроклонального размножения, и культура тканей должна соблюдаться на высшем уровне. Кроме того, при вышеуказанных нарушениях проявляются и иные недостатки: низкорослость, восприимчивость к болезням и так далее. Впрочем, в некоторых случаях исключительно подобным способом и возможно размножение – например, для сахарной свеклы иного метода попросту не подобрать.
Далее мы для примера скажем пару слов о клонировании конкретных растений, но прежде –нужно поделиться информацией об оздоровлении растений, использующихся в качестве посадочного материала. Каким образом этого можно добиться?
Оздоровление
О клонировании картофеля

При микроклональном размножении картофеля его выращивают в пробирках по два черенка, пробирки помещаются под свет люминесцентных ламп силой от шести до восьми тысяч люкс, температура сохраняется ночью в пределах восемнадцати градусов, днем – приблизительно двадцать пять. В России именно картофель выращивают с помощью клонирования наиболее активно.
О клонировании яблони: что нужно знать
В микроклональном размножении яблони широко применяется первый способ – размножение с помощью пазушных почек. Отмечается высокая способность данной культуры к укоренению и приживаемость большего количества эксплантов.

Их помещали в жидкую питательную среду, которая постоянно – ежедневно – обновлялась. Температура для пробирочных растений также поддерживалась на уровне двадцати пяти градусов днем, эксперимент проводился в течение трех-четырех недель.
Интересные факты

Такова информация о микроклональном размножении растений – теме насколько сложной, настолько и интересной.

Картофель является одной из основных продовольственных культур, а во многих странах мира по важности он занимает вторую позицию после зерновых. Традиционно данная культура размножается вегетативно – клубнями. Но этот способ имеет два основных недостатка. Первый состоит в относительно низком коэффициенте воспроизводства, что не позволяет быстро увеличивать площади посадки при изменении экономических условий или потребительского спроса. А во-вторых, картофель весьма восприимчив к вирусным, бактериальным и грибным болезням. При этом труднее всего избавить посадочный материал от вирусов, способных привести к существенному снижению урожая. Установлено, что некоторые из них (PLRV и некоторые варианты PVY) снижают урожай клубней на 50-80%. Единственным известным на сегодня способом избавления посадочного материала картофеля от вирусов является меристемная культура.
Зачем нужна меристемная культура
Меристемная культура позволяет достаточно быстро получить точные генетические копии растений, не зараженные вирусными, грибными и бактериальными инфекциями. Для ее осуществления создается хорошо контролируемая искусственная среда. Данный метод получил широкое распространение для вегетативного размножения многих видов растений. Среди основных его преимуществ следует отметить:
1. Возможность получения большого количества вегетативного посадочного материала, не зараженного вирусами, бактериями и грибами.
2. Возможность проведения работ на протяжении всего года.
3. Работы осуществляются на относительно ограниченной площади.
Эти факторы и стали причиной разработки и распространения технологии меристемного размножения картофеля. Состоит она из нескольких ключевых стадий:
1. Получение не зараженной вирусами меристемной культуры картофеля;
2. Несколько этапов размножения культуры черенкованием;
3. Стимуляция образования микро- или миниклубней из культуры тканей;
4. Высадка мини- или микроклубней в ростовую среду;
5. Вегетативное размножение посадочного материала традиционным методом (клубнями) на протяжении нескольких поколений.
Меристемная безвирусная культура
Материалом для меристемной культуры служит апикальная (верхушечная) меристема, как правило, с двумя пазушными почками (размером 0,1-0,3 мм). Перед ее срезанием, поверхность ткани стерилизуется. Отделение небольшого участка меристемы, размер которого не превышает несколько сот микрон, и его перевод в культуру тканей требует значительного уровня мастерства. Следует также отметить, что формирование даже небольшого растения из апикальной меристемы занимает довольно продолжительный период – от четырех до восьми месяцев.
Если отбирается маленький самый верхний участок меристемной ткани, то риск заражения вирусом резко снижается, но не исключает его полностью. Поэтому на следующей стадии осуществляют дополнительные операции по избавлению от инфекции – нагревание ткани (до 37°C) или ее обработка противовирусными химическими препаратами (например, рибавирин или виразол). Показано, что рибавирин эффективно справляется с наиболее важными вирусами, поражающими картофель – PVX, PVS и PVY. Кроме того, предварительное содержание растения-реципиента при повышенной температуре служит дополнительным средством избавления от вирусов.
Систематически в меристемной культуре отбираются образцы для анализа на присутствие вирусов в клетках растений. Для диагностики в большинстве случаев используют иммуноферментный твердофазный анализ (ELISA), позволяющий выявить даже незначительные количества специфических для вирусов белков, а также обратно-транскриптазный ПЦР анализ, выявляющий вирусную РНК.
Размножение регенерирующих растений
Побеги, вырастающие в пробирке из верхушечных и боковых почек, используют для получения новых растений. За счет этого удается существенно увеличить количество растений-регенератов (их называют мериклонами). Приблизительно за три недели из черенков образуются новые растения. Их можно снова разделить и пересадить на свежую среду. Если предположить, что за каждую такую операцию растение разделяется минимум на три новых зачатка, а интервал между разделениями составляет 25 дней, то, теоретически, за год может быть получено более 14 млн растений из одного меристемного зачатка.
Выращивание микроклубней
Микроклубнями называются небольшие (средний вес 0,10-0,15 г.) клубни, выращенные в пробирке. Их можно хранить продолжительное время, а также перевозить на большие расстояния. Появление микроклубней из мериклонов стимулируется изменением химического состава культуральной среды.
Перед посадкой микроклубни должны пройти период покоя на протяжении 3-4 месяцев при температуре 5-6° С. Отклонение условий хранения микроклубней от оптимальных может привести к значительным потерям из-за преждевременного прорастания. Выставление микроклубней на рассеянный свет для позеленения за 10-15 дней до высадки приводит к накоплению в них гликоалколоидов, что существенно повышает устойчивость к грибным и бактериальным болезням.
Миниклубни
Миниклубни могут быть получены из микроклубней или меристемной культуры. Они являются стадией производства безвирусного посевного материала картофеля, разделяющей лабораторные операции и размножение в полевых условиях. В настоящее время для получения миниклубней из культуры тканей преимущественно используется гидропоника или аэропоника. Это позволяет снизить затраты, вести работы круглый год и уменьшить потери.
Миниклубни получают из микроклубней при их плотной высадке на рассадочную грядку. Данный подход требует меньших усилий на пред- и постпосадочные процедуры, но отнимает несколько дополнительных месяцев на дозревание микроклубней.
Обычно размер миниклубней составляет 1,0-1,5 см, что идеально подходит для хранения, перевозки и механизированной посадки.
Размножение посадочного материала
Изредка в мировой практике наработанные миниклубни используют в качестве посадочного материала при коммерческом выращивании картофеля. Но это не оправдано с экономической точки зрения. Поэтому урожай, полученный из миниклубней, становится преэлитой, которая проходит еще несколько стадий размножения в полевых условиях (супер-суперэлита, суперэлита, элита, первая репродукция), пока не будет получено достаточное количество посадочного материала.
В странах с умеренным климатом посадочный материал, вышедший из лаборатории, должен пройти стадию закаливания. Поэтому на первом этапе его высаживают в теплицы-изоляторы в искусственный торфяно-песчаный грунт. Специалисты тщательно следят за состоянием растений, обеспечивают им оптимальные условия для роста и развития, отбраковывают экземпляры с признаками болезни. По окончании данного этапа отбираются образцы для анализа на зараженность вирусами.
Следующие этапы размножения посадочного материала проходят в открытом грунте. При этом стараются подбирать такие участки, где риск заражения вирусами и грибами, поражающими картофель, минимален. В течение вегетационного сезона уделяется особое внимание защите растений от вредителей и грибных заболеваний (фитофторы). Заболевшие растения тут же удаляются. За несколько недель до уборки ботва картофеля обычно срезается, что снижает риск заражения вирусами, которые могут переноситься насекомыми-вредителями.
Меристемная культура картофеля в России
Именно картофель стал той сельскохозяйственной культурой, в отношении которой были впервые использованы биотехнологические методы для избавления посадочного материала от вирусов. Сегодня этот метод оздоровления посадочного материала широко распространен практически во всех странах, где картофель имеет существенную долю в севообороте.
К сожалению, внедрение данной технологии в России происходит не так быстро, как хотелось бы. Хотя и созданы региональные лаборатории оригинального семеноводства картофеля, но в регионах существуют проблемы с высококвалифицированными кадрами (микробиологами, физиологами растений, специалистами по ИФА-анализу). Кроме того, полученный в лаборатории материал должен пройти несколько стадий репродукции. Это подразумевает наличие значительных площадей, отвечающих ряду довольно жестких условий, а такие поля далеко не всегда имеются поблизости.
Мировая практика показала, что здесь наиболее целесообразно разделение труда. Лаборатория оздоравливает посадочный материал и продает миниклубни на размножение следующему звену производителей посадочного материала. Оно получает супер-суперэлиту и передает ее дальше. И уже только следующее звено реализует элиту и первую репродукцию. Причем все они выращивают картофель почти исключительно на цели воспроизводства. Такое разделение труда позволяет повысить эффективность работы всей цепочки.
Организации, занимающиеся производством безвирусного посадочного материала картофеля с использованием методов биотехнологии, как правило, реализуют не только клубни первой или второй генерации, но и предлагают заказчикам более ранние поколения, которые предстоит размножить собственными силами. За счет этого они избавляются от необходимости обработки значительных площадей, на которых выращивается посадочный материал поздних генераций, а заказчик может заметно снизить собственные затраты.
Следует отметить, что отечественный рынок оздоровленного посадочного материала картофеля заполнен еще очень слабо, и его развитие должно сопровождаться увеличением производительности картофелеводства и переходом отрасли на качественно новую основу.

1. Милехин А.В., Рубцов С.Л., Бакунов А.Л., Дмитриева Н.Н., Вовчук О.А. Перспективы использования биотехнологических установок в безвирусном семеноводстве картофеля в Среднем Поволжье // Известия Самарского научного центра РАН. 2014. Т. 16. № 5(3). С. 1184–1191.
2. Рубцов С.Л., Милехин А.В., Шевченко С.Н., Бакунов А.Л., Дмитриева Н.Н. Методика микроклонального размножения и производство оздоровленных миниклубеней в оригинальном семеноводстве картофеля в условиях высокой инфекционной нагрузки Самарской области // Известия Самарского научного центра Российской академии наук. 2017. Т. 19. № 2(4). С. 650–658.
3. Кушнаренко С.В., Ромаданова Н.В., Аралбаева М.М., Матакова Г.Н., Бекебаева М.О., Бабисекова Д.И. Создание коллекции in vitro сортов и гибридов картофеля как исходного материала для криоконсервации // Биотехнология. Теория и практика. 2013. № 1. C. 28–33.
4. Калинин Ф.Л., Сарнацкая В.В., Полищук В.Е. Методы культуры тканей в физиологии и биохимии растений. Киев: Наукова думка, 1980. 488 с.
5. Дорошенко Н.П. Антибиотики при клональном микроразмножении винограда // Плодоводство и виноградарство юга России. 2016. № 37 (1). С. 126–143.
6. Лакин Г.Ф. Биометрия: Учебное пособие для биол. спец. вузов. 4-е изд., перераб. и доп. М.: Изд-во Высш. Школа, 1990. 352 с.
Картофель имеет большое значение в решении глобальной продовольственной проблемы, являясь важнейшей продовольственной культурой. Большое внимание уделяется оздоровлению семенного картофеля от вирусных болезней, снижающих урожайность культуры. Основным направлением получения оздоровленного посадочного материала является микроклональное размножение [1, 2], преимуществами которого также являются возможность получать высококачественный семенной картофель в условиях лаборатории круглый год в гораздо больших объёмах. В настоящее время в литературе имеются данные по микроклональному размножению картофеля [3], однако поиск эффективного способа стерилизации эксплантов всё ещё ведётся. Соблюдение условий стерильности в процессе микроклонального размножения культур, в том числе картофеля, является важнейшим фактором его успешного проведения. Растения обладают высокой восприимчивостью к микроорганизмам, подавляющим их рост, и не способны сопротивляться инфекциям. А поскольку питательная среда [4], на которой выращиваются экспланты, является идеальной средой для роста микроорганизмов, необходимо не только исключить возможность контаминации из внешней среды, но и обеспечить эффективную стерилизацию растительного материала, так как на его поверхности и внутри тканей почти всегда присутствует посторонняя микрофлора. Для этих целей применяют широкий спектр химических препаратов, однако стерилизующие агенты очень видоспецифичны и их выбор зависит от множества факторов: размер экспланта, наличие кожуры, плотность покровных тканей и др. Необходимо подобрать такие способы и режимы обработки экспланта, которые бы обеспечили его полную стерилизацию, не повредив при этом клеток и тканей растения. Целесообразно выбирать препараты, обладающие не только бактерицидной, но и фунгицидной, а также спороцидной активностью, что увеличивает эффективность стерилизации.
Цель исследования: подбор стерилизующего агента, а также оптимизация режимов стерилизации растительного материала (эксплантов картофеля сортов Импала и Ред Скарлетт).
Материалы и методы исследования
Экспериментальные исследования проводились в лаборатории биотехнологий ФНЦ агроэкологии РАН, а также в ФГАОУ ВО ВолГУ. Для проведения исследований были выбраны районированные и рекомендованные для выращивания в Волгоградской области сорта картофеля Импала и Ред Скарлетт, имеющие высокое продовольственное значение, благодаря низкому количеству в мякоти редуцирующих сахаров, что необходимо для производства чипсов и фри-продукции.
Целями данного исследования являлись подбор стерилизующего агента, а также оптимизация режимов стерилизации растительного материала по плану исследования, представленному в табл. 1. В качестве первичных эксплантов использовали этиолированные ростки картофеля изучаемых сортов. Для получения этиолированных проростков клубни картофеля тщательно промывали под проточной водой, удаляя поверхностные загрязнения мыльным раствором. Затем клубни обрабатывали слабым раствором перманганата калия в течение 20 мин, помещали в картонные коробки с перфорацией, дно которых было выстлано влажной фильтровальной бумагой, и проращивали при 25 °С в течение 7–14 дней.
Исследуемые способы и режимы стерилизации эксплантов
Содержание активного
вещества
Этанол + пероксид
водорода
15 с (С2Н5ОН), 15 мин (Н2О2)
15 с (С2Н5ОН), 20 мин (Н2О2)
Работа в условиях ламинар-бокса, а также приготовление и автоклавирование питательных сред, подготовка посуды, обработка помещения, стерилизация посуды и инструментов проводились согласно общепринятым стандартам и методикам работы в асептических условиях [5]. Параллельно проводилась проверка стерильности условий проведения опыта: пробирку с питательной средой выдерживали в термостате при температуре 37 °С в течение 48 ч. Учет количества асептических жизнеспособных, асептических нежизнеспособных, инфицированных растений проводился ежедневно на протяжении 14 дней.
Все эксперименты по определению эффективности влияния способа стерилизации эксплантов проводили в 100-кратной повторности. Статистический анализ проводили по общепринятым методикам [6].
Результаты исследования
и их обсуждение
Оценка состояния исследуемых растений проводилась в течение двух недель со дня начала эксперимента посредством визуального осмотра. Для наглядного представления полученных результатов были отобраны 4 пробирки, внешний вид которых представлен на рисунке.

Общий вид эксплантов на 7 день культивирования: 1 – стерильный жизнеспособный эксплант, признаки заражения отсутствуют;
2 – стерильный нежизнеспособный эксплант, отмечено отмирание внешних тканей;
3 – нежизнеспособный эксплант с признаками бактериальной инфекции; 4 – нежизнеспособный эксплант, присутствует бактериальная и грибковая инфекция, фенольное
окисление питательной среды
Стерильность условий проведения эксперимента была подтверждена экспериментально – при термостатировании пробы с питательной средой роста микроорганизмов обнаружено не было. В целом нами не установлено существенного влияния сорта картофеля на эффективность стерилизации эксплантов.
Учетным методом было подсчитано количество стерильных и инфицированных растений, а также тех эксплантов, что утратили жизнеспособность в результате химического ожога стерилизующим агентом. Результаты исследования приведены в табл. 2.
Ещё одним перспективным, на наш взгляд, способом было применение двухступенчатой стерилизации – погружение в 3 % раствор пероксида водорода с предварительной обработкой 95 % этанолом в течение 15 с. Время выдержки в пероксиде водорода варьировалось от 15 до 20 мин ввиду малой токсичности вещества для растений и его быстрого разложения при последующем промывании дистиллированной водой. Однако процент выживаемости культур оказался очень низким: экспланты приобретали темно-коричневый цвет, останавливался их рост, на третьи сутки после культивирования появлялись признаки грибковой инфекции.
Стерилизация материала исключительно пероксидом водорода по результатам исследования не отличается высокой эффективностью – 80 % эксплантов оказались инфицированы грибковыми культурами. При этом отсутствуют признаки отмирания тканей, что характеризует данный стерилизующий агент как щадящий и даёт перспективу его использования в совокупности с другими препаратами.
Зависимость жизнеспособности и стерильности растений от способа стерилизации
Читайте также:

