Вещество используемое для протравливания семян этанол уксусная кислота
Добавил пользователь Alex Обновлено: 19.09.2024
ВАРИАНТ 3. ЧАСТЬ А. Тестовые задания с выбором ответа и на установление соответствия
1.(3 балла) Функциональная группа – ОН называется:
2 (2 балла). Гомологами являются:
А.Метанол и этанол Б.Этиленгликоль и глицерин В.Этанол и этиленгликоль Г.Метанол и глицерин
3.(3 балла) Название вещества, формула которого CH3 —C(СН3)(ОН)—CH3
А.2-Метилпропанол-1 Б. 2-Метилбутанол-1 В.3-Метилбутанол-1 Г.2-Метилпропанол-2
4. (3 балла) Изомером вещества, формула которого CH3 —C(СН3)(ОН)—CH3 Является
5.(3 балла) Вещество, вступающее в реакцию с этанолом:
А. Гидроксид меди(2)
В. Гидроксид натрия
6.(3 балла) Реактивом для распознавания этиленгликоля является:
А.Бромная вода Б.Оксид меди(2) В.Гидроксид меди (2) Г.Аммиачный раствор оксида серебра.
7.(3 балла) Веществом Х в цепочке превращений C2H6-- X —C2H5OH Является: А. Этен
8.(3 балла) Способ получения пищевого этилового спирта:
Г.Все ответы верны
9. (3 балла) В качестве ароматизаторов в пищевой промышленности используют:
10.(3 балла) Установите соответствие Формула вещества: 1.С2H6 2/C2H5OH 3) C2H4 Класс соединений:
11.(8 баллов). Составьте уравнения реакций по схеме: Глюкоза—1 этиловый спирт—2 этаналь 3│ Этен
Укажите условия их осуществления
13.(10 баллов) По термохимическому уравнению C2H5OH+3O2—2CO2+3H2O+326,4 кДж рассчитайте количество теплоты, выделившейся при сгорании 92 г этилового спирта.
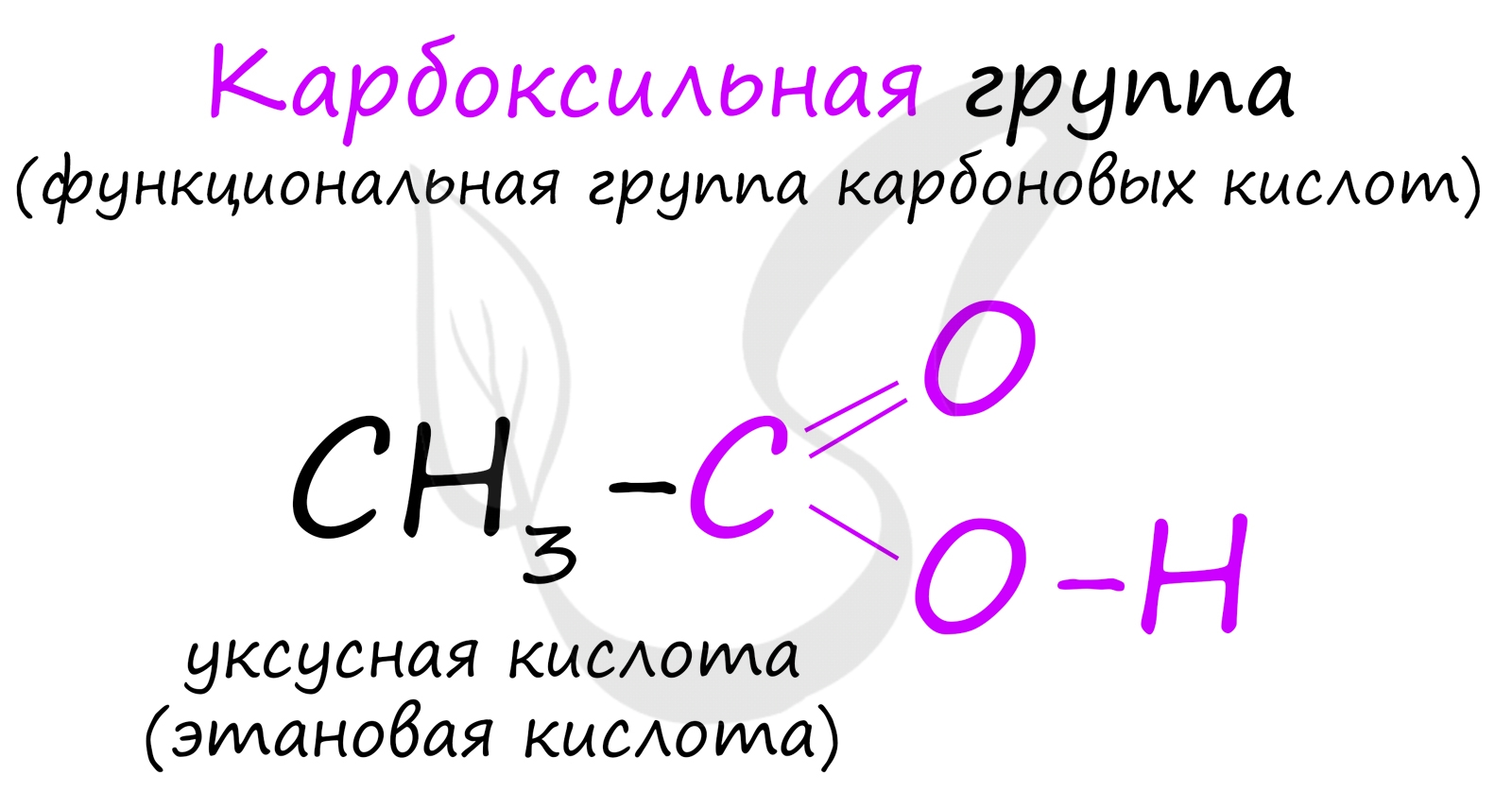
Карбоновые кислоты - класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп COOH.
Имеют разнообразное промышленное применение и большое биологическое значение. Общая формула одноосновных карбоновых кислот CnH2nO2 .
Классификация карбоновых кислот
- Одноосновные - 1 карбоксильная группа
- Двухосновные - 2 карбоксильных группы
- Трехосновные - 3 карбоксильных группы
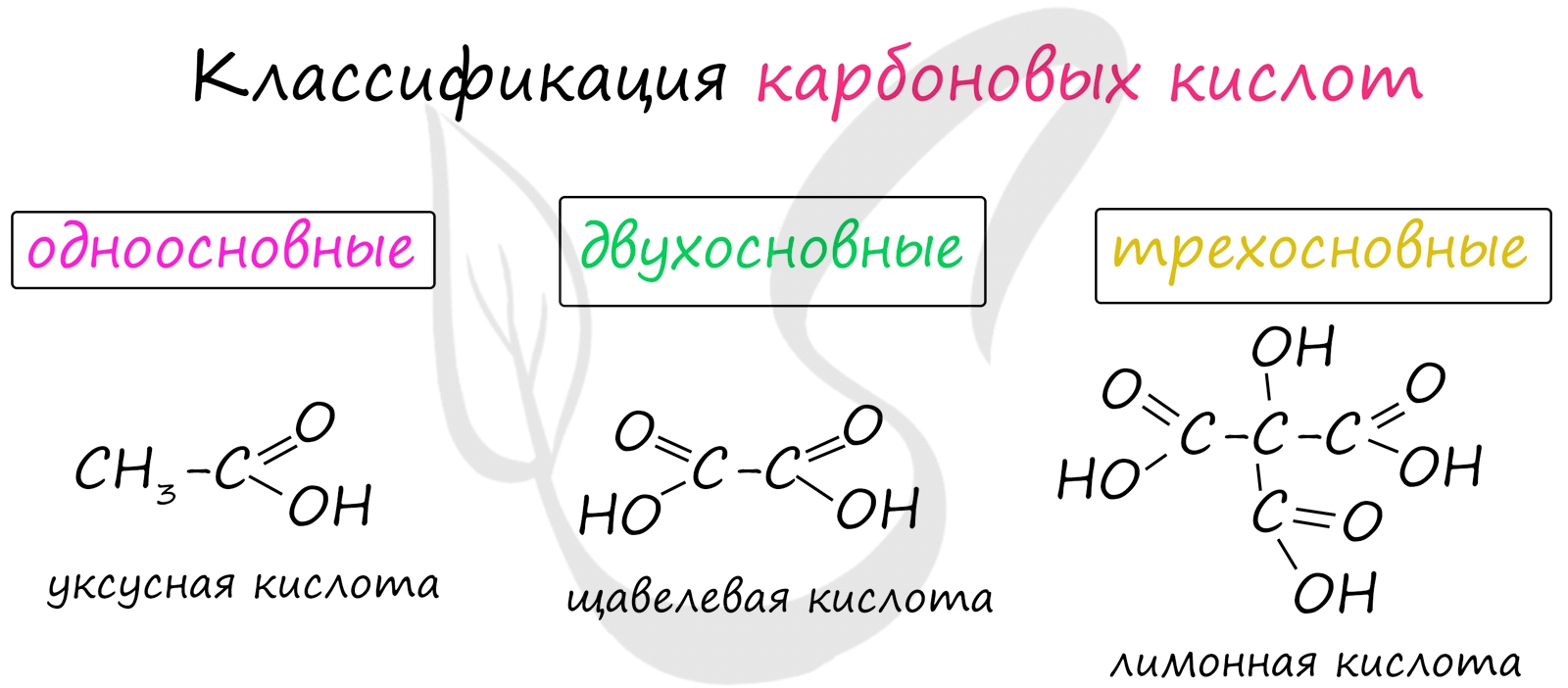
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
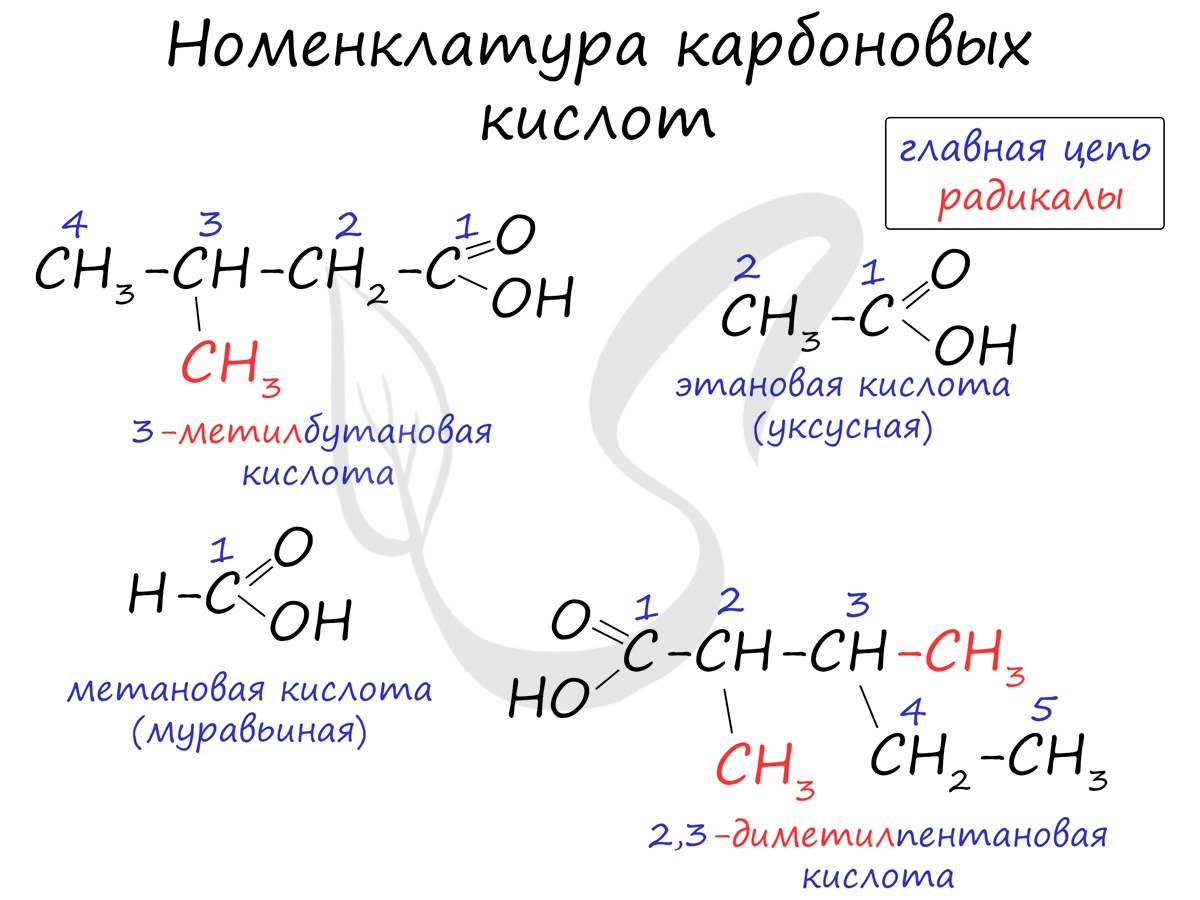
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса "овая" к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
- Метановая - HCOOH - муравьиная кислота
- Этановая - CH3-COOH - уксусная кислота
- Пропановая - C2H5-COOH - пропионовая кислота
- Бутановая - C3H7-COOH - масляная кислота
- Пентановая - C4H9-COOH - валериановая кислота
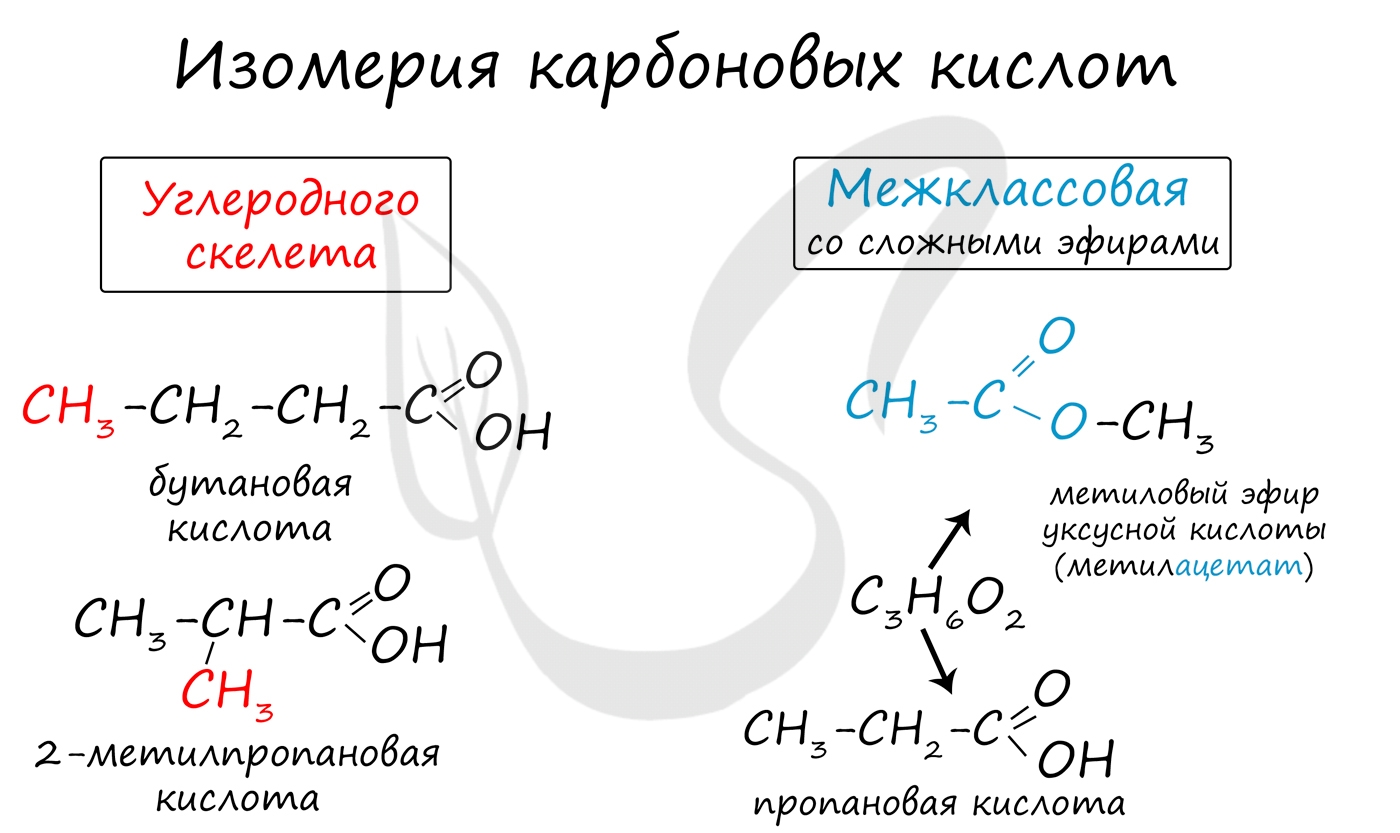
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
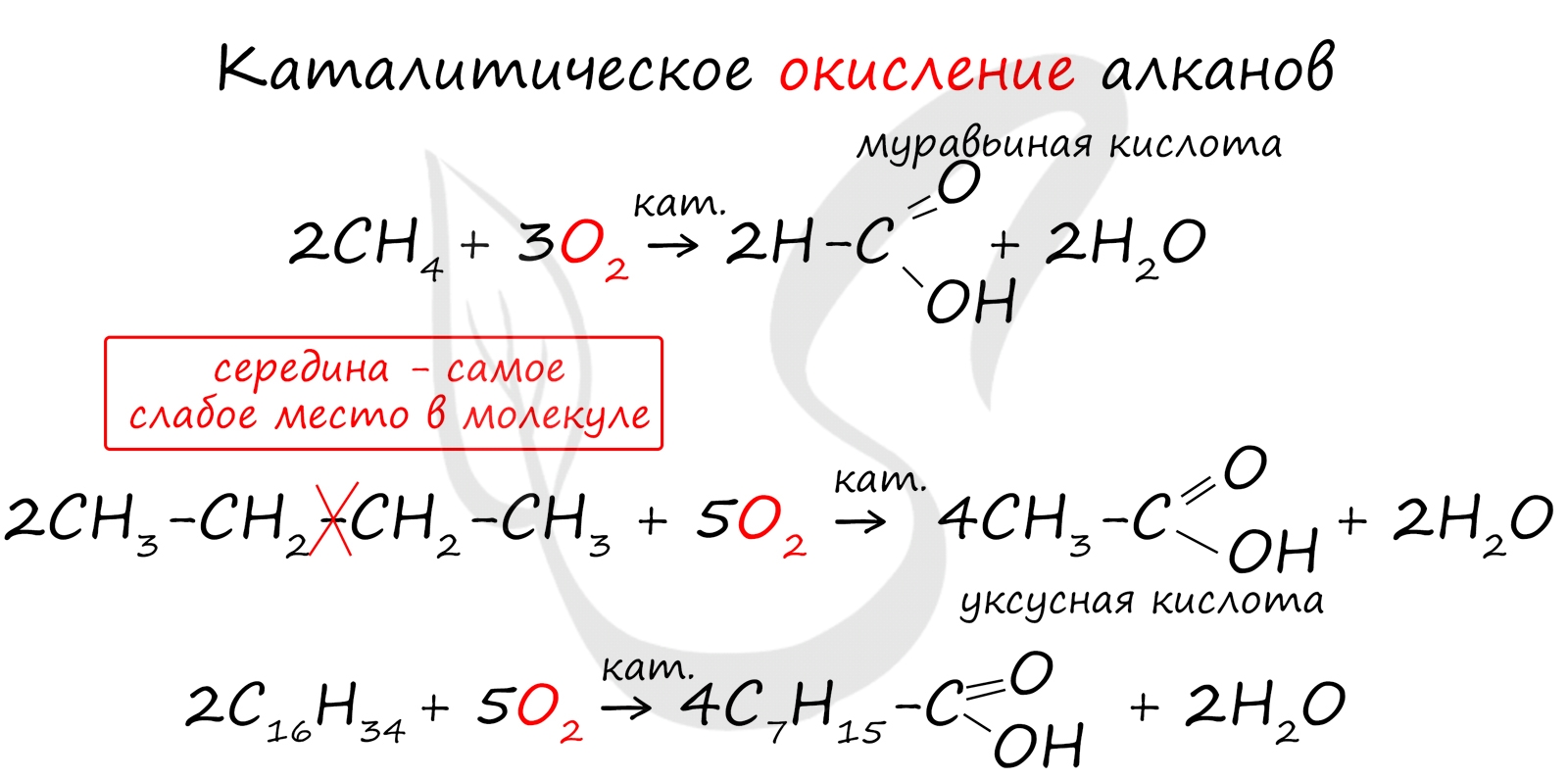
Получение карбоновых кислот
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.
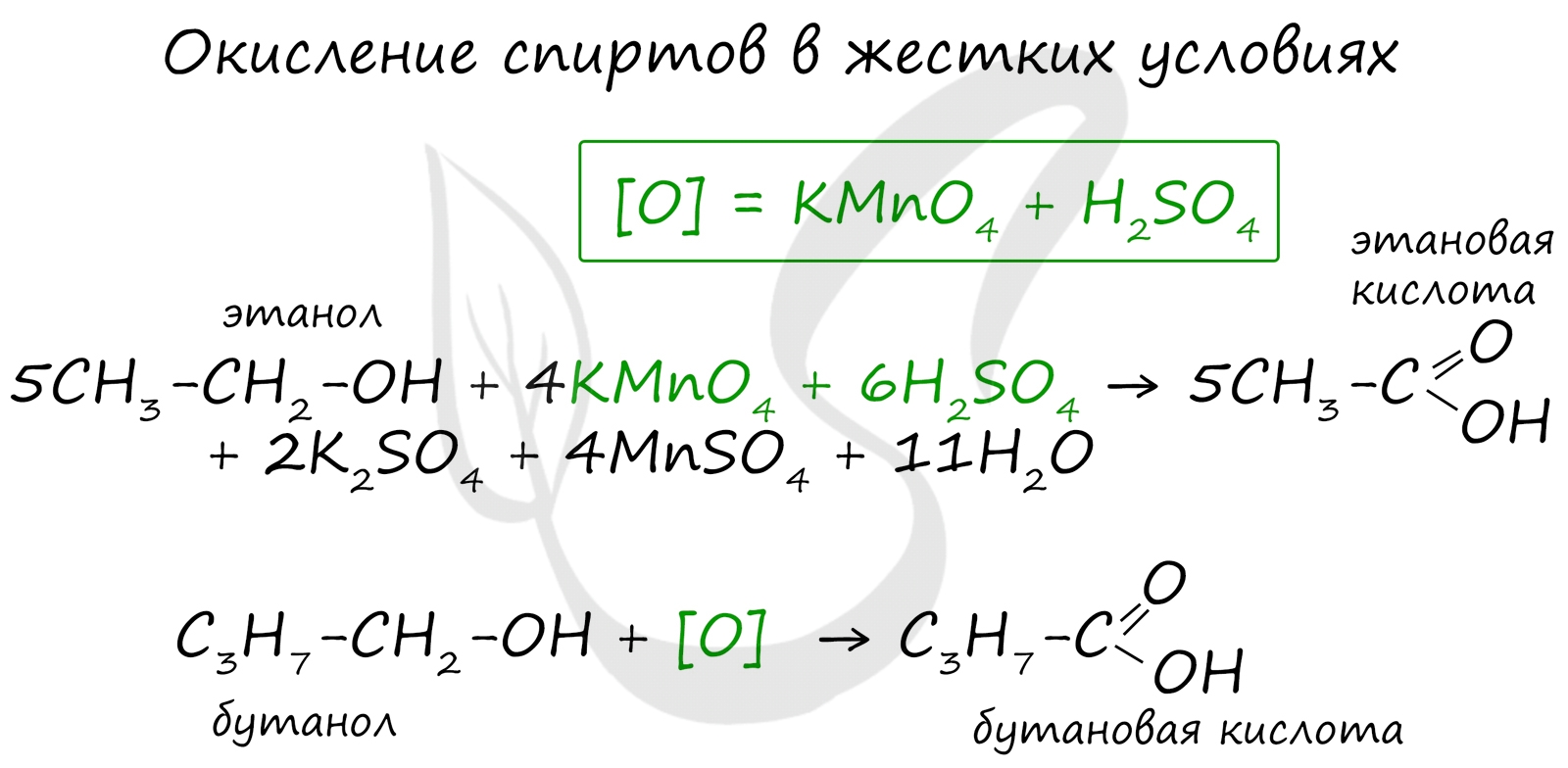
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.
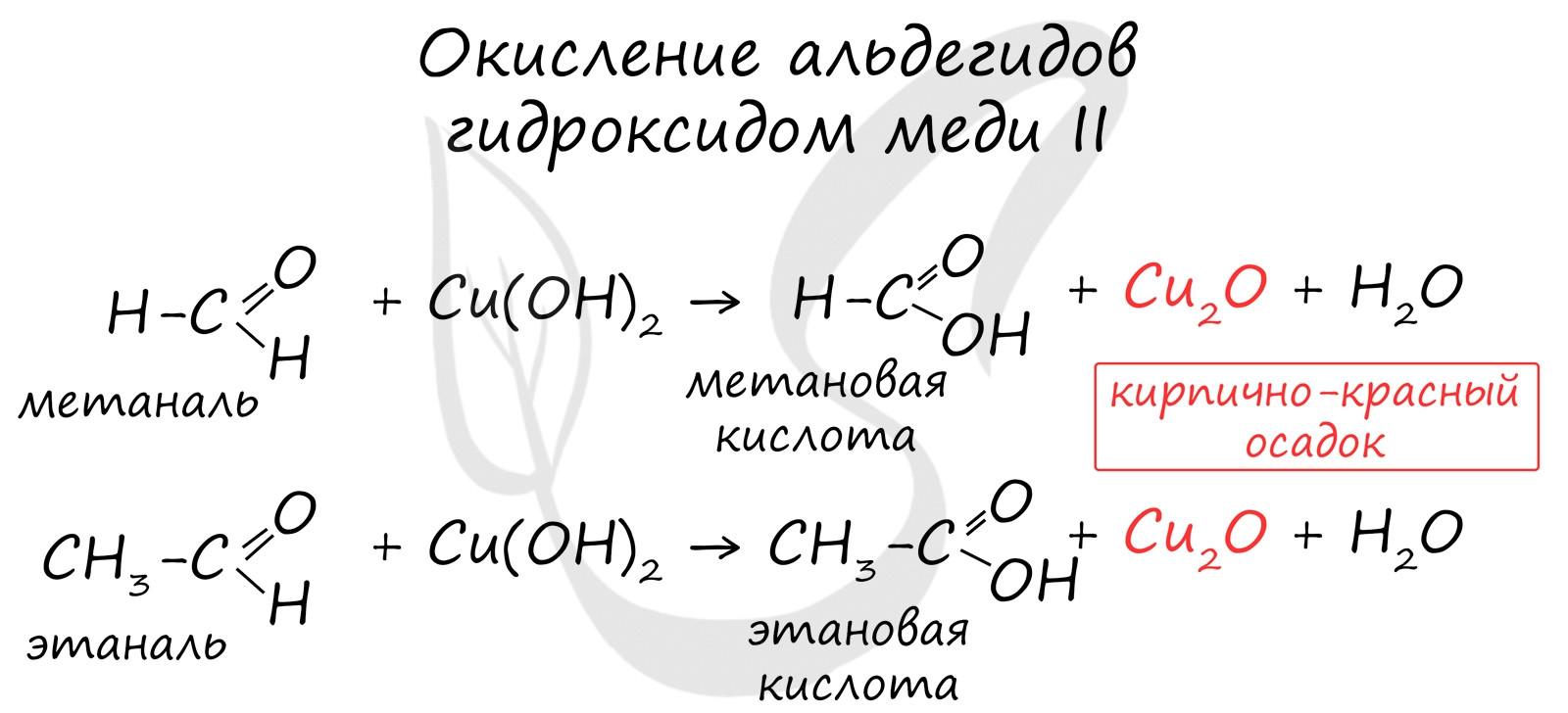
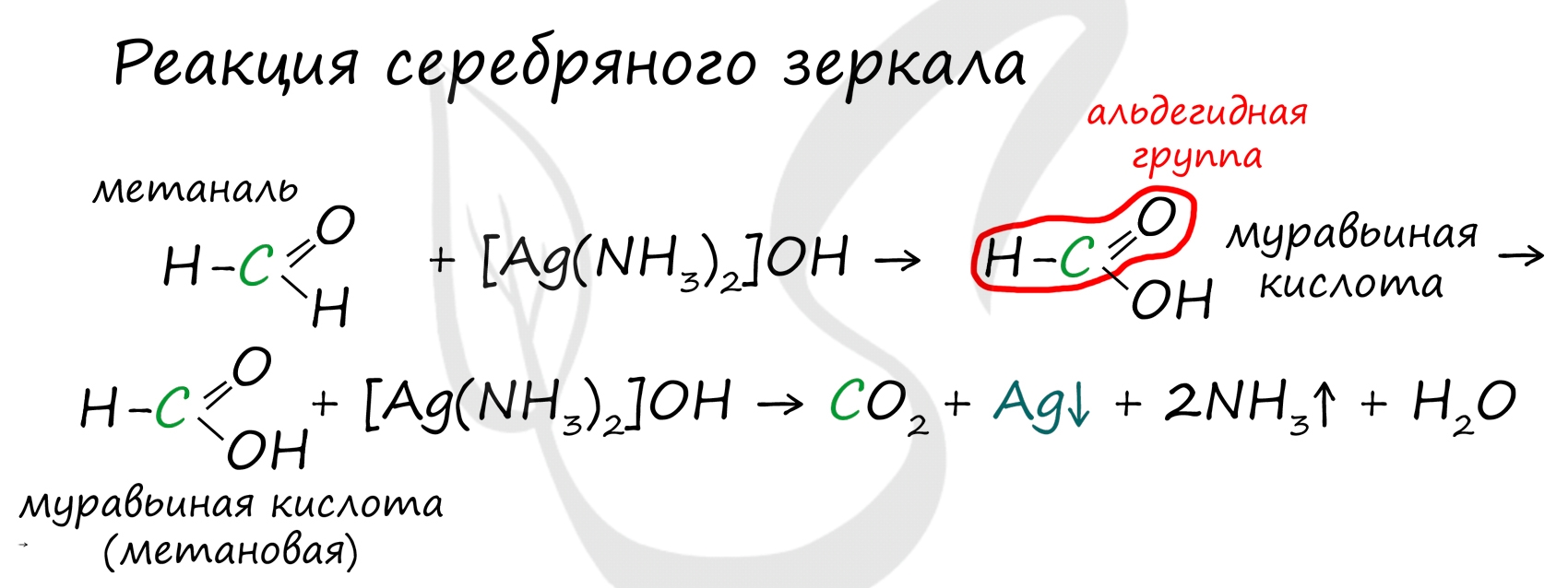
При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией на альдегиды - реакцией серебряного зеркала.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.

Окисление альдегидов также может быть успешно осуществлено другим реагентом - свежеосажденным гидроксидом меди II. В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.
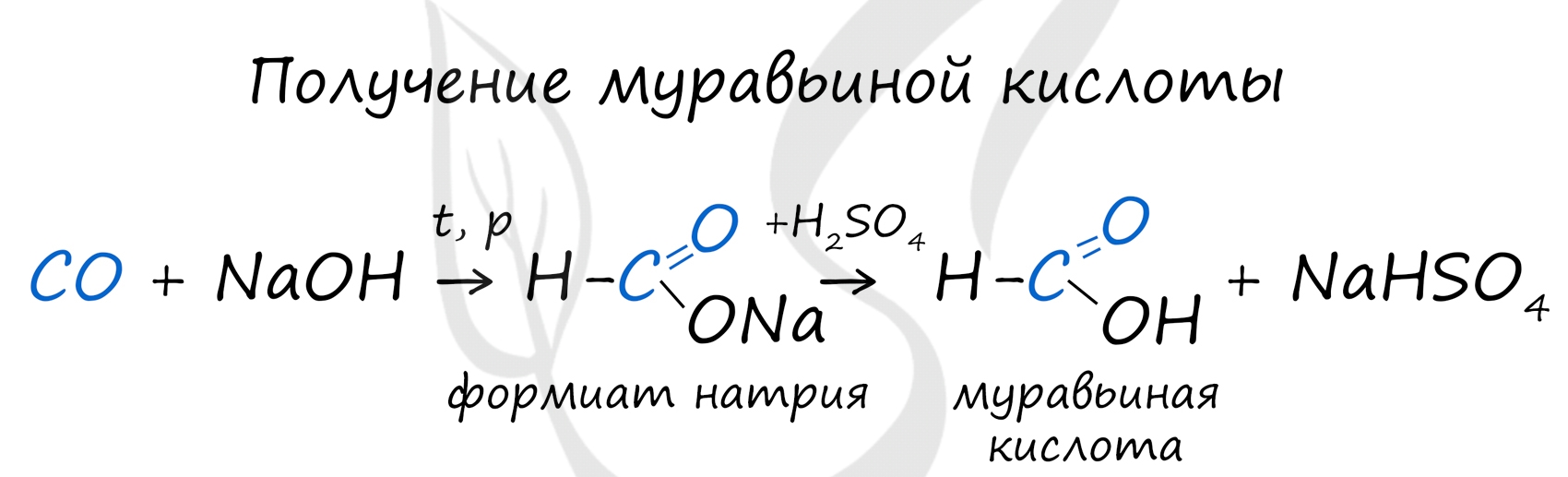
Существует специфический способ получения муравьиной кислоты, который заключается в реакции твердого гидроксида щелочного металла с угарным газом под давлением и температуре 200°С - образуется формиат (соль муравьиной кислоты).
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.
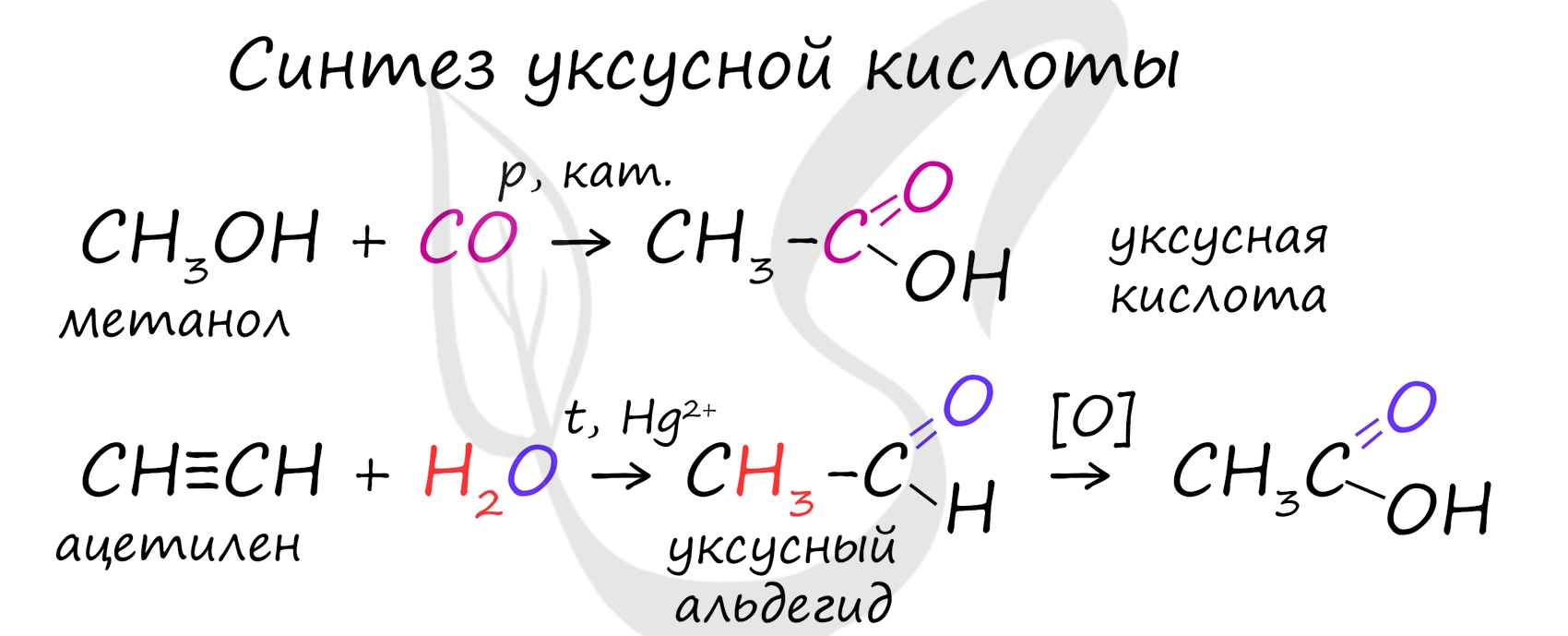
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
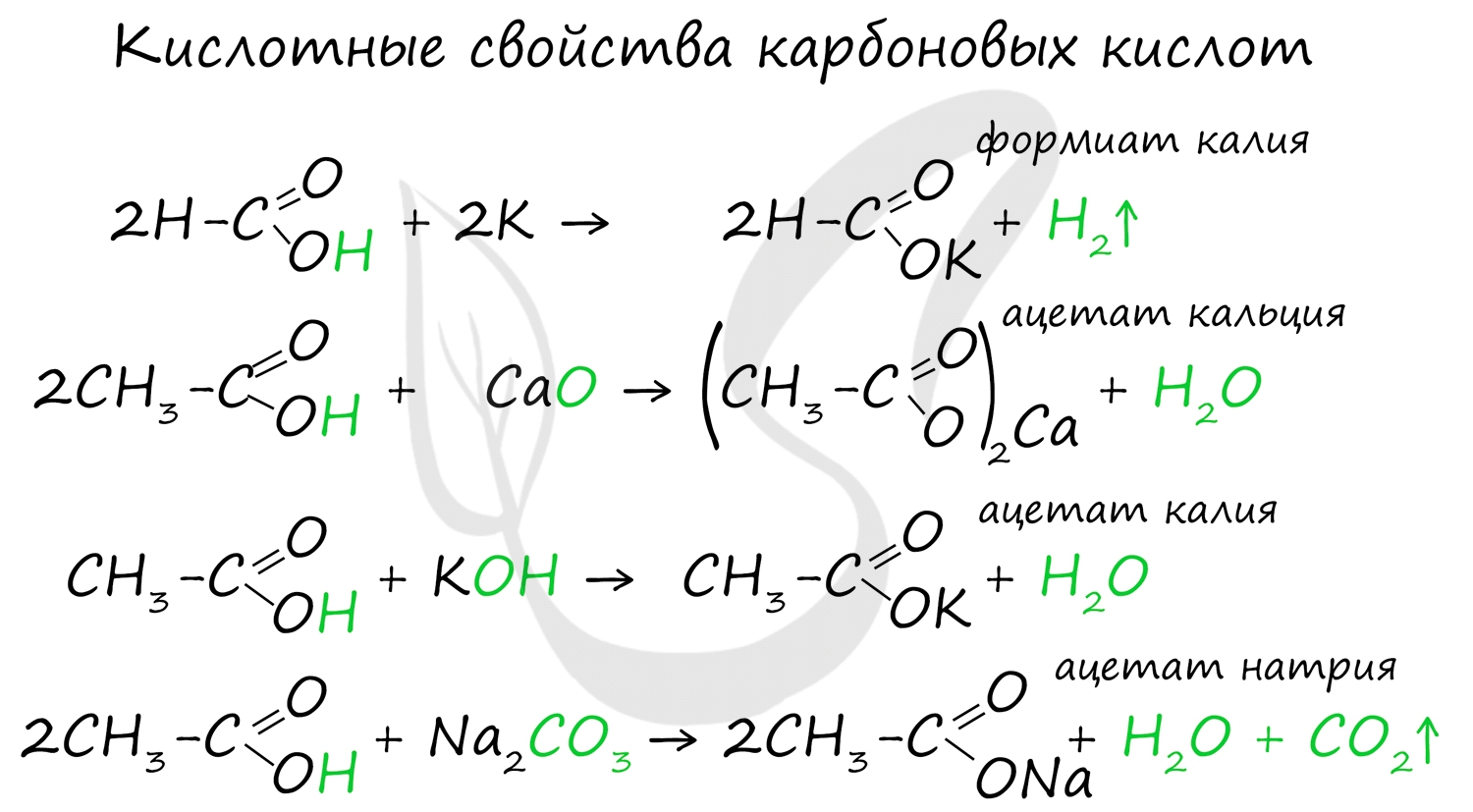
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.
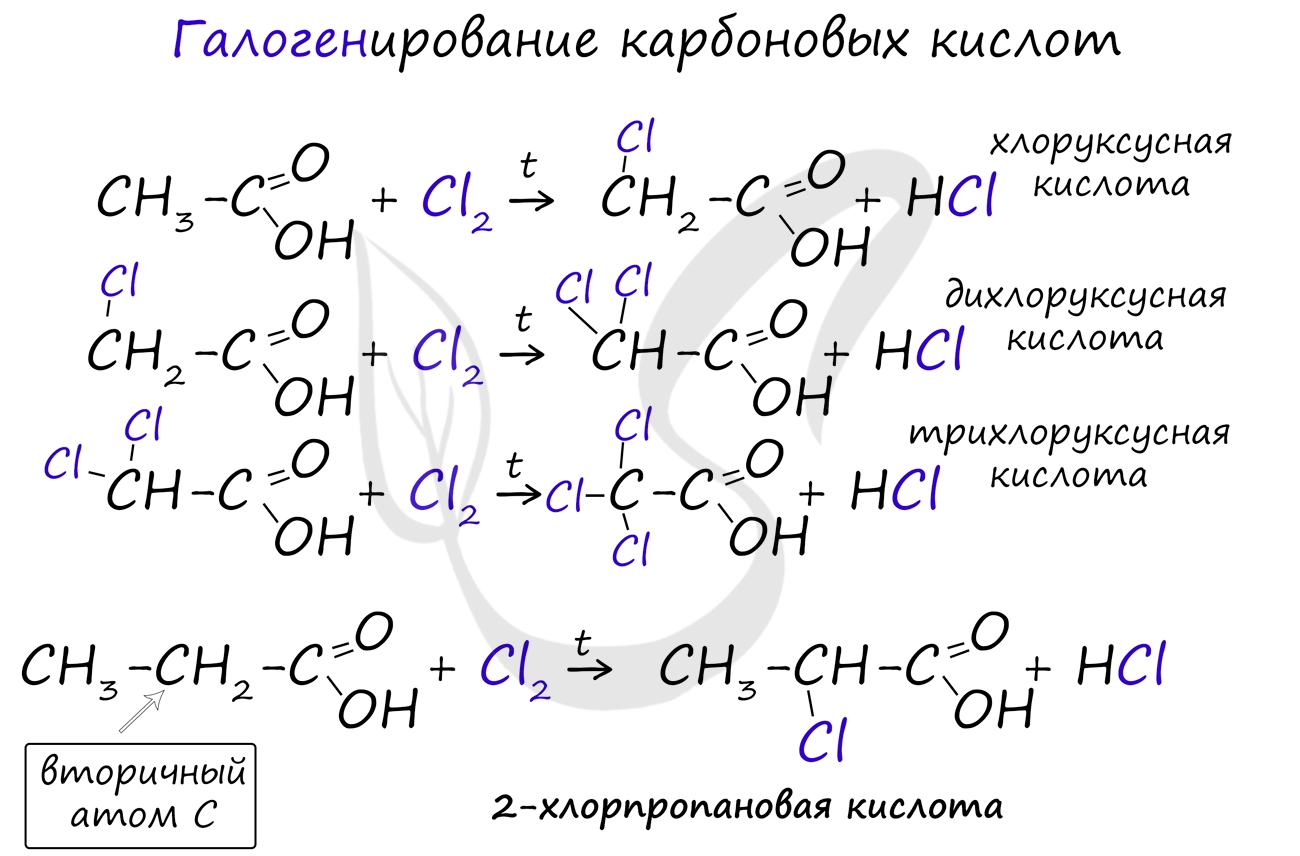
Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко замещается водород у третичного, чуть сложнее - у вторичного, и значительно сложнее - у первичного атома углерода.
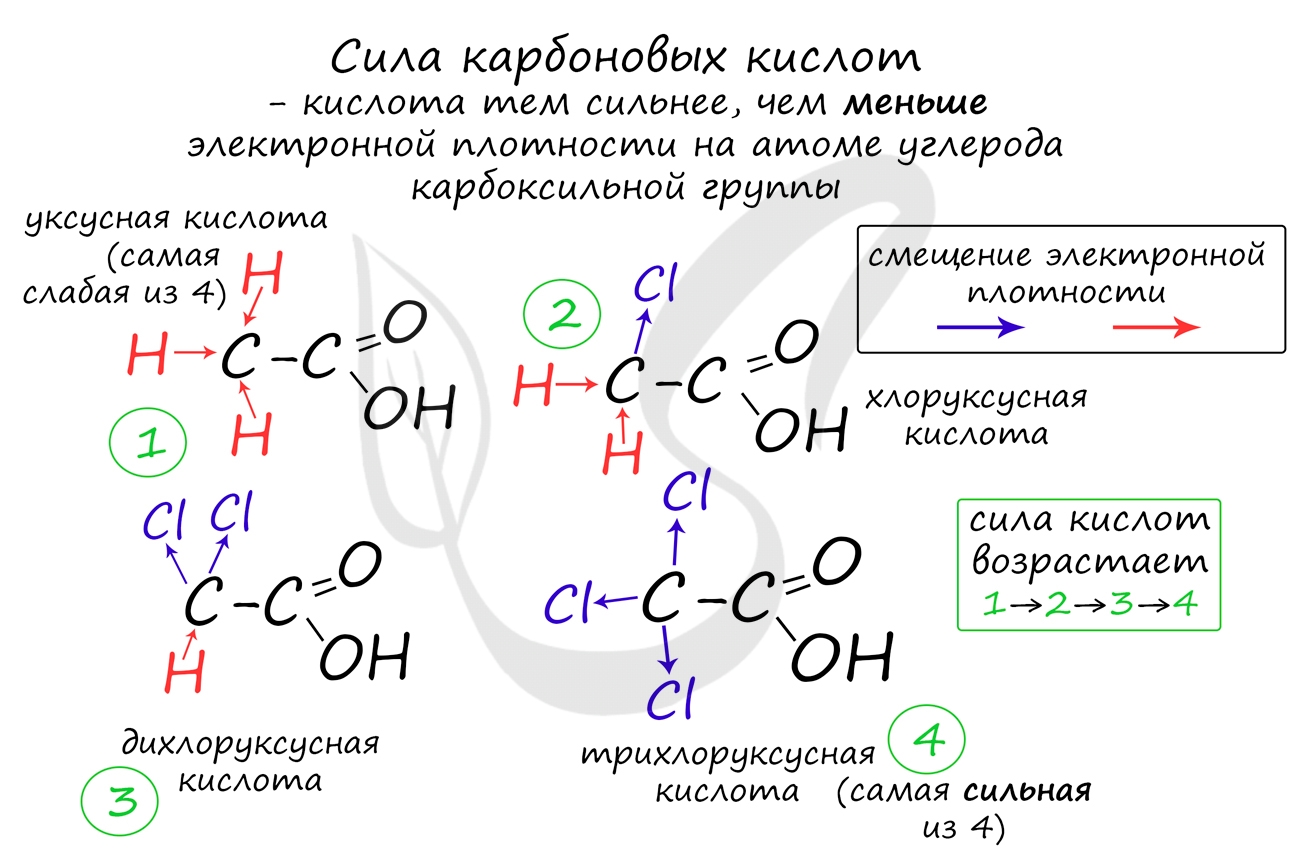
Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе. Поэтому самая слабая из трех кислот - уксусная, чуть сильнее - хлоруксусная, за ней - дихлоруксусная и самая сильная - трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.
При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
Сложные эфиры
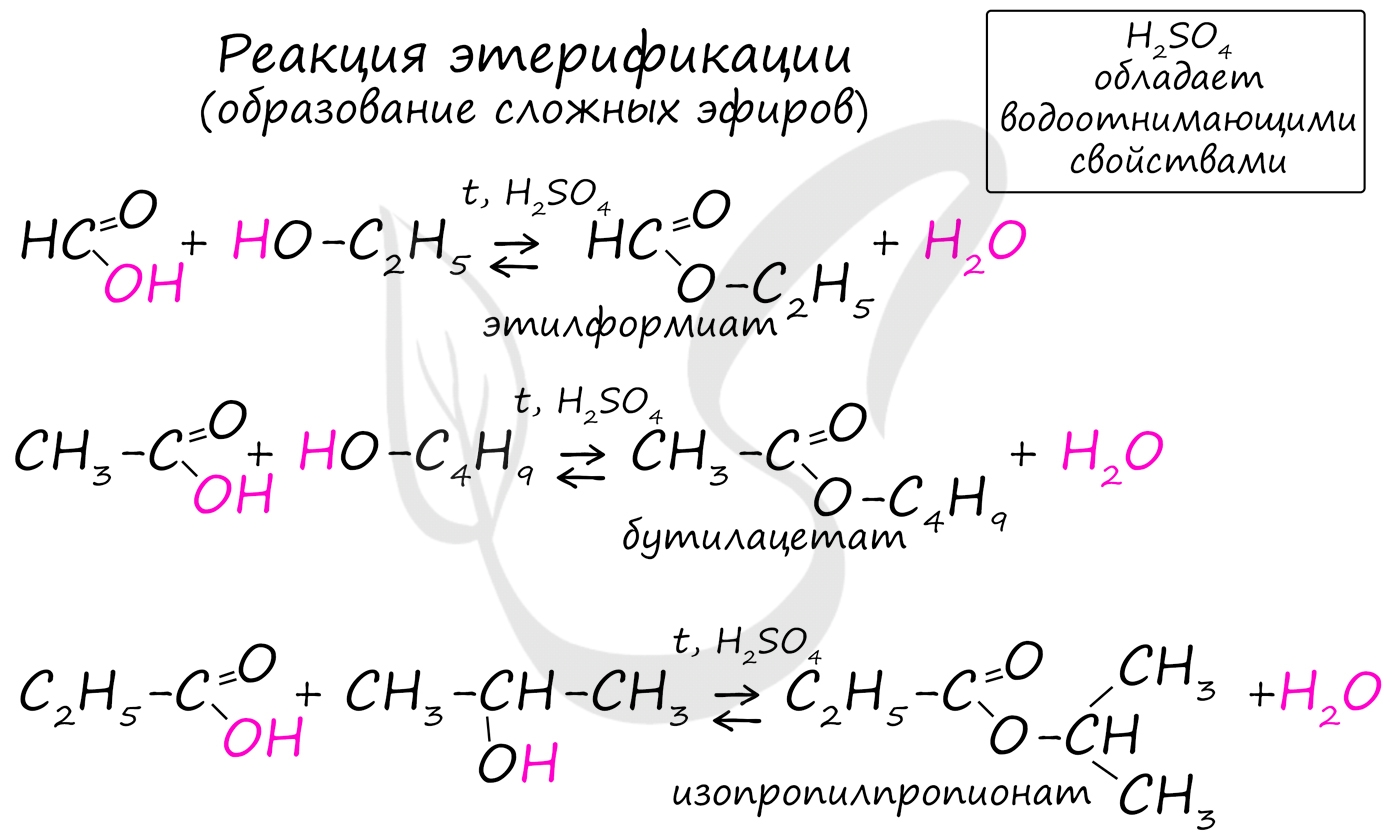
Получение сложных эфиров происходит в реакции этерификации (лат. aether - эфир), заключающейся во взаимодействии карбоновой кислоты и спирта.
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислота + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)
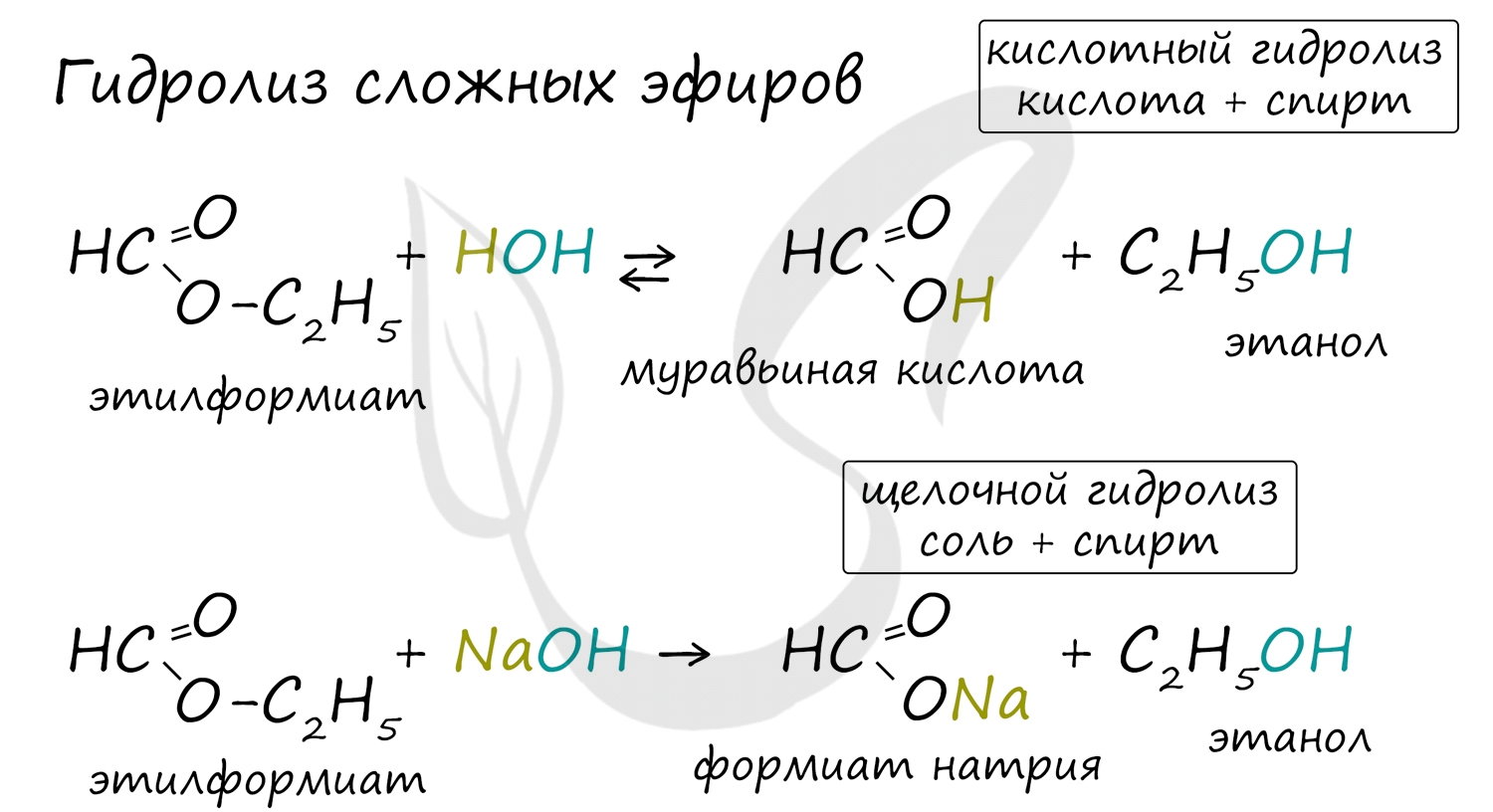
Для сложных эфиров характерной реакцией является гидролиз - их разложение. Возможен щелочной гидролиз, при котором образуется соль кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной - необратимо. Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.
Ангидриды
Ангидриды - химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.
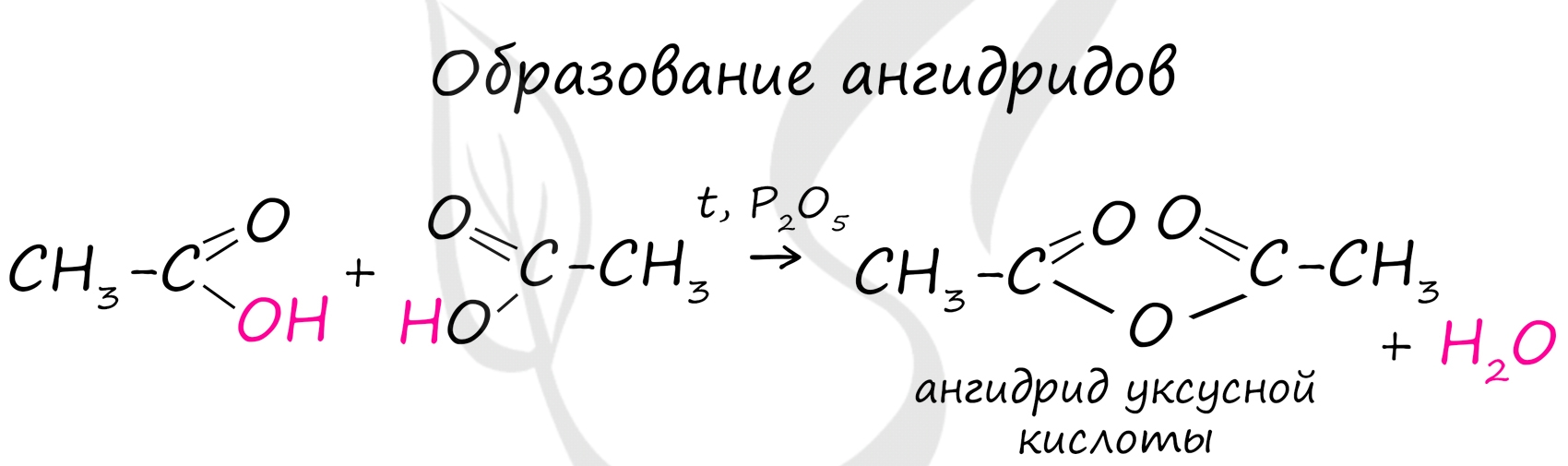
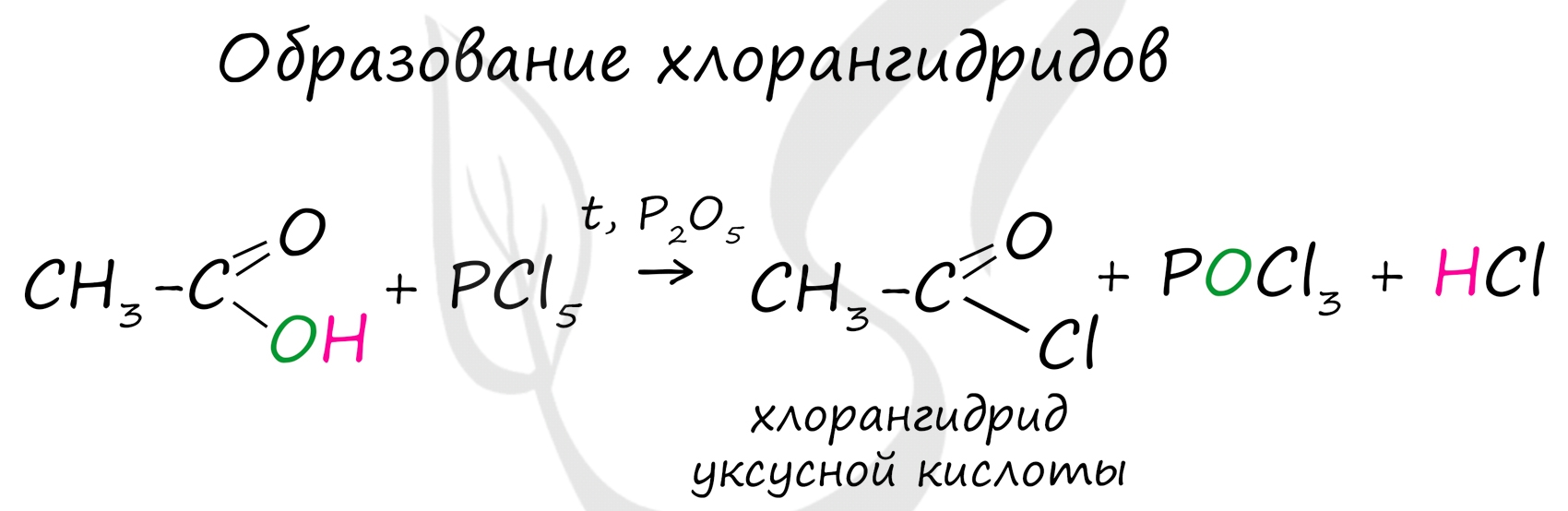
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.
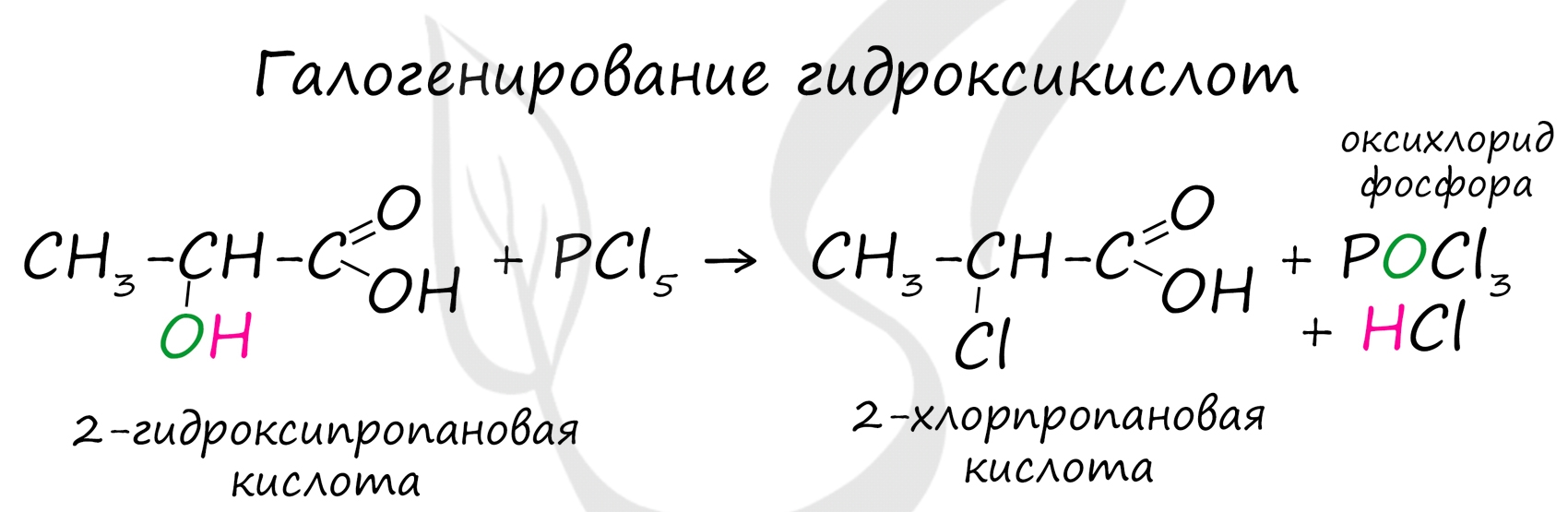
Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
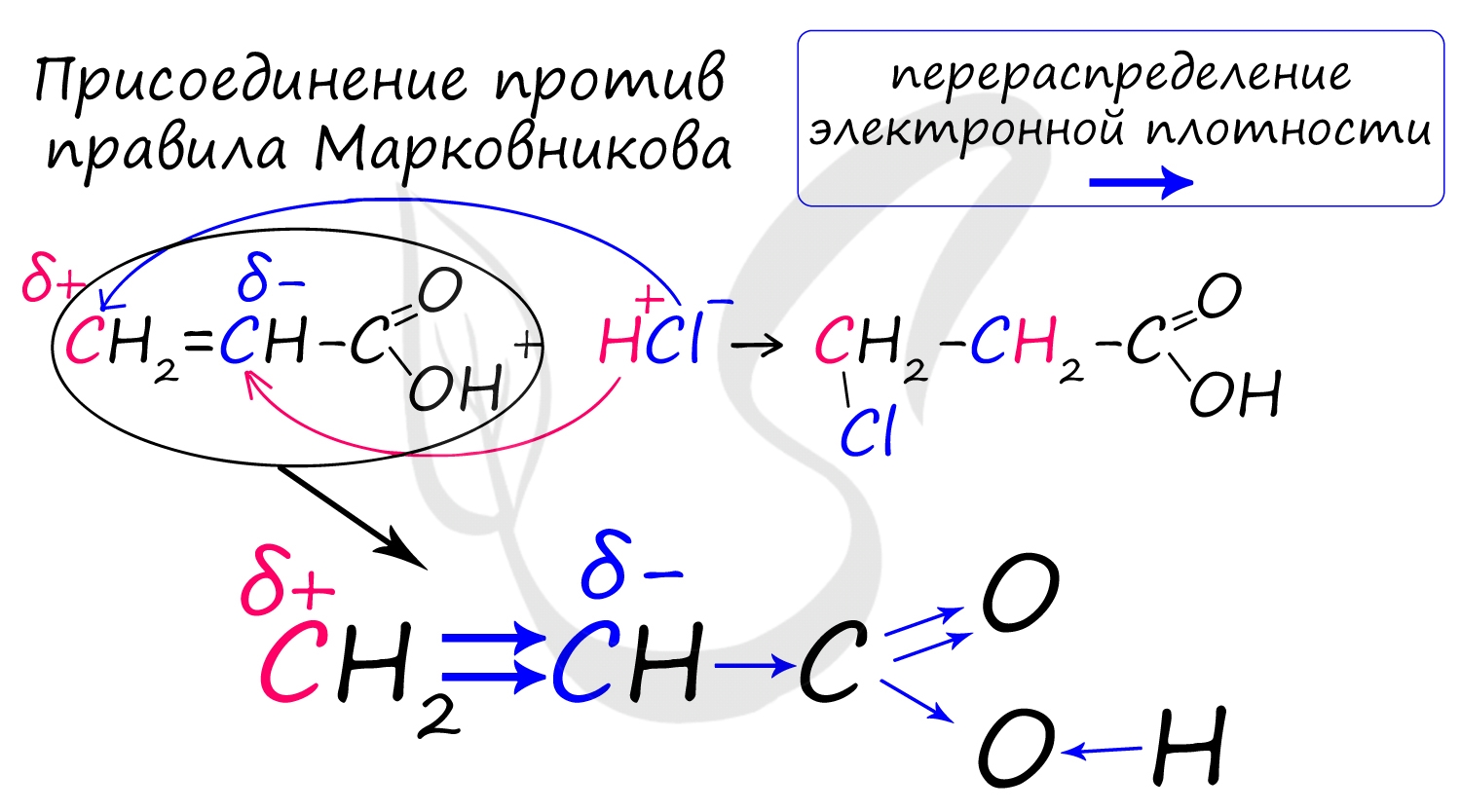
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.

Для вопросов 1-7 выберите вариант ответа (верный - только один ответ из четырех). Каждый правильный ответ: 1 балл, максимально 7 баллов.
Для вопросов 5-7 объясните выбор ответа, записав или уравнение реакции; или определение. Назовите вещества по систематической номенклатуре или составьте их структурную формулу. Каждый правильный дополнительный ответ: 1 балл, максимально 3 балла.
Решите задачу 8, запишите ход решения. Оценивается каждый элемент решения, максимально: 3 балла.
12-13 баллов – оценка “5”, 10-11 баллов – оценка “4”, 7-9 баллов – оценка “3”, менее 7 баллов – оценка “2”.
1 Общей формуле алкенов соответствует:
2 Молекулы алкадиенов содержат:

а) только связи

б) одну связь

в) две связи
г) бензольное кольцо
3 Ацетилен:
а) летучая жидкость, применяется при сварке металлов
б) вязкая жидкость, применяется для получения резины
в) взрывоопасный газ, применяется при сварке металлов
г) газ, применяется для получения резины
4 Вещество, формула которого

5 Изомером циклобутана является:
6 В схеме превращений 3 С2Н2 ----------- Х неизвестным веществом Х является:
7 Сумма коэффициентов в реакции горения этана равна:
8 Массовая доля углерода в углеводороде составляет 81,82%, относительная плотность паров этого вещества по кислороду равна 1,375. Найти молекулярную формулу улеводорода. Написать его название и структурную формулу.
Ответы и критерии оценивания к Варианту 1
1 Ответы на вопросы с выбором ответа:
2 Ответы на дополнительный вопрос (для вопросов 5-7):
Содержание возможного ответа
Структурная формула циклобутана или бутена

СН2=СН–СН2–СН3
Структурная формула бензола:

Уравнение реакции горения этана:
3 Решение задачи:
Содержание верного ответа и указания по оцениванию (возможен другой тип решения)
Рассчитана относительная молекулярная масса вещества:
Рассчитано молярное соотношение атомов и выведена молекулярная формула:
44х0,8182/12 : 44х0,1818/1 = 3 : 8
Дано название составлена структурная формула вещества:
Ответ правильный и полный, включает все вышеназванные элементы
Правильно записан только первый элемент ответа
Все элементы ответа записаны неверно (в первом элементе допущена ошибка, повлекшая за собой неправильное решение)
Максимальное число баллов: 7+3+3=13 баллов.
1 Общей формуле алканов соответствует:

2 Вещество, формула которого
б) 4 - метилпентен-3
в) 2 -метилпентен-2
г) 2,2-диметилбутен -3
3 Для алкинов не характерны реакции
4 Природный каучук – это изомер:
5 При гидратации вещества бутен-1 образуется:
г) бутин и водород
6 Гомологом этилена является:
7 В схеме превращений С2Н4 +Сl2→ Х неизвестным веществом Х является:
8 Массовая доля углерода в углеводороде составляет 85,7%, относительная плотность паров этого вещества по водороду равна 42. Найти молекулярную формулу улеводорода. Написать его название и структурную формулу.
1 Вещество, формула которого С4H6 относится к классу:
а) бесцветный, легко сжижающийся газ
б) бесцветная жидкость, нерастворим в воде, ядовит
в) жидкость, растворим в воде, с неприятным запахом
г) желто-зеленый газ, ядовит

3 Вещество, формула которого
б) 3- метилпентен-3
5 При дегидрировании этана образуется:
в) этановая кислота
6 Сумма коэффициентов в реакции горения ацетилена равна:
7 Число изомеров вещества бутан:
8 Массовая доля водорода в углеводороде составляет 20,0%, относительная плотность паров этого вещества по воздуху равна 1,034. Найти молекулярную формулу улеводорода. Написать его название и структурную формулу
1 Вещество, формула которого СН2=СН –СН =СН2 называется
2 Общей формуле алкинов соответствует:
3 Вещество, формула которого СН3– СН2–СН3 является гомологом:
а) жидкость, нерастворим в воде
б) жидкость, растворим в воде
в) газ, нерастворим в воде
г) газ, растворим в воде
5 В схеме превращений С3Н6 +Н2О → Х неизвестным веществом Х является:




6 Бензол нельзя получить:
а) дегидрированием циклоалканов
б) дегидрированием алканов
в) полимеризацией этилена
г) тримеризацией ацетилена
7 Сумма коэффициентов в реакции горения циклобутана равна:
8 Массовая доля углерода в углеводороде 92,3%. Относительная плотность паров этого вещества по водороду равна 39. Найти молекулярную формулу углеводорода. Написать его название и структурную формулу.
1 Общая формула алкадиенов:

2 Вещество, формула которого
3 Обязательное условие реакции хлорирования алканов:
а) газообразное агрегатное состояние продуктов реакции
в) низкая температура
г) жидкое агрегатное состояние продуктов реакции
а) бесцветный газ, без запаха;
б) бесцветная жидкость, с резким запахом;
в) бесцветная жидкость, без запаха
г) бесцветный газ, с резким запахом.
5 Изомером бутадиена является:
6 В схеме превращений С2Н5ОН - ---→ Х +Y
неизвестными веществами Х и Y являются:
а) этилен и вода
б) этен и водород
в) углекислый газ и вода
г) ацетилен и водород
7 При гидратации ацетилена (в присутствии HdSO4 - реакция Кучерова) образуется
в) уксусный альдегид
г) уксусная кислота
8 Массовая доля углерода в углеводороде 82,75%. Относительная плотность паров этого вещества по воздуху равна 2. Найти молекулярную формулу углеводорода. Написать его название и структурную формулу.
1 Вещество, формула которого С4H8 относится к классу:
2 Молекулы алкинов содержат:
а) только одинарные связи
б) одну двойную связь
в) две двойные связи
г) одну тройную связь

3 Вещество, формула которого
а) бесцветный, легко сжижающийся газ
б) бесцветная жидкость
в) огнеопасная жидкость, с неприятным запахом
г) желто-зеленый газ, ядовит
5 При гидрировании бензола получают
6 Число всех изомеров вещества бутен
7 В схеме превращений С2Н4 +Н2О → Х
неизвестным веществом Х является
8 Массовая доля углерода в углеводороде составляет 83,3%, относительная плотность паров этого вещества по водороду равна 36. Найти молекулярную формулу улеводорода. Написать его название и структурную формулу.
Ответы к заданиям 1-8: Варианты 2-6
КАРБОНОВЫЕ КИСЛОТЫ. СЛОЖНЫЕ ЭФИРЫ. ЖИРЫ.
1. Соотнесите термины, используемые для классификации кислот:
Признак классификации: 1) число карбоксильных групп
2) природа углеродного скелета
Тип кислоты: а) предельная, б) одноосновная, в) ароматическая, г) непредельная, д) двухосновная
2. Формула стеариновой кислоты
3. Название кислоты с формулой СН3-СН-СН2-СООН:
а) 3-метилбутановая б) 2-метилбутановая в) 3-метилбутеновая г) 3,3-диметилпропановая
4. Соотнесите названия и формулы:
Тривиальное название: систематическое название: формула:
I) уксусная 1) пропеновая а) СН2=СН-СООН
II) муравьиная 2) гексановая б) НООС-СООН
IV) акриловая 4) этандиовая г) СН3-СН2-СН2-СООН
V) щавелевая 5) метановая д) СН3-СООН
VI) капроновая 6) бутановая е) НСООН
5. Какие признаки, верно, отражают физические свойства уксусной кислоты: 1) при комнатной температуре бесцветная жидкость, 2) газообразное вещество, 3) не имеет запаха, 4) имеет характерный запах, 5) плохо растворима в воде, 6) неограниченно растворима в воде, 7) слабый электролит, 8) сильный электролит?
а) 1,4,6,7 б) 2,4,5,6,7 в) 1,3,6,8 г) 1,4,5,7
6. Относительная молекулярная масса предельной одноосновной карбоновой кислоты равна 256. число атомов углерода в этой кислоте равно:
а) 15 б) 16 в) 17 г) 18
Назовите эту кислоту.
7. Какой из металлов реагирует с уксусной кислотой с максимальной скоростью?
а) железо б) олово в) цинк г) кальций
Напишите уравнение реакции.
8. Суммы коэффициентов в молекулярном, полном и сокращенном ионных уравнениях реакции муравьиной кислоты с карбонатом натрия соответственно равны:
а) 7,11,7 б) 7,13,7 в) 5,9,5 г) 7,11,5
9. Взаимодействие пропионовой кислоты с этиловым спиртом называется реакцией:
а) гидратации б) этерификации в) гидрирования г) нейтрализации
Напишите уравнение реакции
10. Дана цепочка превращений
Напишите уравнения реакций.
11. Укажите формулу сложного эфира:
12. Соотнесите: вещество: 1) сложный эфир 2) воск 3) жир 4) мыло
13. Соотнесите:
исходные вещества:
название реакции: а) омыление б) гидролиз в) этерификации г) гидрирование
14. В состав природных жиров не входит кислота:
а) щавелевая б) стеариновая в) масляная г) олеиновая
15. С какими из перечисленных веществ в соответствующих условиях реагирует уксусная кислота: 1) медь, 2) оксид кальция, 3) оксид серы (IV), 4) метанол, 5) хлор, 6) этаналь, 7) фенолятнатрия?
а) 2,4,5,7 б) 1,2,5,6 в) 2,3,4,5 г) 4,5,6
Напишите уравнения реакций.
КАРБОНОВЫЕ КИСЛОТЫ. СЛОЖНЫЕ ЭФИРЫ. ЖИРЫ.
1. Соотнесите:
Тип кислоты: формула:
1) предельная а) СН3-СН=СН-СООН б)
2. Пальмитиновая кислота имеет формулу:
3. Назовите кислоту формула которой СН3-СН2-ССl2-СООН :
а) 2-дихлорбутановая б) 2,2-дихлорбутановая в) 1,1- дихлорпропановая г) 3-дихлорбутановая
4. Соотнесите названия и формулы:
Тривиальное название: систематическое название: формула:
I) муравьиная 1) пропановая а) НООС-СН2 –СН2 – СООН
III) янтарная 3) метановая в) СН3-СООН
IV) валериановая 4) бутандиовая г) НСООН
V) уксусная 5) гексановая д) СН3-СН2 -СООН
5. Относительная молекулярная масса предельной одноосновной карбоновой кислоты равна 284. число атомов углерода в этой кислоте равно:
а) 15 б) 16 в) 17 г) 18
Назовите эту кислоту.
6. С каким из веществ муравьиная кислота вступает в реакцию замещения:
Напишите уравнение реакции.
7. Суммы коэффициентов в молекулярном, полном и сокращенном ионных уравнениях реакции уксусной кислоты с гидроксидом меди (II) соответственно равны:
а) 6,8,8 б) 4,10,4 в) 6,9,7 г) 6,8,4
8. Реакцией этерификации называется взаимодействие кислоты:
а) со щелочью б) со спиртом в) с галогенами г) с металлами
9. Дана цепочка превращений: НС СН …1 …2 …3 …4
Укажите формулы веществ 1 – 4:
10. Какие признаки, верно, отражают физические свойства уксусной кислоты: 1) при комнатной температуре бесцветная жидкость, 2) газообразное вещество, 3) не имеет запаха, 4) имеет характерный запах, 5) плохо растворима в воде, 6) неограниченно растворима в воде, 7) слабый электролит, 8) сильный электролит?
а) 1,4,6,7 б) 2,4,5,6,7 в) 1,3,6,8 г) 1,4,5,7
11. С какими из перечисленных веществ в соответствующих условиях реагирует уксусная кислота: 1) медь, 2) оксид кальция, 3) оксид серы (IV), 4) метанол, 5) хлор, 6) этаналь, 7) фенолятнатрия?
а) 2,4,5,7 б) 1,2,5,6 в) 2,3,4,5 г) 4,5,6
Напишите уравнения реакций.
12. Укажите формулу сложного эфира:
13.Соотнесите: группа веществ: 1) воски 2) жиры 3) мыла 4) сложные эфиры
Природа веществ:
а) сложные эфиры глицерина и высших карбоновых кислот
б) сложные эфиры высших карбоновых кислот и высших спиртов
в) натриевые и калиевые соли высших карбоновых кислот
г) производные карбоновых кислот, в которых атом водорода карбоксильной группы замещен на углеводородный радикал.
14. Соотнесите:
исходные вещества: название реакции:
СН –О-СО-С17Н35 + 3КОН в) этерификации
Напишите уравнения реакций.
15. Какое из веществ выпадает из общего ряда?
а) триолеат глицерина б) тринитрат глицерина в) тристеарат глицерина г) трипальмитат глицерина
А1. Молекулярная формула клетчатки
А2. Какой связью соединены остатки двух моносахаридов в молекуле дисахарида
А3. Для моносахаридов характерны свойства
1. Хорошая растворимость в воде
2. Высокие температуры плавления
А4. К восстанавливающим дисахаридам не относится
А5. Заболевание сахарным диабетом вызвано повышением содержанием в крови
А6. Чем можно отличить глюкозу от фруктозы
1. Хлоридом железа (III)
2. Раскаленной медной проволокой
3. Бромной водой
4. Реакцией серебряного зеркала
А7. Из указанных углеводов не окисляется аммиачным раствором оксида серебра
В1. Вещества Х в схемах превращений соответственно являются
А. С6Н12О6 дрожжи Х + СО2
Б. С6Н12О6 + Н2 Ni Х
В. (С6Н10О5)n + 3n НNO3 H2SO4 3nН2O + H2SO4
Г. С6Н12О6 ферменты Х + СО2 + Н2
2. Триацетат целлюлоза
3. Масляная кислота
4. Тринитрат целлюлозы
6. Этиловый спирт
В2. Соотнесите реакцию и ее характерный признак.
1. Сахароза + Cu(OH)2 А. Фиолетовое окрашивание крахмала
2. Крахмал + I2 Б. Блестящий налет на стенках
3. Глюкоза [Ag(NH3)2]OH(t°) В. Комплексное соединение синего цвета
С1. Найдите массу футболки из триацетатного волокна, образовавшегося из 243г целлюлозы.
Инструкция по проверке и оценке работ учащихся по химии

Спиртами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильные группы (–OH).
По числу гидроксильных групп спирты делят на одноатомные, двухатомные, трёхатомные и многоатомные.
Предельными одноатомными спиртами называют класс химических веществ, отвечающий общей формуле CnH2n+1OH и содержащий в своей молекуле функциональную гидроксильную группу –OH, связанную с углеводородным радикалом.
Родоначальником гомологического ряда предельных одноатомных спиртов является метиловый спирт, или метанол. Его структурная формула CH3OH.
Метиловый спирт представляет собой бесцветную жидкость с характерным запахом, которая смешивается с водой во всех отношениях. Его температура кипения равна +64,7 °С, температура плавления –93,9 °С. В промышленности его получают из смеси оксида углерода (II) и водорода в присутствии катализатора — окиси цинка и хрома при высокой температуре:

Метиловый спирт реагирует с щелочными металлами с образованием соответствующих метилатов, вступает в обратимые реакции с галогенводородными кислотами, а также в окислительно-восстановительные реакции:


При межмолекулярной дегидратации метилового спирта (катализатор — концентрированная серная кислота) происходит образование простого эфира:

Метиловый спирт применяют в производстве формальдегида, полимерных материалов, в качестве растворителя в различных процессах.
Метиловый спирт очень ядовит. Известны многочисленные случаи тяжёлых отравлений этим соединением, часто со смертельным исходом.
Разработано несколько промышленных методов получения этанола. Наиболее важными являются спиртовое брожение сахаристых веществ, например глюкозы в присутствии дрожжей, а также каталитическая гидратация этилена:

Этиловый спирт реагирует с щелочными металлами с образованием соответствующих этилатов, вступает в обратимые реакции с галогенводородными кислотами, а также в окислительно-восстановительные реакции:

При межмолекулярной дегидратации этилового спирта (катализатор — концентрированная серная кислота) происходит образование простого эфира:

Если в реакцию этерификации взять смесь метилового и этилового спиртов одним из продуктов реакции может быть эфир несимметричного строения:

Этиловый спирт широко применяется в химической промышленности для производства красителей, ядохимикатов, пороха, пластмасс, уксусной кислоты и т. д. Этиловый спирт применяют в медицине и парфюмерии.
Трехатомные спирты. Эти спирты содержат три гидроксильные группы при разных углеродных атомах. Общая формула трёхатомных спиртов CnH2n-1(OH)3. Простейшим представителем трехатомных спиртов является глицерин. Его структурная формула HOCH2–CH(OH)–CH2OH. Он представляет собой бесцветную сиропообразную жидкость, сладкую на вкус. Смешивается с водой и этиловым спиртом во всех отношениях. Его температура кипения равна +290 °С, температура плавления +17 °С.
Получают глицерин омылением жиров, а также из непищевого сырья.
Глицерин способен образовывать жиры при реакции с карбоновыми кислотами, а его реакция со смесью азотной и серной кислот приводит к образованию тринитрогилцерина NO2–OCH2–CH(O–NO2)–CH2O–NO2— мощного взрывчатого вещества.

При взаимодействии глицерина со свежеосаждённым гидроксидом меди образуется глицерат меди, имеющий характерный ярко-синий цвет. Эта реакция является качественной для определения глицерина.
Глицерин применяют для изготовления полиэфирных полимеров, взрывчатых веществ, в парфюмерии, текстильной и пищевой промышленности.
Уксусная кислота H3CC(O)OH представляет собой бесцветную жидкость с резким запахом. Безводная уксусная кислота, имеющая температура плавления 16,6 °С называется ледяной.
Уксусная кислота широко распространена в природе. Она образуется при уксуснокислом брожении жидкостей, содержащих спирт, содержится в растениях и т. д.
В промышленности уксусную кислоту получают из уксусного альдегида или жидкофазным окислением углеводородов в присутствии солей марганца в качестве катализатора, например:

Уксусная кислота является слабой кислотой. Её производные называют ацетаты.
Она вступает в реакцию с основаниями и амфотерными гидроксидами (реакция нейтрализации), основными и амфотерными оксидами. Во всех случаях образуются соль и вода:

Уксусная кислота может реагировать с активными металлами с образованием солей и выделением водорода:

При хлорировании уксусной кислоты в присутствии красного фосфора образуется хлоруксусная кислота:

Уксусную кислоту используют в качестве полупродукта при производстве ацетонового шелка, красителей и др. Уксусную кислоту также широко применяют в пищевой промышленности. Водные растворы уксусной кислоты с концентрацией 70—80% называются уксусной эссенцией, а с концентрацией 3—5% — столовым уксусом.
Стеариновая кислота СН3(СН2)16СООН представляет собой бесцветные кристаллы с температурой плавления 69,6 °С. В воде стеариновая кислота очень мало растворима. Эта кислота входит в состав животных и растительных жиров, которые и служат источником её получения. Используют стеариновую кислоту в фармацевтической и косметической промышленности. Её натриевая соль — стеарат натрия СН3(СН2)16СООН образуется в результате взаимодействия стеариновой кислоты с гидроксидом или карбонатом натрия.

Стеарат натрия является основной составной частью обычного твёрдого мыла, а стеарат калия — жидкого мыла.
Тренировочные задания
1. Для метанола верны следующие утверждения:
1) это жидкость с характерным запахом, хорошо растворимая в воде
2) содержит в своём составе карбоксильную группу
3) содержит в своём составе гидроксильную группу
4) не горит на воздухе
5) реагирует с бромной водой
2. Для метанола верны следующие утверждения:
1) это газ при нормальных условиях
2) атомы углерода в нём находятся в состоянии sp-гибридизации
3) реагирует с металлическим натрием
4) реагирует с гидроксидом натрия
5) горит на воздухе
3. Для этанола верны следующие утверждения:
1) это жидкость с характерным запахом, не растворимая в воде
2) это низкокипящий газ, хорошо растворимый в воде
3) реагирует с гидроксидом натрия
4) реагирует с хлороводородом
5) реагирует с калием
4. Для этанола верны следующие утверждения:
1) его используют в медицине и пищевой промышленности
2) реагирует с концентрированными щелочами
3) не вступает в окислительно-восстановительные реакции
4) при дегидратации даёт ацетилен
5) при дегидратации даёт этилен
5. Для глицерина верны следующие утверждения:
1) все атомы в его молекуле находятся в состоянии sp-гибридном состоянии
2) реагирует с водой
3) даёт ярко-синее окрашивание со свежеосаждённым раствором гидроксида меди (II)
4) реагирует с угольной кислотой
5) реагирует с азотной кислотой
6. Для глицерина верны следующие утверждения:
1) это предельный двухатомный спирт
2) это предельный трехатомный спирт
3) реагирует с бромной водой
4) реагирует с железом
5) реагирует с натрием
7. Для уксусной кислоты верны следующие суждения:
1) это жидкость с характерным резким запахом, нерастворимая в воде
2) это жидкость с характерным резким запахом, хорошо растворимая в воде
3) все атомы углерода находятся в состоянии sp2-гибридизации
4) атом углерода карбоксильной группы находится в состоянии sp2-гибридизации
5) сгорает на воздухе с образованием углекислого газа и водорода
8. Для уксусной кислоты верны следующие суждения:
1) сильнее соляной кислоты, но слабее угольной кислоты
2) сильнее угольной кислоты, но слабее соляной кислоты
3) не реагирует с основаниями
4) окисляет серу
5) реагирует со щелочами
9. Для стеариновой кислоты верны следующие суждения:
1) это непредельная одноосновная кислота
2) содержит в своём составе карбоксильную группу и углеводородный радикал C17H35
3) сильнее уксусной кислоты
4) сильнее соляной кислоты
5) в виде сложных эфиров входит в состав растительных и животных жиров
10. Для стеариновой кислоты верны следующие суждения:
1) это твёрдое вещество белого цвета, не растворимое в воде
2) реагирует с сульфатом натрия
3) реагирует с гидроксидом натрия
4) относится к сильным кислотам
5) содержит в своём составе углеводородный радикал формулы C15H31
Читайте также:

