Участок посадки для рнк полимеразы у бактерий называют
Добавил пользователь Евгений Кузнецов Обновлено: 19.09.2024
1. РНК-полимераза I – осуществляет только транскрипцию рибососмальной РНК.
2. РНК-полимераза II – осуществляет транскрипцию большинства генов
3. РНК-полимераза III – осуществляет синтез транспортной РНК, 5S-рибосомального гена и малых ядерных РНК.
Структурно сходны друг с другом и имеют некоторые общие субъединицы, тогда как другие субъединицы являются уникальными. Каждая из этих РНК-полимераз, полагают, содержит 10 или более полипептидных цепей. РНК-полимеразы эукариот и бактерий эволюционно родственны. РНК-полимеразы I, II и III отличаются по чувствительности к токсину альфа-аманитину: РНК-полимераза I не чувствительна к нему; РНК-полимераза II очень чувствительна; РНК-полимераза III умеренно чувствительна. РНК- полимераза II транскрибирует гены, РНК-продукты которых будут транслированы в белки. Другие две РНК-полимеразы синтезируют РНК, которые выполняют структурные или каталитические роли, в основном, как часть белок-синтезирующего аппарата.
11.Инициация транскрипции РНК полимеразой II эукариот. Для правильной инициации транскрипции РНК полимеразой II в зоне корового элемента промотора должны собраться соответствующие инициаторные факторы, называемые TFII (Transcription Factors of RNA polymerase II). Среди них: TFIIA, TFIIB, TFIID, TFIIE, TFIIF и TFIIH. Из вышеупомянутых факторов лишь TFIID способен напрямую взаимодействовать с промоторной областью ДНК, остальные факторы удерживаются в промоторной области посредством белок-белковых взаимодействий друг с другом и с TFIID.
Специфическое связывание TFIID с ДНК является начальным этапом инициации транскрипции. В основе этого события лежит специфическое взаимодействие ТАТА - связывающего компонента TFIID (TBP - TATA Binding Protein) с соответствующим участком ДНК.
Связывание TBP с ТАТА-боксом запускает каскад событий, приводящий к формированию преинициаторного комплекса: с TBP-TATA комплексом связывается инициаторный фактор TFIIB, с TFIIB связывается преформированный комплекс полимеразы II с инициаторным фактором TFIIF. Считается, что таким образом реализуется одна из функций TFIIB, состоящая в правильном позиционировании полимеразы относительно промотора. С TFIIF связывается инициаторный фактор TFIIE, с TFIIE связывается фактор TFIIH. На этом формирование преинициаторного комплекса заканчивается.
В преинициаторном комплексе TFIIH проявляет киназную активность - фосфорилирует С - концевой домен большой субъединицы РНК полимеразы II. Тем временем хеликаза АТФ - зависимо расплетает двойную спираль ДНК в районе старта транскрипции. Формируется так называемый "открытый" комплекс. Полимераза уходит с промотора и начинает элонгацию. После ухода полимеразы TFIID остаётся связанным с коровым элементом промотора в течение некоторого времени и может принять участие в новом раунде инициации. После терминации транскрипции специальная фосфатаза возвращает большую субъединицу полимеразы в дефосфорилированное состояние. Таким образом восстанавливается способность полимеразы инициировать транскрипцию. Существуют две модели инициации транскрипции РНК-полимеразой II. В соответствии с одной из них на промоторе происходит постепенная (ступенчатая) сборка инициационного комплекса из отдельных компонентов. Другая модель акцентирует внимание на то, что Pol II может входить в состав инициационного комплекса в виде холофермента, состоящего из многих субъединиц. Сборка такого комплекса начинается с последовательного связывания с промотором основных факторов транскрипции. Инициация транскрипции с промоторов класса II регулируется на уровне сборки мультибелкового преинициаторного комплекса в районе промотора.
Одной из форм регуляции является взаимодействие базальных компонентов преинициаторного комплекса с белками - активаторами, связанными с проксимальными или дистальными элементами промотора.
Другая форма регуляции - посредством прямого связывания соответствующих активаторов с компонентами преинициаторного комплекса. Например, TBP - ассоциированные факторы (TAF's), входящие в состав TFIID, являются мишенью для ген-специфических активаторов транскрипции таких как p53, NF kappa B, эстрогеновый рецептор и другие.
В регуляции инициации также принимают участие белки, называемые non-TAF коактиваторами. Примером такого рода служит дрожжевой белок GCN5. Эти белки играют роль адаптеров между активаторами и факторами, входящими в состав преинициаторного комплекса.
Разнообразные регуляторные взаимодействия имеют место и между самими факторами инициации транскрипции. Например, отмечены взаимодействия между dTAF42 (а также его человеческим гомологом hTAF31) и фактором инициации TFIIB. Показано, что hTAF80 взаимодействует с TFIIF. Вероятно, роль подобных взаимодействий состоит в том, чтобы дополнительно стабилизировать преинициаторный комплекс и облегчить привлечение последующих факторов.
Существует минимальный набор белков, достаточный для того, чтобы инициировать транскрипцию с промотора класса II in vitro. Это - перечисленные выше основные компоненты преинициаторного комплекса. Однако, вышеупомянутые белки способны обеспечить довольно низкий уровень транскрипции, называемый базальным. Причиной подобного эффекта принято считать препятствия, возникающие in vivo в виде негативных регуляторов инициации транскрипции, структуры хроматина и так далее. Считается, что в клетке такого рода препятствия преодолеваются с помощью активаторов транскрипции, взаимодействующих как с ДНК в районе промотора, так и с базальными факторами, входящими в состав преинициаторного комплекса.
Присоединение ТАТА-фактора облегчает взаимодействие промотора с РНК-полимеразой. Факторы инициации вызывают изменение конформации РНК-полимеразы и обеспечивают раскручивание примерно одного витка спирали ДНК, т.е. образуется транскрипционная вилка,
12.Кэпирование, сплайсинг и полиаденилирование транскрпитов,синтезируемых полимеразой II. У эукариот молекула РНК модифицируется после транскрипции. По окончании транскрипции бактериальных р-РНК и т-РНК, они могут быть сразу использованы в трансляции. Никаких дополнительных изменений в структуре этих молекул не происходит. Трансляция бактериальных иРНК может начинаться даже до окончания транскрипции. Это связано с отсутствием границ между ядром и цитоплазмой. Способность инициировать трансляцию прокариотических РНК, до завершения транскрипции, предоставляет уникальную возможность регуляции транскрипции некоторых генов. Еще одна особенность бактериальных иРНК – они полицистронны. Это означает, что один транскрипт является копией нескольких структурных генов У эукариот иРНК –копия одного гена.В отличие от прокариот все типы эукариотических РНК подвергаются значительной посттранскрипционной модификации (процессингу).Вся совокупность ядерных транскриптов РНК-полимеразы II известна как гетерогенная ядерная РНК ( гяРНК ), поскольку одна из основных характеристик, отличающих эту фракцию ядерных РНК - это чрезвычайно высокая вариабельность размеров входящих в нее транскриптов.
По мере синтеза эти транскрипты ковалентно модифицируются по 5'-концам и 3'-концам таким образом, что они становятся отличными от транскриптов, синтезированных другими РНК-полимеразами. Эти модификации будут позже использованы в цитоплазме как сигналы того, что данные информационные РНК должны быть транслированы в белки. Все 3 класса РНК транскрибируются с генов, которые содержат интроны. Последовательности, кодируемые интронами ДНК, должны быть удалены из первичного транскрипта до того, как РНК станет биологически активной. Процесс удаления копий интронных последовательностей получил название сплайсинга РНК.В дополнение сплайсингу, у и-РНК происходит модификация 3’и 5’ концов. К 5 ' концу всех эукариотических иРНК (который синтезируется первым в процессе транскрипции) присоединяется во время процессинга остаток 7-метилгуанозина с образованием уникальной 5 'à 5 ' фосфодиэфирной связи. Этот дополнительный нуклеотид получил название кэпировуание или колпачек. Кэпирование происходит еще до завершения синтеза всей молекулы. Образующаяся структура на 5’ конце иРНК защищает РНК от экзонуклеаз и, что не менее важно, ответственна за последующее связывание молекулы мРНК с рибосомой.
Схема полиаденилирования иРНК

Сразу после завершения транскрипции или после специфического расщепления в определенном месте растущей цепи РНК происходит полиаденилирование. Оно заключается в том, что специальный фермент - полиаденилатполимераза присоединяет к 3'-концу каждого РНК-транскрипта, которому суждено стать молекулой мРНК, от 20 до 250 остатков адениловой кислоты (поли(А)), что и завершает процесс образования первичного РНК-транскрипта. Полиаденилатполимераза узнает специфическую последовательность AAУAAA. Этот фермент, обладающий несколькими активностями отщепляет от первичного транскрипта небольшрй фрагмент в 11-30 нуклеотидов и затем присоединяет поли(А) последовательность Функции этой последовательности неизвестны. Принято считать, что такой "хвост" способствует последующему процессингу РНК и экспорту зрелых молекул мРНК из ядра. Процессы 5'-кэпирования и 3'- полиаденилирования характерны только для транскриптов, синтезируемых РНК-полимеразой II. Это можно объяснить специфическим взаимодействием ферментов, катализирующие эти процессы с РНК-полимеразой II, но не взаимодействующих с РНК-полимеразами I и III . Необходимость маркировать подобным образом концы молекул-предшественников и-РНК может служить объяснением, почему эти молекулы синтезируются специальной РНК-полимеразой.
13. Синтез белка
В пятидесятых годах XX века было установлено, что синтез белка происходит в рибонуклеопротеиновых частицах, называющихся рибосомами. Диаметр рибосомы бактерии E. coli составляет 18 нм, а их общее количество – десятки тысяч в клетке. Рибосомы эукариот несколько крупнее (21 нм). Сам процесс протекает в пять этапов.
1.Активация аминокислот. Каждая из 20 аминокислот белка соединяется ковалентными связями к определённой т-РНК, используя энергию АТФ. Реакция катализуется специализированными ферментами, требующими присутствия ионов магния.
2.Инициация белковой цепи. и-РНК, содержащая информацию о данном белке, связывается с малой частицей рибосомы и с инициирующей аминокислотой, прикреплённой к соответствующей т-РНК. т-РНК комплементарна с находящимся в составе и-РНК триплетом, сигнализирующим о начале белковой цепи.
3.Элонгация. Полипептидная цепь удлиняется за счёт последовательного присоединения аминокислот, каждая из которых доставляется к рибосоме и встраивается в определённое положение при помощи соответствующей т-РНК. В настоящее время генетический код полностью расшифрован, то есть всем аминокислотам поставлены в соответствие триплеты нуклеотидов. Элонгация осуществляется при помощи белков цитозоля (так называемые факторы элонгации).
4.Терминация. После завершения синтеза цепи, о чём сигнализирует ещё один специальный кодон и-РНК, полипептид высвобождается из рибосомы.
5.Сворачивание и процессинг. Чтобы принять обычную форму, белок должен свернуться, образуя при этом определённую пространственную конфигурацию. До или после сворачивания полипептид может претерпевать процессинг, осуществляющийся ферментами и заключающийся в удалении лишних аминокислот, присоединении фосфатных, метильных и других групп и т. п.
Генетический код - это система записи информации о последовательности расположения аминокислот в белках с помощью последовательности расположения нуклеотидов в ДНК.
Поскольку ДНК непосредственного участия в синтезе белка не принимает, то код записывается на языке РНК. В РНК вместо тимина входит урацил.
Открытая рамка считывания — последовательность нуклеотидов в составе ДНК или РНК, потенциально способная кодировать белок. Основным параметром наличия OРС служит отсутствие стоп-кодонов.
Закрытая рамка считывания— рамка считывания, внутри которой в результате мутации возникает стоп-кодон.
Кодо́н(кодирующий тринуклеотид) — единица генетического кода, тройка нуклеотидных остатков (триплет) в ДНК или РНК, обычно кодирующих включение одной аминокислоты. Последовательность кодонов в гене определяет последовательность аминокислот в полипептиднойтцепи белка, кодируемого этим геном.
Антикодо́н— триплет (тринуклеотид), участок в транспортной рибонуклеиновой кислоте (тРНК), который спаривается с кодоном матричной РНК (мРНК) и обеспечивает включение соответствующего аминокислотного остатка в белок в процессе трансляции.
Строение рибосомы: Рибосомы прокариотических и эукариотических организмов различаются по размерам. У эукариот они представлены 80S частицами, тогда как коэффициент седиментации рибосом прокариот составляет 70S.
Рибосомы всех известных организмов построены из двух неравных субчастиц: прокариотические - 30S и 50S , а эукариотические - 40S и 60S. 70S рибосомы эубактерий в своем составе содержат 55-60 рибосомных белков, для 80S рибосом эукариот это число составляет 75-85. В обоих случаях рибосомные белки в составе рибосом ассоциированы с молекулами рРНК, образуя пространственно организованные рибонуклеопротеиновые тяжи.
14.
Рестриктазы — группа бактериальных нуклеаз, специфически расщепляющих ДНК.
Типы рестриктаз:
1. Рестриктаза первого типа (например, ЕсоК из Escherichia coli К12) узнает определённую последовательность нуклеотидов и разрезает двухцепочную молекулу ДНК неподалёку от этой последовательности в произвольной точке и само место разреза не строго специально (по-видимому, после образования комплекса с ДНК фермент неспецифически взаимодействует с удаленной областью ДНК или передвигается вдоль нити ДНК).
2. Рестриктаза второго типа (например, EcoRI) узнает определённую последовательность и разрезает двойную спираль ДНК в определённой фиксированной точке внутри этой последовательности. Рестриктазы этого типа узнают палиндромальные последовательности, которые обладают центральной осью и считываются одинаково в обе стороны от оси симметрии.
3. Рестриктаза третьего промежуточного типа (например, EcoPI) узнает нужную последовательность и разрезает двухцепочную молекулу ДНК, отступив определённое число нуклеотидных пар от её конца (или в нескольких точках на разном удалении от сайта узнавания). При этом образуются фрагменты ДНК либо с ровными (тупыми) концами, либо с выступающими (липкими) 5'- или 3'-концами. Эта рестриктаза узнает асимметричные сайты.
Сайт рестрикции[англ. site — участок, местоположение; лат. restrictio — ограничение] — короткая нуклеотидная последовательность в молекуле ДНК (обычно 4—8 п.н.), узнаваемая рестриктазой, которая определяет место расщепления данным ферментом.
Биолог.роль систем рестрикции: защита клетки от чужеродного генетического материала, например, бактериофагов и плазмид; Защитная функция систем основана на их способности взаимодействовать с сайтами узнавания и различать их метилированное и неметилированное состояние.
Рестрикционной или физической картой называют схему, на которую нанесены сайты узнавания разных рестриктаз, дана линейная последовательность этих сайтов и расстояние между ними в парах нуклеотидов. Для составления рестрикционной карты используют методы: последовательного расщепления ДНК двумя рестриктазами, частичное расщепление ДНК, меченой радиоактивной меткой по определенному концу и др. Для примера рассмотрим способ построения рестрикционной карты путем последовательного расщепления ДНК двумя рестриктазами. При этом способе сначала определяют величины фрагментов, образуемых под действием одной рестриктазы (I). Затем полученные фрагменты обрабатывают другой рестриктазой (II). И наоборот, фрагменты, полученные под действием рестриктазы II, обрабатывают рестриктазой I. На основе логического анализа, сопоставляя размеры фрагментов, образовавшихся после этих расщеплений, строят рестрикционные карты линейной или кольцевой ДНК.
Существует ряд экспериментальных данных, свидетельствующих о том, что транскрипция осуществляется в так называемых транскрипционных фабриках: огромных, по некоторым оценкам, до 10 МДа комплексах, которые содержат около 8 РНК-полимераз II и компоненты последующего процессинга и сплайсинга, а также пруф-ридинга новосинтезированного транскрипта. В ядре клетки происходит постоянный обмен между пулами растворимой и задействованной РНК-полимеразы. Активная РНК-полимераза задействована в таком комплексе, который в свою очередь является структурной организовывающей компактизацию хроматина единицей. Последние данные. свидетельствуют о том, что транскрипционные фабрики существуют и в отсутствие транскрипции, они фиксированы в клетке (пока не ясно, взаимодействуют ли они с матриксом клетки или нет) и представляют собой независимый ядерный субкомпартмент. Попытки выделить белковый функциональный комплекс транскрипционной фабрики пока не привели к успеху ввиду его огромных размеров и низкой растворимости.
РНК-полимеразы эукариот
У эукариот имеется 3 типа РНК-полимераз (не считая митохондриальной и хлоропластной):
РНК полимеразаI - синтезирует в ядрышках рибосомные RNA (18S и 28S рРНК, кроме 5S);
РНК-полимеразаII - синтезирует mRNA и некоторых sRNA;
РНК-полимеразаIII - синтезирует tRNA, sRNA, 5S rRNA.
RNA-полимеразы эукариот отличаются: количеством субъединиц – 2 большие (120-220кДа) и до 8 малых (10-100кДа), потребностью в ионах Mg и Mn, чувствительностью к – амонитину - токсину бледной поганки - пептиду включающему D-аминокислоты: polI - устойчива, polII - ингибируется при концентрации 10-8М, polIII - при 10-6М амонитина. РНК-полимеразы I,II,III кодируются в ядре. Большие субъединицы гомологичны β и β`-субъединицам эубактерий.
РНК-полимераза I
РНК-полимераза II
PolII Человека содержит более 10 субъединиц, слабо ассоциирующих друг с другом. Некоторые из них принадлежат к основным факторам транскрипции (GTF).
Белки holo-фермента PolII дрожжей [Патрушев, 2000].
Pol II - РНК-Полимеразная активность, взаимодействует с множеством общих и тканеспецифических факторов транскрипции, участвует в выборе точки инициации транскрипции.
TFIIB - Связывает Pol II и TBP на промоторе, участвует в выборе точки инициации транскрипции
TFIIF - Взаимодействует с Pol II, стимулирует элонгацию транскрипции Pol II, компонент субкомплекса SRB/медиатор
TFIIH - Активность ДНК-зависимой ATPазы, ДНК-геликазная активность, обладает активностью CTD-киназы
SRB2, SRB5 - Участвуют в образовании инициационного комплекса, стимулируют базальный и индуцированный синтез РНК,
взаимодействуют с TBP, компоненты субкомплекса SRB/медиатор
GAL11/SPT13 - Участвуют в образовании инициационного комплекса, стимулируют базальный и индуцированный синтез РНК,
компоненты субкомплекса SRB/медиатор, предположительно взаимодействуют с активаторами транскрипции
SUG1 - Компонент субкомплекса SRB/медиатор, предположительно взаимодействует с активаторами транскрипции
SRB4, SRB6, SRB7, SRB8, SRB9, SRB10, SRB11 - Компоненты субкомплекса SRB/медиатор, предположительно
взаимодействуют с CTD-доменом Pol II
РНК-полимераза III
Факторы транскрипции
Инициация
Инициация транскрипции происходит на кэп-сайте кодирующем первый нуклеодид первого экзона мРНК.
ТАТА-бокс локализуется в 25-30 пн выше кэп-сайта связывая РНК-полимеразу перед кэп-сайтом. Промотор - примерно 200 пн выше кэп-сайта. Энхансеры обычно имеют длину 100-200 пн.
Элонгация
Терминация
Терминация на сайте полиаденилирования.
Вновь синтезированная РНК генов связывается с ядерными белками - информомерами, подвергается различным посттранскрипционным модификациям и транспортируется из ядра (см. обзор Процессинг) для последующей трансляции (см. обзор Трансляция).
РНК-полимераза E.coli
РНК-полимераза E.coli осуществляет транскрипцию всех бактериальных генов и состоит из нескольких субъединиц: α-35кДа, β‘-165кДа, β-155кДа, σ-чаще 70кДа (σ70). РНК-полимераза состава ααββ’σ70 называется holo-фермент (Еσ70), состава ααββ’- core-фермент (E).
σ - сменный фактор специфичности, который диссоциирует после инициации транскрипции. Элонгация и терминация осуществляется core-ферментом. У Е.coli ~10 видов σ-субъединиц. Транскрипция генов теплового шока, оперонов gln или nif осуществляется σ54 в составе holo-фермента Eσ54 (54 кДа).
Все субъединицы заряжены отрицательно: σ>α>β>β’ – расположены по убыванию заряда. В каждой субъединице имеется кластер (+)-заряженных участков, которыми они связываются с ДНК. Наибольшее число кластеров у – β’, который участвует в связывании фермента с ДНК, β-субъединица содержит активные центры - инициации и элонгации, α-субъединицы обеспечивают правильное взаимодействие фермента с промоторами. Рифампицин – блокирует инициацию, стрептолидигин – блокирует элонгацию, что говорит о разнесении активных центров в РНК-полимеразе.
Узнавание и связывание RNA-pol с промотором осуществляется holo-ферментом
Одновременно в клетке присутствует около 7000 молекул РНК-полимеразы. Только holo-фермент обладает высоким сродством к специфической последовательности нуклеотидов - промотору, сродство к остальным случайным последовательностям ДНК у него снижено в 10000 раз. У core-фермента одинаковое сродство к любой последовательности нуклеотидов.
Сам по себе сигма - фактор обладает наименьшим сродством к ДНК по сравнению с другими субьединицами РНК-полимеразы, однако он придает holo-ферменту такую конформацию, которая обладает повышенным сродством к промотору.
Стадии узнавания и связывания, а также инициации осуществляются holo-ферментом. Элонгация и терминация осуществляются core-ферментом.
Две α субъединицы - каркас РНК-полимеразы. К ним крепятся остальные субъединицы.
β' - субъединица отвечает за прочное связывание с ДНК за счет кластера положительно заряженных аминокислот.
В β - субъединице находятся два каталитических центра. Один отвечает за инициацию, а другой - за элонгацию. Один центр работает в holo-, а другой - в core- ферменте.
Инициация транскрипции
РНК-полимераза Ecoli узнает два 6н разделенных 25н
Элонгация транскрипции
Терминация транскрипции
Регуляция транскрипции
Схема негативной индукции Жакоба и Моно
Lac-оперон E. coli содержит 3 гена, отвечающие за образование белков, участвующих в переносе в клетку дисахарида лактозы и в ее расщеплении.
Z-β - галактозидаза (расщепляет лактозу на глюкозу и галактозу).
Y-β- галактозидпермеаза (переносит лактозу через мембрану клетки).
А - тиогалактозидтрансацетилаза (ацетилирует галактозу).
В отсутствие в клетке лактозы lac-оперон выключен. Активный белок - репрессор, кодируемый в моноцистронном опероне (LacI) , не имеющем оператора, связан с оператором lac-оперона. Поскольку оператор перекрывается с промотором, даже посадка РНК-полимеразы на промотор невозможна.
Как только некоторое количество лактозы попадает в клетку, две молекулы субстрата (лактозы) взаимодействуют с белком - репрессором, изменяют его конформацию - и он теряеет сродство к оператору.
Тут же начинается транскрипция lac-оперона и трансляция образующейся mРНК; три синтезируемых белка участвуют в утилизации лактозы.
Когда вся лактоза переработана, очередная порция репрессора, свободного от лактозы, выключает lac-оперон.
Схема позитивной индукции
В Аra-опероне E. сoli 3 цистрона, которые кодируют ферменты, расщепляющие сахар арабинозу. В норме оперон закрыт. Белок - репрессор связан с оператором.
Когда в клетку попадает арабиноза, она взаимодействует с белком - репрессором. Белок - репрессор меняет конформацию и превращается из репрессора в активатор, взаимодейсивующий с промотором и облегчающий посадку РНК-полимеразы на промотор.
Эта схема регуляции называется позитивной индукцией, поскольку контролирующий элемент - белок - активатор "включает" работу оперона.
Схема позитивной репрессии
В опероне синтеза рибофлавина у Вacilus subtilis располагаются цистроны ферментов синтеза рибофлавина. Есть белок-активатор, обеспечивающий посадку РНК-полимеразы на промотор. В норме оперон открыт. Образуется N молекул рибофлавина.
N+1-ая молекула (лишняя) взаимодействует с активатором и он теряет способность активировать посадку РНК-полимеразы на промотор.
Позитивная репрессия, поскольку в регуляции участвует белок - активатор, а сама регуляция заключается в выключении транскрипции.
Схема негативной репрессии
В опероне синтеза триптофана у E. сoli имеется 5 цистронов, которые кодируют ферменты последовательной цепи реакций синтеза триптофана. В норме оперон включен. Белок - репрессор неактивен (в форме апо-репрессора), он не способен садиться на оператор.
Клетке нужно N молекул триптофана. N+1-ая молекула взаимодействует с апо-репрессором. Он меняет конформацию, садится на оператор и синтез РНК прекращается.
Схема регуляции - негативная репрессия, потому что белок репрессор "выключает" оперон.
Позитивный контроль работы lac-оперона
Lac-оперон, подчиняющийся схеме негативной индукции, имеет и позитивный контроль. цАМФ образуется из АТФ ферментом аденилатциклазой. Фосфодиэстераза превращает цАМФ в АМФ. Глюкоза активирует второй и инактивирует первый фермент. Чем больше в клетке глюкозы, тем меньше цАМФ.
Если нет глюкозы, то цАМФ соединяется с белком катаболической репрессии (САР) и образуется комплекс САР•цАМФ, активирующий посадку РНК-полимеразы на промотор. В присутствии лактозы lac-оперон включается и работает. Если же в клетке есть еще и глюкоза (более экономичный источнок энергии), то нет цАМФ - и активатор не образуется, lac-оперон работает слабо, без дополнительной индукции.
РНК-полимераза (РНКП), или полимераза рибонуклеиновой кислоты, представляет собой мультисубъединичный фермент, который катализирует процесс транскрипция где полимер РНК синтезируется из матрицы ДНК. Последовательность полимера РНК является комплементарной последовательности ДНК-матрицы и синтезируется в 5 ‘→ 3’ ориентации. Эта цепь РНК называется первичным транскриптом и должна быть обработана, прежде чем она сможет функционировать внутри клетка.
РНК-полимеразы взаимодействуют со многими белками, чтобы выполнить свою задачу. Эти белки помогают повысить специфичность связывания фермента, помогают разматывать двойную спиральную структуру ДНК, модулировать активность фермента в зависимости от требований клетки и изменять скорость транскрипции. Некоторые молекулы RNAP могут катализировать образование полимера длиной более четырех тысяч оснований каждую минуту. Тем не менее, они имеют динамический диапазон скоростей и могут время от времени останавливаться или даже останавливаться на определенных последовательностях, чтобы сохранить точность во время транскрипции.
Функции РНК-полимеразы
Традиционно центральный догмат молекулярной биологии рассматривал РНК как посланника молекула, который экспортирует информацию, закодированную в ДНК, из ядра, чтобы стимулировать синтез белков в цитоплазма : ДНК → РНК → Белок. Другими хорошо известными РНК являются переносимые РНК (тРНК ) а также рибосомная РНК (рРНК), которые также тесно связаны с механизмом синтеза белка. Однако за последние два десятилетия стало все более очевидным, что РНК выполняет ряд функций, из которых кодирование белка является только одной частью. Некоторые регулируют ген экспрессия, другие действуют как ферменты, некоторые даже имеют решающее значение в формировании гамет. Они называются некодирующими или нкРНК.
Поскольку РНКП участвует в производстве молекул, выполняющих столь широкий спектр ролей, одной из его основных функций является регулирование количества и вида транскриптов РНК, образующихся в ответ на требования клетки. Ряд различных белков, транскрипционных факторов и сигнальных молекул взаимодействует с ферментом, особенно с карбоксиконцевым концом одной субъединицы, для регуляции его активности. Считается, что эта регуляция имеет решающее значение для развития эукариотических растений и животных, где генетически идентичные клетки демонстрируют дифференциальную экспрессию генов и специализацию в многоклеточный организмы.
Кроме того, оптимальное функционирование этих молекул РНК зависит от точности транскрипции – последовательность в цепи ДНК-матрицы должна быть точно представлена в РНК. Даже единичное базовое изменение в некоторых регионах может привести к совершенно нефункциональному продукту. Следовательно, хотя фермент должен работать быстро и завершить реакцию полимеризации за короткий промежуток времени, ему необходимы надежные механизмы, обеспечивающие чрезвычайно низкую частоту ошибок. нуклеотид подложка скринируется в несколько этапов на комплементарность матричной цепи ДНК. Когда правильный нуклеотид присутствует, он создает среду, способствующую катализу и удлинению цепи РНК. Кроме того, этап корректуры позволяет исключить неправильные основания.
Наконец, РНК-полимеразы также участвуют в посттранскрипционной модификации РНК, чтобы сделать их функциональными, облегчая их экспорт из ядра в направлении их конечного сайта действия.
Типы РНК-полимеразы
Существует заметное сходство РНК-полимераз, обнаруженных у прокариот, эукариот, археи и даже некоторых вирусов. Это указывает на возможность того, что они произошли от общего предка. Прокариотический РНКП состоит из четырех субъединиц, включая сигма-фактор, который отделяется от ферментного комплекса после инициации транскрипции. В то время как прокариоты используют одну и ту же РНКП для катализа полимеризации как кодирующей, так и некодирующей РНК, эукариоты имеют пять различных РНК-полимераз.
Эукариотическая РНКП I является рабочей лошадкой, продуцирующей почти пятьдесят процентов РНК, транскрибируемой в клетке. Он исключительно полимеризует рибосомную РНК, которая образует большой компонент рибосом, молекулярные машины, которые синтезируют белки. РНК-полимераза II широко изучена, потому что она участвует в транскрипции мРНК прекурсоры. Он также катализирует образование малых ядерных РНК и микроРНК. RNAP III транскрибирует трансферную РНК, некоторую рибосомальную РНК и несколько других небольших РНК и является важной, поскольку многие из ее мишеней необходимы для нормального функционирования клетки. РНК-полимеразы IV и V обнаруживаются исключительно в растениях, и вместе они имеют решающее значение для образования малых интерферирующих РНК и гетерохроматина в ядре.
Процесс транскрипции
Транскрипция начинается со связывания фермента RNAP с определенной частью ДНК, также известной как область промотора. Это связывание требует присутствия нескольких других белков – сигма-фактора у прокариот и различных транскрипционных факторов у эукариот. Один набор белков, называемых общими факторами транскрипции, необходим для всей эукариотической транскрипционной активности и включает фактор инициации транскрипции II A, II B, II D, II E, II F и II H. Они дополняются специфическими сигнальными молекулами, которые модулируют экспрессию генов посредством участки некодирующей ДНК, расположенные выше по течению. Часто инициация прерывается несколько раз, прежде чем полимеризуется участок из десяти нуклеотидов. После этого полимераза выходит за пределы промотора и теряет большинство факторов инициации.
Сравнение ДНК и РНК-полимеразы
- 3 ′ -> 5 ′ ориентация – Направленность одной цепи нуклеиновая кислота которая происходит от нумерации атомов углерода на нуклеотидном сахарном кольце. Один конец нуклеиновой кислоты имеет свободный гидроксильная группа на третьем углероде, а другой конец имеет свободный фосфатная группа прикреплен к пятому карбону.
- Гетерохроматин – Сегменты хромосома которые транскрипционно молчат и кажутся более плотными, чем активно транскрибируемые регионы.
- миРНК – Малые интерферирующие РНК – это короткие двухцепочечные молекулы РНК, участвующие в регуляции генов посредством интерференции РНК
- Карбокси-конец – Один конец белка или полипептида, который содержит свободный карбоксильная группа присоединен к альфа-атому углерода аминокислоты. Другой конец полипептида называется N-концом или амино-концом.
викторина
1. Какая из этих РНК-полимераз катализирует образование мессенджерной РНК (мРНК)?A. RNAP IB. RNAP IIC. RNAP IIID. RNAP V
Ответ на вопрос № 1
В верно. РНКП I и III катализируют образование рРНК и других малых РНК. RNAP V участвует в образовании гетерохроматина.
2. Какая из этих РНК-полимераз находится только в растениях?A. RNAP I и IIB. RNAP I и IIIC. RNAP IV и VD. Ни один из вышеперечисленных
Ответ на вопрос № 2
С верно. Остальные встречаются у всех эукариот.
3. Что из этого присутствует во время инициации прокариотической транскрипции?A. Сигма-факторB. Фактор транскрипции II AC. Фактор транскрипции II BD. Фактор транскрипции II D
1. РНК-полимераза I – осуществляет только транскрипцию рибососмальной РНК.
2. РНК-полимераза II – осуществляет транскрипцию большинства генов
3. РНК-полимераза III – осуществляет синтез транспортной РНК, 5S-рибосомального гена и малых ядерных РНК.
Структурно сходны друг с другом и имеют некоторые общие субъединицы, тогда как другие субъединицы являются уникальными. Каждая из этих РНК-полимераз, полагают, содержит 10 или более полипептидных цепей. РНК-полимеразы эукариот и бактерий эволюционно родственны. РНК-полимеразы I, II и III отличаются по чувствительности к токсину альфа-аманитину: РНК-полимераза I не чувствительна к нему; РНК-полимераза II очень чувствительна; РНК-полимераза III умеренно чувствительна. РНК- полимераза II транскрибирует гены, РНК-продукты которых будут транслированы в белки. Другие две РНК-полимеразы синтезируют РНК, которые выполняют структурные или каталитические роли, в основном, как часть белок-синтезирующего аппарата.
11.Инициация транскрипции РНК полимеразой II эукариот. Для правильной инициации транскрипции РНК полимеразой II в зоне корового элемента промотора должны собраться соответствующие инициаторные факторы, называемые TFII (Transcription Factors of RNA polymerase II). Среди них: TFIIA, TFIIB, TFIID, TFIIE, TFIIF и TFIIH. Из вышеупомянутых факторов лишь TFIID способен напрямую взаимодействовать с промоторной областью ДНК, остальные факторы удерживаются в промоторной области посредством белок-белковых взаимодействий друг с другом и с TFIID.
Специфическое связывание TFIID с ДНК является начальным этапом инициации транскрипции. В основе этого события лежит специфическое взаимодействие ТАТА - связывающего компонента TFIID (TBP - TATA Binding Protein) с соответствующим участком ДНК.
Связывание TBP с ТАТА-боксом запускает каскад событий, приводящий к формированию преинициаторного комплекса: с TBP-TATA комплексом связывается инициаторный фактор TFIIB, с TFIIB связывается преформированный комплекс полимеразы II с инициаторным фактором TFIIF. Считается, что таким образом реализуется одна из функций TFIIB, состоящая в правильном позиционировании полимеразы относительно промотора. С TFIIF связывается инициаторный фактор TFIIE, с TFIIE связывается фактор TFIIH. На этом формирование преинициаторного комплекса заканчивается.
В преинициаторном комплексе TFIIH проявляет киназную активность - фосфорилирует С - концевой домен большой субъединицы РНК полимеразы II. Тем временем хеликаза АТФ - зависимо расплетает двойную спираль ДНК в районе старта транскрипции. Формируется так называемый "открытый" комплекс. Полимераза уходит с промотора и начинает элонгацию. После ухода полимеразы TFIID остаётся связанным с коровым элементом промотора в течение некоторого времени и может принять участие в новом раунде инициации. После терминации транскрипции специальная фосфатаза возвращает большую субъединицу полимеразы в дефосфорилированное состояние. Таким образом восстанавливается способность полимеразы инициировать транскрипцию. Существуют две модели инициации транскрипции РНК-полимеразой II. В соответствии с одной из них на промоторе происходит постепенная (ступенчатая) сборка инициационного комплекса из отдельных компонентов. Другая модель акцентирует внимание на то, что Pol II может входить в состав инициационного комплекса в виде холофермента, состоящего из многих субъединиц. Сборка такого комплекса начинается с последовательного связывания с промотором основных факторов транскрипции. Инициация транскрипции с промоторов класса II регулируется на уровне сборки мультибелкового преинициаторного комплекса в районе промотора.
Одной из форм регуляции является взаимодействие базальных компонентов преинициаторного комплекса с белками - активаторами, связанными с проксимальными или дистальными элементами промотора.
Другая форма регуляции - посредством прямого связывания соответствующих активаторов с компонентами преинициаторного комплекса. Например, TBP - ассоциированные факторы (TAF's), входящие в состав TFIID, являются мишенью для ген-специфических активаторов транскрипции таких как p53, NF kappa B, эстрогеновый рецептор и другие.
В регуляции инициации также принимают участие белки, называемые non-TAF коактиваторами. Примером такого рода служит дрожжевой белок GCN5. Эти белки играют роль адаптеров между активаторами и факторами, входящими в состав преинициаторного комплекса.
Разнообразные регуляторные взаимодействия имеют место и между самими факторами инициации транскрипции. Например, отмечены взаимодействия между dTAF42 (а также его человеческим гомологом hTAF31) и фактором инициации TFIIB. Показано, что hTAF80 взаимодействует с TFIIF. Вероятно, роль подобных взаимодействий состоит в том, чтобы дополнительно стабилизировать преинициаторный комплекс и облегчить привлечение последующих факторов.
Существует минимальный набор белков, достаточный для того, чтобы инициировать транскрипцию с промотора класса II in vitro. Это - перечисленные выше основные компоненты преинициаторного комплекса. Однако, вышеупомянутые белки способны обеспечить довольно низкий уровень транскрипции, называемый базальным. Причиной подобного эффекта принято считать препятствия, возникающие in vivo в виде негативных регуляторов инициации транскрипции, структуры хроматина и так далее. Считается, что в клетке такого рода препятствия преодолеваются с помощью активаторов транскрипции, взаимодействующих как с ДНК в районе промотора, так и с базальными факторами, входящими в состав преинициаторного комплекса.

Присоединение ТАТА-фактора облегчает взаимодействие промотора с РНК-полимеразой. Факторы инициации вызывают изменение конформации РНК-полимеразы и обеспечивают раскручивание примерно одного витка спирали ДНК, т.е. образуется транскрипционная вилка,
12.Кэпирование, сплайсинг и полиаденилирование транскрпитов,синтезируемых полимеразой II. У эукариот молекула РНК модифицируется после транскрипции. По окончании транскрипции бактериальных р-РНК и т-РНК, они могут быть сразу использованы в трансляции. Никаких дополнительных изменений в структуре этих молекул не происходит. Трансляция бактериальных иРНК может начинаться даже до окончания транскрипции. Это связано с отсутствием границ между ядром и цитоплазмой. Способность инициировать трансляцию прокариотических РНК, до завершения транскрипции, предоставляет уникальную возможность регуляции транскрипции некоторых генов. Еще одна особенность бактериальных иРНК – они полицистронны. Это означает, что один транскрипт является копией нескольких структурных генов У эукариот иРНК –копия одного гена.В отличие от прокариот все типы эукариотических РНК подвергаются значительной посттранскрипционной модификации (процессингу).Вся совокупность ядерных транскриптов РНК-полимеразы II известна как гетерогенная ядерная РНК ( гяРНК ), поскольку одна из основных характеристик, отличающих эту фракцию ядерных РНК - это чрезвычайно высокая вариабельность размеров входящих в нее транскриптов.
По мере синтеза эти транскрипты ковалентно модифицируются по 5'-концам и 3'-концам таким образом, что они становятся отличными от транскриптов, синтезированных другими РНК-полимеразами. Эти модификации будут позже использованы в цитоплазме как сигналы того, что данные информационные РНК должны быть транслированы в белки. Все 3 класса РНК транскрибируются с генов, которые содержат интроны. Последовательности, кодируемые интронами ДНК, должны быть удалены из первичного транскрипта до того, как РНК станет биологически активной. Процесс удаления копий интронных последовательностей получил название сплайсинга РНК.В дополнение сплайсингу, у и-РНК происходит модификация 3’и 5’ концов. К 5 ' концу всех эукариотических иРНК (который синтезируется первым в процессе транскрипции) присоединяется во время процессинга остаток 7-метилгуанозина с образованием уникальной 5 'à 5 ' фосфодиэфирной связи. Этот дополнительный нуклеотид получил название кэпировуание или колпачек. Кэпирование происходит еще до завершения синтеза всей молекулы. Образующаяся структура на 5’ конце иРНК защищает РНК от экзонуклеаз и, что не менее важно, ответственна за последующее связывание молекулы мРНК с рибосомой.
Схема полиаденилирования иРНК

Сразу после завершения транскрипции или после специфического расщепления в определенном месте растущей цепи РНК происходит полиаденилирование. Оно заключается в том, что специальный фермент - полиаденилатполимераза присоединяет к 3'-концу каждого РНК-транскрипта, которому суждено стать молекулой мРНК, от 20 до 250 остатков адениловой кислоты (поли(А)), что и завершает процесс образования первичного РНК-транскрипта. Полиаденилатполимераза узнает специфическую последовательность AAУAAA. Этот фермент, обладающий несколькими активностями отщепляет от первичного транскрипта небольшрй фрагмент в 11-30 нуклеотидов и затем присоединяет поли(А) последовательность Функции этой последовательности неизвестны. Принято считать, что такой "хвост" способствует последующему процессингу РНК и экспорту зрелых молекул мРНК из ядра. Процессы 5'-кэпирования и 3'- полиаденилирования характерны только для транскриптов, синтезируемых РНК-полимеразой II. Это можно объяснить специфическим взаимодействием ферментов, катализирующие эти процессы с РНК-полимеразой II, но не взаимодействующих с РНК-полимеразами I и III . Необходимость маркировать подобным образом концы молекул-предшественников и-РНК может служить объяснением, почему эти молекулы синтезируются специальной РНК-полимеразой.
13. Синтез белка
В пятидесятых годах XX века было установлено, что синтез белка происходит в рибонуклеопротеиновых частицах, называющихся рибосомами. Диаметр рибосомы бактерии E. coli составляет 18 нм, а их общее количество – десятки тысяч в клетке. Рибосомы эукариот несколько крупнее (21 нм). Сам процесс протекает в пять этапов.
1.Активация аминокислот. Каждая из 20 аминокислот белка соединяется ковалентными связями к определённой т-РНК, используя энергию АТФ. Реакция катализуется специализированными ферментами, требующими присутствия ионов магния.
2.Инициация белковой цепи. и-РНК, содержащая информацию о данном белке, связывается с малой частицей рибосомы и с инициирующей аминокислотой, прикреплённой к соответствующей т-РНК. т-РНК комплементарна с находящимся в составе и-РНК триплетом, сигнализирующим о начале белковой цепи.
3.Элонгация. Полипептидная цепь удлиняется за счёт последовательного присоединения аминокислот, каждая из которых доставляется к рибосоме и встраивается в определённое положение при помощи соответствующей т-РНК. В настоящее время генетический код полностью расшифрован, то есть всем аминокислотам поставлены в соответствие триплеты нуклеотидов. Элонгация осуществляется при помощи белков цитозоля (так называемые факторы элонгации).
4.Терминация. После завершения синтеза цепи, о чём сигнализирует ещё один специальный кодон и-РНК, полипептид высвобождается из рибосомы.
5.Сворачивание и процессинг. Чтобы принять обычную форму, белок должен свернуться, образуя при этом определённую пространственную конфигурацию. До или после сворачивания полипептид может претерпевать процессинг, осуществляющийся ферментами и заключающийся в удалении лишних аминокислот, присоединении фосфатных, метильных и других групп и т. п.
Генетический код - это система записи информации о последовательности расположения аминокислот в белках с помощью последовательности расположения нуклеотидов в ДНК.
Поскольку ДНК непосредственного участия в синтезе белка не принимает, то код записывается на языке РНК. В РНК вместо тимина входит урацил.
Открытая рамка считывания — последовательность нуклеотидов в составе ДНК или РНК, потенциально способная кодировать белок. Основным параметром наличия OРС служит отсутствие стоп-кодонов.
Закрытая рамка считывания— рамка считывания, внутри которой в результате мутации возникает стоп-кодон.
Кодо́н(кодирующий тринуклеотид) — единица генетического кода, тройка нуклеотидных остатков (триплет) в ДНК или РНК, обычно кодирующих включение одной аминокислоты. Последовательность кодонов в гене определяет последовательность аминокислот в полипептиднойтцепи белка, кодируемого этим геном.
Антикодо́н— триплет (тринуклеотид), участок в транспортной рибонуклеиновой кислоте (тРНК), который спаривается с кодоном матричной РНК (мРНК) и обеспечивает включение соответствующего аминокислотного остатка в белок в процессе трансляции.
Строение рибосомы: Рибосомы прокариотических и эукариотических организмов различаются по размерам. У эукариот они представлены 80S частицами, тогда как коэффициент седиментации рибосом прокариот составляет 70S.
Рибосомы всех известных организмов построены из двух неравных субчастиц: прокариотические - 30S и 50S , а эукариотические - 40S и 60S. 70S рибосомы эубактерий в своем составе содержат 55-60 рибосомных белков, для 80S рибосом эукариот это число составляет 75-85. В обоих случаях рибосомные белки в составе рибосом ассоциированы с молекулами рРНК, образуя пространственно организованные рибонуклеопротеиновые тяжи.
14.
Рестриктазы — группа бактериальных нуклеаз, специфически расщепляющих ДНК.
Типы рестриктаз:
1. Рестриктаза первого типа (например, ЕсоК из Escherichia coli К12) узнает определённую последовательность нуклеотидов и разрезает двухцепочную молекулу ДНК неподалёку от этой последовательности в произвольной точке и само место разреза не строго специально (по-видимому, после образования комплекса с ДНК фермент неспецифически взаимодействует с удаленной областью ДНК или передвигается вдоль нити ДНК).
2. Рестриктаза второго типа (например, EcoRI) узнает определённую последовательность и разрезает двойную спираль ДНК в определённой фиксированной точке внутри этой последовательности. Рестриктазы этого типа узнают палиндромальные последовательности, которые обладают центральной осью и считываются одинаково в обе стороны от оси симметрии.
3. Рестриктаза третьего промежуточного типа (например, EcoPI) узнает нужную последовательность и разрезает двухцепочную молекулу ДНК, отступив определённое число нуклеотидных пар от её конца (или в нескольких точках на разном удалении от сайта узнавания). При этом образуются фрагменты ДНК либо с ровными (тупыми) концами, либо с выступающими (липкими) 5'- или 3'-концами. Эта рестриктаза узнает асимметричные сайты.
Сайт рестрикции[англ. site — участок, местоположение; лат. restrictio — ограничение] — короткая нуклеотидная последовательность в молекуле ДНК (обычно 4—8 п.н.), узнаваемая рестриктазой, которая определяет место расщепления данным ферментом.
Биолог.роль систем рестрикции: защита клетки от чужеродного генетического материала, например, бактериофагов и плазмид; Защитная функция систем основана на их способности взаимодействовать с сайтами узнавания и различать их метилированное и неметилированное состояние.
Рестрикционной или физической картой называют схему, на которую нанесены сайты узнавания разных рестриктаз, дана линейная последовательность этих сайтов и расстояние между ними в парах нуклеотидов. Для составления рестрикционной карты используют методы: последовательного расщепления ДНК двумя рестриктазами, частичное расщепление ДНК, меченой радиоактивной меткой по определенному концу и др. Для примера рассмотрим способ построения рестрикционной карты путем последовательного расщепления ДНК двумя рестриктазами. При этом способе сначала определяют величины фрагментов, образуемых под действием одной рестриктазы (I). Затем полученные фрагменты обрабатывают другой рестриктазой (II). И наоборот, фрагменты, полученные под действием рестриктазы II, обрабатывают рестриктазой I. На основе логического анализа, сопоставляя размеры фрагментов, образовавшихся после этих расщеплений, строят рестрикционные карты линейной или кольцевой ДНК.
РНК-полимераза — фермент, осуществляющий синтез молекул РНК. В узком смысле, РНК-полимеразы обычно назвають ДНК-зависимые РНК-полимеразы, осуществляющие синтез молекул РНК на матрице ДНК, то есть осуществляют транскрипцию. Ферменты класса РНК-полимеразы очень важны для функционирования клетки, поэтому они у всех организмах и во многих вирусах. Химически РНК-полимеразы является нуклеотидил-трансферазы, что полимеризуют рибонуклеотиды на 3'-конце цепочки РНК.
История исследования
РНК-полимераза была открыта независимо Сэмом Вайссом и Джерардом Хурвиц в 1960 году. К этому моменту Нобелевская премия по физиологии и медицине в 1959 году уже была присуждена Северо Очоа и Артуру Корнбергу за открытие вещества, которое считали РНК-полимеразы, что впоследствии оказалась рибонуклеазы.
Нобелевская премия по химии в 2006 году была присуждена Роджеру Корнбергу за получение точных изображений молекул РНК-полимеразы в различные моменты процесса транскрипции.
Управление транскрипцией
Управление процессом транскрипции генов позволяет контролировать экспрессию генов и таким образом позволяет клетке адаптироваться к изменениям условий внешней среды, поддерживать метаболические процессы на должном уровне, а также выполнять специфические функции, необходимые для существования организма. Неудивительно, что действие РНК-полимеразы очень сложная и зависит от множества факторов (так, в Escherichia coli идентифицировано более 100 факторов, тем или иным способом влияют на РНК-полимеразы).
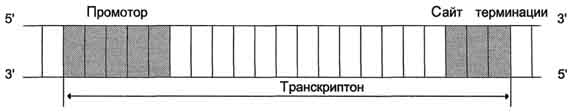
РНК-полимераза начинает транскрипцию с особых участков ДНК, называемых промоторами, и синтезирует цепочку РНК, комплементарный соответствующей части цепи ДНК.
Процесс наращивания молекулы РНК нуклеотидами называется элонгацией. В эукариотических клетках РНК-полимераза может собирать цепочки длиной более 2400000 элементов (например, такую длину имеет полный ген белка дистрофину).
РНК-полимераза завершает формирование цепочки РНК, когда встречает в ДНК специфическую последовательность, называется терминатором.
РНК-полимераза синтезирует такие типы РНК:
РНК-полимераза осуществляет синтез с нуля. Это возможно вследствие того, что взаимодействие начального нуклеотида гена и РНК-полимеразы позволяет ей закрепиться на цепочке и присоединиться к следующим нуклеотидов. Это отчасти объясняет, почему РНК-полимераза обычно начинает транксрипцию с аденина, за которым следует гуанин, урацил и затем цитозин. В отличие от ДНК-полимеразы РНК-полимеразы присуща также геликазна активность, не требует дополнительных ферментов для раскручивания спирали ДНК.
Действие РНК-полимеразы
Связывания и инициация транскрипции
В связке РНК-полимеразы участвует α-субъединица, распознающая элемент ДНК, предшествующий гену (-40 … -70 шагов), и σ-фактор, участок, распознает элемент на позициях -10 … -35. Существует большое количество σ-факторов, контролирующих экспрессию генов. Например: σ) завершается, и σ-фактор отделяется от РНК-полимеразы. Это позволяет РНК-полимеразной комплекса начать движение вперед, поскольку σ-фактор удерживал его на месте.
Добавление рибонуклеотидов к РНК имеет механизм, очень близок к полимеризации ДНК. Считается, что ДНК и РНК-полимеразы могут быть эволюционно связаны. Аспарагин остатки в РНК-полимеразы связываются с ионами Mg 2+, которые, в свою очередь, осуществляют выравнивание фосфатных групп рибонуклеотидов: первый Mg 2+ удерживает α-фосфат нуклеотидтрифосфату, подлежащего добавлению в цепочку. Это позволяет осуществить связывание нуклеотида с 3 'OH-группой конца снятого цепочки и таким образом добавить НТФ в цепочку. Второй Mg 2+ удерживает пирофосфат НТФ. Общее уравнение реакции таким образом имеет вид:
Терминация
Терминация транскрипции РНК может быть ρ-независимой или ρ-зависимой.
Бактериальная РНК-полимераза
У бактерий один и тот же фермент катализирует синтез трех типов РНК: мРНК, рРНК и тРНК.
РНК-полимераза — достаточно большая молекула. Основной фермент содержит 5 субъединиц (~ 400 кДа):
- α 2: две α-субъединицы связывают остальные элементы фермента и распознают регулирующие факторы. Каждая субъединица состоит из двух доменов: αСКД (С-концевой домен) связывает первый элемент промотора, и αNКД (N-концевой домен) связывается с остальными компонентами полимеразы.
- β: эта субъединица имеет собственное полимеразной действие, то есть катализирует синтез РНК. Она осуществляет инициацию процесса и управляет элонгацией.
- β ': неспецифически связывается с ДНК.
- ω: восстанавливает денатурированную РНК-полимеразы назад в дееспособную форму in vitro. Также обнаружено ее защитная / шаперонна воздействие на β'-субъединицы в Mycobacterium smegmatis.
Для связывания с промоторной областями ДНК, основной фермент нуждается еще одну субъединицу — сигма (σ). Сигма-фактор значительно снижает сродство РНК-полимеразы к неспецифическим областей ДНК, и в то же время повышает ее чувствительность к определенным промоторов, в зависимости от своей структуры. С его помощью транскрипция начинается с нужного участка ДНК.
Полный голофермент таким образом состоит из 6 субъединиц: α 2 ββ'σω (~ 480 кДа).
В структуре РНК-полимеразы присутствует канавка 55 Å длиной (5,5 нм) и 25 Å шириной (2,5 нм). Именно в эту канавку помещается двойная спираль ДНК, имеет ширину 20 Å (2 нм). На длине канавки заключается 16 нуклеотидов.
Молекулы РНК-полимеразы не плавают свободно в цитоплазме. Когда РНК-полимераза не используется, она связывается с неспецифическими областями ДНК в ожидании открытия активного промотора.
Транскрипционные кофакторы
Отдельный кофактор Mfd задействован в транскрипционном восстановлении ДНК. Во время этого процесса РНК-полимераза обнаруживает поврежденные участки ДНК и привлекает другие ферменты для ее восстановления.
Многие другие кофакторов имеют регулирующее воздействие, заставляя РНК-полимеразы экспрессировать либо не экспрессировать определенные гены.
РНК-полимераза в эукариотических клетках
Эукариоты имеют различные типы РНК-полимеразы, которые классифицируются по типам РНК, которые они синтезируют:
- РНК-полимераза I, синтезирует 45S-предшественника рРНК, что превращается затем в рРНК 28S, 18S и 5,8S, которые создают главные РНК-секции рибосомы.
- РНК-полимераза II, синтезирует предшественников для мРНК, а также для большинства мяРНК и миРНК. Это лучше изученный тип РНК-полимеразы. Учитывая то, что транскрипция должна происходить под строгим контролем, РНК-полимеразы II для связывания с промоторами требуется целый набор факторов транскрипции.
- РНК-полимераза III, синтезирует тРНК, 5S рРНК и другие малые РНК, присутствует в ядре и цитозоле.
Существуют также и другие типы РНК-полимеразы, используемые в митохондриях и хлоропластах.
РНК-полимераза у архей
Археи используют один вид РНК-полимеразы, который тем не менее очень похож на три основных типа РНК-полимеразы у эукариот. Некоторые ученые предполагают, что архейна РНК-полимераза в определенном приближении может быть эволюционным предком специализированных эукариотических полимераз.
РНК-полимераза у вирусов
Многие вирусы содержат РНК полимеразы. Пожалуй, лучше всего изучена вирусная РНК-полимераза бактериофага Т7. Эта РНК-полимераза, состоящая из одной субъединицы, похожа на митохондриальную и хлоропластная, а также на ДНК-полимеразы.
Считается, что большинство вирусных полимераз произошли от ДНК-полимеразы, а не от сложных многокомпонентных РНК-полимеразы.
Вирусные полимеразы очень разнообразны. Некоторые из них могут использовать как шаблон РНК, а не ДНК, как, например, у вирусов с двухцепочечной РНК или одноцепочечной РНК с обратной последовательностью. Некоторые вирусы с одноцепочечной РНК с прямой последовательностью также содержат РНК-зависимые РНК-полимеразы.
Функциональные области
C'-концевой домен РНК-полимеразы
Инициирование транскрипции
Домен, расположенный на карбоксильных конце РНК-полимеразы II осуществляет инициацию транскрипции ДНК. C'-концевой домен обычно состоит из порядка 52 повторения последовательности Tyr-Ser-Pro-Thr-Ser-Pro-Ser.
Фактор транскрипции TFIIH, что является киназы, гиперфосфорилюруе C'-концевой домен РНК-полимеразы, тем самым заставляя полимеразной комплекс начать движение от места инициации транскрипции.
5'-кеппинг
Домен карбоксильного конца также является местом связывания с комплексом кэп-синтеза и кэп-связывания. У эукариот после сборки 5'-конца РНК, кэп-синтезирующий комлекс отщепляет гамма-фосфат от 5'-фосфата и присоединяет к нему гуанозинмонофосфат с образованием 5 ', 5'-трифосфатных связи. Синтезирующий комплекс затем отделяется и шапочка с ГТФ связывается с кэп-связывающим комплексом, который в свою очередь связан с C'-конечным доменом РНК-полимеразы. Шапочка на 5'-конце эукариотических РНК важна для связывания молекул РНК с рибосомами или РНК-полимеразы, а также предотвращает разрушение РНК.
Сплайсосома
Углекисло-концевой домен РНК-полимеразы также является областью связывания с сплайсосомнимы факторами, участвующих в процессе сплайсинга РНК. Эти факторы способствуют осуществлению сплайсинга и удаление интронов в процессе транскрипции РНК.
Мутация в C'-конечном домене
Проведен ряд исследований поведения РНК-полимеразы при удалении определенных аминокислот с ее C'-концевого домена. Показано, что мутации усечения C'-концевого домена РНК-полимеразы II влияют на ее способность начинать транскрипцию набора генов in vivo, снижая чувствительность к активационных последовательностей этих генов.
Читайте также:
- Подготовка руки к письму в подготовительной группе детского сада
- Весной зеленела летом загорела осень в сад пришла красный факел зажгла
- Выберите предложение в котором нет ошибок и здесь растет зеленая трава
- Актинидия фестивальная описание сорта
- Традиционный способ выведения новых сортов растений и пород животных

