Среды для получения изолированных колоний при посеве исследуемого материала
Добавил пользователь Евгений Кузнецов Обновлено: 19.09.2024
Чистой называют культуру, содержащую микроорганизмы одного вида и полученную как потомство одной клетки.
Культуры бактерий одного вида, выделенные из различных источников или из одного источника в разное время, называют штаммами. Разные штаммы одного и того же вида бактерий могут отличаться друг от друга по ряду свойств, например по чувствительности к антибиотикам, способности к образованию токсинов, ферментов и др.
Чистые культуры можно получить из исходной микробной клетки, изолированной при помощи микроманипулятора, или из изолированных колоний путем их пересева в отдельные пробирки с питательной средой.
При получении чистой культуры из изолированных колоний предпочтительно производить высев исследуемого материала на неселективные среды, поскольку в случае использования селективных сред в колонии или рядом с ней могут присутствовать жизнеспособные, но не растущие на этих средах сопутствующие микроорганизмы, которые будут пересеяны вместе с выделяемым микроорганизмом. На неселективных же средах сопутствующие микроорганизмы образуют видимые колонии.
Для выделения чистой культуры по способу Дригальского расплавленную питательную среду разливают в 3 чашки Петри. Застывшую среду обязательно подсушивают, так как влажная поверхность способствует сливному росту. В первую чашку вносят одну каплю исследуемого материала и стерильным шпателем втирают его в поверхность питательной среды.
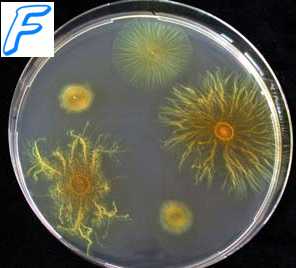
Далее, не набирая нового материала и не прожигая шпателя, последний переносят во вторую, а затем и в третью чашки, втирая в поверхность питательных сред оставшийся на нем материал. При посеве материала, обильно обсемененного микрофлорой, на второй и на третьей чашках вырастают изолированные колонии. Полученные отдельные колонии служат для пересева в пробирки с жидкой или твердой питательной средой и получения чистой культуры микроорганизма.
Метод рассева по поверхности, предложенный Дригальским, наиболее широко применяется для получения чистой культуры микробов. Вместо шпателя можно пользоваться петлей. Материал на питательной среде распределяют по всей чашке параллельными штрихами в одном направлении. Затем, повернув чашку на 90 °, проводят штрихи в направлении, перпендикулярном первым штрихам. При таком способе посева материал, находящийся в петле, расходуется постепенно, и по линиям штрихов, нанесенных в конце посева, вырастают изолированные колонии микробов.
При получении чистой культуры методом рассева в глубине среды (по Коху) три пробирки, содержащие по 15 мл мясопептонного агара, ставят в водяную баню для расплавления агара. Расплавленную среду остужают до температуры 43-45 °С. В пробирку вносят одну бактериологическую петлю исследуемого материала. Для лучшего перемешивания материала со средой засеянную пробирку вращают несколько раз, зажав между ладонями.
После этого одну петлю (прокаленную и остуженную) содержимого первой пробирки переносят во вторую и таким же образом из второй в третью. Приготовленные разведения микробов выливают из пробирок в стерильные чашки Петри, обозначенные номерами, соответствующими номерам пробирок.
После застудневания среды с исследуемым материалом чашки помещают в термостат. Количество колоний в чашках с питательной средой уменьшается по мере разведения материала.
Консервирующие для длительного хранения микроорганизмов в условиях морозильной камеры. Эти среды содержат криопротекторы (10% глицерин), защищающие мембраны в процессе замораживания; необходимы для создания коллекций микроорганизмов.
Приготовление питательных сред.
Большинство сред, используемых в бактериологии, представляют собой высушенные концентраты в заводской фасовке, которые взвешивают, растворяют в дистиллированной воде, стерилизуют и разливают в лабораторную посуду. Этапы приготовления таких сред следующие:
Взвешивают навеску сухой концентрированной среды в соответствии с инструкцией по применению.
Растворяют навеску в соответствующем объеме дистиллированной воды.
Доводят до кипения при постоянном перемешивании и кипятят 1 мин до полного растворения компонентов. Доводят рН среды до требуемой величины обычно, 7,2±0,2.
Разливают среду в подготовленную посуду, закрывают ватно-марлевыми пробками, стерилизуют в автоклаве при +121 0 С в течение 15 мин. Среды с углеводами стерилизуют при +115 0 С в течение 15 мин.
После охлаждения среды до 4550 0 С добавляют при необходимости селективные и/или стимулирующие добавки: 5% крови, 5% сыворотки, антибиотики, гемин, витамины и др., тщательно перемешивают.
Разливают среду в стерильные чашки Петри по 20 мл на чашку (чтобы глубина агарового слоя составляла не менее 4 мм), равномерно распределяют, оставляют до застывания. Используют стерильные одноразовые пластиковые чашки Петри или стеклянные, многоразового использования, предварительно простерилизованные.
После застывания среды её подсушивают от конденсата в термостате в течение 30 мин. Для этого на полку термостата кладут лист фильтровальной бумаги и помещают чашку так, чтобы крышка служила опорой для края её дна, перевёрнутого средой вниз.
При необходимости чашки Петри с готовой средой можно хранить в запаянном полиэтиленовом пакете при +2+8 0 С в течение 710 суток; перед посевом среды подсушивают в термостате до исчезновения конденсата на внутренней поверхности крышки.
Рост бактерий в жидких питательных средах.
При росте бактерий в жидких питательных средах могут наблюдаться:
1) равномерное помутнение среды типично для большинства факультативно-анаэробных бактерий; при этом степень помутнения может быть слабой, умеренной или сильной;
2) придонное или пристеночное помутнение среды специфично для стрептококков и облигатно анаэробных бактерий; осадок может быть плотным, рыхлым, слизистым или хлопьевидным;
Рост бактерий на плотных питательных средах.
На плотной питательной среде из одной микробной клетки вырастает скопление микроорганизмов колония. Морфотипы колоний, вырастающих на средах, зависят от видовой принадлежности микроорганизма и позволяют идентифицировать и дифференцировать микроорганизмы.
На плотных питательных средах колонии микроорганизмов могут отличаться размерами, формой, краем, поверхностью, прозрачностью, структурой и консистенцией, профилем, цветом и запахом (табл. 7, рис. 19).
Развитие управляющих функций мозга ребёнка: полезные советы и упражнения для педагогов
Сертификат и скидка на обучение каждому участнику
Методы выделение чистых культур микроорганизмов аэробов и анаэробов.
1. Методы выделения аэробов. Бактериологический метод: назначение, цель, этапы
2. Методы выделения анаэробов
1.Бактериологический (культуральный) метод — комплекс методов для выявления патогенных микроорганизмов у больного, у носителя или на объектах внешней среды. Это метод выделения, выращивания и определения свойств чистой культуры микроорганизмов с целью установления принадлежности к той или иной систематической группе (виду, роду) и называется их идентификация. Выделение чистой культуры основа бактериологического метода.
Чистая культура — микроорганизмы одного вида, полученные из одной или нескольких клеток в результате размножения на искусственной питательной среде. Бактериологическое исследование может быть использовано для диагностики, профилактики инфекционных заболеваний, для санитарно-гигиенической характеристики среды, окружающей человека, для научного исследования. Материал и метод бактериологического исследования зависят от цели анализа, условий среды, патогенеза и течения заболевания. В целом бактериологический метод исследования представляет собой многоэтапное бактериологическое исследование.

Выделение чистых культур аэробов занимает, как правило, три дня и производится по следующей схеме:
1-й день (I этап). - Основная цель этого дня – произвести посев исследуемого материала таким способом и методом, чтобы получить рост изолированных колоний.
1. Макроскопическая оценка исследуемого материала (объём, цвет, характер, консистенция). От этой оценки зависит подготовка материала к посеву и выбор сред. Механический метод выделения чистой культуры используют если: Материала много и он жидкий (моча, СМЖ), то материал центрифугируют и для посева используют осадок, предварительно слив надосадочную жидкость, таким образом, посевной материал содержит все микроорганизмы исследуемого материала. Если материал вязкий ( гной, мокрота, фекалии), то небольшую порцию материала растирают со стерильным физ. раствором и полученную эмульсию используют для посева. Если материал плотный (кусочки ткани или кости), то с них делают смыв стерильным физ. раствором и засевают на среды смывы.
Физический метод используют, если исследуемый материал по направлению предполагает наличие споровых культур, в таком случае часть или весь материал прогревают до + 800С, при этом сопутствующая вегетативная флора погибает, а сохранившиеся споры после посева прорастают и дают чистую культуру возбудителя.
Химический метод используют, если материал может предполагать наличие кислотоустойчивых бактерий, то в этом случае порцию материала обрабатывают 2-4 % раствором H2SO4, а затем нейтрализуют щёлочью под контролем индикатора и используют для посева. При такой обработке погибает вся сопутствующая флора, сохраняются только кислотоустойчивые бактерии. Соответственно поступают и при наличии щёлоче- и спиртоустойчивых бактерий.
Биологический метод . К этому методу относят добавление в питательную среду антибиотика, к которому устойчив предполагаемый возбудитель, этом случае гибнет под воздействием данного антибиотика вся сопутствующая флора в исследуемом материале. Также к биологическому методу относят заражение исследуемым материалом лабораторных животных, чувствительных к данному возбудителю, после чего у животного берут материал и высевают на питательные среды.
Метод элективных сред позволяет выделить определённого возбудителя, за счет нахождения в питательной среде элективного фактора к которому чувствительна сопутствующая флора.
2. В некоторых случаях проводят микроскопию мазка из исследуемого материала, окрашенного (обычно по Граму) - для предварительного ознакомления с микрофлорой и ориентировочного ответа, что может быть полезным в выборе питательной среды для посева.
3. Если в исследуемом материале заведомо мало выделяемого возбудителя, то такой материал засевают на среды обогащения, в этом случае бактериологическое исследование длиться дольше на один или несколько дней.
4.Затем посев материала на питательные среды для получения изолированных колоний. Среды подбирают также исходя из особенностей предполагаемого возбудителя и характера материала.
Способ посева может быть открытым или закрытым, что зависит от возможности предполагаемого возбудителя находиться в воздухе. Для того чтобы получить рост изолированных колоний можно использовать методы посева, выполненные с помощью бак. петли, шпателя, стеклянной палочки и ватного тампона:
А.Рассев можно произвести по методу Дригальского на три чашки Петри с питательной средой. Каплю материала наносят на первую чашку и распределяют шпателем по всей чашке. Затем этим же шпателем распределяют оставшуюся на нем культуру на второй чашке и таким же образом - на третьей. Наибольшее количество колоний вырастет на первой чашке, наименьшее - на третьей. В зависимости от того, сколько было микробных клеток в исследуемом материале, на одной из чашек вырастут изолированные колонии.
Б.Такого же результата можно достигнуть, произведя рассев на одной чашке. Для этого делят чашку на четыре сектора - метод посева по секторам. Исследуемый материал засевают бактериологической петлей штрихами на первом секторе, делая посевную площадку, затем, прокалив и остудив петлю, распределяют посев из первого сектора во 27 второй и таким же образом последовательно в третий и четвертый сектор. Из отдельных микробных клеток после суточного инкубирования в термостате образуются изолированные колонии.
Посев по секторам с посевной площадкой. Посев по секторам можно произвести и без посевной площадки. Начав с первого сектора без прокаливания петли произвести посев последовательно во втором, третьем и четвёртом секторах
В. Можно использовать и другие техники посева. Например, посев бактериологической петлёй штрихами или зигзагообразно по всей поверхности чашки Петри. Для этого исследуемый материал набирают стерильной петлей и втирают в поверхность среды возле края чашки.
После этого петлю стерилизуют в пламени, чтобы уничтожить избыток материала, охлаждают. Следующий этап посева начинают с места, где закончился предыдущий. Петлю кладут горизонтально на поверхность агара, где было сделана посевная площадка, проводят один-два раза по поверхности и делают штрихи по остальной среде. Необходимо пытаться, чтобы штрихи посева длились от края к краю чашки, не повреждали поверхности агара и располагались близко друг к другу. Этим искусственно продлевается линия посева и создаются возможности для получения изолированных колоний
Посев шпателем и тампоном в чашки Петри. Материал предварительно наносят на поверхность питательной среды возле края чашки петлей или пипеткой. Стерильный шпатель проносят через пламя, охлаждают, касаясь стенки чашки. Осторожными круговыми движениями распределяют материал равномерно по поверхности среды.
2-й день (II этап). Начинают данный этап с изучения культуральных свойств полученных колоний. На основании изучения этих характеристик, выросшие колонии разделяются на группы. Затем из исследуемой группы отбирают изолированную колонию, готовят мазок для микроскопического исследования с целью изучения морфологических и тинкториальных свойств и проверки однородности микробов в колонии (приготовление мазка, окраска по Граму). Из этой же колонии производят посев в пробирку со скошенным питательным агаром с целью накопления чистой культуры. Пробирку инкубируют в термостате 24 часа при температуре 37° С.
Т ехника посева в пробирки со скошенной средой : На скошенные среды переносят культуру из другой пробирки или с колоний на чашках. Прокалённой петлёй берут часть необходимой колонии с чашки Петри, чашку закрывают и отставляют. Пробирку держат в левой руке наклонном положении между большим и указательным пальцами так, чтобы поверхность среды можно было наблюдать. Петля - в правой руке. Пробку пробирки вынимают, зажимая их между мизинцем и ладонью. В таком положении она остаётся до конца посева. Край пробирки обжигают, переносят петлю, не прикасаясь к стенкам, в 29 пробирку и делают сплошной штриховой посев. Петлю прокаливают, ставят в штатив, край пробирки прокаливают и закрывают пробкой. Техника посева в конденсационную воду: выбирают свежескошенную среду, содержащую на дне каплю конденсационной жидкости. Исследуемую культуру забирают петлей, открывают пробку, обжигают края пробирки, осторожно, не касаясь среды и стенок, вносят в конденсационную воду петлю с культурой. У выраженных подвижных культур рост с конденсационной воды распространяется на влажную поверхность косяка.
3-й день (III этап).
1.Описывают культуральные свойства накопленной чистой культуры.
2.Проверка чистоты культуры, выросшей на скошенном агаре путем микроскопии мазка ( мазок окрашивают по Граму, в мазке должны быть однородные по морфологическим признакам и тинкториальным свойствам клетки). При однородности исследуемых бактерий выделение чистой культуры можно считать законченным.
3. Идентификация выделенной культуры проводится по: - биохимическим свойствам. Среды Гисса дифференциально-диагностические питательные среды для выявления ферментативной активности бактерий. Содержат 1% пептонную воду, 0,5% раствор определенного углевода (глюкоза, лактоза, мальтоза, манит, сахароза и др.) и индикатор Андреде (кислый фуксин в растворе NaOH). Среда при рН 7,2-7,4 – бесцветна, при ферментации углеводов приобретает красный цвет. В пробирки со средой помещают поплавок (небольшая трубочка, один конец которой запаян) для улавливания газообразных продуктов, образующихся при расщеплении углеводов.
чувсвительности к антибиотикам.
- антигенным свойствам - фагочувствительности - токсигенности и другим признакам. Фаготипирование по методу Фишера. Испытуемую культуру засевают на МПА, затем условно делят чашку на квадраты. В каждый квадрат наносят по одной капле различных фагов. После суточной инкубации в термостате отмечают квадраты, в которых отмечается лизис бактерий. Фаготип бактериальной культуры определяется типом лизирующего ее фага
Фагоидентификация по методу Отто. На чашку с МПА шпателем или петлёй выполняется посев выделенной культуры бактерий. Затем наносят каплю известного бактериофага и, наклонив чашку, дают капле несколько растечься по поверхности питательной среды. Через сутки наблюдают полную задержку роста в месте внесения диагностического фага.
4. Посевы инкубируют в термостате 24 часа при температуре 37° С. 4-й день (IV этап). Учет результатов и выдача ответа


2.Методы выделения анаэробов
Анаэробы растут и размножаются в условиях, исключающих доступ кислорода воздуха. Молекулярный кислород оказывает на них токсическое действие. Необходимую для существования энергию анаэробы получают путем расщепления органических и неорганических соединений, входящих в состав питательной среды. Для выращивания анаэробов необходимо создать определенные условия, сущность которых заключается в удалении молекулярного кислорода из питательной среды и пространства, окружающего эти культуры. Другим обязательным условием, обеспечивающим выделение анаэробов из исследуемого материала, является внесение большого количества посевного материала в питательную среду. А также условием может быть и режим инкубации – посевы со многими анаэробными культурами выдерживают в термостате при 420С 2-3 суток. Удаление кислорода из питательной среды.
Единственным отличием питательных сред, применяемых для выращивания анаэробов, служит пониженное содержание в них свободного кислорода. Самым простым способом удаления растворенного кислорода является кипячение. Непосредственно перед посевом материала пробирки с питательными средами кипятят в водяной бане в течение 10—20 мин. При кипячении из среды вытесняется воздух и, следовательно, удаляется кислород. Свежепрокипяченную питательную среду быстро охлаждают, погружая в лед или подставляя под струю холодной воды, чтобы не дать ей насытиться кислородом воздуха, и используют для посева. Для уменьшения диффузии кислорода из воздуха питательные среды заливают сверху стерильным вазелиновым или парафиновым маслом (толщина слоя 1—1,5 см). Засев среды производят пипеткой сквозь масло в наклонном положении пробирки. Можно использовать вещества, связывающие кислород. В качестве редуцирующих веществ используют глюкозу, аскорбиновую кислоту, цистеин, глютатион. Активно связываются с кислородом животные ткани паренхиматозных органов. На этом свойстве животных клеток основано приготовление питательной среды Китта—Тароцци, широко применяемой для выращивания анаэробов. В жидкие питательные среды помещают иногда пористые вещества: вату, пемзу, которые адсорбируют на своей поверхности пузырьки воздуха.
Удаление кислорода из окружающего пространства. Для создания бескислородных условий используют физические, химические и биологические факторы.
Физические способы культивирования анаэробов.
1 .Способ Виньяля - Вейона. Берут 4-5 пробирок с 0,5% расплавленным и охлажденным до температуры 40-45 °С сахарным агаром. В содержимое одной из них вносят пипеткой небольшое количество исследуемого материала (1 мл.) и тщательно размешивают. Для уменьшения концентрации материала с целью получения изолированных колоний засеянную среду в количестве, соответствующем объему внесенного материала, переносят из 1-й пробирки во 2-ю, из 2-й в 3-ю. Затем содержимым каждой пробирки заполняют капилляры трех пастеровских пипеток. Чтобы предупредить застывание питательной среды в момент насасывания ее в пипетки, кончик их, пока он не обломан, погружают на 3-5 минут в стерильную воду температуры 45-50°С. После заполнения вытянутый конец трубки запаивают на спиртовке, а широкий заливают парафином и помещают в стеклянный цилиндр с ватой на дне. Через 2-3 суток в столбике агара вырастают ясно видимые колонии микробов-анаэробов. Выросшие колонии легко изолировать. Для этого капилляр надрезают напильником выше уровня намеченной колонии, надламывают, а колонию микроба, находящуюся в агаре, извлекают петлей и пересевают в свежую питательную среду.

2 . Метод Перетца —
3. Выращивание анаэробов в условиях вакуума . Вакуумные условия для выращивания анаэробов создают в анаэростате или эксикаторе. Исследуемый материал или культуру микробов засевают в пробирки с жидкой средой или в чашки Петри с плотной питательной средой. Посевы помещают в анаэростат, который представляет собой толстостенный металлический (пластиковый, стеклянный) цилиндр с герметически привинчивающейся крышкой, на которой имеются вакуумметр и два крана, затем присоединяют его к насосу и выкачивают воздух. Степень разреженности воздуха определяют по показаниям вакуумметра. Колонии анаэробов в вакуумных условиях растут на поверхности плотной питательной среды. Можно создать бескислородные условия при помощи эксикатора, если эксикатор с краном, то по тому же принципу откачивается воздух, как и в анаэростате. Если эксикатор без крана, то в этом случае чашки с посевами кладут внутрь, ставят свечу и её зажигают, затем плотно притирают крышку. Пламя свечи выжгет весь кислород в эксикаторе и погаснет, таким образом, внутри эксикатора создадутся бескислородные условия.

Химические способы культивирования анаэробов.
Способ Аристовского. Материал, исследуемый на наличие анаэробов, засевают на среду в чашки Петри и помещают их в эксикатор, на дно которого кладут химический поглотитель кислорода: гидросульфит натрия или пирогаллол. В расширенную часть сосуда устанавливают на подставке чашки с посевами. Прибор помещают в термостат при температуре 37 °С на 24 - 48 ч.
Биологический метод выращивания анаэробов.
Способ Фортнера. В чашку Петри наливают толстым слоем сахарный агар. Посередине чашки в питательной среде вырезают стерильным скальпелем канавку шириной 1—1,5 см, которая делит питательную среду на две половины. Одну из них засевают культурой анаэробов или исследуемым на их наличие материалом, другую половину - культурой аэробов: чудесной палочкой (Serratia marcescens) или кишечной палочкой (Е. coli). Перед посевом чашки подсушивают в термостате, чтобы аэробы вместе с капельками влаги - не могли попасть на другую сторону чашки. Чашка закрывается, ее края запаиваются парафином (с целью не допустить попадания воздуха внутрь чашки). . В термостате чашки устанавливают вверх дном. Сначала вырастают в присутствии кислорода аэробы, создают тем самым благоприятные условия для роста анаэробов.
Питательные среды для выращивания анаэробов .
1. Среда Китта-Тароцци. обеспечивает рост многих спорообразующих и строгих аспорогенных анаэробов. Состоит из питательного бульона, 2% глюкозы и кусочков печени или мясного фарша для адсорбции кислорода. Перед посевом среду прогревают на кипящей водяной бане в течение 10-15 минут для удаления воздуха. После посева среду заливают небольшим слоем вазелинового масла. Выросшие анаэробы вызывают помутнение питательной среды.
2. Среда Вильсона-Блер а (железо-сульфитный агар) используется для выделения анаэробных бактерий. Готовится из питательного агара, к которому добавляют 1% глюкозу, хлорид железа и сульфит натрия. Анаэробы образуют на среде колонии черного цвета за счет образования соединений железа с серой. Посев можно делать на поверхность среды, налитой в чашку Петри, а также в расплавленную среду в пробирке (рост в виде черных прожилок).

3.Среда Цейсслера - сахарный агар с кровью для выращивания и дифференциации анаэробов. Готовится следующим образом: к обычному мясопептонному агару добавляют 1- 2% глюкозу (рН среды =7,2—7,4) и стерилизуют в автоклаве при температуре 112° 20 минут. К 100 мл расплавленного, охлажденного до 45° агара добавляют 10 - 15 мл стерильно взятой дефебрилированной человеческой, лошадиной или бараньей крови, тщательно перемешивают и разливают в чашки Петри. Перед использованием чашки следует выдерживать сутки при комнатной температуре. В основу определения вида анаэробов положена форма роста их на среде Цейсслера в анаэробных условиях.
4. Молоко по Тукаеву . К 1% пептонной воде прибавляют 5-6% обезжиренного молока, среду стерилизуют дробно при 1000C 3 дня подряд по 30 мин. Анаэробы дают рост в виде белого сгустка и просветления над ним среды. 5. 1% сахарный агар. Мясо-пептонный агар с добавлением 1% раствора глюкозы, стерилизуют в автоклаве при температуре 112° 20 минут, разливают в пробирки и в чашки Петри. Посев делают чаще в расплавленную среду, где анаэробы в толще среды дают колонии разнообразной формы .
Цель занятия. Освоить технику посева микроорганизмов на плотные и жидкие питательные среды и методы выделения чистых бактериальных культур. Ознакомить студентов с основными культуральными характеристиками микроорганизмов и методами определения количества бактерий.
Оборудование и материалы. Бульонные и агаровые культуры В. cereus, Е. coli и S. aureus в пробирках и в чашках Петри, смешанная бульонная культура Е. соli и S. aureus, стерильные МПА и МПБ в пробирках, чашках Петри, солевой МПА (8 % хлорида натрия) в чашках Петри, стеклянные шпатели, стерильные пипетки Пастера, бактериологические петли.
Культура микроорганизмов — это популяция (расплодка) клеток на питательной среде. Посев и пересев культур микроорганизмов на питательные среды — наиболее частый методический прием, который используют для первичного выделения микроорганизма из какого-либо объекта, а также для поддержания культур в жизнеспособном состоянии в лабораторных условиях.
Чистая культура — это популяция бактерий одного вида или биологического варианта (биовара), выращенная на питательной среде.
Штаммы — чистые культуры микроорганизмов одного вида, выделенные из разных объектов или из одного и того же объекта, но в разное время.
Колония — макроскопически видимое скопление клеток микроорганизма на поверхности или внутри плотной питательной среды, образовавшихся в результате размножения одной жизнеспособной клетки. По этой причине колонию обычно рассматривают как чистую культуру микроорганизма.
Посев на жидкую питательную среду. Пробирку с исследуемым материалом и пробирку с питательной средой держат в левой руке, в правую руку берут бактериологическую петлю или пипетку и'пробки от пробирок (рис. 37). Над пламенем горелки обжигают края пробирок, бактериологическую петлю (пипетку) вводят в пробирку с материалом, переносят материал в пробирку со стерильной питательной средой и стряхивают с петли в среду, не смачивая при этом петледержатель. Края пробирок вновь проводят над пламенем горелки, закрывают пробирки пробками, стерилизуют петлю и ставят ее в штатив. Использованную пипетку опускают концом вниз в банку с дезинфицирующим раствором.
Посев на плотную питательную среду. Выполняют разными способами.


При посеве на чашку Петри: чашку берут в левую руку, большим пальцем левой руки слегка приподнимают крышку, обжигают на пламени горелки края чашки в зоне щели, вносят посевной материал на поверхность питательной среды, затем растирают его при помощи стеклянного шпателя или бактериологической петли (рис. 40).
Посев на полужидкую питательную среду. Выполняют методом укола в столбик питательной среды.
Выделение чистых культур микроорганизмов. При бактериологическом исследовании искомый микроорганизм обнаруживают в материале, как правило, в смеси с бактериями других видов. Классическими методами бактериологии возможно идентифицировать микроорганизм только при условии, что он находится в виде чистой культуры.
Методы, основанные на механическом разобщении клеток. Эти методы наиболее часто применяют при выделении чистых культур микроорганизмов.
Метод Пастера (метод разведений): из исследуемого материала готовят ряд последовательных, чаще десятикратных разведений на стерильной жидкой питательной среде в пробирках или колбах (10 -1 …10 -10 ). Предполагают, что количество микробных клеток в каждом последующем разведении будет меньше, чем в предыдущем, и в какой-то из пробирок останется только одна микробная клетка, которая и даст/начало чистой культуре Микроорганизма. Однако для успешного применения этого метода необходимо, чтобы искомый микроорганизм в материале количественно преобладал над сопутствующими видами.
Метод Коха (метод заливок): исследуемый материал в небольшом количестве вносят в пробирку с расплавленным и охлажденным до 45. 50 "С МПА, перемешивают, затем каплю питательной среды переносят во вторую пробирку с расплавленным МПА и т. д. Количество разведений зависит от предполагаемой численности микроорганизмов в исследуемом материале. Затем содержимое каждой пробирки выливают в стерильные чашки Петри, после затвердения среды посевы помещают в термостат. Фиксированные в плотной среде микробные клетки при размножении формируют колонии, из которых можно отвить (пересеять) чистую культуру микроорганизма.
Метод Дригальского: берут три—пять чашек Петри с плотной питательной средой. В одну из чашек вносят посевной материал и распределяют его шпателем по поверхности питательной среды. Не обжигая шпатель, оставшийся на нем материал последовательно растирают на поверхности среды во второй, третьей и остальных чашках. В последних чашках Петри после инкубирования в термостате обычно наблюдают формирование изолированных колоний бактерий.

Более экономичен следующий способ получения изолированных колоний. Бактериологической петлей с посевным материалом несколько раз делают параллельные штрихи в одном секторе чашки Петри с питательным агаром (рис. 41). Пет- о лю прожигают в пламени горелки, дают остыть и часть материала из первого сектора <А) аналогичным образом распределяют во втором секторе (В), затем в третьем (С) и четвертом (Д) секторах. Даже при рассеве бактериальной массы из колоний в секторе Д при таком способе получают рост изолированных колоний.
Методы, основанные на биологических особенностях микроорганизмов.Направлены на подавление роста сопутствующей микрофлоры.
Прогревание: при выделении чистой культуры споро-образующего вида бактерий исследуемый материал прогревают при 80 °С 20 мин или кратковременно кипятят. Вегетативные клетки сопутствующей микрофлоры в этих условиях погибают, а споры искомого микроорганизма сохраняют жизнеспособность и прорастают после посева на питательные среды.
Использование селективных питательных сред, которые содержат вещества, подавляющие рост сопутствующей микрофлоры (антибиотики, красители и т. д.), — частый прием при исследовании контаминированного материала. Однако необходимо учитывать, что селективные факторы часто находятся не в бактерицидных, а в бактериостатических концентрациях, поэтому клетки сопутствующих микроорганизмов не растут, но остаются жизнеспособными на поверхности питательной среды и при отвивке колоний исследуемой культуры на обычные среды могут быть причиной получения смешанной культуры.
При выделении чистых культур некоторых видов бактерий используют их другие биологические особенности. Например, способность микроорганизма расти при низких (листерии) или высоких (термофильные бактерии) температурах, которые лежат за пределами температурных диапазонов сопутствующих видов бактерий. Для выделения культуры P. vulgaris используют способность данного вида давать ползучий рост (роение) на поверхности плотной питательной среды. С этой целью материал, содержащий P. vulgaris, засевают в конденсационную воду на дне пробирки со скошенным МПА, не касаясь поверхности среды. Сопутствующая микрофлора растет в нижней части питательной среды, а протей в виде прозрачной пленки распространяется вверХ.
Для выделения С. tetani материал засевают точечно на плотную питательную среду в чашках Петри и после выращивания отвивают культуру с периферии ползучего роста.
Культуральные свойства микроорганизмов. В процессе идентификации наряду с другими свойствами у микроорганизмов изучают культуральные признаки — особенности роста на плотных, жидких и полужидких питательных средах при определенных условиях.
На плотных средах изучают колонии микроорганизмов. Бактерии каждого вида формируют колонии с определенными признаками, которые обычно учитывают при идентификации. Размер колоний: крупные — диаметром 4. 6 мм и более, средние—2. 4 мм, мелкие — 1. 2мм и точечные колонии диаметром менее 1 мм. Форма колоний может быть правильной круглой, неправильной (амебовидной, розеткообразной), корневидной (рис. 42). Цвет зависит от способности микроорганизма образовывать пигмент: белый, желтый, красный, сине-зеленый и т. д. Бактерии, не синтезирующие пигмент, формируют бесцветные колонии. Учитывают характер поверхности, которая может быть шероховатой, блестящей, матовой, сухой, влажной, гладкой, радиально или концентрически исчерченной. Края колонии могут быть ровными, волнистыми, зазубренными, бахромчатыми, их исследуют невооруженным глазом и под малым увеличением микроскопа (рис. 43). Рельеф (профиль) определяют, рассматривая колонию сбоку; различают плоские, конусообразные, куполообразные, плоские с конусовидным центром или углублением в центре колонии, с утолщенными (валикообразными) краями (рис. 44). Учитывают прозрачность колонии: непрозрачная, полупрозрачная, прозрачная. Структура может быть однородной, зернистой, волокнистой и т.д. (рис. 45). Ее выявляют при слабом увеличении микроскопа. Консистенция может быть пастообразной, слизистой, плотной (сухой) и т.д.; ее определяют, дотрагиваясь до колонии бактериологической петлей. Колонии некоторых видов врастают в толщу питательной среды, что также определяют при помощи бактериологической петли. Запах: многие виды бактерий в процессе роста на питательных средах выделяют специфические ароматические вещества.


Ценную дополнительную информацию об особенностях строения колоний дает их изучение в косопадающем пучке света (рис. 46). Культуры на прозрачной агаровой среде в чашках Петри помещают на предметный столик бинокулярной лупы. Между бинокулярной лупой и источником света помещают зеркало от микроскопа вогнутой стороной вверх таким образом, чтобы лучи, отраженные от него, попадали в плоскость изучаемого объекта под углом 40. 45°. Зеркало устанавливают на равном уда
лении от объекта и источника света (12. 14 см). При таком освещении колонии бактерий могут быть окрашены в различные цвета. Цвет зависит как от видовых особенностей, так и от состояния культуры (S-, R-формы, см. тему 12).
В жидких средах учитывают следующие признаки: степень помутнения среды (интенсивное, среднее, слабое), наличие или отсутствие пристеночного кольца на границе мениска и внутренней поверхности пробирки, характер поверхностной пленки (толщина, цвет, поверхность), характер осадка (обильный, скудный, компактный, хлопьевидный, слизистый). При характеристике осадка пробирку слегка встряхивают и учитывают результат: осадок разбивается в гомогенную равномерную суспензию; образуются мелкие или крупные хлопья, глыбки; слизистый осадок при встряхивании обычно поднимается в виде косички. Пигментообразующие микроорганизмы вызывают окрашивание питательной среды и осадка (желтое, зеленоватое, красное и т. д.).
Определение количества бактерий. При характеристике развития микробной популяции, санитарной оценке кормов, продуктов питания, при вычислении показателя вирулентности микроорганизма необходимо устанавливать количество микробных клеток в единице объема того или иного материала.
Определение общего количества микроорганизмов. Можно применять метод прямого счета и метод измерения светорассеяния.
Метод прямого счета: бактерии подсчитывают в камерах Горяева, Тома или в окрашенных мазках. В последнем случае 0,01 мл бактериальной суспензии микропипеткой наносят на предметное стекло и равномерно распределяют на 1 см2. Мазок фиксируют, окрашивают и подсчитывают клетки в 10. 15 полях зрения по диагонали квадрата. Определяют среднее число клеток в одном поле зрения. Делят 1 см 2 на площадь поля зрения, которую измеряют методом микрометрии (см. тему 1), затем частное умножают на среднее число микробных клеток в поле зрения, получают их количество в 0,01 мл взвеси бактерий.
Метод измерения светорассеяния считают более точным. Количество света, рассеиваемого суспензией бактерий, пропорционально их концентрации. Этот показатель достаточно точно можно измерить при помощи фотоэлектроколориметра. Зависимость между оптической плотностью и концентрацией клеток различна для бактерий разных видов. Поэтому при работе с таким прибором для каждого вида бактерий необходимо строить свою калибровочную кривую зависимости.
Например, в пробирку поместили 0,1 мл суспензии бактерий, содержащей неизвестное количество клеток. Для уравнивания оптической плотности исследуемой суспензии со стандартом мутности 10 ед. в пробирку добавили 0,9 мл физиологического раствора, т. е. исходную суспензию развели в 10 раз. Известно, что суспензия данного вида бактерий при оптической плотности 10 ед. содержит 1,3*10 9 кл/мл. Следовательно, концентрация исследуемой суспензии составляет 1,3*10 10 кл/мл.
Определение количества живых микроорганизмов. Метод основан на выводе, что бактериальная колония — это результат деления единичной клетки на плотной питательной среде (исключение составляют бактерии, образующие цепочки из клеток).
Мерной пипеткой объемом 1 мл добавляют 1 мл культуры Е. coli в бактериологическую пробирку с 9 мл стерильного физиологического раствора, подогретого до 37. 38 °С (разведение 10-1). Далее аналогичным способом готовят разведения культуры от 10 -2 до 10 -8 . Для каждого разведения используют новую пипетку того же объема и класса. Из пяти последних пробирок суспензию бактерий по 0,1 мл наносят на поверхность подсушенного МПА в две чашки Петри. Внесенный материал стерильным шпателем распределяют по поверхности питательной среды. Посевы инкубируют при 37. 38 ºС 24 ч.
Учет результатов: в чашках Петри, где выросло более 150. 300 и менее 10 колоний, результаты не учитывают. Выбирают чашки Петри с параллельными посевами (из одного разведения), содержащими 10. 150 колоний. Подсчитывают колонии на чашках из одного разведения, суммируют, определяют среднее число колоний и с учетом степени разведения рассчитывают содержание жизнеспособных клеток (колониеобразующих единиц) в 1 мл исходной суспензии бактерий.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Провести пересев бульонной и агаровой культур бактерий на скошенный МПА и в МПБ в пробирках.
2. Провести посев смешанной бульонной культуры на МПА в чашках Петри по методу Дригальского.
3. Описать характер роста Е. coli, S. aureus, В. cereus на МПА (колонии) и в МПБ.
4. Определить количество микробных клеток в 1 мл бульонной культуры Е. coli методом прямого счета и при помощи стандарта мутности.
5. Провести посев бульонной культуры Е. coli на МПА в чашках Петри с целью определения количества жизнеспособных клеток.
Контрольные вопросы
1.Что такое культура, смешанная культура, чистая культура, штамм и колония бактерий?
2.Какие методы применяют для получения чистых культур микроорганизмов?
3.Какие культуральные признаки учитывают при идентификации бактерий?
4.Какими методами определяют общее число микроорганизмов и количество жизнеспособных клеток?
Читайте также:

