Способы посева микроорганизмов принципы культивирования бактерий
Добавил пользователь Skiper Обновлено: 19.09.2024
1.Физический- откачивание воздуха, введение специальной газовой безкислородной смеси (чаще- N2- 85%, CO2- 10%, H2- 5%).
2.Химический- применяют химические поглотители кислорода.
3.Биологический- совместное культивирование строгих аэробов и анаэробов (аэробы поглощают кислород и создают условия для размножения анаэробов).
4.Смешанный- используют несколько разных подходов.
Необходимо отметить, что создание оптимальных условий для строгих анаэробов- очень сложная задача. Очень непросто обеспечить постоянное поддержание безкислородных условий культивирования, необходимы специальные среды без содержания растворенного кислорода, поддержание необходимого окислительно- восстановительного потенциала питательных сред, взятие и доставка, посев материала в анаэробных условиях.
Существует ряд приемов, обеспечивающих более подходящие условия для анаэробов- предварительное кипячение питательных сред, посев в глубокий столбик агара, заливка сред вазелиновым маслом для сокращения доступа кислорода, использование герметически закрывающихся флаконов и пробирок, шприцев и лабораторной посуды с инертным газом, использование плотно закрывающихся эксикаторов с горящей свечой. Используются специальные приборы для создания анаэробных условий- анаэростаты. Однако в настоящее время наиболее простым и эффективным оборудованием для создания анаэробных и микроаэрофильных условий является система “Газпак” со специальными газорегенерирующими пакетами, действующими по принципу вытеснения атмосферного воздуха газовыми смесями в герметически закрытых емкостях.
Основные принципы культивирования микроорганизмов на питательных средах.
1.Использование всех необходимых для соответствующих микробов питательных компонентов.
2.Оптимальные температура, рН, rH2, концентрация ионов, степень насыщения кислородом, газовый состав и давление.
Микроорганизмы культивируют на питательных средах при оптимальной температуре в термостатах, обеспечивающих условия инкубации.
По температурному оптимуму роста выделяют три основные группы микроорганизмов.
1.Психрофилы- растут при температурах ниже +20 градусов Цельсия.
2.Мезофилы- растут в диапозоне температур от 20 до 45 градусов (часто оптимум- при 37 градусах С).
3.Термофилы- растут при температурах выше плюс 45 градусов.
Краткая характеристика питательных сред.
По консистенции выделяют жидкие, плотные (1,5- 3% агара) и полужидкие (0,3- 0,7 % агара) среды.
Агар- полисахарид сложного состава из морских водорослей, основной отвердитель для плотных (твердых) сред. В качестве универсального источника углерода и азота применяют пептоны- продукты ферментации белков пепсином, различные гидролизаты- мясной, рыбный, казеиновый, дрожжевой и др.
По назначению среды разделяют на ряд групп:
- универсальные (простые), пригодные для различных нетребовательных микроорганизмов (мясо- пептонный бульон- МПБ, мясо- пептонный агар- МПА);
- специальные- среды для микроорганизмов, не растущих на универсальных средах (среда Мак- Коя на туляремию, среда Левенштейна- Иенсена для возбудителя туберкулеза);
- дифференциально- диагностические- для дифференциации микроорганизмов по ферментативной активности и культуральным свойствам ( среды Эндо, Плоскирева, Левина, Гисса);
- селективные (элективные)- для выделения определенных видов микроорганизмов и подавления роста сопутствующих- пептонная вода, селенитовая среда, среда Мюллера.
По происхождению среды делят на естественные, полусинтетические и синтетические.
Под понятием культивирование бактерий, которое использует микробиология, подразумевается процесс выделения отдельных типов, видов либо клонов микроорганизмов. Благодаря естественным и искусственным субстратам можно получать комбинации из различных микроорганизмов.

Когда возникает потребность в чистых культурах?
Под чистыми культурами подразумевается набор бактерий, которые относятся к одному виду и обладают сходными культуральными, химическими и морфологическими характеристиками.
Применяться такие культуры могут в следующих случаях:
- При необходимости изучить систематику и переменчивость отдельных бактерий.
- При необходимости диагностировать инфекционное заболевание.
- В промышленных целях – в виде сырья для создания антибиотиков, витаминных и ферментных препаратов, гормонов стероидного типа, вакцин и прочих продуктов.
- В пищевой промышленности – в виде сырья для производства пива, вина, создания хлебобулочной и молочной продукции.
Чтобы получить чистые культуры отдельных микроорганизмов, применяются следующие методы: капельная технология Линднера, метод Ганзена с использованием влажной камеры, метод выделения из единой колонии на желатиновой либо агарной среде и микроманипуляторный метод.

Какие среды могут использоваться для культивирования аэробов?
Аэробы представляют собой микроорганизмы, для размножения и жизнедеятельности которых требуется кислород в свободном виде.
Современная микробиология предполагает принципы выделения аэробов на сложных и простых, полужидких, жидких, а также твердых питательных средах.
Среди самых распространенных простых питательных сред – мясопептонный агар, молоко, пептонная вода, картофельные ломтики, мясопептонный бульон.
Сложные среды представлены в виде простых составов, разбавленных специальными добавками – животной сывороткой, кровью, асцитической жидкостью и т.п.
Среды, в зависимости от целей дальнейшего использования микроорганизмов, подразделяют на следующие виды:
- Элективные. К таким средам относятся те, на которых рост аэробных и анаэробных микроорганизмов происходит значительно интенсивнее.
- Среды накопления (обогащения) дают возможность накопить либо же изолировать определенную разновидность бактерий. К данной группе относятся такие питательные среды, как среды Мюллера, Кауфмана и Килиана, благодаря которым удается изолировать распространение дифтерийных, паратифозных, тифозных и кишечных микроорганизмов.
- Дифференциально-диагностические среды. Их применяют при необходимости дифференцирования разновидности исследуемого микроорганизма, а также определения его качественных характеристик.
- Консервирующие среды, состоящие из веществ (к примеру, глицерина), благодаря которым имеется возможность в процессе транспортировки сохранять в живом виде патогенные микроорганизмы.

Какими методами выполняют культивирование?
В микробиологии выведение бактерий аэробного типа может происходить в следующих условиях:
- Условия, для которых берутся плотные питательные среды либо прослойка жидкой среды, в которой получение кислорода происходит из окружающего воздуха.
- Условия, при которых размножение происходит в питательных жидких средах (глубинный метод культивирования). Получение кислорода микроорганизмами в данном случае происходит из растворенных растворенных в жидкости молекул. Чтобы при низком содержании кислорода бактерии аэробного типа росли более интенсивно, жидкость потребуется аэрировать.
Используя такие методы, можно получить чистые аэробные культуры, используемые для разнообразных целей не только в медицине, но и промышленной и пищевой индустрии.
Культивирование микроорганизмов-анаэробов: основные особенности
Анаэробы представляют собой микроорганизмы, развитие и деление которых происходит в среде, не содержащей кислород в свободном виде. Обнаруживаются они практически во всех человеческих тканях, пробы берутся из воспалительно-гнойных очагов.

Принципы выращивания анаэробных микроорганизмов представляют собой более длительную и хлопотную процедуру, чем культивирование аэробных форм. Связано это с тем, что контакт культур с кислородом нужно свести к минимуму. Чтобы анаэробные условия были правильными, применяются разные методы, которые условно разделяются на биологические, химические и физические. Несмотря на свои особенности, все они имеют один сходный принцип – обеспечение замкнутого пространства.
Под физическими методами культивирования подразумевается выращивание микроорганизмов посредством микроанаэростата. В данном вакуумном агрегате вместо воздуха применяется газовая смесь.
К химическим методикам культивирования можно отнести:
- Методы, при которых используются химические вещества, способные поглощать кислородные молекулы. Для реализации в лабораторных условиях берутся хлорид меди одновалентной, раствор пирогаллола щелочной, дитионит натрия, а также другие реактивы.
- Метод, для которого используются восстанавливающие агенты, добавляемые с целью уменьшения окислительно-восстанавливающего эффекта среды. Происходить это может благодаря аскорбиновой кислоте, цистеину, тиогликолату натрия.
Что касается биологических способов размножения бактерий, то для их выполнения применяется, к примеру, чашка Петри, разделенная на две половины посредством желобка. В одной из половин помещаются анаэробные, а в другой – аэробные микроорганизмы, после чего края чаши заливаются парафином. Как только аэробы используют весь кислород, активируется рост анаэробных организмов.

Для культивирования молочнокислых бактерий могут применяться и другие способы:
- Посев в высокие слоя питательных сред.
- Размножение в плотных средах (с самой их толще).
- Метод размножения в вязких условиях, при которых процесс диффузии кислородных молекул в жидкость снижается при повышении ее плотности.
- Культивирование при помощи вазелинового масла либо стерильного парафина, заливаемого в питательную среду.
При наличии необходимых навыков, оборудования и реактивов, выделение анаэробных и других бактерий можно проводить и в домашних условиях.
Работаю врачом ветеринарной медицины. Увлекаюсь бальными танцами, спортом и йогой. В приоритет ставлю личностное развитие и освоение духовных практик. Любимые темы: ветеринария, биология, строительство, ремонт, путешествия. Табу: юриспруденция, политика, IT-технологии и компьютерные игры.
Посев бактерий. Посев бактерий на плотные питательные среды. Получение изолированных колоний бактерий. Температура культивирования бактерий.
При достаточном содержании патогенных бактерий в образце проводят посев на плотные питательные среды (для получения изолированных колоний). Если в исследуемом материале бактерий мало, то посев проводят на жидкие среды обогащения. На практике выделение относительно неприхотливых бактерий обычно проводят на простых средах (например, на КА, агаре Плоскирева, тиогликолевом бульоне, агаре Сабуро и т.д.).
Для выделения прихотливых видов бактерий в среды вносят питательные вещества (кровь, сыворотку, дрожжевой экстракт и др.), а также поглотители токсических метаболитов, образующихся при росте бактерий (например, древесный уголь). Для посевов применяют микробиологические петли, реже иглы и шпатели.
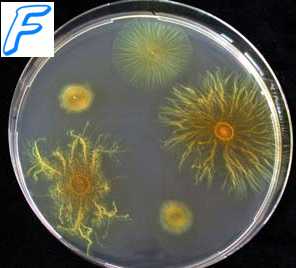
Получение изолированных колоний бактерий
Исключение составляет техника посева при бактериологическом исследовании мочи (техника штрихового засева показана на рис. 11-13). Указанные методы пригодны для посева аэробных и факультативно анаэробных бактерий, а также нестрогих анаэробов.
Температура культивирования бактерий
Патогенные бактерии вариабельны в отношении температур, оптимальных для их роста, но большинство из них неплохо развивается при 35-37 °С. Исключение составляют некоторые атипичные микобактерии, возбудитель чумы, листерии и лептоспиры (температурный оптимум 20-30 °С), а также Campylobacter jejuni (температурный оптимум 42 °С).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
↑Требования микроорганизмов к питательным веществам
Культивирование микроорганизмов – это один из основных приемов в микробиологии. Для роста и развития микроорганизмов в природе и в лабораторных условиях необходимо наличие питательных веществ для энергетических и конструктивных реакций. Требования разных групп микроорганизмов к источникам энергии и химическим элементам определяются их метаболическими возможностями. Выращивание и поддержание микробных культур в лаборатории основано на моделировании естественных условий обитания данного организма в лаборатории, а также на знании особенностей обмена веществ.
Основными биогенными элементами являются углерод, азот, фосфор, кислород, водород, сера. Это компоненты белков, углеводов и жиров, а также нуклеиновых кислот. Эти элементы требуются в значительных количествах (г/л) и поэтому их называют макроэлементами. К макроэлементам также относятся ионы калия, магния, натрия, кальция и железа. Они выполняют в клетке разнообразные функции. Например, К + необходим для активности большого числа ферментов и в частности ферментов белкового синтеза. Са 2+ определяет устойчивость бактериальных эндоспор к нагреванию. Mg 2+ стабилизирует рибосомы, многие ферменты и клеточные мембраны. Fe 2+ и Fe 3+ являются частью цитохромов и кофакторами электронпереносящих белков.
Микроэлементы, необходимые в микромолярных количествах, - это ионы таких металлов, как хром, кобальт, медь, молибден, марганец, никель, селен, вольфрам, ванадий, цинк, обычно входящие в состав ферментов и кофакторов. Например, Со 2+ является компонентом витамина В12, Cu 2+ входит в состав цитохромоксидазы и купредоксинов, Mn 2+ активирует ферменты, катализирующие перенос фосфатных групп, Мо 2+ входит в состав нитрогеназы и нитратредуктазы, Ni 2+ является компонентом уреазы, гидрогеназы, кофактора F430, Zn 2+ входит в состав карбоангидразы, ДНК- и РНК-полимераз и т.д. Необходимые для микроорганизмов количества микроэлементов содержатся в обычной водопроводной воде. При работе на дистиллированной воде микроэлементы добавляют специально в виде растворов их минеральных солей. Некоторые группы микроорганизмов проявляют специфические потребности. Так, диатомовые водоросли, включающие в свои клеточные стенки значительные количества соединений кремния, требуют добавления их в среду в высокой концентрации.
Биогенные элементы должны присутствовать в питательной среде в доступной для микроорганизмов форме. Как правило, ионы металлов, сера, фосфор и микроэлементы добавляют в среду в виде минеральных солей. Минеральная основа среды (минеральный фон) практически одинакова для большинства микроорганизмов.
Источники углерода и азота в среде могут быть как неорганическими соединениями (СО2, N2, карбонаты, нитриты, нитраты, аммонийные соли), так и органическими веществами разной степени сложности и окисленности (сахара, спирты, органические кислоты и аминокислоты, олигосахариды, пептиды и т.д.). Если микроорганизму требуется набор источников углерода или азота, и тогда применяют различные экстракты и гидролизаты смеси белков и полисахаридов неопределенного состава (сусло, гидролизат молочного белка, пептон и др.).
У некоторых микроорганизмов спектр потребляемых органических веществ очень широк (например, у Pseudomonas, Actinomyces), у других – достаточно узок (например, у облигатных метилотрофов). В то же время, можно найти микроорганизмы, способные использовать сложные неприродные соединения типа пластиков, красителей, пестицидов. У некоторых микроорганизмов потребности в питании так сложны, что они растут только внутри живого организма (например, внутриклеточные паразиты риккетсии и хламидии).
Как правило, лабораторные среды содержат питательные вещества в более высоких концентрациях, чем это присуще природным местообитаниям. Для разных микроорганизмов границы значений физико-химических факторов, в которых может происходить рост, существенно отличаются. Поэтому важным условием успешного культивирования является поддержание оптимальных значений таких параметров, как рН, температура, освещенность, аэрация и т.д.
↑Типы сред и способы культивирования микроорганизмов
Разнообразные питательные среды, используемые в микробиологической практике для культивирования микроорганизмов, подразделяются по составу, физическому состоянию и назначению.
По составу среды делятся на натуральные и синтетические. Синтетические среды применяют для изучения обмена веществ у микроорганизмов. Они имеют определенный химический состав с точным указанием концентрации каждого соединения. Натуральные среды применяют для накопления биомассы микроорганизмов и широко используют для первичного выделения из естественных субстратов, поскольку их состав позволяет удовлетворить питательные потребности многих групп микроорганизмов. В них содержатся богатые различными органическими веществами продукты животного или растительного происхождения, имеющие сложный и непостоянный состав. Часто натуральные среды готовят на основе мясо-пептонного бульона (МПБ) и солодового сусла. МПБ – это прокипяченный экстракт мясного фарша с добавлением пептона и поваренной соли. Он богат азотсодержащими органическими соединениями, но обеднен углеводами. Солодовое сусло, напротив, содержит преимущественно углеводы. Его получают путем настаивания размолотого солода в водопроводной воде при постепенном нагревании. Солодом называют пророщенные и высушенные зерна ячменя. В процессе приготовления сусла происходит гидролиз крахмала ячменя и экстракция сахаров в воду. В зависимости от партии зерна концентрация сахаров в сусле может быть разной. Ее выражают в градусах Баллинга ( о Б), что примерно соответствуют процентному содержанию сахаров в растворе. Сусло с разной концентрацией сахаров применяют для выращивания разных групп микроорганизмов.
Жидкие среды представляют собой растворы или суспензии ингредиентов в воде. В качестве сыпучих сред применяют наборы длительно хранящихся сухих компонентов, которые перед работой растворяют или смачивают водой. Это могут быть зерно, отруби, твердые отходы сельского хозяйства и пищевой промышленности. В настоящее время получили широкое распространение порошкообразные синтетические и натуральные среды. Для получения твердых сред в жидкую основу добавляют уплотняющие агенты. Наиболее известными отвердителями являются желатин, агар и силикагель. Желатин – это белок из соединительной ткани животных, образующий гель при 25 о С. Неудобство его применения заключается в том, что температура роста многих микроорганизмов выше, чем температура плавления желатина. Наличие протеолитических ферментов у многих микроорганизмов приводит к расщеплению и разжижению желатина. Более удобен как уплотнитель сложный полисахарид агар, получаемый из морских бурых водорослей, так как большинство микроорганизмов не использует его для питания. Агар может многократно плавиться при 100 о С и застывать при 45 о С. Добавлением 2% агара в жидкую основу получают широко применяемые мясо-пептонный агар (МПА), сусло-агар (СА) и бульон-сусло-агар (БСА). В качестве твердой основы для синтетических сред часто используют неорганическое соединение кремния силикагель.
По назначению среды подразделяются на универсальные, элективные и индикаторные. Универсальные среды используют для накопления микробных клеток и первоначального выявления видового разнообразия микроорганизмов в смешанных популяциях. Они позволяют поддерживать рост значительного числа микроорганизмов. В то же время следует помнить, что не существует одной среды, универсальной для всех микробных культур. Элективные среды используют для получения накопительных культур как первого этапа при выделении чистой культуры из природных местообитаний. Создание условий, благоприятных для определенной группы микроорганизмов (элективных условий), приводит к преобладанию в смешанной популяции желаемых микроорганизмов. Рост и размножение других микроорганизмов в этих условиях не значительны. Для быстрого выявления определенных групп микроорганизмов или особенностей их метаболизма применяют индикаторные среды, содержащие вещество-индикатор, реагирующий изменением цвета на проявление какого-либо свойства организма. Индикаторные среды наиболее часто используют в санитарной и медицинской микробиологии.
↑Способы культивирования микроорганизмов
Особенности роста микроорганизма (культуральные свойства) иногда служат одним из критериев при определении его систематического положения. Микробные клетки в зависимости от условий могут расти в виде суспензии, микроколоний или обрастаний в жидких средах и образовывать колонии, штрихи или газон на твердых средах. Глубинные колонии формируются в толще агаризованных сред в виде чечевичек, тонких пленок или пучков ваты. Из-за выделения газов микроорганизмами при глубинном росте могут наблюдаться разрывы агаризованной среды. Поверхностные колонии отличаются большим разнообразием формы, размера, цвета, профиля. Колония может быть прозрачной, плотной, мягкой, хрупкой, врастать в агар, сниматься целиком в виде пленки, тянуться за петлей и т.д. Ее поверхность может быть блестящей или матовой, гладкой или шероховатой, иметь различные выпуклости, исчерченность и т.д. Различия в форме края и структуре колоний можно увидеть при малом увеличении микроскопа. Морфология колоний может значительно изменяться в зависимости от состава среды, возраста культуры и температуры культивирования. При посеве штрихом (прямой линией по агару) рост бывает обильный или скудный, сплошной или в виде цепочек очень мелких колоний, перистый, древовидный с различной формой края. При развитии культуры в жидких средах развитие микроорганизма может приводить к окрашиванию среды и появлению запаха, образованию пены и пузырьков, появлению помутнения, пленки на поверхности среды или осадка на дне сосуда.
Непрерывное (проточное) культивирование позволяет зафиксировать культуру в какой-то определенной фазе (обычно экспоненциальной). При этом состав среды и условия роста остаются постоянными. Этого добиваются постоянным прибавлением новой питательной среды в сосуд для выращивания и одновременным удалением такого же количества среды с клетками. Простейшая схема организации протока представлена на рис. 45. Подача свежей среды и удаление части суспензии (проток) происходит с той же скоростью, с какой растет культура. В этом случае устанавливается динамическое равновесие.
Некоторые микроорганизмы способны к пребыванию в особом физиологическом состоянии, при котором живые клетки не дают колоний на пригодных для них лабораторных средах, но под микроскопом наблюдаются как живые. Такое некультивируемое состояние (некультивируемая форма) присуще ряду микроорганизмов в природных местообитаниях, например, возбудителям сальмонеллеза и холеры, находящимся вне организма человека. Механизм перехода в некультивируемую форму и обратно не изучен, но есть данные о том, что этот процесс запрограммирован в геноме микроорганизмов и запускается недостатком питательных веществ в природных эконишах. В природных образцах такие микроорганизмы изучают путем прямого наблюдения и с помощью методов молекулярного анализа состава нуклеиновых кислот образца.
↑Смешанные и чистые культуры микроорганизмов. Накопительные культуры. Способы получения чистых культур
Читайте также:

