Посев смыва с рук
Добавил пользователь Алексей Ф. Обновлено: 19.09.2024
При взятии смывов необходимо пользоваться следующими рекомендациями:
1) Из оборудования следует обращать внимание на разделочные доски, мясорубки, производственные столы для готовой пищи, особенно в цехе приготовления холодных закусок. Смывы в цехах производства кондитерских кремовых изделий производят в соответствии с "Методическими указаниями по проведению санитарно-бактериологических исследований на предприятиях, вырабатывающих кондитерские кремовые изделия", М., 1976.
2) Смывы с рук, с санитарной одежды, полотенец берутся в основном у работников, имеющих дело с продукцией, не подвергающейся в дальнейшем тепловой обработке (персонал кухни, холодного цеха, раздатчицы, буфетчицы, официанты, продавцы). Порядок определен разделом 2.7.3, п. "а".
3) Смывы с крупного оборудования и инвентаря берут с поверхности в 100 кв. см, для ограничения поверхностей используют шаблон (трафарет), сделанный из проволоки, металлической пластинки. Трафарет имеет площадь 25 кв. см, чтобы взять смывы с площади в 100 кв. см, его накладывают 4 раза в разных местах поверхности контролируемого объекта.
4) При взятии смывов с мелких инструментов обтирается вся поверхность предмета, при заборе смывов с тарелок протирают всю внутреннюю поверхность. При взятии смывов с мелких предметов одним тампоном протирают три одноименных объекта - три тарелки, три ложки и т.п. У столовых приборов протирают их рабочую часть.
5) При исследовании стаканов протирают внутреннюю поверхность и верхний наружный край стакана на 2 см вниз.
6) При взятии смывов с рук протирают тампоном ладонные поверхности обеих рук, проводя не менее 5 раз по каждой ладони и пальцам, затем протирают межпальцевые пространства, ногти и подногтевые пространства.
7) При взятии смывов с санитарной одежды протирают 4 площадки по 25 кв. см - нижнюю часть каждого рукава и 2 площадки с верхней и средней частей передних пол спецовки. С различных мест полотенца берут 4 площадки по 25 кв. см.
Взятие смывов производится с помощью стерильных увлажненных ватных тампонов. Стерильные ватные тампоны на стеклянных, металлических или деревянных палочках, вмонтированных в пробирки с ватными пробками, заготавливают заранее в лаборатории. В день взятия смывов в каждую пробирку с тампоном наливается (в условиях бокса над горелкой) по 5 мл стерильного 0,1% водного раствора пептона или изотонического раствора хлорида натрия таким образом, чтобы ватный тампон не касался жидкости.
Непосредственно перед взятием смыва тампон увлажняют наклонением пробирки или опусканием тампона в жидкость. В процессе отбора смывов рекомендуется неоднократное смачивание тампонов.
Контроль чистоты оборудования, аппаратуры и инвентаря производят перед началом работы после проведения санитарной обработки (мойки и дезинфекции). Каждый контролируемый объект проверяется не реже 2 раз в месяц.
Забор проб на микробиологическое исследование производят при помощи смывов.
При проверке закрытой аппаратуры и трубопроводов для исследования берется последняя порция промывной воды, вытекающей из аппарата или трубопровода.
При бактериологическом анализе смывов с оборудования и инвентаря в них определяется общая бактериальная обсемененность и наличие бактерий группы кишечной палочки.
Пробу на бактериологический анализ санитарного состояния оборудования и инвентаря берут пинцетом со стерильным увлажненным ватным или марлевым тампоном, вытирая 100 см2 поверхности исследуемого оборудования или инвентаря. Для ограничения 100 см2 площади на поверхность оборудования или инвентаря накладывают жестяной трафарет площадью 100 см2 или 4 раза в разных местах исследуемого объекта накладывают трафарет площадью 25 см2.
При взятии пробы с мелких предметов обтирают всю поверхность предмета. Ватные или марлевые тампоны готовят отдельно следующим образом: ватный или марлевый тампон заворачивают в бумагу и стерилизуют в автоклаве при 120°С в течение 30 мин, после стерилизации тампоны подсушивают в сушильном шкафу.
Перед взятием пробы тампон увлажняют, погружая его в пробирку с 10 см3 стерильной водопроводной воды. После взятия пробы тампон помещают в эту же пробирку. Содержимое пробирки тщательно перемешивают 1 см3 и 0,1 см3 подготовленной пробы высевают в чашки Петри. Посевы заливают расплавленным и охлажденным до 45°С СПА или МПА, содержащим 1% глюкозы.
Результаты посевов учитывают через 24 ч после термостатирования при 37°С. Количество микроорганизмов вычисляют на 1 см2 площади исследуемого объекта по формуле:
После санитарной обработки общая обсемененность 1 см2 поверхности оборудования, изготовленного из металла, стекла, резины, пластмассы, дерева, не должна превышать 300 микробных клеток. Обсемененность оборудования в цехах, производящих продукты детского и диетического питания, должны быть не более 50 микробных клеток на 100 см2 поверхности оборудования.
После высева 1 см3 и 0,1 см3 подготовленной пробы для определения общей бактериальной обсемененности в пробирку добавляют 1 см3 концентрированной среды Эйкмана и содержимое пробирки перемешивают. Засеянные пробирки помещают в термостат при температуре 43°С. Через 48 ч из засеянных пробирок со средой Эйкмана, в которых наблюдается появление мути и газообразования или появление только одной мути, производится посев на чашки Петри со средой Эндо. Для пересева берут петлей минимальное количество материала и размазывают его штрихом по поверхности агара. Посевы выдерживают в течение 24 ч при температуре 37°С.
На среде Эндо колонии бактерий группы кишечной палочки имеют вид круглых с ровным краем, блестящих, слегка выпуклых, в диаметре не более 3-х мм колоний, которые могут быть красными с металлическим блеском, красными без блеска, розовыми с красным центром, а также белыми.
Из типичных для бактерий групп кишечной палочки колоний готовят мазки и окрашивают по Граму.
Для приготовления препаратов на обезжиренном спиртом предметном стекле делают тонкий мазок, который фиксируют проводят троекратно над пламенем горелки. Фиксированный препарат окрашивают 1%-ным водным раствором метилового фиолетового, погружая его на 30 с, а затем раствором йода по Бурке (йодистый калий - 3 г, йод - 1 г, вода дистиллированная - 100 см3) в течение 1 мин, далее ацетоном, погружая в него препарат и тотчас вынимая, и, наконец 0,5%-ным водным раствором сафранина в течение 2-3 мин. После каждого этапа окрашивания препарат промывают в проточной водопроводной воде. Подсушенный на воздухе препарат микроскопируют.
Грамположительные микробы окрашиваются в темно-фиолетовый, грамотрицательные - в красный цвет. Отсутствие в мазках грамотрицательных палочек свидетельствует об отсутствии бактерий группы кишечной палочки.
При наличии в мазке грамотрицательных палочек ставят пробу на среде Гисса с глюкозой и индикатором Андредэ. Для этого подозрительную колонию переносят петлей в среду Гисса. Посевы термостатируют 24 ч при 43°С. Изменение цвета и газообразование среды подтверждает присутствие бактерий группы кишечной палочки.
Наличие бактерий группы кишечной палочки в смыве со 100 см2 поверхности оборудования и инвентаря, соприкасающейся по ходу технологического процесса с продукцией, не допускается.
2. Контроль чистоты тары
Ежесменно проводят бактериологический контроль качества подготовки жестяных банок и крышек для продукции цехов, производящих продукты детского и диетического питания, а также жестяных банок и крышек линии кофе натурального растворимого и молотого.
Бактериологический анализ качества очистки жестяных банок и крышек проводят на присутствие бактерий группы кишечной палочки и общую бактериальную обсемененность. Для этого в обработанную банку наливают 50 см3 стерильной водопроводной воды, ополаскивают банку и высевают 1 см3 на чашку Петри для определения общей бактериальной обсемененности, а в 49 см3 добавляют 5 см3 концентрированной среды Эйкмана для выявления бактерий группы кишечной палочки.
Для определения общей бактериальной обсемененности и выявления бактерий группы кишечной палочки всю поверхность крышки, обращенную к банке, вытирают увлажнением тампоном.
После взятия пробы тампон помещают в пробирку с 10 см3 стерильной водопроводной воды, в этой же пробирке тампон увлажняли перед взятием пробы, 1 см3 подготовленной пробы высевают в чашку Петри для определения общей бактериальной обсемененности, а в пробирку добавляют 1 см3 концентрированной среды Эйкмана. Чашки Петри с посевами для определения общей бактериальной обсемененности заливают расплавленным и охлажденным до 45°С СПА или МПА, содержащими 1% глюкозы. Посевы термостатируют при 37°С в течение 24 ч.
Общая бактериальная обсемененность банок и крышек не должна превышать соответственно 500 и 100 микробных клеток.
Посевы в банках и пробирках со средой Эйкмана термостатируют при 43°С в течение 48 ч.
Дальнейшее проведение анализа по выявлению бактерий группы кишечной палочки осуществляется по методике, изложенной в I разделе.
Жестяные банки и крышки, подготовленные для наполнения, не должны содержать бактерий группы кишечной палочки.
От каждой партии пакетов из полимерных материалов, используемых для упаковки продуктов детского и диетического питания, а также сухих завтраков, берется смыв из 3-х пакетов для определения общей бактериальной обсемененности.
В эту тару вливают 20 см3 стерильной водопроводной воды и после непродолжительного встряхивания (1-2 мин) делают посев 1 см3 смывной воды на МПА в 2 чашки Петри. Инкубируются посевы при температуре 37°С в течение суток. Количество микроорганизмов во всем пакете устанавливается путем умножения полусуммы количества выросших колоний в 2-х чашках Петри на количество используемой для смыва воды.
Общая обсемененность полиэтиленовых пакетов не должна превышать 40 микробных клеток (внутренняя поверхность пакета 200-300 см ).
3. Контроль чистоты воздуха
В цехах, производящих продукты для детского и диетического питания, ежесменно должен производиться контроль чистоты воздуха.
Пробы отбираются седиментационным методом. Чашку с застывшей агаризованной средой МПА + 1% глюкозы оставляют открытой в течение 10 мин. Затем чашку закрывают и термостатируют при 37°С в течение 24 ч.
Показатели общей обсемененности в цехе детского и диетического питания не должны превышать 10-ти колоний в чашке при 10-минутной экспозиции, в расфасовочно-упаковочном отделении - 5-ти колоний в чашке при 10-минутной экспозиции.
4. Контроль чистоты рук
Бактериальную чистоту рук у каждого рабочего проверяют не менее 2 раз в месяц. Контроль производится перед началом работы, перед выходом на рабочее место.
Определение чистоты рук ведется методом смыва. При бактериологическом анализе смывов с рук в них определяется общая бактериальная обсемененность и наличие бактерий группы кишечной палочки.
Перед взятием пробы стерильный тампон увлажняют, погружая его в пробирку с 10 см3 стерильной водопроводной воды.
При взятии смывов с рук протирают увлажненным тампоном поверхности обеих рук, проводя не менее 5 раз по каждой ладони и пальцам, затем протирают межпальцевые пространства, ногти и подногтевые пространства.
После взятия пробы тампон помещают в пробирку, в которой увлажняли тампон. Содержимое пробирок тщательно перемешивают, 1 см3 и 0,1 см3 подготовленной пробы высевают в чашки Петри. Посевы заливают расплавленным и охлажденным до 45°С СПА или МПА, содержащими 1% глюкозы.
Результаты анализа учитывают через 24 ч после термостатирования при 37°С. Количество микроорганизмов, обнаруженных на руках, не должно превышать 10000.
После высева 1 см3 и 0,1 см3 подготовленной пробы для определения общей бактериальной обсемененности в пробирку добавляют 1 см3 концентрированной среды Эйкмана для определения бактерий группы кишечной палочки и содержимое пробирки перемешивают. Посевы на среде Эйкмана термостатируют 48 ч при 43°С. Через 48 ч из засеянных пробирок со средой Эйкмана, в которых наблюдается появление мути и газообразование или появление только одной мути, проводится посев на среду Эндо.
Дальнейшее проведение анализа и идентификация типичных для бактерий группы кишечной палочки колоний, выросших на среде Эндо, проводится по общепринятой схеме, описанной в 1 разделе.
При оценке данных следует исходить из требований отсутствия кишечной палочки.
При учете общей бактериальной обсемененности ориентировочно можно придерживаться следующей оценки:
Еще до возникновения медицины люди эмпирическим путем пришли к выводу, что в чистоте заключен залог здоровья. От той поры было очень далеко до представления о существовании БГКП, и смывы их брать было некому.
Регулярные умывания, стирка одежды, обработка продуктов питания перед использованием их в приготовлении блюд стали первыми зачатками санитарии. Постепенно количество навыков чистоплотности увеличивалось: чистка зубов, посещение бань или саун, канализование отходов.

Виды микробных загрязнений
Изобретение микроскопа положило начало микробиологии, которая не только выявила наличие микроорганизмов, но и установила их связь с возникновением заболеваний у людей. Появились первые научно обоснованные санитарные правила, рекомендации и законы, охраняющие здоровье граждан.
Изучение инфекционных заболеваний людей и животных привело ученых к выводу о том, что источниками заражения являются они сами. Бактерии, являющиеся причиной болезней, попадают на продукты питания, предметы быта с микрочастицами кала или каплями слюны. Так были определены две большие группы бактериальных загрязнений.
- Оральная группа, представленная микроорганизмами, обитающими в полости рта.
- Фекальный вид загрязнения бактериями, которые попадают во внешнюю среду из кишечника людей и животных.
Встал вопрос о том, присутствие какого вида бацилл точно свидетельствует об инфекционной опасности объекта или продукта питания. Ведь в кишечнике и ротовой полости сотни различных видов микробов. Была проведена колоссальная работа по выявлению показательных представителей микрофлоры. Определили две группы:
- стафилококки как показатель орального обсеменения;
- бактерии группы кишечной палочки (БГКП) для определения фекального загрязнения.
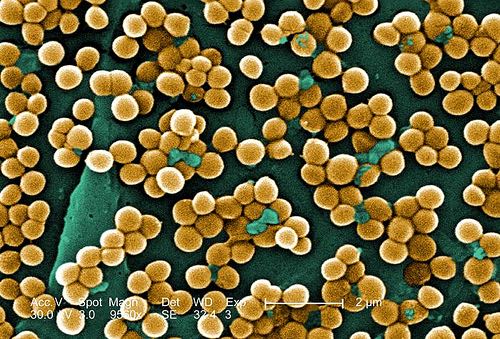
Во рту могут находиться разные виды стафилококков. Присутствие любого из стафилококков в большом количестве будет свидетельствовать о загрязнении. Но есть среди них особо показательный стафилококк. Это золотистый стафилококк, получивший свое название по цвету колоний, которые он создает на лабораторных средах.
БГКП в отличие от стафилококков составляют разнородные микроорганизмы: цитробактеры, эшерихии, шигеллы, иерсинии и другие бациллы. Их всех роднит между собой похожесть на главного представителя кишечной флоры. Это кишечная палочка. Хотя их свойства похожи, на лабораторных средах они образуют колонии разного вида и цвета.
Среди представителей БГКП эшерихии отличаются по свойствам размножения от цитробактера и энтеробактера. Практически это используется для определения давности микробного обсеменения. Присутствие эшерихий свидетельствует о недавнем загрязнении. Наличие цитробактера или энтеробактера означает, что с момента появления БГКП на исследуемом месте прошло несколько недель.
На основании данных изучения микроорганизмов разрабатывались правила и рекомендации, которые легли в основу создания регламентирующей документации.
- СанПиН – санитарные правила и нормы.
- МУ – методические указания.
- Приказы.
- Санитарные правила.

В них расписаны все действия санитарных служб: периодичность проверок, объекты контроля, рекомендованные методики, использование сред для посева, режимы роста стафилококков или БГКП из смыва. Скрупулезность описания действий в МУ и СанПиН объясняется серьезностью вопроса инфекционной безопасности населения.
Забор материала, его исследование
Для изучения стафилококков или БГКП их нужно собрать с поверхности объекта. Простейшая методика – взятие смыва. Для выполнения смыва необходимы стерилизованные перед использованием материалы и емкости.
- Пробирки.
- Пептонный раствор.
- Ватные тампоны.
- Рамка 5х5 см.
Чтобы собрать с поверхности большее количество стафилококков или БГКП, тампон увлажняется раствором. Им тщательно протирается предмет или руки персонала. Смыв с поверхности производится с помощью рамки. По правилам МУ и СанПиН надо взять 4 смыва с разных мест объекта. Затем тампон помещается в пробирку и плотно укупоривается.
Пробирки устанавливаются в гнезда штатива, который ставят в специальный контейнер для транспортировки в лабораторию. Для предотвращения получения искаженных результатов используют контейнер, сохраняющий низкую температуру. Иначе стафилококк или БГКП может размножиться в пептонной среде.
По прибытии в лабораторию пробирки с тампонами устанавливают в гнезда аппарата, рабочая часть которого вибрирует, взбалтывая их содержимое. Так достигается максимальный выход стафилококков или БГКП из тампона в раствор. Затем производится посев смыва на среды для роста колоний.
Для определения в смыве БГКП раньше использовалась среда Кесслера на основе лактозы, где индикатором выступал генцианвиолет. Если произошло расщепление углевода с изменением цвета среды, значит, БГКП присутствуют. Сейчас чаще используют среду Кода.
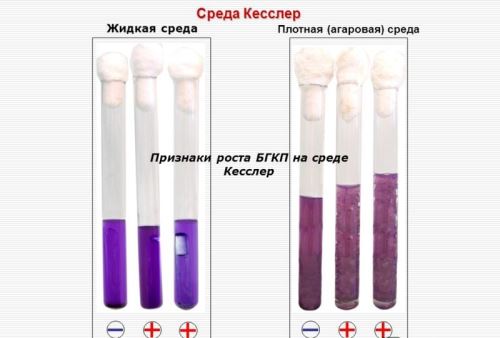
Она более доступна и эффективна. К тому же среда Кода имеет преимущество в цене перед предшественницей – она дешевле. В составе старого материала используется желчь, которая часто дает искажения результатов исследования. Среда Кода в своем составе не имеет подобных включений.
Экспертиза пищевых продуктов, смывов на предмет присутствия БГКП средой Кода модифицированного вида высоко достоверна. Поэтому среда Кесслера быстро замещается более эффективным аналогом Кода.
Новые лаборатории, центры стандартизации и сертификации, надзорные организации используют только среду Кода (индикаторную с тестом на углекислое газообразование). Она рекомендована к применению в МУ и СанПиН, регламентирующих работу экспертных лабораторий.
Контроль загрязнения БГКП в разных учреждениях
Проверки санитарными службами проводятся во всех местах, которые могут явиться источниками массового заражения людей.
- Водозаборные станции.
- Салоны бытовых услуг.
- Бассейны, бани, сауны, аквапарки.
- Столовые, рестораны, кафе, другие места общественного питания.
- Объекты пищевой промышленности.
- ЛПУ (лечебно-профилактические учреждения).
- ДОУ (дошкольные образовательные учреждения).
Это основные места, где существует риск инфекционных заболеваний или вспышек массовых пищевых отравлений. Поэтому в отношении этих объектов, особенно ЛПУ и ДОУ, санитарными службами ведется самый строгий надзор. Нарушение СанПиН или МУ работниками этих учреждений влечет за собой наложение суровых санкций, так как цена ошибки – здоровье людей и детей.
Согласно положениям СанПиН или МУ, утверждаются графики выхода специалистов в подконтрольные учреждения для взятия смывов на присутствие стафилококков и БГКП. СанПиН и МУ определяют периодичность плановых проверок и случаи экстренных обследований.

Главное правило плановых мероприятий на соблюдение требований СанПиН и МУ – внезапность приезда специалистов, чтобы застать и оценить истинное положение с бактериальной загрязненностью объекта.
План проверок составляется с учетом количества объектов на территории, возможностей лаборатории. Но не реже, чем установлено в СанПиН и МУ. Периодичность для разных учреждений установлена своя.
- ЛПУ контролируется дважды в год органами санэпиднадзора. Его собственная лаборатория проверяет стерилизацию инструментов, рук хирургического персонала еженедельно.
- Для клиник родовспоможения специалистами надзорной организации установлена ежеквартальная периодичность.
- Сотрудники ЛПУ регулярно проходят обследование на носительство золотистого стафилококка.
- Периодичность контроля ДОУ – ежеквартальные проверки.
При проверке этих организаций берутся смывы со всех поверхностей кабинетов, залов, комнат, рук персонала согласно правилам МУ и СанПиН. В случае выявления инфекции накладывается карантин до устранения угрозы заражения. Учреждение или его отделение начинает работу после заключительной дезинфекции.

Все проверки проводятся на основании договора надзорной организации с подконтрольным учреждением по статье КОСГУ (классификации операций сектора государственного управления). По соответствующей статье КОСГУ будут оплачены услуги контролирующей организации.
Образование высшее филологическое. В копирайтинге с 2012 г., также занимаюсь редактированием/размещением статей. Увлечения — психология и кулинария.
1.1. Настоящие методические указания предназначены для специалистов органов, осуществляющих функции по контролю и надзору в сфере обеспечения санитарно-эпидемиологического благополучия населения, организаций и учреждений Роспотребнадзора, лечебно-профилактических и других организаций независимо от организационно-правовой формы и формы собственности.
1.2. Методические указания устанавливают методы санитарно-бактериологических исследований в учреждениях здравоохранения, других организациях лечебного профиля. Объектами санитарно-бактериологических исследований, на которые распространяются настоящие методические указания, являются:
· объекты окружающей среды, в т.ч. изделия медицинского назначения, зонды, катетеры, бужи, резиновые перчатки и другие изделия из резин и металлов, шовный материал, подготовленный к использованию, и прочее, спецодежда;
1.3. Номенклатура, кратность и объем санитарно-бактериологических исследований устанавливается действующими нормативно-методическими документами с учетом санитарно-эпидемиологической обстановки.
1.4. Для санитарно-бактериологических исследований объектов окружающей среды, воздуха и контроля стерильности изделий медицинского назначения в учреждениях здравоохранения и других организациях лечебного профиля могут быть использованы питательные среды лабораторного и промышленного приготовления, расходные материалы, биологические препараты, указанные в настоящих методических указаниях. Применение других коммерческих питательных сред (расходных материалов, биологических препаратов) допускается при наличии методик исследования, утвержденных и разрешенных к применению в установленном порядке.
3.1. Исследования бактериальной обсемененности воздушной среды
3.1.1. Исследования бактериальной обсемененности воздушной среды проводят в помещениях лечебных организаций в зависимости от их функционального назначения на санитарно-микробиологические показатели:
общее количество микроорганизмов в 1 м 3 воздуха (КОЕ/м 3 );
количество колоний S . aureus в 1 м 3 воздуха (КОЕ/м 3 );
количество плесневых и дрожжевых грибов в 1 м 3 воздуха.
3.1.2. Пробы воздуха отбирают аспирационным методом с помощью аппаратов и устройств, разрешенных к применению в установленном порядке.
Количество пропущенного воздуха должно составлять 100 дм 3 для определения общего количества микроорганизмов, дрожжевых и плесневых грибов и 250 дм 3 для определения S. aureus . Исследование воздуха седиментационным методом не допускается.
3.1.3. Для определения общего количества микроорганизмов в 1 м 3 воздуха забор проб проводят на питательный агар типа МПА, СПА, ГРМ-агар и другие, приготовленные согласно инструкций по применению. Посевы инкубируют при температуре 37 °С в течение (48 ± 2) ч, подсчитывают количество выросших колоний и производят перерасчет на 1 м 3 воздуха. При наличии роста колоний дрожжевых и плесневых грибов, их подсчитывают и делают пересчет на 1 м 3 воздуха. В протоколе количество дрожжевых и плесневых грибов указывают отдельно.
Примечание : При переносе аппаратов и устройств для отбора проб воздуха из одного помещения в другое их поверхность обрабатывают раствором дезинфицирующего средства. Столик, внутренние стыки, крышку и прочие части прибора с внутренней и внешней стороны протирают спиртом (70 %).
Для определения наличия S. aureus забор проб проводят на желточно-солевые среды на основе сред: элективно-солевой агар, стафилококк-агар, маннитолагар или среда № 10 по ГФ XII, агар Байд-Паркер. Чашки с посевами инкубируют в термостате при 37 °С (48 ± 2) ч.
2. Второй-третий день.
На вышеуказанных средах стафилококк растет в виде круглых, блестящих, маслянистых, выпуклых, пигментированных колоний. Следует учитывать, что стафилококки, выделенные от человека, дают положительную лецитовителлазную реакцию в 60 - 70 % случаев. Отвивка на скошенный агар для дальнейшего исследования не менее 2 колоний, подозрительных на стафилококк. Для исследования отвивают прежде всего колонии, дающие положительную лецитовителлазную реакцию (образование радужного венчика). При отсутствии на чашках таких колоний дальнейшему исследованию подвергаются пигментированные колонии, схожие по морфологии со стафилококком. При одновременном наличии на чашках колоний стафилококка, отличающихся по пигменту, следует отвивать не менее двух колоний различного вида. Пробирки с посевом помещают в термостат при 37 °С на (24 ± 2) ч.
3. Четвертый день.
После инкубации у выделенных штаммов проверяют морфологию, тинкториальные свойства (окраска по Граму) и наличие плазмокоагулирующей активности в реакции плазмокоагуляции (РПК).
Если культура обладает только плазмокоагулирующей или только лецитовителлазной активностью, то для окончательного ответа требуется учитывать другие признаки, позволяющие определить принадлежность штамма к виду S. aureus (ферментация маннита, гемолитическая активность).
При необходимости, после выделения чистой культуры, проводят определение чувствительности/устойчивости к антибиотикам, дезинфицирующим средствам, бактериофагам.
Учет результатов дополнительных тестов. Окончательная выдача ответа.
3.2. Исследования микробной обсемененности объектов внешней среды
3.2.1. Бактериологическое исследование микробной обсемененности объектов внешней среды предусматривает определение стафилококков, бактерий группы кишечных палочек, сальмонелл, синегнойной палочки. Отбор проб с поверхностей различных объектов осуществляют методом смывов. По эпидемиологическим показаниям номенклатура исследований микробной обсемененности объектов внешней среды может быть расширена.
3.2.2. Взятие смывов производят стерильными ватными тампонами, вмонтированными в пробирки. Для увлажнения тампонов в пробирки наливают по 2,0 мл стерильной 0,1 % пептонной воды с добавлением нейтрализаторов дезинфицирующих средств.
3.2.3. При контроле мелких предметов смывы забирают с поверхности всего предмета. При контроле предметов с большой поверхностью смывы проводят в нескольких местах исследуемого предмета общей площадью примерно 100 см 2 .
3.2.4. Для обнаружения стафилококков делают высев 0,2 - 0,3 мл смывной жидкости в пробирку с 5,0 мл 6,5 % солевого бульона. Засеянные пробирки инкубируют при 37 °С в течение (24 ± 2) ч, после чего делают высев на желточно-солевые среды на основе сред: элективно-солевой агар, стафилококкагар, манитолагар или среда № 10 по ГФ XII, агар Байд-Паркер. Дальнейшие исследования выделенных культур стафилококков проводят по п. 3.1.4.
3.2.5. Для обнаружения бактерий группы кишечных палочек делают высев 0,2 - 0,3 мл смывной жидкости в пробирку с 5,0 мл среды Кесслера. Засеянные пробирки инкубируют при 37 °С в течение (24 ± 2) ч и делают пересев на среду Эндо. Выросшие колонии на среде Эндо подвергают дальнейшему изучению для установления их возможной принадлежности к патогенным энтеробактериям.
3.2.6. Для обнаружения сальмонелл делают высев 0,2 - 0,3 мл смывной жидкости в пробирку с 5,0 мл одной из сред обогащения (магниевая, селенитовая или среда Раппапорта-Вассилиадиса). Засеянные пробирки инкубируют при 37 °С в течение 18 - 20 ч, делают пересев на среду Эндо и висмут-сульфит агар с последующим отбором подозрительных колоний и их идентификацией.
3.2.7. Для обнаружения синегнойной палочки делают высев на среду № 8 (бульон для накопления стафилококков и синегнойной палочки) и среду № 9 (для определения синегнойной палочки по наличию пигмента пиоцианина) или питательные среды в соответствии с ГФ XII. Колонии, подозрительные на синегнойную палочку (колонии с ровными или слегка волнистыми краями, гладкой блестящей поверхностью с характерным запахом и пигментом, однако, следует учесть, что запах и пигмент могут сильно варьировать или вообще отсутствовать), пересевают на скошенный агар.
P. aeruginosa - грамотрицательная, подвижная, оксидазоположительная палочка, окисляющая, но не ферментирующая глюкозу, дающая рост при 42 °С.
3.2.8. Ориентировочный перечень объектов, подлежащих санитарно-бактериологическому контролю методом смывов:
А. Операционный блок:
· маска наркозного аппарата;
· тройник наркозного аппарата;
· емкости и приспособления для мытья и обработки рук;
· фартуки (клеенчатые или полиэтиленовые);
· шланг вакуум-отсоса, внутренняя часть емкости;
· шланг кислородной подводки;
· стоики для введения лекарственных средств и вспомогательные приспособления;
· ручка бестеневой лампы;
· руки персонала, участвующего в операции;
· медицинские изделия многократного применения;
Б. Послеоперационные палаты, отделения, палаты реанимации и интенсивной терапии:
· кровать и постельное белье, подготовленные для больного;
· полотенца и приспособления для обработки рук персонала;
· шланг кислородной подводки;
· запасная наркозная аппаратура (набор реанимационной укладки);
· шланг вакуум-отсоса, внутренняя часть емкости;
· внутренняя поверхность шкафов и холодильников (для хранения лекарственных средств, градусников);
· медицинские изделия многоразового использования;
В. Перевязочные, процедурные:
· кушетка и приспособления для перевязок;
· полотенца и приспособления для обработки рук персонала;
· мебель (медицинские столы, тумбочки);
· оборудование для химической стерилизации (стойки, чехлы для хранения стерильных эндоскопов, емкости с крышкой для химической стерилизации);
· гибкая часть эндоскопов и оптика;
· внутренняя поверхность шкафов и холодильников для хранения лекарственных препаратов и изделий медицинского назначения;
· внутренняя и наружная поверхности бактерицидных камер для хранения простерилизованных изделий медицинского назначения.
4.1. Отбор проб на стерильность производит специалист после прохождения инструктажа по технике выполнения отбора проб для микробиологического анализа.
4.2. Все изделия медицинского назначения, подлежащие контролю, направляют в микробиологическую лабораторию в упаковке, в которой осуществляли их стерилизацию, дополнительно заворачивают в стерильную простыню или помещают в стерильную наволочку.
При стерилизации изделий в неупакованном виде в отделении отбор проб проводят в стерильные емкости, соблюдая правила асептики.
Контроль стерильности проводят путем прямого посева (погружения) изделий целиком (при их небольших размерах) или отдельных деталей (разъемные изделия) и фрагментов (отрезанные стерильными ножницами кусочки шовного, перевязочного материала и т.п.) в питательные среды. При посеве изделия или его части непосредственно в питательную среду количество среды в пробирке (колбе, флаконе и т.д.) должно быть достаточным для полного погружения изделия или его части.
При проверке стерильности более крупных изделий проводят отбор проб методом смывов с различных участков поверхности изделий: с помощью стерильного пинцета (корнцанга) каждый участок тщательно протирают марлевой салфеткой (размер салфетки 5 ´ 5 см), увлажненной стерильной питьевой водой. Каждую салфетку помещают в отдельную пробирку (колбу, флакон) с питательной средой.
У изделий, имеющих функциональные каналы, рабочий конец опускают в пробирку с питательной средой и с помощью стерильного шприца или пипетки 1 - 2 раза промывают канал этой средой.
Контроль стерильности проводят путем прямого посева (погружения) изделий целиком (при их небольших размерах) или отдельных деталей (разъемные изделия) и фрагментов (отрезанные стерильными ножницами кусочки шовного, перевязочного материала и т.п.) в питательные среды.
4.3. Для контроля стерильности используют следующие питательные среды: тиогликолевую, бульон Сабуро (с ингибитором посторонней микрофлоры - теллурит калия или левомицетин).
При контроле изделий каждого наименования обязателен одновременный посев на обе указанные питательные среды.
На каждый вид исследуемого материала используют по две пробирки каждой среды.
При посеве изделия или его части непосредственно в питательную среду количество среды в пробирке (колбе, флаконе и т.д.) должно быть достаточным для полного погружения изделия или его части.
4.4. Посевы в тиогликолевой среде выдерживают в термостате при температуре 32 °С. Посевы в бульоне Сабуро - при температуре 20 - 22 °С в течение 14 суток при контроле изделий, простерилизованных растворами химических средств и газовым методом, в течение 7 суток - простерилизованных физическими методами (паровой, воздушный).
4.5. Учет результатов исследования на стерильность.
При отсутствии роста микроорганизмов во всех пробирках (колбах, флаконах) делают заключение о стерильности изделий. Материал не стерилен при росте микрофлоры.
5.1. Смывы с рук персонала производят стерильными марлевыми салфетками размером 5 ´ 5 см, смоченной в нейтрализаторе. Марлевой салфеткой тщательно протирают ладони, околоногтевые и межпальцевые пространства обеих рук. После отбора проб марлевую салфетку помещают в широкогорлые пробирки или колбы с физиологическим раствором и стеклянными бусами, встряхивают в течение 10 мин. Жидкость засевают глубинным способом на 2 чашки Петри с мясопептонным агаром (по 0,5 мл) и в 2 пробирки с 0,5 %-м сахарным бульоном (по 1 мл). Посевы инкубируют при температуре 37 °С в течение 48 ч.
5.2. Учет результатов.
Отсутствие роста патогенных и условно патогенных бактерий.
6.1. Требования к помещению для посева на стерильность
6.1.1. Контроль стерильности изделий проводят с соблюдением асептических условий, исключающих возможность вторичной контаминации изделий микроорганизмами.
Контроль стерильности изделий проводят в боксах с ламинарным потоком воздуха. При отсутствии боксов с ламинарным потоком воздуха контроль стерильности проводят в боксированных помещениях (бокс с предбоксником).
6.1.2. В боксированном помещении поверхность пола, стен, потолка, мебели должна быть гладкой, без щелей, устойчивой к многократному действию моющих и дезинфицирующих средств. Полы должны быть нескользкими, иметь гидроизоляцию. Поверхность столов не должна иметь швов и трещин.
6.1.3. Боксы оборудуют приточно-вытяжной вентиляцией (с преобладанием притока над вытяжкой) с подачей в них воздуха через бактериальные фильтры. В боксе и предбокснике устанавливают бактерицидные облучатели в соответствии с нормами, предусмотренными действующими нормативно-методическими документами.
6.2. Подготовка бокса, инструментов и персонала к работе
6.2.1. Перед проведением работы поверхности в помещениях бокса и предбоксника (стены, пол, оборудование и др.), а также внутренние поверхности бокса с ламинарным потоком воздуха обрабатывают раствором дезинфицирующего средства, разрешенного к применению в установленном порядке.
6.2.2. Через 45 - 60 мин после обработки в бокс вносят все необходимые для работы материалы и инструменты, кроме образцов изделий.
6.2.3. Перед началом работ бокс с ламинарным потоком воздуха включают на время, достаточное для обеспечения полного обмена воздуха, а затем помещают в него необходимый для работы материал.
6.2.4. В боксе и предбокснике перед работой включают бактерицидные облучатели.
6.2.5. Инструменты, посуду и спецодежду, используемые в работе, предварительно стерилизуют при следующем режиме: температура 32 °С, время стерилизационной выдержки - 90 мин; изделия из резин (перчатки и т.д.) - при температуре 120 °С в течение 60 мин.
6.2.6. Перед посевом исследуемый материал вносят в предбоксник, предварительно снимая наружную мягкую упаковку. В предбокснике пакеты, биксы протирают снаружи с помощью стерильного пинцета (корнцанга) стерильной салфеткой (ватным тампоном), обильно смоченной раствором дезинфицирующего средства, обладающего спороцидными свойствами, разрешенного к применению в установленном порядке, и оставляют на 30 мин. При поступлении изделий, упакованных в два слоя (бумага, перманганаты, ткани), первый слой снимают в предбокснике и изделия во внутренней упаковке сразу переносят в бокс.
6.2.7. Перед входом в бокс работники лаборатории тщательно моют руки теплой водой с мылом, вытирают их стерильным полотенцем (салфеткой), надевают в предбокснике бахилы, стерильные халаты, 4-слойные маски, шапочки и стерильные перчатки.
6.2.8. В процессе посева в боксе проверяют обсемененность воздуха. Для этого на рабочий стол ставят 2 чашки с мясопептонным агаром (МПА), открывая их на 15 мин, затем чашки помещают в термостат при температуре 37 °С на (48 ± 2) ч. Допускается рост не более трех колоний неспорообразующих сапрофитов.
Для контроля стерильности питательные среды после изготовления и стерилизации помещают в термостат при температуре 37 °С на (48 ± 2) ч.
Бульон Сабуро контролируют полностью (всю приготовленную серию пробирок или колб).
Для тиогликолевой среды термостатируют 1 % от общего числа приготовленных пробирок или колб каждой серии. Для проведения исследований материала на стерильность эту часть сред не используют.
Читайте также:

