Посев на питательные среды
Добавил пользователь Алексей Ф. Обновлено: 19.09.2024
Бактериологический (культуральный) метод исследования заключается в выявлении патогенных микроорганизмов и определении их чувствительности к антибиотикам. Процесс выявления микроорганизмов состоит из нескольких этапов:
- 1. Посев материала на питательные среды.
- 2. Получение чистых культур микроорганизмов.
- 3. Идентификация микроорганизмов.
- 4. Определение чувствительности к антибиотикам, антимикотиков.
Первый и второй этапы бактериологического исследования одинаковы и для классического, и для автоматического бактериологического методов.
Первый этап
Биологический материал высевают на питательные среды. Для каждого вида биологического материала используется определенный набор питательных сред. Это связано с тем, что в разных видах биологического материала находятся различные виды микроорганизмов и необходимо, чтобы выросли максимально все. Используются питательные среды общего назначения - на них растет подавляющее большинство микроорганизмов - кровяной агар, шоколадный агар; дифференциальные среды - позволяют отличать разные виды микроорганизмов - среда Эндо для энтеробактерий, селективные среды - растут только отдельные виды бактерий - энтерококагар для выявления энтерококков, маннитол-солевой агар для обнаружения стафилококков.
Посев делают таким образом, чтобы получить отдельные изолированные колонии.
Посевы помещают в термостат, как правило, на 24 ч при 37С. Некоторые посевы инкубируют при 28С, а некоторые в течение 48 часов. Посевы для выявления грибов рода Candida до 5 суток, мицелиальных грибов - до 30 суток.
Второй этап
Просматривают посевы на питательных средах. По внешнему виду колоний (размер, цвет, форма), определёнными быстрыми тестами и микроскопией определяют возможный вид микроорганизмов и их значение в конкретном случае. Избранные колонии отсеивают на универсальные питательные среды для накопления чистой культуры микроорганизмов. В случае роста колоний только одного вида можно проводить идентификацию и определение чувствительности без этапа накопления чистой культуры.
Третий этап
В зависимости от вида микроорганизма проводят его идентификацию (определение биохимических и антигенных свойств) с помощью фиксированного набора субстратов и сывороток. Субстратами являются углеводы, аминокислоты и другие сложные соединения. По результатам устанавливают род и вид микроорганизма.
Для установления вида некоторых микроорганизмов может потребоваться серологическая идентификация.
Все среды для идентификации и определения чувствительности к антибиотикам готовятся и стерилизуются отдельно. Такая процедура очень трудоемкая, то есть требует много ручного труда и времени, дополнительного оборудования. Таким образом у данного метода низкий уровень стандартизации.
Для идентификации некоторых требовательных клинически значимых видов микроорганизмов необходимы сложные и дорогие субстраты, которые в рутинной практике трудно готовить и использовать. Из-за этого спектр микроорганизмов, которые можно было бы идентифицировать, сужается по сравнению с возможностями автоматического анализатора.
Четвертый этап
Определение чувствительности к антибиотикам проводится с учетом результатов идентификации и вида биологического материала.
При использовании классического бактериологического метода, определение чувствительности к антибиотикам происходит диско-диффузным методом. Этот метод базируется на изучении зон задержки роста микроорганизма вокруг бумажного диска, который пропитан антибиотиком. В зависимости от зон задержки роста определяют устойчивые, умеренно-стойкие и чувствительные штаммы микроорганизмов к тому или иному антибиотику. Данный метод является наиболее распространенным для изучения чувствительности, а также дешевым и простым в исполнении. Однако он также плохо поддается стандартизации, поскольку требует много ручного труда.
Кроме того, согласно рекомендациям международных организаций, которые занимаются совершенствованием существующих методик и разработкой новых (EUCAST - Европейский комитет по определению чувствительности к антибиотикам, CLSI - Институт клинических лабораторных стандартов), чувствительность к некоторым антибиотикам НЕЛЬЗЯ определять диско-диффузным методом, поскольку не определены критерии оценки полученных результатов.
- 1. колистином - кишечная палочка, клебсиелла и другие энтробактерии, синегнойная палочка, ацинетобактер;
- 2. бета-лактамы (пенициллины, цефалоспорины, карбапенемы), гликопептиды (ванкомицин, тейкопланин), даптомицином, фосфомицин – стафилококки;
- 3. даптомицином - стрептококки групп А, В, С и G;
- 4. меропенем - пневмококки при менингитах;
- 5. бета-лактамы (пенициллины, цефалоспорины, карбапенемы) – пневмококки.
Кроме того существуют микроорганизмы, чувствительность которых к антибиотикам вообще нельзя определять диско-диффузным методом: Neisseria gonorrhoea, Neisseria meningitidis, все анаэробные микроорганизмы, Helicobacter pylori, Candida spp., Aspergilus spp. и другие мицелиальные грибы.
В настоящее время проведения микробиологических исследований является важной и актуальной деятельностью в биологии и медицине, так как они позволяют с высокой степенью точности и достоверности подтвердить или опровергнуть факт присутствия в организме человека возбудителей инфекционных заболеваний. Классический бактериологический метод исследования решает задачи выделения чистой культуры возбудителя с его последующей идентификацией. Благодаря микробиологическим методам исследования можно установить возбудителей тех или иных инфекционных заболеваний и подобрать рациональное лечение этого заболевания.
Преимущества автоматического метода
1. Скорость получения результата. Результат наших исследований является максимально быстрым. Уже на 3 сутки Вы получаете название микроорганизма, который был обнаружен в исследуемом образце, а также его чувствительность к антибиотикам. (!) Срок исследований в автоматическом методе продлен до 5 суток за счет длительного роста грибов рода Candida.
2. Точность. Автоматический анализатор дает возможность быстро и очень точно определить какой именно из 400 микроорганизмов есть в биоматериале.
3. Большой спектр антибиотиков к которым определяется чувствительность позволяет врачу назначить наиболее рациональную антибиотикотерапию с учетом характера заболевания и особенностей пациента. К тому же определение чувствительности таким методом является максимально быстрым и точным по сравнению с классическим.
Важно! В результате микробиологического исследования проведенного автоматическим методом антибиотикочувствительность издается с показателем МИК * (минимальная ингибирующая концентрация)
Посев бактерий. Посев бактерий на плотные питательные среды. Получение изолированных колоний бактерий. Температура культивирования бактерий.
При достаточном содержании патогенных бактерий в образце проводят посев на плотные питательные среды (для получения изолированных колоний). Если в исследуемом материале бактерий мало, то посев проводят на жидкие среды обогащения. На практике выделение относительно неприхотливых бактерий обычно проводят на простых средах (например, на КА, агаре Плоскирева, тиогликолевом бульоне, агаре Сабуро и т.д.).
Для выделения прихотливых видов бактерий в среды вносят питательные вещества (кровь, сыворотку, дрожжевой экстракт и др.), а также поглотители токсических метаболитов, образующихся при росте бактерий (например, древесный уголь). Для посевов применяют микробиологические петли, реже иглы и шпатели.
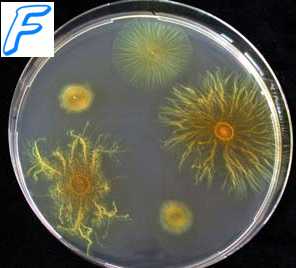
Получение изолированных колоний бактерий
Исключение составляет техника посева при бактериологическом исследовании мочи (техника штрихового засева показана на рис. 11-13). Указанные методы пригодны для посева аэробных и факультативно анаэробных бактерий, а также нестрогих анаэробов.
Температура культивирования бактерий
Патогенные бактерии вариабельны в отношении температур, оптимальных для их роста, но большинство из них неплохо развивается при 35-37 °С. Исключение составляют некоторые атипичные микобактерии, возбудитель чумы, листерии и лептоспиры (температурный оптимум 20-30 °С), а также Campylobacter jejuni (температурный оптимум 42 °С).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
1. При посеве в жидкую питательную среду петлю с находящимся на ней материалом погружают в среду. Если материал вязкий и с петли не снимается, его растирают на стенке сосуда, а затем смывают жидкой средой. Жидкий материал, набираемый в пастеровскую или градуированную пипетку, вливают в питательную среду.
2. При посеве на скошенный мясо-пептонный агар пробирку берут в левую руку между I и II пальцами, чтобы основание пробирки находилось на поверхности кисти руки и посев осуществлялся под контролем глаза. Пробку из пробирки вынимают правой рукой V и IV пальцами, не прикасаясь к той части пробки, которая входит внутрь пробирки. Остальные 3 пальца правой руки остаются свободными для взятия бактериальной петли, посредством которой производится посев. Петлю держат, как писчее перо. После вынимания пробки пробирку с питательной средой держат в наклонном положении во избежание попадания в нее посторонних микроорганизмов из воздуха.
Петлю с находящимся на ней пересеваемым материалом вводят в пробирку до дна, опускают плашмя на поверхность питательной среды и скользящими движениями наносят штрих снизу вверх, от одной стенки пробирки к другой (рис. 4).
3. При посеве на поверхность плотной питательной среды в чашки Петри чашку держат в левой руке. Дно ее с одной стороны придерживают I и II пальцами, а с другой — IV и V пальцами. Крышку, приоткрытую настолько, чтобы в образовавшуюся щель свободно проходили петля или шпатель, фиксируют I и III или I и II пальцами. Небольшое количество исследуемого материала втирают бактериальной петлей в поверхность питательной среды у края чашки (рис. 5). Затем петлю прожигают, чтобы уничтожить избыток находящегося на ней материала. Линию посева начинают с того места, в котором находится материал. Бактериальную петлю кладут плашмя на питательную среду, чтобы не поцарапать ее поверхности, и проводят штрихи по всей среде или по секторам, разграфив предварительно дно чашки (при условии, что среда прозрачна) на несколько равных частей. Нужно стараться, чтобы штрихи, наносимые петлей, располагались как можно ближе друг к другу, так как это удлиняет общую линию посева и дает возможность получить изолированные колонии микроорганизмов.
Рис. 5. Посев на плотную питательную среду в чашки Петри
Для равномерного распределения засеваемого материала по поверхности плотной питательной среды можно пользоваться вместо петли тампоном или шпателем.
При обилии в засеваемом материале микробов они растут в виде пленки, покрывающей всю поверхность питательной среды. Такой характер микробного роста получил название сплошного, или газонного. Посев газоном производят, когда нужно получить большие количества микробной культуры одного вида.
4. Из материала, подлежащего посеву в толщу плотной питательной среды, готовят взвесь в стерильной водопроводной воде или в изотоническом растворе. Набирают 0,1—1 мл взвеси в пипетку (в зависимости от степени предполагаемого микробного загрязнения) и выливают в пустую стерильную чашку Петри. Вслед за этим чашку заливают 15—20 мл мясо-пептонного агара, расплавленного и остуженного до температуры 40—45°С (при такой температуре пробирка со средой, приложенная к щеке, не должна вызывать ощущения ожога). Для равномерного распределения исследуемого материала в питательной среде закрытую чашку с содержимым слегка вращают по поверхности стола.
5. Посев уколом в столбик питательной среды производят в пробирку со средой, застывшей в виде столбика. Пробирку берут в левую руку, как обычно, и в центре столбика до дна пробирки вкалывают петлю с находящимся на ней материалом.
Получение чистых культур
Чистой культурой микробов называют популяцию микроорганизмов одного вида, полученную из изолированной микробной колонии. Под микробной колонией подразумевается потомство бактерий, возникающее в результате размножения одной микробной клетки.
Выделение чистой культуры микробов является обязательным этапом всякого бактериологического исследования. Чистая культура необходима для изучения морфологических, культур культуральных, биохимических и антигенных свойств, по совокупности которых определяется видовая принадлежность исследуемого микроорганизма.
Для выделения чистых культур микробов из материалов, содержащих обильную смешанную микрофлору, предложено много различных методов. Наибольшее распространение получил метод механического разъединения микроорганизмов, находящихся в исследуемом материале, с целью получения изолированных колоний на поверхности или в глубине питательной среды.
Очень широко применяются элективные питательные среды, стимулирующие развитие тех микроорганизмов, чистую культуру которых предполагается выделить.
Некоторые виды микробов обладают высокой чувствительностью к воздействию определенных факторов внешней среды. Индивидуальная устойчивость микробов к тому или иному фактору была использована для разработки методов выделения чистых культур путем умерщвления сопутствующей микрофлоры. Этим способом производится выделение споpoвых форм микробов, устойчивых к действию высокой температуры, микобактерий туберкулеза, безразличных к действию концентрированных растворов минеральных кислот, в отличие от остальных микробов, содержащихся в мокроте.
При выделении чистой культуры патогенных микробов из патологического материала, загрязненного посторонней микрофлорой, прибегают иногда к заражению лабораторных животных, восприимчивых к тому виду микроба, который предполагается выделить из исследуемого материала. Биологический метод выделения чистой культуры применяется при исследовании мокроты на содержание в ней пневмококков, микобактерий туберкулеза.
Для выделения бактерий в виде чистых культур известно сравнительно мало методов. Чаще всего это делают путем изолирования отдельных клеток на твердой питательной среде, используя метод посева штрихом или разлива по чашкам небольшого количества жидкой культуры. Однако получение отдельной колонии не всегда гарантирует чистоту культуры, поскольку колонии могут вырасти не только из отдельных клеток, но из их скоплений. Если микроорганизмы образуют слизь, то к ней часто прикрепляются посторонние формы. В случае выделения штаммов Bacillus или актиномицетов контаминирующие микроорганизмы могут быть опутаны цепочками клеток или, соответственно, гифами этих микробов. Для очистки предпочтительнее использовать неселективную среду, поскольку на ней лучше растут контаминирующие микроорганизмы и их легче обнаружить. Но даже на неселективной среде не следует очень быстро отбирать колонии, поскольку за данный отрезок времени могут не вырасти медленно растущие контаминирующие бактерии.
Из чистой культуры обычно вырастают одинаковые колонии и при микроскопировании выявляются похожие клетки, в частности, по размеру и окраске по Граму. Однако возможны исключения, например, колонии, вырастающие из чистой культуры, могут быть гладкие (S) и шероховатые (R). Кроме того, в чистых культурах различных микроорганизмов могут появиться кокковидные клетки, цисты и споры. Наконец, некоторые микроорганизмы проявляют грамвариабельность. Тем не менее, указанные критерии широко используются при определении чистоты культур.
Посев штрихом
В Г Д
Рис. 6. Удобный метод посева штрихом в чашки для получения отдельных колоний. А. Для маркировки на обратной стороне чашки Петри карандашом наносят букву Т, разделяющую дно на 3 сектора. Б. Петлей с культурой зигзагом наносят штрихи на поверхности агара в секторе 1, как показано на рисунке. Для этого крышку чашки сначала приподнимают, а после нанесения штриха сразу закрывают. Петлю стерилизуют в пламени и дают ей остыть (15 с). В. Проводят петлей по поверхности среды в секторе 1, как показано на рисунке, и затем немедленно наносят ею зигзагом штрихи на поверхности среды в секторе 2. Прогревают петлю в пламени и дают ей остыть. Г. Проводят петлей по поверхности среды в секторе 2, как показано, и затем наносят ею зигзагом штрихи на поверхности среды в секторе 3. Д. Инкубируют опрокинутые вверх дном чашки, как показано на рисунке, для того, чтобы конденсирующаяся вода с крышки не попала на поверхность агара. В секторе 1 вырастает большое число колоний, тогда как в секторах 2 и 3 появляются отдельные хорошо изолированные колонии.
Техника посевов и пересевов культур микроорганизмов.Универсальным инструментом для производства посевов является бактериологическая петля (металлическая многоразовая или пластмассовая одноразовая). Кроме нее, для посева уколом применяют специальную бактериологическую иглу, а для посевов на чашки Петри – металлические, стеклянные или пластиковые шпатели. Для посевов жидких материалов наряду с петлей используют пастеровские и градуированные пипетки.
Все манипуляции с микробами осуществляют с помощью стерильных инструментов вблизи пламени горелки.Металлическую бактериологическую петлю перед использованием, после каждой манипуляции и по окончании работы стерилизуют путем прокаливания в пламени горелки.
Культивирование микробов осуществляют посевом их на питательные среды с последующей инкубацией в оптимальных условиях температуры, влажности, газового состава атмосферы и т.д. С этой целью материал, содержащий микроорганизмы (материал от больного, из чистой культуры, из изолированной колонии и т.д.), помещают (засевают) в жидкие или на плотные среды. В последнем случае посев может быть произведен как на поверхность, так и в глубину агара уколом. Предварительно посуду (пробирку, чашки Петри и др.) надписывают, указывая дату посева и характер посевного материала (номер исследования или название культуры).
В зависимости от техники посева и концентрации микробов в посевном материале бактерии на поверхности плотной питательной среды могут давать равномерный сплошной рост-бактериальный газон,"сливной рост" (возникает при помещении большого количества микроорганизмов на ограниченный участок поверхности агара) или образовывать изолированные колонии.
Посев на плотные питательные среды. Плотные питательные среды используют для посева материала на их поверхность и в толщу среды.
Посев петлей на среду в чашку Петри. Заранее подписанную чашку Петри с агаровой средой приоткрывают под углом во избежание попадания микробов извне. Бактериологическую петлю кладут плашмя на питательную среду, чтобы не поцарапать ее поверхность, и проводят штрихи по всей среде. Штрихи, наносимые петлей, должны располагаться как можно ближе друг к другу, так как это удлиняет общую линию посева и дает возможность получить на поверхности среды изолированные колонии микробов.
Окончив посев, петлю фламбируют, чтобы уничтожить оставшихся на ней микроорганизмов, и ставят в штатив. Пробирку закрывают, предварительно обеззаразив ее края и ту часть пробки, которая входит в горлышко пробирки. Чашку Петри с посевами переворачивают вверх дном, во избежание размыва колонии конденсационной водой, и ставят в термостат для культивирования.
Посев шпателем на среду в чашку Петри. Исследуемую микробную культуру наносят на поверхность питательной среды у края чашки. Стерильным шпателем распределяют ее равномерно по всей поверхности. Чашку подписывают, переворачивают вверх дном и помещают в термостат для выращивания.
При обилии в засеваемом материале микробов они растут в виде пленки, покрывающей всю поверхность питательной среды. Такой характер микробного роста получил название сплошного или газонного. Посев газоном производят, когда нужно получить большие количества микробной культуры одного вида.

Посев в жидкую питательную среду. При посеве в жидкую питательную среду обе пробирки (одна с исследуемой культурой, другая с питательной средой) берут в левую руку между большим и указательным пальцами так, чтобы их основания находились поверх кисти руки. Все действия проводят над пламенем горелки (радиус 10- 15 см). Пробки из пробирок вынимают мизинцем и безымянным пальцами правой руки, не прикасаясь к той части пробки, которая входит внутрь пробирки. Края пробирок при вынимании пробок прожигают. Остальные три пальца правой руки остаются свободными для взятия петли или пипетки, посредством которых материал переносят из одной пробирки в другую и распределяют в питательной среде. Бактериальную петлю прокаливают на огне непосредственно перед взятием материала. Чтобы остудить горячую петлю, ее вводят в глубь пробирки и погружают в конденсационную жидкость. При взятии петлей материала для посева должна образоваться в кольце петли тонкая прозрачная пленка – “зеркальце”. Петлю с находящимся на ней материалом погружают в питательную среду. Если материал вязкий и с петли не снимается, его растирают на стенке пробирки и смывают жидкой средой. Пробирки закрывают пробками, предварительно профламбировав их края. Петлю обеззараживают и ставят в штатив. Пробирку с посевами подписывают и помещают в термостат для культивирования.

Рис7.3. Механизмы транспорта веществ через ЦПМ

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Читайте также:

