Посев грибов в чашке петри
Добавил пользователь Владимир З. Обновлено: 19.09.2024
Каждый из нас задумывался о том, сколько же бактерий обитает вокруг нас. Они есть везде, начиная с рук и заканчивая любыми предметами, которые используются человеком систематически. Чтобы больше узнать об этих организмах, можно воспользоваться методом, который позволит увидеть весь мир бактерий, буквально во всех его красках.
Для того чтобы выращивание в чашке Петри прошло правильно, в ней должна быть создана благоприятная среда. Поэтому заранее нужно подготовить все необходимое:

- Бульон (мясо – 50 г, вода – 0,5 л, агар – 1 пакетик (растительный порошок, который делается из водорослей))
- Чашка Петри – от 5 до 10 штук
- Термометр
- Холодильник
- Ватные палочки
- Маска и перчатки
- Раствор хлора
Создание всех необходимых условий
Заселение бактерий
Утилизация материалов
По окончанию эксперимента, необходимо правильно избавиться от выращенных микроорганизмов:
- Для своей защиты нужно надеть перчатки и, по возможности, маску;
- Чашки Петри залить раствором хлора и не трогать несколько минут;
- Вылить содержимое, промытьчашкиисложивихвполиэтиленовыйпакет, выкинуть в мусорное ведро.
Никогда нельзя забывать, что самостоятельно выращивать микроорганизмы нужно крайне осторожно. Ни в коем случае, нельзя задействовать какие-либо биологические жидкости, такие как слюна и тому подобные. Так как это может вызвать серьезные последствия для здоровья.
3) при выделении чистой культуры микробов в целях всестороннего изучения их свойств и определения видовой принадлежности и т.д.
Основным методом бактериологического исследования является посев анализируемого материала на питательные среды.
Посевом в микробиологической практике называется внесение в стерильную питательную среду какого-либо исследуемого материала для обнаружения в нем микроорганизмов.
Пересев - это перенос выращенных микроорганизмов в свежую стерильную питательную среду. При выполнении этих приемов требуется перенести тот или иной материал в питательную среду так, чтобы в нее из воздуха не попали посторонние микроорганизмы.
При посевах и пересевах с одной питательной среды на другую пользуются платиновой проволокой в виде петли или иглы, так как они допускают быструю стерилизацию на огне без повреждения металла. Платиновая проволочка накаливается очень быстро и так же быстро остывает. Над пламенем горелки иглу или петлю следует держать вертикально, чтобы проволока на всем протяжении была одновременно накалена докрасна. Затем слегка обжигают прилегающий к проволоке отрезок стеклянной или металлической палочки, в которую впаяна или заделана проволочка. Нужно строго следить за тем, чтобы до внесения в огонь стеклянная палочка была совершенно сухая, в противном случае стекло треснет и петля (или игла) из него выпадет. После нагревания до красного каления платиновая проволочка будет простерилизована. Лишь после такой стерилизации петлю или иглу можно вносить в пробирку с бактериальной культурой. Но прежде чем захватить ею бактериальную культуру, петелькой или концом иглы касаются части среды, свободной от микробного налета (если имеют дело с твердой средой), или внутренней стенки пробирки с жидкой средой. Это делается для того, чтобы удостовериться, что прокаленная петля достаточно остыла. Если проволочка имеет еще высокую температуру, то среда на данном участке расплавляется или кипит. Этим создается гарантия, что бактерии, снятые проволочкой, будут вполне жизнеспособны.
Посев на жидкую питательную среду (бульон)
Посев на жидкую питательную среду производится с помощью петли и стерильных трубок и пипеток.
Посев петлей (иглой). Прокаленной петлей или иглой, которую держат в руке между указательным, средним и большим пальцами (подобно карандашу или ручке), захватывают небольшое количество налета с поверхности сырья или каплю посевного материала из исследуемой жидкости, слегка погрузив в нее петлю. В левой руке держат пробирку (или колбочку) с питательной средой. На пламени горелки обжигают верхнюю часть пробирки (колбы) непосредственно у пробки. При этом сосуд со средой слегка наклоняют, но так, чтобы жидкость не выливалась и не смачивала пробки и краев посуды. Мизинцем и безымянным пальцем правой руки вынимают пробку из пробирки и зажимают ее до конца посева между этими пальцами и ладонью так, чтобы входящая в пробирку часть пробки не прикасалась к руке. Все манипуляции производят над пламенем горелки. В открытую и наклоненную пробирку вводят петлю с посевным материалом, слегка погружая петельку в среду и размазывая внесенный материал по стенке пробирки, осторожно размешивают петлей питательную среду. Закончив посев, не изменяя наклонного положения пробирки, закрывают ее ватной пробкой, обжигая в пламени горелки конец пробирки и ту часть ватной пробки, которая входит в пробирку. Лишь после этого возвращают пробирку в вертикальное положение. По окончании посева петлю немедленно стерилизуют в пламени горелки.
Техника посева петлей бактериологического материала из одной пробирки в другую почти аналогична. Обе пробирки - с культурой и стерильной питательной средой - держат в наклонном положении между большим и остальными пальцами левой руки (рис. 56, положение а). При этом пробирку с культурой микробов следует держать ближе к себе. Вся работа, как и в первом случае, выполняется под защитой пламени горелки, а наклонное положение пробирок предохраняет питательную среду от оседания в нее микроорганизмов из воздуха.
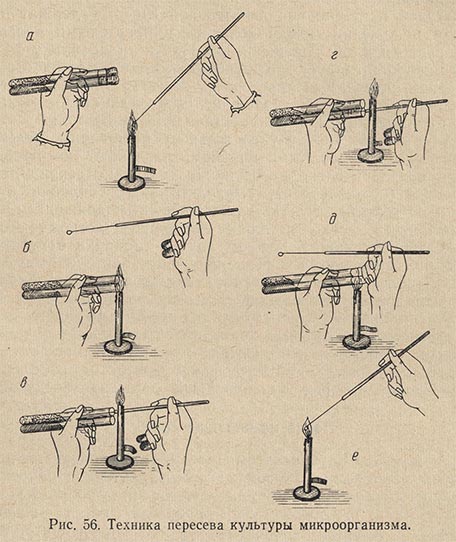
Петлю держат между указательным и большим пальцами правой руки, а свободными пальцами извлекают из пробирок пробки, предварительно внеся их на несколько секунд в пламя горелки (положение б). Извлекать ватные пробки нужно плавно, не рывком, а легким винтообразным движением.
Прокалив на огне петлю и подвергнув легкому обжигу верхние концы пробирок, вводят внутрь пробирки с культурой петлю, забирают петлей ничтожную часть бактериального материала (положение в) и переносят его во вторую пробирку со стерильной средой (положение г). Когда посев закончен, края пробирок и нижние концы ватных пробок проводят сквозь пламя горелки и легким движением закрывают пробирки пробками (положение д). Петля стерилизуется и откладывается (положение е). Работать нужно быстро, но избегая резких движений, вызывающих усиленное движение воздуха.
Посев на плотную среду
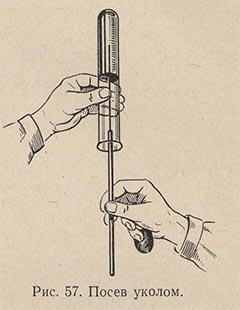
Посев уколом делают в желатиновые среды с целью выявления протеолитической способности микробов. Засеянные пробирки выдерживают 2-3 дня при температуре 22-23 °С, наблюдая за быстротой и формой разжижения столбика желатиновой среды. У различных видов микробов форма разжижения желатины различна: послойная, в форме гвоздя, чулка и пр. Затем пробирки опускают в холодную воду. Если среда в пробирке с микроорганизмом остается жидкой, а среда в контрольной пробирке застынет, это значит, что микроб обладает протеолитической способностью.
Можно установить протеолитическую способность микроба, фиксируя также образующиеся при распаде белка продукты - сероводород, аммиак, индол, являющиеся показателями протекающего процесса гниения. Наличие этих продуктов определяют с помощью цветных реакций. Сероводород дает почернение полоски фильтровальной бумаги, смоченной раствором основного уксуснокислого свинца, благодаря превращению H2S в PbS. Появление серебристой побежалости (оттенка) свидетельствует об образовании при гниении тиоспиртов и меркаптанов.
Раствор основного уксуснокислого свинца готовят приливанием к 10%-ной взвеси РЬ(СН3СОО)2 10%-ного раствора едкого натра до растворения осадка. Полоски фильтровальной бумаги пропитывают этим раствором, высушивают при комнатной температуре и хранят в склянке с притертой пробкой. При проведении опыта подготовленную полоску фильтровальной бумаги смачивают стерильной дистиллированной водой и помещают в пробирку с изучаемой культурой между ватной пробкой и стенками пробирки. Полоска бумаги должна свободно свешиваться внутрь пробирки, а не касаться ни ее стенок, ни среды. Пробку сверху плотно закрывают целлофановым колпачком (можно надеть резиновую соску), что предотвращает улетучивание выделяющихся при гниении газов.
Для выявления в продуктах гниения аммиака в пробирку с культурой микроорганизма аналогично помещают влажную красную лакмусовую бумажку, синеющую от присутствия NH3.
Индолообразование выявляется добавлением к 5 мл бульонной культуры микроба 5 мл специфического раствора Эрлиха и 2,5 мл насыщенного раствора пиросульфита калия (K2S2O7). При наличии индола появляется интенсивное красное окрашивание. Реактив Эрлиха приготовляют растворяя 4 г парадиметиламидобензальдегида в 30 мл 96%-ного спирта-ректификата, приливая затем сюда же 80 мл концентрированной соляной кислоты.
Посев уколом в высокий столбик сахарного агара дает возможность выявить у микроорганизмов степень анаэробности. Аэробы растут только в верхней части укола; анаэробы, наоборот, - только в нижней; факультативные анаэробы - по всему уколу. Укол должен проходить по возможности посредине столбика среды в пробирке на равном расстоянии от краев и доходить почти до дна. Внесение материала в толщу питательной среды можно также производить после предварительного ее расплавления и вносить материал в остуженную до 45 °С, но еще жидкую среду, а затем дать ей остыть.
Техника посева в чашки Петри
Питательный агар в колбах, флаконах, пробирках расплавляют в кипящей водяной бане. Сосуд со средой следует погружать в баню так, чтобы уровни среды и воды совпадали или уровень среды был чуть ниже уровня воды в бане. Затем среде дают несколько остыть - до 50-60 °С и разливают ее в стерильные чашки Петри, установив их на горизонтальной поверхности. Техника розлива среды в чашки Петри следующая (рис. 58). Над пламенем горелки, слегка наклоняя сосуд, содержащий расплавленный агар, вынимают пробку и края сосуда обжигают. Левой рукой приподнимают с одной стороны крышку чашки и, вводя в образовавшийся просвет открытый конец сосуда со средой, выливают среду в чашку. Совсем открывать чашку Петри нельзя. Ее лишь слегка приоткрывают с одной стороны. Это предохраняет среду от оседания в нее микробов из воздуха.
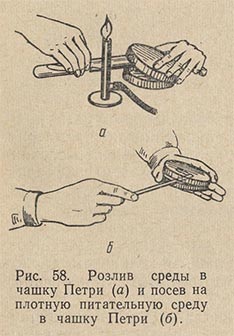
Опустив крышку и наклоняя чашку в разные стороны, распределяют налитый в нее агар ровным слоем по всему дну. Когда агар застынет, чашки ставят в термостат вверх дном для подсушивания и удаления конденсационной воды. Посев на агаровые среды в чашки Петри производится штрихом при помощи платиновой петли или стеклянным шпателем.
При посеве штрихом платиновой петлей забирают небольшое количество материала и легко проводят по поверхности агара, нанося ряд линий. При этом один край крышки чашки Петри следует лишь осторожно приподнять левой рукой, не дотрагиваясь пальцами до нижнего ранта. Закрыв первую чашку Петри той же петлей, не набирая материала, наносят штрихи на поверхность агара во второй, затем в третьей чашке с соблюдением тех же предосторожностей, предупреждающих попадание микробов из воздуха на поверхность среды.
После посева чашки ставят в термостат вверх дном на 24 ч и по истечении указанного срока рассматривают выросшие колонии микроорганизмов. В первой чашке, куда попало много материала, может получиться сплошной рост, во второй и третьей чашках вырастут единичные изолированные колонии. Каждая колония представляет собой обособленное скопление однородных микробов.
При посеве на твердую среду можно пользоваться и одной чашкой Петри, разделив ее на несколько секторов. Для этого на стекле с нижней стороны дна чашки наносят линии карандашом для стекла. Каждый отдельный сектор в данном случае будет заменять соответствующую чашку Петри.
При посеве шпателем на поверхность агаровой среды наносят платиновой петлей одну небольшую каплю исследуемого материала. Затем прокаленным и остуженным шпателем растирают эту каплю по всей поверхности среды, совершая легкие зигзагообразные движения во все стороны. Этим же шпателем засевают вторую и третью чашки.
Посев жидких материалов на твердую среду в чашки Петри пипеткой. Определенный объем исследуемой жидкости (обычно 1 или 0,1 мл) вносят в стерильную чашку. Затем в эту же чашку вливают расплавленный и остуженный до температуры 45 °С мясопептонный агар и плавными движениями чашки на горизонтальной плоскости тщательно перемешивают среду с исследуемой жидкостью. После застывания агара чашку Петри, как обычно, перевертывают вверх дном и ставят в термостат. Выращивание микробов производят 24-48 ч при температуре, оптимальной для изучаемого вида микроорганизмов, чистую культуру которых выделяют.
Каждая микробная клетка, а также спора, попавшая в питательную среду из посевного материала, при застывании среды оказывается закрепленной на одном месте, начинает развиваться и дает колонию. Чем меньше колоний выросло на чашке и чем изолированнее одна от другой эти колонии, тем успешнее можно выделить чистую культуру микроба. Поэтому при посевах желательно брать посевной материал, содержащий как можно меньше микроорганизмов. С этой целью производят разбавление (разведение) материала.
Для разведения исследуемых материалов необходимо иметь достаточное количество стерильных пипеток емкостью 1 мл и стерильную воду в пробирках по 9 мл.
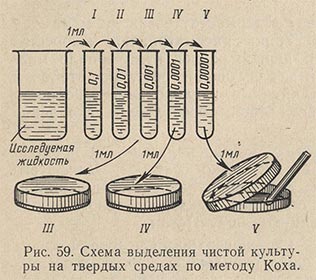
Техника разведения следующая (рис. 59). После тщательного перемешивания исследуемой пробы стерильной пипеткой отбирают 1 мл материала и вносят в пробирку с 9 мл стерильной воды. Работу проводят над пламенем горелки с соблюдением правил стерильности. Получают первое разведение в 10 раз. Осторожно перемешивают содержимое пробирки. Перемешивание можно произвести повторным всасыванием жидкости в пипетку и выпусканием ее обратно в пробирку. Из пробирки с первым разведением второй стерильной пипеткой переносят 1 мл в следующую пробирку, содержащую 9 мл стерильной воды. Получают второе разведение (в 100 раз). Эту операцию при необходимости производят и дальше, получая третье, четвертое, пятое разведения. Производить разведение более чем в 100 000 раз (пятое разведение) не рекомендуется, так как при слишком больших разведениях изучаемые микробы могут не попасть в отбираемую пробу, особенно в том случае, если количество их составляло относительно небольшой процент по отношению ко всей микрофлоре субстрата.
Выделение чистых культур аэробных микроорганизмов
Из каждого разведения 1 мл жидкости высевают в стерильную чашку Петри, заливая 10-15 мл расплавленного и охлажденного до 45 °С мясопептонного агара. Посев выращивают в термостате при температуре, оптимальной для изучаемых микроорганизмов, в течение 24-48 ч. Просматривая чашки Петри после выращивания, отбирают ту чашку, в которой выросшие колонии оказываются наиболее изолированными.
Однородность по внешнему виду выросших на чашке колоний свидетельствует о том, что посевной материал содержал микроорганизмы одного вида. Если же колонии оказываются неоднородными, то, следовательно, в посевном материале находилась смесь разнообразных микробов. Все выросшие колонии в этом случае нужно разбить на группы по однородности и изучать каждую группу однородных колоний в отдельности.
Из однородных колоний в чашке Петри выбирают одну изолированную колонию, из нее делают мазок и устанавливают чистоту культуры. Об этом будет свидетельствовать морфологическая однородность микробных клеток, наблюдаемых в поле зрения микроскопа. Оставшуюся часть колонии прокаленной и остуженной петлей с соблюдением правил стерильности пересевают (отвивают) на поверхность скошенного агара. Выросшая на косом агаре культура также должна давать однородный рост и при микроскопировании однородные клетки. В противном случае пересевы колоний с чашек Петри повторяют до тех пор, пока не убедятся в чистоте выделенной культуры.
Выделение чистых культур анаэробных микроорганизмов
Одним из основных условий при культивировании анаэробных микробов является удаление из питательной среды молекулярного кислорода, оказывающего токсическое действие на анаэробные культуры. Вторым обязательным условием, обеспечивающим выделение анаэробов из исследуемого субстрата, является внесение большого количества посевного материала в питательную среду.
Изолированные колонии анаэробных микробов можно получить в глубине плотной питательной среды - в трубках Вейона. Средой накопления для анаэробов является среда Китта-Тароцци. Уже указывалось, что для создания анаэробных условий при приготовлении среды Китта-Тароцци на дно пробирок помещают кусочки печени. Можно использовать и круто сваренный белок куриного яйца.
Анаэробные микроорганизмы являются спорообразующими, поэтому при исследовании материалов, где предполагается наличие вегетативных форм, необходимо засеянные пробирки прогреть в водяной бане при 80 °С в течение 30 мин.
Посевы выдерживают в термостате при 37 °С в течение 5 суток. При наличии роста отмечают наступившее в среде Китта-Тароцци изменение: помутнение или помутнение и газообразование; из проросших пробирок делают мазки и окрашивают по Граму. Материал для мазков берут пастеровской пипеткой, которую опускают до дна пробирки.
Высев из среды Китта-Тароцци можно производить и в чашки Петри, применяя метод последовательного разведения. В этом случае посевы необходимо выдерживать в анаэростатах или эксикаторах, на дно которых помещаются кислородпоглощающие вещества (смесь гидросульфита натрия с двууглекислой содой или щелочной раствор пирогаллола).
Развитие управляющих функций мозга ребёнка: полезные советы и упражнения для педагогов
Сертификат и скидка на обучение каждому участнику
Научно-практическая конференция
старшеклассников
"Науке - старт молодых"
Руководитель: Мосияченко А.Д. учитель биологии
Глава 1. Теоретическая часть ………………………………………………….5
1.1История открытия бактерий………………………………………………..5
1.2Строение и жизнедеятельность бактерий…………………………………5
Глава 2. Практическая часть …………………………………………………..7
2.1Посев бактерий в МАОУ СОШ №5 Кувандыкского городского округа Оренбургской области……………………………………………………………7
2.2Результаты эксперимента…………………………..……………………. 9
2.3 Методы борьбы с бактериями……………………………………………10
Бактерии - неотъемлемая часть в жизни человека. Мы сталкиваемся с ними повсеместно: дома, на улице, на работе, в школе, в магазинах и во многих других местах. Они постоянно находятся на нашем теле и в нашем организме. Где-то их больше, а где-то меньше. И хоть большая их часть безобидна и даже полезна, то другая, меньшая составляющая, является возбудителями многих опасных заболеваний.
Актуальность работы: У детей иммунная система слабее, чем у взрослых и шансов заболеть у них намного больше, чем у взрослого человека. А школа является не только источником большого количества людей, но и огромным домом для множества бактериальных клеток. Каждый день дети ходят в школу и каждый день они вдыхают огромное количество воздуха, в котором находятся бактерии. Во всех больших заведениях часто проводятся уборки, и шанс заболеть у людей уменьшается. Что бы узнать, достаточно ли тех манипуляций по очищению школьного помещения, и каков шанс заразиться у детей, проводится этот опыт.
Объект исследования: бактерии.
Предмет исследования: выращивание бактерий в школьной среде.
Цель: выяснить, много ли опасных бактерий окружает учащихся в школе.
а) узнать о строении и жизнедеятельности бактерий;
б) определить методы борьбы с бактериями в школе;
г) сделать выводы по работе.
Гипотеза: Много ли бактерий обитает в школе и насколько опасными они могут быть?
Практическая значимость работы заключается в том, что у учащихся воспитывается бережное отношение к своему здоровью, появляется заинтересованность в соблюдении личных санитарно – гигиенических требований.
Методы исследования:
Эксперимент. Этот метод исследования используем во время посева бактерий.
Чтобы узнать с какой скоростью растут колонии, используем метод наблюдения.
В конце нашего наблюдения, описываем и анализируем полученный результат.
Глава 1. Теоретическая часть
История открытия бактерий
Строение и жизнедеятельность бактерий
Бактерии – это прокариотические живые организмы. Их размеры колеблются от 1 до 15 мкм. Само же название прокариот говорит о том, что в клетке нет оформленного ядра и наследственная информация представлена в виде кольцевой ДНК (бактериальной хромосомой), которая находится в специальной зоне клетки, носящей название нуклеоид. Кроме основной кольцевой ДНК бактерии обычно содержат несколько мелких молекул ДНК называемых плазмидами. В бактериальных клетках отсутствуют мембранные органоиды, которые характерны для эукариотических клеток. Функции эндоплазматической сети, аппарата Гольджи, лизосом, пластид, митохондрий выполняют впячивания клеточной мембраны. Обязательными органоидами являются рибосомы, которые обеспечивают синтез белка. Рибосомы бактерий намного меньше рибосом эукариотов. Все органоиды находятся в цитоплазме. А цитоплазма окружена мембраной, кнаружи от которой находится клеточная стенка. Если условия не удовлетворяют условию жизни бактерии, то она начинает выделять слизь, образуя капсулу. Таким образом, клетки сохраняют жизнеспособность на очень длительное время. Бактерии размножаются простым делением надвое.
По форме бактерии делятся на четыре основных типа:
Палочковидные – бациллы . Среди них есть одиночные (кишечная палочка) и собранные в цепь (возбудитель сибирской язвы) бактерии.
Сферические – кокки . Парные кокки называются диплококками (возбудитель пневмонии). Цепочки клеток – стрептококки (возбудители ангины, скарлатины). Группы клеток – стафилококки (вызывают пищевые отравления)
Спиралевидные – спириллы .
Имеющие форму запятой – вибрионы (возбудитель холеры)
По типу питания бактерии делятся на два типа:
Автотрофные бактерии способны сами синтезировать органические вещества из неорганических в результате фотосинтеза и хемосинтеза. По этому типу питания бактерии делятся на фототрофы, хемотрофы, нитрифицирующие и серобактерии.
Гетеротрофные бактерии не способны сами себе создавать органические вещества, поэтому питаются только готовыми.
Обитают бактерии в почве, воде и организме. Но так же они часто встречаются в воздухе.
Бактерии – это живые организмы способные выжить почти при любых условиях, и встречаются они везде.
Глава 2. Практическая часть
2.1 Посев бактерий в школьной среде
Как и говорилось ранее, бактерии обитают везде, в частности и в школе. Некоторые из них могут быть опасными, а некоторые безобидными.
Взяли пробы с разных этажей и с рук. Каждую чашку Петри пометили числом, когда делали посев и откуда брали этот посев. Убрали в теплое место. В результате посева получилось 6 чашек Петри:
Чашка № 1 – этаж №3, кабинет №15
Чашка № 2 – этаж №3, коридор
Чашка № 3 – этаж №2, коридор
Чашка № 5 – грязные руки
Чашка № 6 – чистые руки
После посева бактерий, стали наблюдать за содержимым в чашках Петри, изменения отмечали в таблице (табл.1).
Образовались две колонии размером 5 мм и 2 мм.
Проявляется рост бактерий. В чашке под №2 колонии не изменились в размерах. Под №4 образовалась колония размерами 7 на 4 мм. Под №5 две колонии размерами 7 и 7 мм.
В пробирке №1 рассыпаны колонии белых бактерий по 1 мм. Во второй белые колонии по 1 мм и одна колония 2 мм, другие две прозрачные 7 и 3 мм. Под №3 золотистая колония 2 мм, молочного цвета 2 см и разбросанные меньше 1 мм. В чешке Петри под №4 разбросаны пятна меньше 1 мм и две прозрачные колонии 1мм и 8 мм. Пробирка под №5 имеет две колонии золотистого цвета, прозрачные колонии 28 мм и 16 мм, и разбросанные белые колонии по 1 мм. В чешке №6 наблюдается прозрачная колония размером 3 мм.
Во второй чашке появляется черная плесень мукор размером 3 мм, две колонии белые 7 и 4 мм и белые, разбросанные по 1 мм. В третьей чашке одна золотая колония 3 на 1 мм, вторая колония белого цвета 3 мм и белые, разбросанные так же по 1 мм. В чашечке №4 разбросаны белые колонии по 1 - 2 мм и белая колония 8 мм. В пробирке №5 прозрачные колонии 16 и 30 мм, золотистая колония 3 мм и белые разбросанные. В чашке Петри №6 колония выросла и стала составлять 5 мм.
Была проведена пересадка колоний и осмотр бактерий под микроскопом. Для дальнейшего исследования взяли колонии золотых, бежевых и розовых бактерий, а так же мукор. Всех их разместили по разным чашкам Петри в питательную среду агар-агар с мясным бульоном.
Мукор достиг размеров 25 на 10 мм. Золотая колония 20 на 15 мм. Бежевая - 13 на 5 мм. Розовая колония 7 на 5 мм.
Мукор сильно увеличился в размерах и стал составлять 47 на 25 мм. Золотая колония 20 на 15 мм. Бежевая - 14 на 7 мм и розовая колония 8 на 6 мм.
По данным из таблицы видно, что вырастить бактерии в школьных условиях возможно и что скорость роста колоний зависит от питательной среды, чем больше в ней углеводов и белков, тем лучше рост.
2.2 Результаты эксперимента
В результате посева бактерий в школе, выяснилось что:
В школах довольно много бактерий. Больше всего их находится на немытых руках детей, а меньше на чистых. Это еще раз подтверждает то, что нужно мыть руки перед каждым приемом пищи.
Скорость роста колоний зависит от среды, в которой они живут. Так в среде агар-агара с мясным бульоном они росли намного быстрее, нежели просто в агар-агаре.
В школе встречается плесень, которая может сильно навредить не только здоровью учащихся, но и здоровью взрослых.
В школах могут находиться болезнетворные бактерии. Окрашивать их по Граму не удалось, и рассмотреть под микроскопом тоже. Поэтому отталкиваясь по внешнему цвету бактерий, выяснилось, что бежевого и золотистого цвета в основном кокки и опасным из них является стафилококк. Другого цвета бактерии опасности никакой не представляют.
2.3 Методы борьбы с бактериями
Существуют следующие методы борьбы с бактериями:
Пастеризация (способ консервирования молока и других продуктов путем однократного нагревания до 60-70 градусов в течении 15-30 минут);
Стерилизация (при воздействии пара с температурой более 100 градусов в течение 20 минут или с помощью огня);
Охлаждение (оно не вызывает гибель, но приостанавливает жизнедеятельность бактерии);
Консервирование (воздействие солей);
Дезинфекция для уничтожения болезнетворных бактерий.
Бактерии населяют все среды жизни. Это мельчайшие просто устроенные организмы, которые трудно увидеть в световой микроскоп. Многие из них являются опасными и представляют угрозу для других живых существ. Но так же, многие из них не представляют опасности для других.
В школьной среде при посеве бактерий, встретилось несколько колоний разного цвета – оранжевого, желтого, золотистого, бесцветного, бежевого и белого. Кроме бактерий, обнаружили споры плесневых грибов – Мукора и Пеницилла.
В результате работы с материалом о строении бактерий, встретилась информация, что бактерии в колонии образуют капсулу из вязкого, студенистого вещества. При посеве бактерий эта капсула была обнаружена.
Школа предоставляет угрозу заражения учеников микроорганизмами, но бояться этого сильно не стоит. Чтобы избежать таких последствий детям стоит соблюдать простые правила гигиены и при необходимости носить маски.
Список литературы
Мурадова Е.О.: Микробиология. – М.: Эксмо, 2007. – 336с.
Приложение 1
Строение бактерий

Приложение 2
Основные требования к проведению экспериментальных работ с микроорганизмами
При выполнении экспериментов по биологии учащиеся работают с различным биологическим материалом, культурами микроорганизмов или изучают свой организм. Изучают строение живых организмов и основную структурную единицу живых организмов – клетку. Клетки очень малы и невооруженным глазом их сложно увидеть. Для изучения таких объектов, готовят препараты, которые рассматривают под лупой или микроскопом.
Микроорганизмы, к которым относятся мельчайшие существа называемые микробами, невооруженным глазом тоже нельзя увидеть. Кроме как приготовить микропрепарат соответствующим образом. Поэтому, для выполнения таких работ существуют определенные места, которые должны отвечать определенным требованиям. У всех учащихся, кто проводит эксперимент, должны находиться необходимые для его проведения оборудования. Основным оборудованием является – спиртовка, штатив для пробирок, кювета для окрашивания препаратов, фильтровальная бумага, дезинфицирующий раствор, препаровальная игла, скальпель, мерный стакан и другое что может пригодиться на данной работе.
Если учащиеся работают с микроорганизмами, обеспечивается стерильность работы, которая исключает попадание посторонних микроорганизмов извне, или из работы в окружающую среду. Так как большинство микроорганизмов являются патогенными, есть возможность заражения каким - либо заболеванием. Чтобы такого не произошло, существуют правила, которые необходимо соблюдать.
Правила работы с микроорганизмами:
Работать с микроорганизмами необходимо в специальной одежде – халате;
Халат не одевается за пределы кабинета, в котором проводится работа;
В этом кабинете запрещается принимать пищу или хранить ее;
Из кабинета не выносится посуда и материалы, использующиеся в работе;
На рабочий стол нельзя ставить сумки или другие вещи;
Если из пробирки или чашки Петри микроорганизмы попадают в окружающую среду, необходимо сообщить учителю и провести обеззараживание, а затем провести уборку;
Во время работы необходимо соблюдать тишину, не размахивать руками;
Перед началом работы и после работы проводится уборка помещения;
Перед началом работы каждый учащийся проверяет наличие нужного оборудования и исправность микроскопа;
На занятиях данные фиксировать необходимо в лабораторной тетради, в которой обязательно прописывается цель работы, делается основная работа, если необходимо сделать рисунок, рисунок берется не из книг или наглядных материалов, а из микроскопа, в последнюю очередь записывается вывод по работе;
В конце урока тетрадь сдается учителю на проверку;
В конце занятий каждый ученик приводит свое рабочее место в порядок, микроскоп протирается и убирается на место, тщательно вымываются руки с мылом, снимается халат.
Читайте также:

