Формальдегид не используется для протравливания семян
Добавил пользователь Владимир З. Обновлено: 19.09.2024
Характеристика и классификация альдегидов. Правила проведения дезинфекции помещения формальдегидом. Особенности глутарового альдегида, его предназначение и применение. Режимы профилактической и вынужденной дезинфекции помещений объёмными аэрозолями.
| Рубрика | Сельское, лесное хозяйство и землепользование |
| Вид | лабораторная работа |
| Язык | русский |
| Дата добавления | 12.09.2017 |
| Размер файла | 19,0 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Дезинфицирующие средства, применяемые в ветеринарной санитарии. Альдегиды
1. Характеристика и классификация альдегидов
4. Глутаровый альдегид
1. Характеристика и классификация альдегидов
Альдегимды (от лат. alcohol dehydrogenatus -- спирт, лишённый водорода) -- класс органических соединений, содержащих альдегидную группу (-CHO)Альдегиды классифицируются следующим образом:
В зависимости от насыщенности углеводородного заместителя они делятся на:
· предельные (насыщенные) альдегиды (ацетальдегид);
· непредельные (ненасыщенные) альдегиды (акролеин);
· ароматические альдегиды (бензальдегид).
По числу карбонильных групп подразделяются на:
· альдегиды с одной карбонильной группой (формальдегид);
Альдегидсодержащие средства - группа препаратов, действующим началом которых является глутаровый или янтарный альдегид. Нас интересуют формальдегид, формалин и глутаровый альдегид т.к. они обладают антисептическим действием.
альдегид дезинфекция помещение аэрозоль
Формалин - 40 % водный раствор формальдегида. Обладает бактерицидным, спороцидным и фунгицидным действием. С повышением температуры повышается эффект обеззараживания.(30-60 оС). Применяется для дезинфекции на предприятиях пивоваренной, безалкогольной и дрожжевой промышленности в 1,5-5 % концентрации.
Перед проведением дезинфекции формальдегидом помещения подготавливаются. Они должны быть герметичными. Заделывают все отверстия на стенах, потолках, окнах и дверях, вентиляционную систему отключают, вытяжные и приточные трубы закрывают.
4. Глутаровый альдегид
Глутаровый альдегид - сложное органическое вещество, обладающее стерилизующими и дезинфицирующими свойствами. Глутаровый альдегид относится к группе альдегидов (от лат. alcohol dehydrogenatum -- спирт, лишённый Гидрогена) и содержит действующего вещества не менее 25 %. В условиях щелочного катализа глутаровый альдегид способен полимеризоваться по механизму альдольной конденсации с образованием полиглутарового альдегида. Глутаровый альдегид смешивается с водой, спиртами, хлороформом, толуолом и бензолом. Глутаровый альдегид стабилен при температуре эксплуатации. Условия, которых следует избегать: активный ингредиент разлагается при повышенных температурах; избегать контакта с аминами, аммиаком, сильными кислотами и основаниями, с алюминием, углеродистой и мягкой сталью, медью и железом. Глутаровый альдегид представляет собой прозрачную бесцветную жидкость с резким фруктовым запахом, содержащую 50-51 % активного вещества.
Формальдегид применяют для дезинфекции закрытых помещений. Для этого в металлическую или форфоровую посуду наливают 45 весовых частей (40%-ного формальдегида) и 22 части воды, а затем добавляют 30 частей калия перманганата. Персонал покидает помещение и закрывает его. При взаимодействии формалина с калия перманганатом возникает реакция, сопровождающаяся высокой температурой, в результате чего формалин быстро закипает и испаряется. Для дезинфекции берут 40-50 мл формалина на 1 м3 помещения при температуре 25-30 °С и экспозиции 5-6 ч. После этого помещение тщательно проветривают. В пароформалиновых камерах дезинфицируют твердую тару (клетки, ящики) и спецодежду (брезент, мешковину, халаты, комбинезоны, фартуки). В камере создают необходимую относительную влажность (65-70%) и температуру 60 °С, расход формалина 40-50 мл на 1 м3 при экспозиции 1 ч. По окончании дезинфекции для нейтрализации формалина в камеру вводят половинное от формалина количество раствора аммиака (нашатырного спирта) и через 5 мин содержимое камеры выгружают. Для дезинфекции помещений может быть использован в аэрозольном состоянии формалин из расчета 20 мл (40%-ный) на 1 м3 при экспозиции 5-6 ч. Для одновременной дезинфекции и дезинсекции берут формалин с добавлением 5% хлорофоса. Для дезбарьеров и дезматов применяют щелочной раствор формальдегида, содержащий 3% формальдегида и 3% едкого натра. Для обеззараживания автотранспорта или другой техники в очагах ящура применяется 2%-ный раствор формальдегида или аэрозоли формальдегида из расчета 60 мл 40%-ного раствора формальдегида на 1 м3 помещения при экспозиции 30 мин. В качестве противобродильного средства формалин применяют при тимпа-нии преджелудков, вздутии желудка в форме 1-2%-ного водного раствора. Формалин применяют для консервирования патолого-анатомического материала, вакцин и некоторых сывороток. Для дезинфекции помещений кроликоферм используют 1%-ный раствор формальдегида, а также аэрозоли из 36-40%-ного раствора формальдегида из расчета 10 мл на 1 м3 помещения при экспозиции 6 ч, после чего помещение проветривают и нейтрализуют избыток формальдегида раствором аммиака.
| 12+ Свидетельство СМИ ЭЛ № ФС 77 - 70917 Лицензия на образовательную деятельность №0001058 | Пользовательское соглашение Контактная и правовая информация |
Бесплатные всероссийские конкурсы

Нужна помощь? Инструкции для новых участников
Сложность вопроса:

64%
Раствор этого вещества вызывает свертывание белка, поэтому без него не получить анатомических препаратов. Этим веществом протравливают семена. Без него не получить пластмассу. Это вещество:
Цели урока: Рассмотреть гомологические ряды, виды изомерии и номенклатуру альдегидов и кетонов. Разобрать строение карбоксильной группы и на этой основе подчеркнуть особенное для альдегидов в сравнении с кетонами. Познакомить учащихся с физическими свойствами представителей этих классов соединений и их значением в живой природе и повседневной жизни человека. На основании строения альдегидов и кетонов спрогнозировать их химические свойства, которые затем рассмотреть в сравнении для обоих классов этих соединений.
Оборудование и реактивы: демонстрационные образцы: глюкоза, ванилин, формалин, ацетон, чистящее или моющее средство (порошок или жидкость) с лимонным запахом; плакат с формулами ванилина, цитраля, феромонов, ацетон, растворы аммиака, нитрата серебра, сульфата меди (II), гидроксида натрия, спиртовка, пробирки. Мультимедиа проектор, компьбтер или ноутбук, экран. На уроке используется презентация. Приложение 1
Ход урока
I. Организационный момент. Проверка домашнего задания
а) замещения атома водорода в гидроксильной группе
б) замещения атомов водорода в бензольном кольце
в) присоединения
- Какие качественные реакции на фенол вам известны?
- Назовите основные области применения фенола.
II. Изучение нового материала.
1. Вступительное слово учителя. Как уксусный альдегид двух химиков поссорил слайд 3
В конце XVIII в. химики интенсивно изучали свойства известных органических соединений. В 1782 г. К. Шееле, окисляя этиловый спирт оксидом марганца (IV) в серной кислоте, заметил, что помимо основного продукта — уксусной кислоты — образовалось еще какое-то резко пахнущее соединение, выделить которое не удалось. В последующие годы новый “кислородный эфир” упоминался в работах А. Фуркруа, Л. Воклена. В 1821 г. Иоганн Вольфганг Дёберейнер окислял этиловый спирт в присутствии платинового катализатора и получил некоторое количество смеси исходного спирта с продуктами его окисления. Многие химики, в том числе и Ю. Либих, сомневались, что в этой смеси содержится неизвестное вещество.
Дёберейнер отправил полученный им образец Ю. Либиху, из которого тот в 1835 г. выделил чистое вещество, содержащее на два атома водорода меньше, чем этанол. Ученый установил его состав (С2Н4О) и объявил, что получил новое вещество, названное Alkohol dehydrogenatus — безводородный алкоголь или сокращенно альдегид. В ответ на претензии И. В. Дёберейнера на приоритет открытия Ю. Либих в характерной ему едкой манере заметил, что тот имеет столько же оснований претендовать на открытие альдегида, сколько ньютоновское яблоко — на открытие закона всемирного тяготения.
Поскольку первый из известных альдегидов содержал два атома углерода, начались попытки получения первого представителя гомологического ряда. Они были неудачными вплоть до 1868 г., когда немецкий химик-органик Август Вильгельм Гофман, пропуская пары метилового спирта над раскаленной платиновой спиралью, получил газообразное вещество состава СН2О.
2. Строение альдегидов. Номенклатура и изомерия альдегидов и кетонов.
Альдегиды и кетоны относят к классу карбонильных соединений. Молекулы этих веществ содержат реакционно-способную поляризованную карбонильную группу:
Общая формула для альдегидов и кетонов – СnH2nO
“Отличительными” суффиксами в названиях альдегидов и кетонов служат соответственно -аль и -он.
Альдегидная группа может располагаться только на конце молекулы. Нумерация самой длинной цепи в альдегидах начинается с углерода альдегидной группы, а её положение (цифра 1) как само собой разумеющееся в названии не указывается.
В кетонах же карбонильная группа может находиться и в середине углеродной цепи, поэтому в названии после суффикса -он через дефис указывается её положение. Нумеруют самую длинную цепь в кетонах с того конца, к которому ближе карбонильная группа.
Если, помимо карбонильной группы, соединение содержит двойную или тройную связь, то цифру, показывающую её положение в цепи, удобно ставить до основы названия.
б) отработка навыков номенклатуры альдегидов и кетонов по слайду 5.
2 в) Занимательный материал и номенклатура альдегидов и кетонов. Слайд 6
Насекомые общаются между собой, выделяя ничтожные количества органических соединений, имеющих сравнительно небольшие молекулы. Такие вещества называются феромонами. Феромоны делят на половые, возбуждающие, успокаивающие, сбора, тревоги и другие. Чувствительность насекомых к феромонам просто поразительна: самец ночной бабочки большой павлиний глаз чувствует половой феромон самки на расстоянии до 10 км! Синтетические феромоны используются для борьбы с вредными насекомыми путем заманивания их в ловушки, дезориентации в период спаривания, отпугивания.
Муравьи для подачи сигнала тревоги выделяют два феромона. Формулы этих феромонов вы сейчас видите на экране. Дайте названия этим веществам.
3. Гомологический ряд альдегидов и кетонов.
Подведя итоги всему услышанному и увиденному рассмотрим гомологические ряды альдегидов и кетонов и ещё раз дадим названия рассмотренным веществам. Слайд 7
4. Физические свойства альдегидов и кетонов. Слайд 8
Характеризуя агрегатное состояние и растворимость в воде низших представителей гомологических рядов альдегидов и кетонов, учитель говорит о том, что карбонильная группа также может участвовать в образовании межмолекулярных водородных связей с молекулами воды, но прочность этих связей значительно меньше, чем для спиртов. Поэтому карбонильные соединения имеют меньшие температуры кипения и плавления, чем спирты с соответствующей молекулярной массой:
Отличительной чертой многих альдегидов и кетонов является их запах. Для низших представителей гомологических рядов он резкий и часто неприятный. Высшие альдегиды и кетоны, особенно непредельные или ароматические, входят в состав эфирных масел и содержатся во многих цветах, фруктах, плодах, душистых и пряных растениях. Получается, что мы сталкиваемся с альдегидами и кетонами практически ежедневно!
Демонстрация пищевого ванилина и какое-либо средства бытовой химии с лимонным запахом. Ванилин — это ароматический альдегид, получаемый синтетически, а запах лимона чистящему средству придает синтетический цитраль, по химической структуре являющийся диеновым альдегидом:
Обоняние в мире животных играет часто большую роль, чем зрение или слух. Например, муравьи по запаху могут определить не только форму предмета, но и его твердость. Для многих видов запах — это основная сигнальная система. Человек среди земных “нюхачей” занимает одно из последних мест. Мы часто в прямом и переносном смысле употребляем фразу “нюх как у собаки”. Она не лишена основания: собака улавливает запахи в концентрации, недоступной не только обонянию человека, но и современным приборам. Она, например, может уловить запах масляной кислоты, если в 1 см 3 воздуха содержится всего 9000 молекул этого вещества.
Рассчитайте пожалуйста, сколько это составляет по количеству вещества и чему равна масса кислоты.
5. Химические свойства альдегидов и кетонов.
Общие реакции для альдегидов и кетонов — реакции присоединения по карбонильной группе. При этом альдегиды вступают в вышеназванные реакции более активно, чем кетоны.
При гидрировании из альдегидов можно получить первичные спирты, а из кетонов — вторичные.
1. Гидрирование. Присоединение водорода по кратной связи С = О происходит при нагревании в присутствии катализаторов гидрирования (никель, платина, палладий):
В результате образуются спирты соответствующего строения. Это реакция, обратная получению карбонильных соединений из спиртов.
2. Присоединение циановодорода. Альдегиды и кетоны присоединяют по карбонильной группе полярную молекулу синильной кислоты (циановодород). Присоединение идет в соответствии с распределением электронной плотности в реагентах:
Образующийся продукт реакции относится к классу циан-гидринов (нитрил оксикислоты) и содержит на один атом углерода больше, чем исходный альдегид. Такая реакция применяется для наращивания углеродной цепи в органических молекулах.
Наряду с общими реакциями для альдегидов и кетонов есть и принципиальные отличия в их химическом поведении:
Присоединение гидросульфита натрия. Альдегиды в отличие от кетонов способны присоединять молекулу гидросульфита натрия. Эта важная реакция позволяет не только обнаружить альдегиды, но и выделить их из смеси с другими веществами. Образующиеся сульфопроизводные выпадают в осадок и очень легко разлагаются кислотами с образованием исходного альдегида:
Aльдегиды легко окисляются до соответствующих карбоновых кислот. Кетоны можно окислить лишь в жестких условиях (нагревание с азотной или хромовой кислотами). При этом образуется смесь низкомолекулярных карбоновых кислот и реакция сопровождается деструкцией углеродного скелета
1. Как уже говорилось, альдегиды в отличие от кетонов легко окисляются. Эти реакции используются как в целях органического синтеза, так и для качественного обнаружения альдегидов.
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АЛЬДЕГИДЫ слайд 11
Альдегидную группу в органических соединениях можно обнаружить с помощью таких реакций, как взаимодействие со свежеосажденным гидроксидом меди(II) при нагревании,
С аммиачным раствором оксида серебра
Эти реакции позволяют отличить альдегиды от кетонов.
При взаимодействии альдегида с гидроксидом меди (II) наблюдается образование кирпично-красного осадка оксида меди(I), а в реакции серебряного зеркала на стенках пробирки или колбы, в которой проводится эксперимент, образуется налет металлического серебра.
Впервые эта реакция была предложена немецким химиком Ю. Либихом.
2. Демонстрационный эксперимент. В результате окисления альдегидов образуется новый класс веществ, называемый карбоновыми кислотами. В качестве окислителя можно использовать и кислород воздуха, и неорганические соли (перманганат калия) и даже такие специфические слабые окислители, как аммиачный раствор оксида серебра или гидроксид меди (II).
1. Реакция “серебряного зеркала”
2. Реакция с гидроксидом меди (II).
3. Рассказ учащегося об учёном Ю. Либихе. слайд 12 приложение 2
5. Реакции конденсации. слайд 13
Изучением свойств альдегидов занимался выдающийся русский химик и композитор, автор знаменитой “Богатырской симфонии” и всемирно известной оперы “Князь Игорь” Александр Порфирьевич Бородин. В 1872 г. он обнаружил, что при действии металлического натрия на альдегиды образуются не только продукты их диспропорционирования (спирт и карбоновая кислота), но также вещества с удвоенной : по сравнению с альдегидом молекулярной массой. Детальное исследование необычного продукта привело ученого к выводу, что вещество содержит одновременно и альдегидную, и гидроксильную группы, т. е. является алъдегидоспиртом (альдолем).
По химическому строению альдоль представлял собой продукт присоединения одной молекулы альдегида к другой:
Открытая А. П. Бородиным реакция получила название альдольной конденсации. Она протекает в щелочной среде и широко используется в промышленности для получения синкретического каучука, смол, лаков и душистых веществ.
Рассказ учащегося о А.П. Бородине. слайд 14 приложение 3
6. Подведение итогов по рассмотренному материалу.
В начале работа по ОК, приложение 4, а затем совместная работа по слайду 15
7. Отдельные представители и их применение.
СИНТЕЗЫ НА ОСНОВЕ ФОРМАЛЬДЕГИДА
Характерные реакции для альдегидов и кетонов — присоединение по реакционно-способной карбонильной группе
Чем больше поляризована эта группа, тем легче идут реакции присоединения.
Для формальдегида такая тенденция проявляется особенно ярко, так как карбонильная группа в молекуле формальдегида поляризована в наибольшей степени по сравнению с другими членами гомологического ряда альдегидов.
Являясь альдегидом, формальдегид может восстанавливаться до соответствующего спирта (метилового) и окисляться до соответствующей кислоты (муравьиной).
В таблице представлены основные направления органических синтезов на основе формальдегида: получение полимерных материалов (карбамидные и фенолформальдегидные смолы); образование продуктов конденсации формальдегида (триоксан, параформ); синтез взрывчатых веществ (гексоген), лекарственных препаратов (уротропин), первичных спиртов.
Мы упоминули очень интересное соединение — уротропин. Впервые оно было..получено А. М. Бутлеровым в 50-х гг. XIX в. при действии на формальдегид аммиаком. Молекулярная формула вещества (СН2)6N4 определила его химическое название — гексаметилентетрамин. Структура вещества
При нагревании в присутствии кислот уротропин вновь разлагается на аммиак и формальдегид. Это его свойство позволяет использовать уротропин в медицине в качестве антисептического средства. В организме человека он медленно гидролизуется, выделяющийся формальдегид уничтожает болезнетворные микроорганизмы. На том же свойстве основано применение препарата кальцекс, представляющего собой комплекс уротропина с хлоридом кальция.
Большое количество формальдегида используется для производства фенолоформальдегидных смол. Их смешивают с различными наполнителями и изготавливают пластмассы, называемые фенопластами. При растворении фенолоформаль-дегидных смол в ацетоне или спирте получают лаки/
При взаимодействии формальдегида с карбамидом <мочевиной) (NН2)2СО получают карбамидную смолу, а из нее — амино-пласты. Из этой пластмассы изготавливают электротехнические изделия (выключатели, розетки), материалы для отделки мебели и интерьеров, древесностружечные плиты, искусственный мрамор, тепло- и звукоизоляционные пористые материалы.
Большое количество формальдегида используется в органическом синтезе для производства лекарственных веществ, красителей.
Широко применяется 40%-ный водный раствор формальдегида — формалин. Его использование связано со способностью свертывать белок. Так, например, в кожевенном производстве в результате дубильного действия формалина кожа твердеет и не подвергается гниению. На том же свойстве основано применение формалина для хранения биологических препаратов. Формалин используется для дезинфекции и протравливания семян.
Чтобы проверить как вы усвоили материал и ещё раз закрепить полученные знания я предлагаю вам разгадать кроссворд по теме “Альдегиды и кетоны”. слайд 17 приложение 5
9. Подведение итогов.
10. Домашнее задание. § 19, самостоятельно разобрать способы получения (ОК на доске). № 2,3, 4(задача), № 11*
Submit to our newsletter to receive exclusive stories delivered to you inbox!

Главный Попко
Лучший ответ:

Таня Масян
Водный раствор формалина используется:
4.все ответы верны


Вы можете из нескольких рисунков создать анимацию (или целый мультфильм!). Для этого нарисуйте несколько последовательных кадров и нажмите кнопку Просмотр анимации.
Формальдегид СН20 в чистом виде — это бесцветный едкий газ, при температуре минус 19 °С сжижающийся в легкоподвижную жидкость. Упругость паров Рсн 0 над водными растворами невелика из-за гидратации его молекул СН20 + Н20 = = СН2(ОН)2. В присутствии метанола величина Р возрастает. Это отражается и на свойстве дистиллята, получаемого при разгонке метанолсодержащих растворов формальдегида. Еще больше возрастает упругость паров СН20 при повышении давления (рис. 6.1). Объясняется это дегидратацией находящегося в растворе моногидрата в свободный формальдегид. Этим свойством пользуются при отгонке СН20 из слабых загрязнен' ных растворов, получая в дистилляте 30—40 %-ный формалин.
При полимеризации СН20 в присутствии воды образуются полиоксиметиленгликоли (СН20)я-Н20, растворимые при нагревании, которые выпадают в осадок в холодное время года из формалина, содержащего более 30 % СН20 (осадок называют параформом). Технический параформ получают пульверизацией или выпаркой обесспиртованного формалина при остаточном давлении 53—60 кПа и при 45—80 °С. После вакуум - сушки и измельчения полиоксиметиленгликоль с числом п от
6 до 12 может применяться взамен формалина. Из формальдегида вырабатывают также весьма ценный, особо прочный полимер— полиформальдегид с числом п более 1000.
Благодаря высокой бактерицидное™ (1:1 000 000) формалин как антисептик применяется в сельском хозяйстве (для протравливания семян), медицине и ветеринарии.
Способность формальдегида конденсироваться с фенолами, карбамидом, белковыми веществами (казеином, протеином), аминами и другими веществами широко используется в производстве фенол-, карбамидоформальдегидных и других смол. Из него вырабатывают уротропин, параксоль, пентаэритрит, красители и другие продукты.
Уротропин, или гексаметилентетрамин (СН2)6Ы4, получают при взаимодействии формальдегида с аммиаком; он применяется в производстве пластмасс, в медицине и т. д.
На лесохимических заводах значительное количество формалина перерабатывают на месте в карбамидную смолу, используемую в качестве клея в производстве фанеры и мебели. Процесс ведут в реакторе в две ступени. Сначала загружают формалин и постепенно при нагревании и перемешивании вводят в него карбамид, регулируя pH среды добавлением аммиачной воды и буферного катализатора ЫН4С1. Затем в реакционную
Водород и подвести необходимое количество тепла, что достигается окислением части водорода:
Н2 + 1/20* = Н20 + 284,9 кДж.
Побочными реакциями этого процесса являются:
Полное окисление части метилового спирта и формальдегида
СН30Н 4-1 1 /202 = С02 + 2Н20 + 720,7 кДж;
СН20 + 02 = С02 + Н20+ 561,5 кДж;
Образование муравьиной кислоты из формальдегида, г СН20+ 1/202 = НСООН;
Разложение формальдегида и восстановление СНгОН да метана
СН20-> СО + Н2 — 93,4 кДж;
СН3ОН + Н2 -> СН4 + Н20 + 209,5 кДж.
Некоторые исследователи полагают, что формальдегид образуется в основном путем непосредственного окисления метанола:
Наличие же водорода в реакционной смеси объясняют распадом формальдегида на СО и Н2. Однако такой взгляд не подтверждается составом реакционных газов, содержащих 18— 22 % водорода и всего лишь 4—5 % углеродсодержащих газов, в том числе только десятые доли процента СО.
Метанол для формалинового производства должен быть очищен от примесей — альдегидов, кетонов, непредельных соединений и других веществ, утомляющих катализатор. Особо тщательно следует очищать некоторые сорта синтетического метанола от пентакарбонила железа Ре(СО)5, необратимо отравляющего катализатор. Воздух должен освобождаться от пыли, сернистых соединений (БОг, Н25), образующих с серебром Ад25>, а также от других контактных ядов промывкой щелочным раствором метанола.
Исходный метанол направляют в спиртоиспарители, представляющие собой в простейшем исполнении обычные кипятильники. В подкубке испарителя поддерживается постоянный уровень метанола и строго определенная температура. Под слоем жидкости находится барботер для прососа воздуха или нагнетания его под давлением. Воздух насыщается парами метанола и образует спиртовоздушную смесь. Последняя перед направлением на катализ перегревается с целью испарения капельно-жидкого метанола и его активации. Состав смеси (соотношение 02: СН3ОН) зависит от ее температуры и концентра-
Крепость остатка в испарителе, %
Соотношение 02 : СНзОН, л/г
Соотношение 02: СНзОН, л/г
Соотношение О, : СНзОН, л/г
~Ре + 5СО, заполненную силикагелем или кусками фарфора или керамики, затем один-два слоя медной огнепредохранительной сетки, препятствующей возможному распространению огня из контактного аппарата в спиртоиспаритель. Разогретый катализатор в дальнейшем работает за счет теплоты окислительных реакций, без подвода тепла извне; запальник выключается.
Чем больше кислорода в рабочей смеси, тем полнее связывается выделившийся водород; при этом повышается температура и возрастает степень превращения метилового спирта в формальдегид (конверсия). Но с повышением температуры начинаются реакции частичного распада и окисления СН20 и СН3ОН, что увеличивает химические потери (рис. 6.2). Эти реакции можно затормозить присадкой водяных паров к спиртовоздушной смеси (добавкой воды в исходный метанол), что-
Рис. 6.2. Зависимость состава отходящих газов и химических потерь, ■%, от температуры в зоне катализа:
/ — химические потери; 2 — содержание СО2+СО+СН4; 3 — содержание СН4
Широко используется на практике, если желают более полно провести конверсию.
Нагрузку на катализатор исчисляют как количество паров метанола в граммах, пропущенного в течение 1 ч через 1 см2 поперечного сечения контактной массы. Чем меньше нагрузка, тем дольше время пребывания паров метанола в зоне катализа и выше конверсия и наоборот. Оптимальной нагрузкой на свежий 35—40 %-ный катализатор серебро на пемзе при высоте его слоя 70—100 мм и конверсии 55—65 % считается 150—175 г/(см2-ч). По мере его утомления нагрузка падает до 125 г/(см2-ч) и ниже.
О влиянии вышеотмеченных факторов можно судить по составу неконденсируемой части реакционной смеси (табл. 6.2). Содержание суммы углеродсодержащих газов свыше 4 % свидетельствует об усилении побочных реакций, в частности увеличение С02 — об избытке кислорода в спиртовоздушной смеси. Появление СО в газах — результат уменьшения нагрузки на катализатор, или недостаточного теплоотвода, или, наконец, ■отравления катализатора окисью меди. Наличие СН4 — следствие завышенной температуры в нижних слоях контактной массы, где нет уже кислорода, или же отравления катализатора железом, или попадания в него асбеста (от прокладок). В последних двух случаях характерно выделение сажи. Недостаток водорода (ниже 18%) указывает на малую конверсию, если температура низка, и на избыток кислорода при повышенной температуре. Повышенное содержание Н2 в газах (даже сверх 20%) не является плохим признаком, а наоборот, чем больше водорода, тем меньше химических потерь.
Для извлечения СН20 и остаточного СН3ОН реакционную смесь, выходящую из контактного аппарата, направляют в поглотительную систему, противоточно орошаемую чистой водой. При охлаждении горячей реакционной смеси и поглощении паров СН20 и СН3ОН водой выделяется большое количество тепла (теплота поглощения СН20 = 62,85 кДж/моль). Поэтому подконтактный холодильник и поглотительную аппаратуру обеспечивают мощной системой теплоотвода. Количество воды для орошения берут из расчета получения 37 %-ного или 30 %-ного формалина.
При неполной (55—65 %-ной) конверсии, когда в реакционной смеси имеется избыток непрореагировавшего метанола, получают так называемый конденсат, который перерабатывают
Крепость, %: исходного СН3ОН остатка в испарителе Температура, °С: в испарителе в зоне катализа Нагрузка на катализатор, г/(см2-ч)
Объемное содержание компонентов газа, %:
64±0,5 670—680 ПО—105
Итого С02 + СО + €Н^
Химические потери (ХП), %
18—22 1,6—2,3 72,1—74,7 5—6
19,5—22,8 0,7—0,8 71,4—75,8 6-8
17,2—19,2 0,2—0,4 74,5-75,9 9—12
17,5 0,3 75,7 До 14
* После выхода из зоны катализа.
На формалиноразделительной колонне с получением возвратного метанола и формалина.
Муравьиная кислота, находящаяся в формалине, способствует выпадению параформа, особенно в присутствии окислов металлов (Ре, Си и др.). Кислотность формалина снижают, пропуская его через ионообменные смолы, доводя его pH до 2,8—4,5. Предотвратить выпадение параформа можно также при хранении формалина в нагретом состоянии.
Одним из наиболее распространенных способов частичной стабилизации формалина является присутствие в нем метанола: в летнее время 5—7%, зимой 9—11 %. Этот способ все же не оправдывает себя при температурах ниже О °С. Поэтому целесообразно перейти на выпуск 30%-ного формалина, содержащего 0,5—1 % метанола, как это делается в ряде стран. При этом одновременно повышается на 16,5 % выход формалина (в пересчете на 37%-ный) и на каждую тонну его соответственно экономится свыше 57 кг метанола.
Формалин технический выпускают двух сортов: высшего и
I сорта с содержанием СНгО 37±0,5 % и кислотностью для высшего сорта 0,02% и для I сорта 0,04% (не более). Содержание метанола соответственно 5—8% и не более 11 %; содержание Ре не более 0,0001 и 0,0005 %.
Технологический процесс получения формалина. При работе по способу неполной конверсии процесс ведут так (рис. 6.3): воздух очищается от загрязнений в пенном насадочном воздухоочистителе 1, орошаемом циркулирующим в системе щелочным раствором, содержащим 40—60 % метанола и 1—3 % едкого натра. Метанол подогревается в теплообменнике 2 и поступает в тарельчатый испаритель 3. Высококипящие примеси метанола накапливаются в подкубке испарителя и выводятся из него в виде метанольного остатка крепостью 80±5%, используемого при приготовлении щелочного раствора для возду - хоочистки. Спиртовоздушная смесь перегревается в перегревателе 4 и, пройдя ловушку 5 для Fe (СО) 5 и огнепредохранительную сетку 6, направляется в контактный аппарат 7. Слой катализатора (серебро на пемзе) засыпают высотой 75—100 мм; температура в слое катализатора 580—610 °С.
Реакционная смесь по выходе из зоны катализа имеет температуру 500—550 °С. Ее охлаждение до ПО—120 °С происходит в подконтактном холодильнике-парообразователе 8, в меж - трубное пространство которого подается горячий конденсат пара, собираемый в приемнике 9 и циркулирующий в системе насос 10— подконтактный холодильник 8 — сепаратор 11 — приемник 9. Получаемый при этом пар используется для приготовления спиртовоздушной смеси; избыток его сбрасывается через сепаратор 12 в барометрический затвор приемника 9У а конденсат пара из теплообменника 2 собирается в приемник 13. Свежий пар в спиртоиспаритель (через перегреватель 4) подается лишь при пуске аппарата.
Дальнейшее охлаждение реакционной смеси до 50—40 °С и поглощение основного количества СН20 и паров СН3ОН происходит в барботажном конденсаторе-холодильнике 14, отходящие газы из которого через сепаратор 15 поступают в низ пеннопромывной колонны (ППК) 16. Колонна орошается сверху деминерализованной водой, подаваемой насосом 17 через холодильник 18. Каждая из восьми ситчатых полок ППК охлаждается двухходовыми трубчатками. Промытые газы содержат минимальное количество СН3ОН и СН20 и через сепаратор 19,. дополнительный холодильник и ресивер направляются в топку Разрежение в конце системы 27—30 кПа.
Раствор из подкубка ППК 16 стекает в барботажный холодильник 14, а конденсат из последнего с массовой долей СН20' 30—33 % и СНзОН 16—20 % направляют в середину формалиноразгонной колонны (ФРК) 20, имеющей до 14 + 24 тарелок, дефлегматор 21 и конденсатор 22. ФРК работает при флег - мовом числе 5—8, под разрежением с присоединением воздушника к низу ППК- Отбираемый из ФРК возвратный метанол, содержащий не более 0,2—0,3 % СН20, непосредственно
Поступает на нижнюю из четырех тарелок спиртоиспарителя Зг а в случае некондиционности (в период пуска и наладки режима)— в промежуточный приемник 23 для повторной пере-
Отходящие т газы
Работки на ФРК. Готовый формалин из подкубка ФРК с температурой до 95 °С частично охлаждают в холодильнике 24, собирают в вакуум-бачки 25 и откачивают насосом 26. ФРК обогревается через змеевики в подкубке. Конденсат пара из них без охлаждения поступает в общий приемник 9.
Химические потери при работе по описанной схеме не превышают 5—7%. Расход тепла 716 кДж, или 300 кг пара на
1 т формалина. Расход А£1МОз 6—8 г, электроэнергии 34— 48 кВт-ч, воды 15—25 м3/т.
По способу глубокой конверсии используется метанол, разбавленный водой до крепости 69—70 %. температура в испарителе и в зоне катализа поддерживается значительно выше, чем по способу неполной конверсии, а нагрузка на катализатор несколько снижается (см. табл. 6.2). Достоинства способа: отпадает необходимость регенерации остаточного метанола, так как из поглотительной колонны отбирается готовый формалин; уменьшается унос паров метанола с отходящими газами. Основной недостаток способа — повышение химических потерь из-за высокой температуры в зоне катализа.
В последние годы в формалиновом производстве начали применять окисные катализаторы, из которых наиболее эффективными оказались смеси окислов Мо + У, Ре + Мо и др. Процесс ведется при необычно низкой температуре в зоне катализа — 350—360 °С. Окисные катализаторы обладают высокой (до - 96%) селективностью (т. е. до 96% всего прореагировавшего метанола превращается в целевой продукт) и обеспечивают при этом глубокую общую конверсию, а потери сырья на побочные - реакции не превышают 2 %■ В отходящих газах содержится 1,1—1,3 % СО и всего лишь 0,2 % СОг. Расход метанола на 1 т формалина снижается до 427 кг.
Материалы для аппаратуры. Аппаратуру для формалинового производства изготовляют преимущественно из меди и кислотостойкой стали марок 12Х18Н10Т или 0Х21Н5Т (лучшая тара из той же стали). Контактный аппарат и трубчатку под - контактного холодильника лучше изготовлять из титана. Для колонн, емкостей и железнодорожных цистерн пригоден алюминий. Корродирующее начало в формалине — муравьиная кислота.
Сточными водами в формалиновом производстве являются незначительное количество отработанной воды от вакуум-насосов и промывные воды от периодической чистки аппаратуры, обезвреживаемые в смеси с общезаводскими стоками.
Технико-экономические показатели. При работе по методу неполной конверсии выходы 37%-ного формалина из 1 т сырья при оставлении в нем 7% СНзОН достигают 1,86 т. Примерные показатели работы по этому методу (на 100 кг пропущенного* СН3ОН) приведены ниже.
Соотношение сухой воздух: СН3ОН, м3/кг. 0,952
То же 02 : СН3ОН (45,5 °С), м®/хг. 0,20
TOC o "1-5" h z Получено формалина, кг. 152,0
Содержание в нем, кг:
Получено возвратного СН3ОН, кг (%) . 18,28
Полезная конверсия (56, 24.1,067), кг. 60,01
Полезное использование СН3ОН (60,01 + 18,28 + 10,64), кг. 88,93
Потери, в пересчете на СН3ОН (100—88,93), кг (%). 11,07
Химические (по анализу газов). 6,10*
Механические (по разности) . 4,97
•Суммарная конверсия (60,01+6.10), % . 66,11
Общий расход СН3ОН (100—18,28), кг. 81,72
То же на I т формалина (81, 72 : 0,152), кг/т. 537,6
Выход 37 %-ного формалина (152,0 : 81,72), кг/кг. 1,86
Рис. 6.4. Состав отходящих газов при различной величине химических Потерь, Р/Ь:
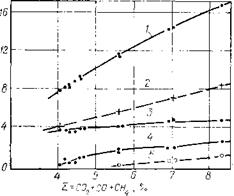
1 — химические потери; 2— сумма СОг+СО+СН4; 3 — СОг; 4 — СО; Г— СН а при применении холодильной смеси для теплоотвода из поглотительной колонны уменьшить механические потери и обеспечить выход 37%-нога формалина, содержащего 7 % СН3ОН, свыше 1,9 т/т.
Из выхлопных газов формалинового производства можно- получить азот в количестве до 700 кг на 1 т формалина. На небольших предприятиях эти газы, содержащие до 20 % водорода и имеющие теплоту сгорания 4600 кДж/м3 и более, целесообразно сжигать в котельных.
ТЕХНОЛОГИЯ И ОБОРУДОВАНИЕ ЛЕСОХИМИЧЕСКИХ ПРОИЗВОДСТВ
Обезвреживание газовых выбросов
Отходящие газы от различных аппаратов лесохимических производств содержат значительное количество паров летучих веществ и подлежат очистке с целью предотвращения попадания их в атмосферу и регенерации некоторых из них. Газовые выбросы …
Очистка и обезвреживание промышленных стоков
Количество промышленных стоков и степень их загрязненности зависят от принятой схемы технологических процессов и на различных заводах колеблются в весьма широких пределах. В частности, при экстракции уксусной кислоты из жижки …
ОЧИСТКА И ОБЕЗВРЕЖИВАНИЕ ПРОМЫШЛЕННЫХ СТОКОВ И ГАЗОВЫХ ВЫБРОСОВ
В процессах производства лесохимических продуктов образуются различные сточные воды — отбросные воды ректификационных аппаратов, промывные, подсмольные и подскипидар - ные воды и др. Все они объединяются общим названием промышленных стоков …
Продажа шагающий экскаватор 20/90
Цена договорная
Используются в горнодобывающей промышленности при добыче полезных ископаемых (уголь, сланцы, руды черных и
цветных металлов, золото, сырье для химической промышленности, огнеупоров и др.) открытым способом. Их назначение – вскрышные работы с укладкой породы в выработанное пространство или на борт карьера. Экскаваторы способны
перемещать горную массу на большие расстояния. При разработке пород повышенной прочности требуется частичное или
сплошное рыхление взрыванием.
Вместимость ковша, м3 20
Длина стрелы, м 90
Угол наклона стрелы, град 32
Концевая нагрузка (max.) тс 63
Продолжительность рабочего цикла (грунт первой категории), с 60
Высота выгрузки, м 38,5
Глубина копания, м 42,5
Радиус выгрузки, м 83
Просвет под задней частью платформы, м 1,61
Диаметр опорной базы, м 14,5
Удельное давление на грунт при работе и передвижении, МПа 0,105/0,24
Размеры башмака (длина и ширина), м 13 х 2,5
Рабочая масса, т 1690
Мощность механизма подъема, кВт 2х1120
Мощность механизма поворота, кВт 4х250
Мощность механизма тяги, кВт 2х1120
Мощность механизма хода, кВт 2х400
Мощность сетевого двигателя, кВ 2х1600
Напряжение питающей сети, кВ 6
Более детальную информацию можете получить по телефону (063)0416788
Читайте также:

