Диссертации по озимому рапсу
Добавил пользователь Morpheus Обновлено: 18.09.2024
Проведена оптимизация условий индукции каллусогенеза и регенерации побегов озимого рапса сорта Северянин из гипокотилей 14-дневных проростков. Учитывались следующие параметры культивирования растений в условиях in vitro: эффективность стерилизации, обеспечивающая наибольший выход стерильного материала при наименьшей его гибели, влияние типа экспланта и комбинаций регуляторов роста на каллусогенез, пролиферацию и регенерацию растений. Эффективность каллусогенеза составила от 65 до 100 % на всех экспериментальных средах. Наибольшая эффективность пролиферации каллусной культуры отмечена при культивировании эксплантов из нижней части гипокотиля на среде с добавлением 0,1 мг/л альфа-нафтилуксусной кислоты + 2 мг/л бензиладенина, однако определяющим фактором морфогенетического потенциала является эффективность регенерации побегов, а она в этом варианте была низкой (10 %). При культивировании эксплантов на инициирующей среде, содержащей 1 мг/л 2,4-дихлорфеноксиуксусной кислоты, с последующим пассажем на среду с добавлением 4 мг/л бензиладенина + 2 мг/л зеатина эффективность регенерации побегов была максимальной (49,3 %) в варианте с использованием нижней части гипокотиля. Наиболее высокая эффективность регенерации отмечена при культивировании эксплантов на среде с добавлением 0,1 мг/л альфа-нафтилуксусной кислоты и 0,3 мг/л тидиазурона (81,8 %).

1. Cardoza V., Stewart N.C. Brassica biotechnology: progress in cellular and molecular biology // In Vitro Cell. Dev. Biol. Plant. – 2004. – vol. 40, № 6. – Р. 542–551.
2. Ravanfar S.A., Aziz M.A., Rashid A.A., Salim S. In vitro adventitious shoot regeneration from cotyledon explants of Brassica oleracea subsp. italica and Brassica oleracea subsp. capitata using TDZ and NAA // Pak. J. Bot. – 2014. – vol. 46, № 1. – Р. 329–335.
3. Ravanfar S.A., Aziz M.A., Kadir M.A., Rashid A.A., Sirchi M.H.T. Plant regeneration of Brassica oleracea subsp. italica (broccoli) cv Green Marvel as affected by plant growth regulators // African Journal of Biotechnology. – 2009. – vol. 8, № 11. – Р. 2523–2528.
4. Zeynali M. Influence of genotype and plant growth regulator on somatic embryogenesis in rapeseed (Brassica napus L.) // African Journal of Biotechnology. – 2010. – vol.9, № 26. – Р. 4050–4055.
5. Gerszberg A., Hnatuszko-Konk K., Kowalczyk T. In vitro regeneration of eight cultivars of Brassica oleracea var. capitate // In Vitro Cell. Dev. Biol. Plant. – 2015. – vol. 51, № 1. – Р. 80–87.
6. Pavloviс S., Vinterhalter B., Mitiс N., Adzic S., Pavlovic N., Zdravkovic M., Vinterhalter D. In vitro shoot regeneration from seedling explants in Brassica vegetables: red cabbage, broccoli, savoy cabbage and cauliflower // Arch. Biol. Sci. – 2010. – vol. 62. – Р. 337–3456.
7. Burbulis N., Blinstrubiene A., Kupriene R., Jonytiene V., Rugienius R., Staniene G. In vitro regeneration of Brassica napus L. shoots from hypocotyls and stem segments // Zemdirbyste-Agri. – 2009. – vol. 96, № 3. – Р. 176–185.
8. Ivashuta S.I., Mazin V.V. Regeneration of winter rape in vitro for genetic transformation // Russian Journal of Plant Physiology. – 1994. – vol. 41, № 3. – Р. 388–390.
9. Turczynowska A., Siatkowski I., Broda Z. Analysis of genetic components of winter oilseed rape (Brassica napus ssp. oleifera) regeneration ability under in vitro culture // BioTechnologia. – 2015. – vol. 96, № 1. – Р. 30–35.
11. Sretenovic-Rajicic T., Ninkovic S., Uzelac B., Vinterhalter B., Vinterhalter D. Effects of plant genotype and bacterial strain on Agrobacterium tumefaciens-mediated transformation of Brassica oleracea L. var. capitate // Russ J. Plant Physiol. – 2007. – vol.54, № 5. – Р. 653–658.
12. Maheshwari P., Selvaraj G., Kovalchuk I. Optimization of Brassica napus (canola) explant regeneration for genetic transformation // Nat. Biotechnol. – 2011. – vol.29, № 1. – Р. 144–155.
Рапс озимый (Brassica napus) принадлежит к семейству Brassicaceae и является ценным растением, возделываемым для получения масла пищевого или технического назначения.
Материалы и методы исследования
Питательные среды. Для проращивания семян в стерильных условиях использовали агаризованную среду Мурасиге – Скуга (MS), содержащую половинную концентрацию макросолей. Для изучения регенерационной способности растений озимого рапса использовали среду MS с добавлением микроэлементов, витаминов и регуляторов роста в различных концентрациях и комбинациях в шести вариантах, подобранных согласно данным литературных источников.
Подготовка эксплантов и их культивирование. При достижении донорными растениями 12–14-дневного возраста их подвергали сегментированию в асептических условиях. В экспериментах по регенерации в качестве эксплантов использовали сегменты длиной около 7 мм из верхней, средней и нижней частей гипокотиля, которые помещали на чашки Петри диаметром 90 мм, заполненные 20–25 мл агаризованной питательной среды MS с добавлением регуляторов роста в различных комбинациях. На одну чашку Петри располагали 15 штук эксплантов, эксперименты проводили в трехкратной повторности для каждого варианта.
Каллусогенез и регенерация. В экспериментах по индукции каллусогенеза использовали 6 вариантов состава питательных сред, различающихся по содержанию фитогормонов и регуляторов роста.
Для роста образовавшихся побегов использовали среду MS, содержащую регуляторы роста в пониженных концентрациях. Каждые 3 недели экспланты пассировали на свежие среды.
В экспериментах были использованы следующие концентрации и комбинации регуляторов роста:
1. 1 мг/л 2,4-Д (первый пассаж), далее 4 мг/л 6-БАП + 2 мг/л Зеатин.
2. 1 мг/л 2,4-Д + 1 мг/л 6-БАП (первый пассаж), далее 1 мг/л 6-БАП.
3. 0,1 мг/л НУК + 1 мг/л 6-БАП (первый пассаж), далее 0,1 мг/л НУК + 1 мг/л 6-БАП.
4. 0,1 мг/л НУК + 2 мг/л 6-БАП (первый пассаж), далее 0,1 мг/л НУК + 2 мг/л 6-БАП.
5. 0,05 мг/л НУК + 0,3 мг/л ТДЗ (первый пассаж), далее 0,3 мг/л ТДЗ + 0,1 мг/л НУК.
6. 0,05 мг/л НУК + 0,1 мг/л ТДЗ (первый пассаж), далее 0,1 мг/л ТДЗ + 0,1 мг/л НУК.
В ходе эксперимента учитывали три показателя эффективности влияния регуляторов роста на процессы морфогенеза у эксплантов:
1. Эффективность каллусогенеза (выражали в процентах путем деления количества эксплантов, образовавших каллус, на общее количество эксплантов в каждом варианте).
2. Интенсивность пролиферации эксплантов (выражали кратностью увеличения объема экспланта путем деления начального объема сегмента гипокотиля на объем образовавшегося каллуса в каждом варианте).
3. Эффективность регенерации из эксплантов (выражали в процентах путем деления количества эксплантов, образовавших побеги, на общее количество эксплантов в каждом варианте).
Статистическую обработку данных проводили с помощью дисперсионного анализа с последующим множественным сравнением частных средних и оценки их по критерию Дункана.
Результаты исследования и их обсуждение
Известно, что тип экспланта и экзогенные регуляторы роста оказывают большое воздействие на частоту регенерации при использовании различных методов культивирования тканей. Для исследования морфогенного потенциала генотипа и разработки системы эффективной и стабильной регенерации целых растений было изучено влияние типа экспланта и комбинаций регуляторов роста на каллусогенез, пролиферацию и регенерацию растений. Комбинации регуляторов роста были подобраны согласно литературным источникам.

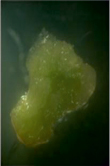

Рис. 1. Каллусогенез у гипокотилей рапса при использовании различных регуляторов роста: А – НУК + 6-БАП (вар. 4), Б – НУК + ТДЗ (вар. 5), В – 2,4-Д (вар. 1)
Влияние различных комбинаций регуляторов роста на каллусогенез, интенсивность пролиферации и эффективность регенерации озимого рапса
Читайте также:

