Выращивание растений из каллусной ткани
Обновлено: 07.07.2024
Рефераты и конспекты лекций по географии, физике, химии, истории, биологии. Универсальная подготовка к ЕГЭ, ГИА, ЗНО и ДПА!
Калюс - ткань, возникшая в результате неорганизованной пролиферации клеток органов растений.
В природе Калюс образуется в результате дедиференциации паренхимных клеток в ответ на ранение.
Образование и рост каллуса регулируются ауксинов и цитокининов. С помощью этих веществ можно индуцировать образование каллуса в тех тканей растения, которые не образуют его в ответ на ранение. Существуют новые представления, согласно которых ауксины и цитокинины, а полисахариды и какие-то другие индукторы вызывают деления, в результате которого образуется Калюс.
Переход клетки in vitro с дифференцированного состояния к дедиференциации и активных клеточных делений обусловлен изменением активности генов (эпигенетической изменчивостью). Включение одних генов и репрессированию других приводит к изменению белкового состава клеток. В каллусных клетках появляются специфические белки и одновременно исчезают или уменьшаются в количестве белки, характерные для фотосинтезирующих клеток листа.
После индуцирования образования каллуса в асептических условиях его отделяют и помещают на поверхность агаровой питательной среды. В результате этого получают стерильную каллусных культур или ткань, которая является основным типом растительной ткани, что культивируется. Впервые Калюс был получен из корня моркови Р.Готре в 1938 году.
Стоит отметить, что для успешной инициации первичного каллуса в питательную среду часто необходимо добавлять антиоксиданты (глютатион - 5 мг / л, диэтилдитиокарбамат - 5, цистеин - 5, аскорбиновую кислоту - 5, поливинилпирролидон - 250-500 мг / л и др.), будут ингибировать ферменты, окисляющие фенолы. Продукты окисления фенолов токсичны и подавляют деление клеток эксплантаты.
При получении первичного каллуса эксплантаты лучше культивировать на нескольких средах с различным соотношением ауксинов: цитокининов (табл. 4). Успех получения каллуса в значительной степени зависит от подбора регуляторов роста, индукторов клеточного деления.
С ауксинов чаще всего используют 2,4-Д или ИОК, которая имеет меньшую активность. Для индуцирования калюсогенезу соотношение ауксинов в цитокининов в питательной среде должно быть 10:1.
Для получения каллуса клетки специализированных тканей при помещении на питательную среду должны дедиференциюватися. В большинстве случаев клетки переходят к специализации из фазы G1, которая предшествует S-фазе - фазе синтеза ДНК, реже из фазы G2. Довольно часто эксплантаты, который используют для получения каллуса, содержит ткани, клетки которых по разному дифференцированы. Разное тканевое происхождение первичных каллусных клеток является одной из причин гетерогенности каллусных ткани, так как некоторые функциональные особенности дифференцированных клеток передаются в ряду клеточных поколений, как устойчивые модификации. Однородность исходной ткани имеет особое значение для злаков.
В двудольных растений каллуса легко образуются на эксплантаты различных органов: из семян, прорастающих в асептических условиях, сегментов стебля и корней, изолированных фрагментов паренхимы клубней, изолированной сердцевины стебля, с листа, органов цветка, зародышей, плодов и т.д.
Для получения каллуса голосеменных целесообразно использовать, как исходный материал, почки, которые растут, стерильные проростки, фрагменты флоэмы. Каллуса злаков получают из зародышей, мезокотиль, корней или отрезков основания стебля. Основная проблема получения каллуса злаков связана со сложностью выделения из этих растений эксплантаты, состоящий из однородной ткани и имеет оптимальный, достаточный размер. Первая каллусных культур злаковых получена из эндосперма кукурузы в 1949 году.
На сегодня разработаны условия получения каллуса ряда злаковых культур. Так, Калюс ржи получили из изолированного корня, Калюс ячменя - из зародыша, а суспензионную культуру - из отрезков корня проростков, Калюс черта - из узлов стебля, отрезков корней, побегов, овса - из семян, прорастающих, пшеницы - с семядольных узлов и зародыша.
Основной особенностью сред для калюсогенезу у злаков и дальнейшего культивирования каллуса является высокое содержание ауксинов, чаще 2,4-Д (до 10 мг / л). ИОК обычно используют в высокой концентрации, чем ее синтетический аналог. Оптимальная концентрация ИУК для злаков достигает 100 мг / л. Исключением является Калюс эндосперма кукурузы, который растет на среде без ауксинов, так как способен их синтезировать.
Процесс калюсоутворення зависит от размеров эксплантаты - обычно это 5-10 мм3. Для многих эксплантаты обязательно соблюдать физиологической полярности. Каллуса можно выращивать очень долго. Для этого необходимо каждые 3-4 недели пересаживать часть образованных клеток на свежий питательную среду. "Старым" считают штамм клеток, полученный из корнеплода моркови Роже Готра еще в 1938 году, и сегодня выращивают во многих лабораториях мира.
В цикле выращивания каллусных клетки после ряда разделов проходят обычный для растительной клетки онтогенез, они переходят к росту растяжением, затем дифференцируются как зрелые каллусных клетки и наконец отмирают.
Каллусных ткань представляет аморфную массу тонкостенных паренхимных клеток. Цвет массы может быть белым, желтоватым, зеленым, красным.
В зависимости от происхождения и условий выращивания каллусных ткани бывают:
1) рыхлыми, сильно оводнен, рассыпчатыми;
2) средней плотности, или компактными с меристематических зонами;
Консистенция каллуса зависит, в значительной степени, от состава среды: на средах с ауксинов, особенно 2,4-Д, каллуса становятся пухлыми. С рыхлых каллуса очень легко получить суспензионную культуру при помещении их в жидкую среду. С компактных каллуса можно получить пухлые, но не наоборот. Наибольшая способность к морфогенеза характерна для компактных каллуса, медленно растут.
Рыхлые и плотные каллуса отличаются анатомически: плотные каллуса менее дифференцированные содержат много вакуолизирован клеток, плотно упакованы. Кроме того, в плотных каллуса общее количество полисахаридов клеточной стенки выше, но содержание целлюлозы по сравнению с пектиновыми веществами и гемицеллюлозами занижен.
Каллусных ткани используют для сохранения в растущей состоянии коллекций разных штаммов, линий, мутантов, из них получают клеточные суспензии, которые культивируют в жидкой питательной среде, для регенерации растений.
Каллусная ткань - один из видов клеточной дифференцировки, возникает путем неорганизованной пролиферации дедифференцированных клеток органов растения. У растений в природе каллусная ткань возникает в исключительных обстоятельствах (например, при травмах) и функционирует непродолжительное время. Эта ткань защищает место поранения, может накапливать питательные вещества для анатомической регенерации или регенерации утраченного органа.
Образование каллуса не всегда связано с травматическим воздействием. Каллус может возникнуть и в результате пролиферации внутренних тканей экспланта без связи с поверхностью среза из-за нарушения гормонального баланса. Растущий каллус разрывает слои ткани и развивается на поверхности. Для получения культивируемых каллусных клеток фрагменты тканей различных органов высших растений - корней, листьев, стеблей, пыльников, зародышей (экспланты) помещают на искусственную среду, содержащую ауксины, в пробирки, колбы, чашки Петри (in vitro).
Одними из важнейших гормонов, применяемых при культивировании in vitro, являются ауксины, которые активируют деление и растяжение клеток. Проникая в клетки, ИУК связывается со специфическими рецепторами, оказывая влияние на функциональную активность мембран, рибосом и работу ядерного аппарата. В качестве ауксинов используют 2,4-дихлорфеноксиуксусную кислоту (2,4-Д), нафтилуксусную кислоту (НУК), индолил-масляную кислоту (ИМК), индолилуксусную кислоту (ИУК) в концентрации 0,5 - 10 мг / л, в зависимости от вида экспланта.
Для регенерации растения из каллуса или экспланта используют среды с более высоким содержанием цитокининов. К наиболее употребимым относятся: 6-бензиламинопурин (БАП), зеатин, 6-фурфуриламинопурин (кинетин).
Процессу образования каллуса предшествует дедифференцировка тканей экспланта. При дедифференцировке ткани теряют структуру, характерную для их специфических функций в растении, и возвращаются к состоянию делящихся клеток. Если эксплант, используемый для получения каллуса, является фрагментом органа, то имеет в своем составе эпидермальные клетки, клетки камбия, сосудистой системы, сердцевинной и первичной коровой паренхимы. Преимущественно пролиферируют клетки камбия, коры, сердцевинной паренхимы.
Клетки в культуре могут существовать в двух видах: в виде суспензии в жидкой питательной среде и на поверхности твердой питательной среды в виде каллуса. Поверхностное культивирование осуществляют на твердой агаризованной среде.
Каллусная ткань, выращиваемая поверхностным способом, представляет собой аморфную массу тонкостенных паренхимных клеток, не имеющую строго определенной анатомической структуры. Цвет массы может быть белым, желтоватым, зеленым, красным. В зависимости от происхождения и условий выращивания каллусные ткани бывают:
- рыхлые, сильно оводненные, легко распадающиеся на отдельные клетки;
- средней плотности, с хорошо выраженными меристематическими очагами;
- плотные, с зонами редуцированного камбия и сосудов. Как правило, в длительной культуре на средах, содержащих ауксины, каллусные ткани теряют пигментацию и становятся рыхлыми.
В цикле выращивания каллусной ткани клетки после ряда делений приступают к росту растяжением, дифференцируются как зрелая каллусная ткань и деградируют. Для того, чтобы не произошло старения, утраты способности к делению и дальнейшему росту, а также отмирания каллусных клеток, первичный каллус переносят на свежую питательную среду через 28 - 30 дней, то есть проводят пассирование или субкультивирование каллусной ткани.
Суспензионные культуры
Суспензионные культуры – это одиночные клетки, мелкие, средние и крупные агрегаты (группы клеток), выращиваемые в жидкой питательной среде при постоянной аэрации (доступ кислорода) в асептических условиях. Суспензии получают из каллусов. Для инициации суспензионной культуры необходимо 2-3 г свежей рыхлой массы каллусных клеток на 60-100 мл жидкой питательной среды. Первичную суспензию культивируют в колбах с жидкой питательной средой на круговых качалках со скоростью 100-120 об./мин.
Суспензионные культуры широко используются в качестве модельных систем для изучения путей вторичного метаболизма, индукции ферментов и экспрессии генов, деградации чужеродных соединений, цитологических исследований и др.
Модельная кривая роста суспензии имеет S-образную форму и включает: лаг-фазу, экспоненциальную фазу, стационарную фазу и фазу деградации. Форма реальных ростовых кривых отличается продолжительностью фаз. Это зависит от генетики популяции, количества инокулюма и состава питательной среды. Скорость нарастания биомассы колеблется от 15 до 70 суток.
Суспензии используют для получения важных химических веществ: органических кислот, ферментов, алкалоидов, красителей, белков, аминокислот, которые применяются в фармакологии, парфюмерии, пищевой и химической промышленности, сельском хозяйстве.
Суспензионные культуры имеют большое значение для генетики и особенно молекулярной биологии: из суспензионных клеток получают протопласты, необходимые для соматической гибридизации, генетической инженерии, а также для изучения метаболизма клеток.
Культивирование растительных клеток в жидкой питательной среде при постоянном перемешивании лишено многих недостатков, свойственных культивированию каллусных клеток на агаризованных твердых средах. Постоянное движение растительных клеток в жидкой среде облегчает газовый обмен, решает проблемы питательного градиента и полярности роста клеток. Большинство суспензионных культур можно получить путем переноса кусочков рыхлого каллуса в перемешиваемую жидкую среду того же состава, что и среда, на которой выращивался каллус. Для каждой линии суспензионной культуры клеток существует минимальный размер инокулюма (числа пересеваемых клеток), при меньшем размере которого суспензионная культура клеток не растет. С уменьшением размера инокулюма увеличивается длина лаг-фазы. Суспензионные культуры клеток растений широко используются в качестве модельных систем для изучения путей вторичного метаболизма, индукции ферментов и экспрессии генов, а также как исходный материал для выделения ферментов. Важным их преимуществом при выделении ферментов или продуктов вторичного метаболизма является отсутствие у большинства суспензионных культур клеток хлорофилла и каротиноидных пигментов. В связи с тем, что суспензионные культуры клеток, в основном, состоят из относительно гомогенной популяции клеток, которые можно быстро обрабатывать с помощью добавляемых в среду культивирования химических веществ, они очень удобны для биохимических экспериментов, проводимых при исследовании метаболизма уводимых веществ, а также для выделения и характеристики мутантов.
Микрочеренкование.
Микроклональное размножение пробирочных растений осуществляют с помощью черенкования. Такое размножение основано на подавлении апикального доминирования и активации пазушных меристем при удалении верхушки побега. Из пазушных почек на питательных средах образуются побеги. Растения, сформировавшие 5-6 листочков, в стерильных условиях извлекают из пробирок и разрезают на части (отрезок стебля с листом и пазушной почкой). Черенки высаживают на глубину междоузлия в питательные среды либо без гормонов, либо с добавлением ауксинов.
Черенки культивируют в тех же условиях, что и меристемы: при температуре 24-25 о С днем и 19-20 о С ночью, освещенности 5-6 кLx и продолжительности фотопериода 16 часов.
Рост стебля и корней начинается на 3-4 день после посадки на питательную среду, а полностью растения формируются через 12-15 дней.
Каждое последующее черенкование проводят через 14-20 дней. Из одного растения можно получить 5-8 черенков, а через 2-3 месяца – 3-5 тыс. черенков.
Нижнюю часть растения используют для ИФА. Растения, зараженные вирусами, бракуют, а здоровые дают начало мериклонам (меристематическим клонам).
Если почки или черенки высадить на питательные среды с высоким содержанием цитокининов, то образуется конгломерат почек и побегов. Полученные побеги легко отделяются друг от друга, их можно либо укоренить, либо использовать для дальнейшего микрочеренкования.
Для укоренения растений, образовавшихся при микрочеренковании, их необходимо пересадить на новую питательную среду. Черенки и побеги легко укореняются на средах с обедненным составом минеральных солей (среда Уайта, Мурасиге-Скуга, разбавленная вдвое), либо на средах с добавлением ауксинов: ИУК, НУК, ИМК.
Проростки, сформировавшиеся в пробирках со средами, можно рассматривать как небольшие укорененные растения, которые необходимо адаптировать к обычным условиям выращивания. Такие растения лучше пересаживать в грунт, когда полностью сформируются 5-6 листьев и достаточно разрастутся корни. Однако, разные виды культурных растений по-разному приспосабливаются к изменению условий среды. Каждое растение требует специально подобранных условий культивирования в грунте, которые устанавливают экспериментально.
В данной статье изложены результаты эксперимента по получению здорового посадочного материала осины методом клонального микроразмножения. В результате проведенных исследований нами были получены из каллусной ткани растения-регенеранты осины, отличающиеся различной скоростью роста. Были получены растения двух типов: растения, характеризующиеся быстрым ростом, и растения, харак-теризующиеся медленным ростом. Приведены данные биохимических исследований по содержанию рас-творимых фенольных соединений в растениях-регенерантах осины. Так, у растений, обладающих быст-рым ростом на протяжении 5 пассажей, суммарное содержание растворимых фенольных соединений бы-ло на уровне 30–33 мг/г сырой массы, а у растений с медленным ростом данный учитываемый показа-тель существенно возрос и составил 52-58 мг/г сырой массы. Кроме того, приведены результаты цитоло-гических исследований растений-регенерантов осины, полученных из каллусной ткани, в результате ко-торых были обнаружены изменения на уровне числа хлоропластов в замыкающих клетках устьиц. Обос-нована необходимость размножения растений-регенерантов осины, характеризующихся быстрым ро-стом, и внедрения их в лесохозяйственное производство в условиях Республики Татарстан.

1. Байбурин Р.К. Интродукция древесных растений, выращенных в культуре in vitro // Генетика и селекция на службе лесу : тез. докл. межд. научно-прак. конф. - Воронеж, 1996. - С. 11-13.
3. Калашникова Е.А. Методы совершенствования технологии клонального микрораз-множения сосны обыкновенной // Лесное хозяйство. - 1994. - № 3. - С. 21-23.
7. Кузьмина Н.А. Основы биотехнологии : учеб. пособ. для студ. биол. фак-та. – Омск : Изд-во Омского пед. ун-та, 2005.
8. Шевелуха В.С. Лабораторный практикум по сельскохозяйственной биотехнологии. - М. : Изд-во МСХА, 2004. – С. 116.
10. Orlikowske Т., Gabryszewska E. In vitro propagation of Acer rubrum cv // Red Sunset: II J. Fruit ornamental Plant Res. - 1995. - Vol. 3. - N. 4. - P. 195-204.
Применение достижений генетики и селекции в практике лесного хозяйства позволяет в полной мере использовать большие потенциальные возможности генетических ресурсов для сохранения и приумножения лесных богатств (Калинин и др., 1992). В настоящее время в технологии in vitro для древесных культур достигнут значительный прогресс. Тем не менее остаются широкие возможности для улучшения этих методов в плане промышленного производства. Успешно размножают такие древесные растения, как тополь (Байбурин, 1996), береза (Durkovic, 1996), клен красный (Orlikowske, Gabryszewska, 1995), ель сибирская и лиственница, сосна обыкновенная (Калашникова, 1994). Для промышленного размножения лесных древесных растений методом клонального микроразмножения очень важно использовать в качестве исходного материала ценные формы, сорта, гибриды. В качестве эксплантов используют различные части и органы растений. Широко используются боковые или верхушечные почки, сегменты стеблей и корней, высечки из листьев, пыльники и т.д.
Из литературных данных следует, что растения осины (растения рода Populus) являются объектом исследования по культуре тканей. Один из способов размножения осины в культуре in vitro - получение растений-регенерантов из каллусной ткани.
Первые работы по культуре тканей древесных растений были опубликованы в середине 20-х годов прошлого столетия и связаны с именем Готре, который показал, что камбиальные ткани некоторых растений способны к каллусогенезу in vitro. Первые растения-регенеранты осины, доведенные до почвенной культуры, были получены лишь в середине 60-х годов Матесом. Со временем этот метод стал незаменим при размножении ценных видов растений (Кузьмина, 2005).
Г.П. Бутова и Т.М. Табацкая (1975) изучали каллусообразование и рост каллуса при пересадках у разных видов тополя, а также камбиальную активность in vitro в зависимости от времени года и вторичную дифференциацию и органогенез в каллусной ткани изучаемых тополей.
Целью данного исследования является изучение сомаклональной изменчивости при получении растений-регенерантов осины из каллусной ткани.
Основные результаты исследования
Для получения каллуса в качестве первичного экспланта нами были использованы черенки с вегетативными почками, нарезанные с однолетних побегов 5-6 летних корневых отпрысков, устойчивых к сердцевинной гнили клонов осины Матюшинского участкового лесничества Пригородного лесничества Республики Татарстан (квартал 81).
Для выращивания каллуса использовали питательную среду Мурасига и Скуга (MS). Почки вводили в культуру in vitro в мае месяце.
Для стерилизации нарезанные черенки помещали в марлевые мешочки и в ламинар-боксе погружали в 0,1%-ный раствор сулемы (двухлористая ртуть) на 10 минут. После этого черенки промывали в 3-5 объемах стерильной дистиллированной воды и слегка подсушивали. Затем готовили черенки для введения в культуру.
Готовый растительный материал с помощью стерильного пинцета горизонтально помещали в чашки Петри с питательной средой МS, содержащей в качестве стимуляторов каллусогенеза 2,5 мг/л 2,4-Д и 2,0 мг/л цитодеф (рис. 1). В пробирки, содержащие питательную среду MS в сочетании со стимуляторами каллусогенеза НУК (0,5 мг/л) и БАП (0,5 мг/л), помещали черенки осины с 1-2 почками (рис. 2).
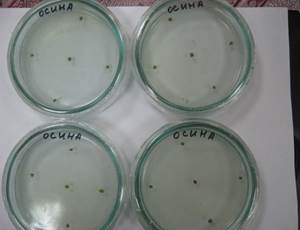
Рисунок 1 - Чашки Петри с эксплантами

Рисунок 2 - Пробирка с черенками осины
Чашки Петри и пробирки с эксплантами закрывали плёнкой Parafilm (США) и ставили в световую комнату, где поддерживали температуру 22-25 °С.
Для дальнейшего формирования растений-регенерантов полученную каллусную ткань пересаживали на питательную среду WPM, содержащую в качестве ауксина ИУК (0,5 мг/л) и цитокины – 2iр (2-изопентениладенин) (2 мг/л) и БАП (2 мг/л). Сахароза во всех питательных средах присутствовала в концентрации 2%. Пересадку осуществляли 1 раз в 1,5 месяца. Условия выращивания были стандартные.
В результате проведенных исследований нами было установлено, что растения, полученные из каллусной ткани, отличались различной скоростью роста. Были получены растения двух типов: растения, характеризующиеся быстрым ростом, и растения, характеризующиеся медленным ростом. По морфологическим характеристикам данные растения не отличались друг от друга, однако проведенные биохимические исследования позволили выявить некоторые отличия по содержанию растворимых фенольных соединений.
Определение содержания суммы растворимых фенольных соединений проводили по следующей методике: навеску сырого материала 800 мг растирали в 70%-ном водном этаноле. Доводили объем жидкости до 10 мл, помещали на качалку на 1 час при 20 °С, центрифугировали при 3000 об/мин 10 минут (центрифуга Т-23, Польша). Определение в надосадочной фракции проводили с помощью реактива Фолина-Дениса (Шевелуха и др., 2004): 0,5 мл этанольного экстракта смешивали с 6,5 мл Н2О и 0,5 мл реактива Фолина-Дениса. Через 3 мин. добавляли 1 мл водного насыщенного раствора соды Na2CО3 и 2 мл Н2О. Через 1 час экспонирования в комнатных условиях спектрофотометрировали раствор при 725 нм и рассчитывали по калибровочной кривой.
Так, у растений, обладающих быстрым ростом на протяжении 5 пассажей, суммарное содержание растворимых фенольных соединений было на уровне 30–33 мг/г сырой массы, а у растений с медленным ростом данный учитываемый показатель существенно возрос и составил 52-58 мг/г сырой массы (рис. 3).

Рисунок 3 - Суммарное содержание растворимых фенольных соединений в растениях-регенерантах осины
(контроль – растения, полученные из пазушных почек; растения первого типа – растения, полученные из каллусной ткани, характеризующиеся быстрым ростом; растения второго типа – растения, полученные из каллусной ткани, характеризующиеся медленным ростом)
Можно сделать предположение, что медленный рост обусловлен повышенным содержанием фенольных соединений в тканях растений, которые в свою очередь могут вызывать ингибирование ростовых процессов. Полученные данные согласуются с результатами многих исследователей, свидетельствующими об ингибировании ростовых процессов фенольными соединениями, которые синтезируются в тканях растений как в условиях in vitro, так и в условиях in vivo (Кефели, 1974; Крамер, Козловский, 1983).
Таким образом, растения-регенеранты, полученные из каллусной ткани, отличались между собой по скорости роста, что, возможно, обусловлено изменением биохимических процессов, в частности фенольного метаболизма.
Кроме того, в результате проведения цитологических исследований нами были обнаружены изменения и на уровне числа хлоропластов в замыкающих клетках устьиц (рис. 4).
Как видно на схеме, растения из каллуса отличаются количеством хлоропластов в клетках замыкающих устьиц (листовая пластинка). Наибольшее количество хлоропластов было обнаружено у быстрорастущих растений, и наоборот – наименьшее – у медленнорастущих.
Таким образом, по всем обнаруженным показателям можно говорить о сомаклональной изменчивости. Являясь источником расширения генетического разнообразия исходного материала, сомаклональная изменчивость может быть использована в селекции для получения новых хозяйственно ценных генотипов. Растения-регенеранты осины, характеризующиеся быстрым ростом, могут успешно использоваться в лесном хозяйстве для получения необходимого количества высококачественного посадочного материала данной культуры.

Рисунок 4 - Содержание хлоропластов в замыкающих клетках устьиц у быстрорастущих и медленнорастущих растений
Рецензенты:
При помещении фрагмента ткани или органа растения на питательную среду соответствующего состава может происходить дедифференциация соматических клеток с образованием каллусной ткани (рис. 4.9, рис. 4.10).

Рис. 4.9. Получение каллусной ткани из различных эксплантов: фрагментов стебля, корня, листа, лепестков, тычинок

Рис. 4.10. Каллус, образованный в культуре незрелых зародышей ячменя (а, б) и пшеницы (в) (фото Н.В. Зобовой)
Первый этап дедифференциации клетки связан с ее вхождением в клеточный цикл, что происходит под действием фитогормонов - ауксинов и цитокининов. Три фазы роста клеток: 1 - деление, 2 - растяжение, 3 - дифференцировка (утолщение вторичной клеточной оболочки и потеря способности к делению). Для того чтобы дифференцированные клетки вновь приобрели способность к делению, необходимо, чтобы произошла их дедифференцировка, т.е. клетки должны как бы возвратиться в меристематическое состояние.
Размножение дедифференцированных клеток приводит к анархическому, неорганизованному росту, в результате чего образуется каллусная ткань. Таким образом, превращение специализированной клетки в каллусную связано с индукцией клеточного деления, способность к которому она потеряла в процессе дифференцировки.
Если дедифференцировка специализированной клетки обуславливается индукцией деления под влиянием цитогормонов, то дедифференцировка делящейся меристематической клетки связана с остановкой делений, деспециализацией клетки и только после этого - с индукцией делений, приводящей к каллусообразованию.
Одни цитокинины в среде (сердцевинной паренхимы табака) блокируют клеточный цикл, клетки только старятся, как и без гормонов, но не растут; а у семядолей подсолнечника в таких же условиях каллус образуется.
Как правило, для индукции каллусной ткани необходимо присутствие двух гормонов: ауксинов (дедифференцировка и подготовка к делению) и цитокининов (пролиферация - деление).
Но, например, зрелые и незрелые зародыши пшеницы и ячменя дают каллусообразование только с ауксинами (2,4-Д).
Вероятно, это связано с наличием у последних достаточного количества эндогенных цитокининов, о чем свидетельствует их прорастание на среде МС без гормонов, т.е. идет увеличение массы стебля и корня - процесс, активируемый цитокининами. Есть достаточно экспериментальных данных о влиянии эндогенных фитогормонов, т.е. гормонального статуса донорного растения, на процесс индукции каллусов в культуре изолированных тканей растений.
Имеются данные, что не только ауксины и цитокинины вызывают деление клеток, приводящее к образованию каллуса, но и так называемые элиситоры (от англ. Elect - выбирать) - метаболические вещества, индуцирующие защитные системы растений. Элиситоры - это БАВ, дерепрессирующие гены и, как следствие, активирующие клеточные деления, сравнительно быструю дедифференцировку специализированных клеток, сопровождающуюся активацией белкового синтеза.
Отмечено, что при повреждении растительных тканей продукты деградации клеточных стенок действуют как гормоны, которые распространяются по растению, связываются со специфическими рецепторами на клеточных мембранах и инициируют каскад защитных механизмов - такие молекулы называются эндогенными элиситорами.
Эффект, вызываемый действием одних и тех же гормонов, может быть различным в зависимости от физиологической характеристики ткани-мишени.
Компетентность ее в рассмотренных примерах определяется степенью дифференцировки клеток.
Переход клетки in vitro из дифференцированного состояние к дедифференцировке и активным клеточным делениям обусловлен изменением активности генов (эпигенной изменчивостью). Активирование одних генов и репрессирование других приводит к изменению в белковом составе клеток. В каллусных клетках появляются специфические белки и одновременно исчезают или уменьшаются в количестве белки, характерные для фотосинтезирующих клеток листа. У двудольных растений процесс репрессии и депрессии генов, лежащий в основе дифференцировки, происходит легче, чем у однодольных.
Для того чтобы не произошло старения, утраты способности к делению и отмиранию каллусных клеток, первичный каллус через 4-6 недель переносят на свежую питательную среду (пассирование). При регулярном пассировании способность к делению может поддерживаться в течение десятков лет. Культура каллусной ткани моркови, полученная Готре более 50 лет назад, до сих пор растет в коллекции.
Читайте также:

