Вероятность генетических отклонений у плода при близкородственных скрещиваниях
Добавил пользователь Валентин П. Обновлено: 19.09.2024
Пренатальная диагностика - это комплекс генетических исследований во время беременности, проводящийся с целью обнаружения патологии у плода на стадии внутриутробного развития.
Данный вид исследований позволяет обнаружить более 99 % плодов с синдромом Дауна (или трисомия по 21 хромосоме), синдромом Эдвардса (трисомия по 18 хромосоме),синдромом Патау (трисомия по 13 хромосоме). Хромосомные аномалии имеют место в 1 из 150 случаев деторождения. В случае наличия у плода болезни родители при помощи врача-генетика тщательно взвешивают возможности современной медицины и свои собственные в плане реабилитации ребёнка. В результате семья принимает решение о судьбе данного ребёнка и решает вопрос о продолжении вынашивания
Пренатальная диагностика подразделяется на инвазивную и неинвазивную.
- Инвазивные методы диагностики – такие как биопсия хориона, амниоцентез (забор околоплодных вод), кордоцентез (забор крови из пуповины).
- Неинвазивные методы диагностики более щадящие. К ним относят неинвазивный пренатальный тест на частые хромосомные аномалии, которые совместимы с жизнью, но такие хромосомные аномалии как синдромы Дауна, Эдвардса и Патау сопровождаются множественными пороками развития и не поддаются излечению. НИПТ надежнее биохимического скрининга, так как относится к прямым методам исследования плодной ДНК. При этом, у будущей мамы нет риска напрасной тревоги при беременности при попадании в группу риска по хромосомным аномалиям, нет риска спонтанного прерывания беременности. НИПТ одобрен во многих странах и включен в систему добровольного медицинского страхования (такие развитые страны как Швейцария, США, Канада, Нидерланды, Германия).
Какие же основные синдромы выявляет НИПТ
Хромосомное заболевание характеризуется комплексом множественных пороков развития и трисомией 18 хромосомы. Описан в 1960 году Джоном Эдвардсом. Популяционная частота по миру 1:5000 на 2016 г. Дети с трисомией 18 чаще рождаются у пожилых матерей, взаимосвязь с возрастом матери менее выражена, чем в случаях трисомии 21 хромосомы. Основные признаки синдрома Эдвардса: малый вес, аномалии форм черепа, пороки сердца, дефекты межжелудочковой перегородки, умственная отсталость.
Частота – 1:16000 родов. Характерны нарушения развития нервной системы, глаз, выраженная деформация лица, пороки развития сердца и других внутренних органов. Характерна глубокая задержка умственного развития. 90% детей умирают в возрасте до 1 года.
Гоносомные анеуплоидии:
Если в клетке присутствует только одна хромосома вместо двух, это называется моносомией. Частота встречаемости – 1:2500. Возникает в случае отсутствия второй половой хромосомы, встречается только у девочек. Единственная моносомия, при которой возможно рождение живого ребенка. Хромосомная болезнь, сопровождающаяся характерными аномалиями физического развития, низкорослостью и половым инфантилизмом.
Частота – 1:500. Когда в клетках с мужским кариотипом присутствует дополнительная Х-хромосома. Встречается только у мальчиков. Это заболевание, при котором особи мужского пола имеют дополнительную Х-хромосому. Обычно женщины имеют пару ХХ хромосом, а мужчины пару ХY хромосом, однако при этом заболевании мужчины имеют по крайней мере две Х-хромосомы и хотя бы одну Y хромосому. Синдром Клайнфельтера является не только самой частой формой мужского гипогонадизма, бесплодия, эректильной дисфункции, но и одной из наиболее распространённых эндокринных патологий, занимая третье место после сахарного диабета и заболеваний щитовидной железы.
Частота – 1:1000. В клетках присутствует дополнительная Y-хромосома. Встречается только у мальчиков. Носитель синдрома имеет дополнительную Y-хромосому, общий хромосомный набор составляет 44 аутосомы и три половые хромосомы. Наличие второй Y-хромосомы в большинстве случаев не ведёт к каким-либо физическим отклонениям. В то же время, многие мужчины с XYY-синдромом имеют одну или несколько особенностей. При рождении они имеют нормальный рост, но часто быстрее растут в детстве. В среднем, во взрослом состоянии носитель выше, чем 75% мужчин того же возраста. Некоторые мужчины с синдромом XYY имеют небольшие нарушения координации движений, в результате чего могут казаться неуклюжими. Фертильность чаще всего не нарушена, обычно такие мужчины гетеросексуальны и имеют нормальную сексуальную функцию. Тем не менее, описаны случаи существенного снижения фертильности, вплоть до бесплодия. У небольшого числа носителей также повышен уровень половых гормонов, связанных со сперматогенезом, что может вести к бесплодию ввиду нарушения образования спермы. Неизвестно, насколько высоко число случаев бесплодия у мужчин с XYY-синдромом. IQ находится в пределах нормы, но часто несколько ниже, чем у родных братьев и сестёр. Примерно половина носителей имеет проблемы с обучением, в частности, могут быть нарушения и чтения. Может быть повышен риск поведенческих проблем, таких как синдром гиперактивности, мужчины с XYY-синдромом часто импульсивны и эмоционально незрелы.
Частота – 1:1000. В клетках присутствует 3 копии Х-хромосомы. Встречается только у девочек.
В большинстве случаев носители дополнительной X-хромосомы — женщины без заметных признаков патологии, поэтому при медицинских исследованиях 90% трисомиков по X-хромосоме остаются не выявленными. Развитие может протекать с некоторыми нарушениями, могут возникнуть проблемы с координацией, моторикой и развитием речи. В некоторых случаях отмечен меньший размер головы (без заметного снижения умственных способностей). Трисомия по X-хромосоме не приводит к значительным нарушениям фертильности, в большинстве случаев может проявляться только в более ранней менструации.
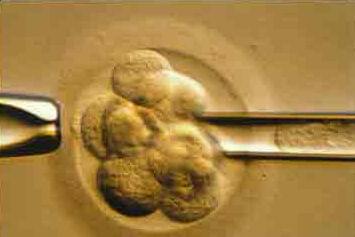
Каждая из 100 триллионов клеток в организме человека (за исключением красных кровяных клеток) содержит весь человеческий геном. Хромосомы – это струноподобные элементы внутри ядра (в центре) каждой клетки вашего тела. Они содержат генетическую информацию, ДНК. Ген занимает определенное место на хромосоме. В норме, есть 23 идентичных пары хромосом (2 метра ДНК) в каждой клетке, в общей сложности 46 хромосом. Каждый партнер во время оплодотворения обычно предоставляет 23 хромосомы. Если яйцеклетка или сперматозоид имеют аномальную упаковку хромосом, эмбрион, который они создают, также будет иметь хромосомные аномалии. Иногда это связано с перестройкой хромосом, или недостатком части хромосомы. В некоторых случаях есть отсутствующие хромосомы, или дополнительная хромосома (анеуплоидии), ведущие к наследственным заболеваниям. Любой эмбрион, в котором отсутствует хромосома (моносомия) перестанет расти до имплантации (фатальная аномалия). Если анеуплоидии включают хромосомы 13, 18, 21, Х или Y, беременность может дойти до родов. Наиболее распространенной из этих несмертельных аномалий является трисомия 21, или синдром Дауна, при которой присутствует дополнительная 21-я хромосома. Другие включают синдром Тернера у женщин и синдром Клайнфельтера у мужчин.
История преимплантационной генетической диагностики (ПГД)
Как передаются по наследству генетические заболевания
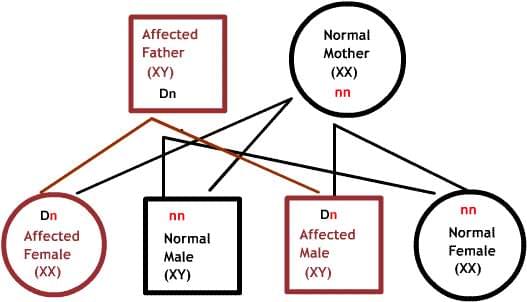
В диаграммах ниже, D или d представляет дефектный ген, а N или n представляет нормальный ген. Мутации не всегда приводят к болезни.
Доминантные заболевания:
Один из родителей имеет один дефектный ген, который доминирует над своей нормальной парой. Так как потомки наследуют половину своего генетического материала от каждого из родителей, есть 50% риск наследования дефектного гена, и, следовательно, заболевания.
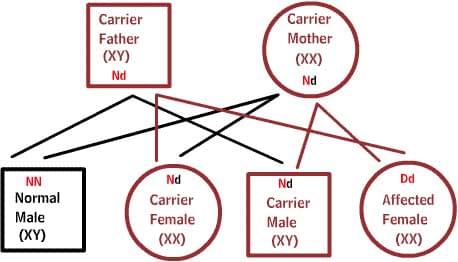
Рецессивные заболевания:
Оба родителя являются носителями одного дефектного гена, но при этом имеют нормальную пару гена. Для наследования заболевания необходимы две дефектных копии гена. Каждый потомок имеет 50% шанс быть носителем, и 25% шанс унаследовать заболевание.
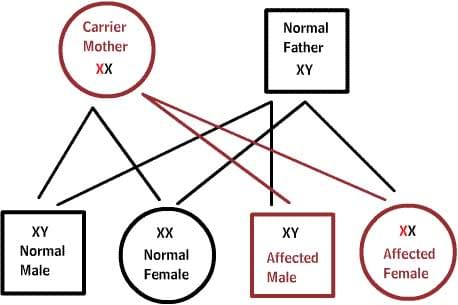
X-сцепленные заболевания:
Нормальные женщины имеют XX хромосомы, а нормальные мужчины XY. Женщины, которые имеют нормальный ген на одной из Х-хромосом, защищены от дефектного гена на их другой Х-хромосоме. Однако, у мужчины отсутствует такая защита в связи с наличием только одной Х-хромосомы. Каждый мужской потомок от матери, которая несет в себе дефект, имеет 50% шанс унаследовать дефектный ген и заболевание. Каждый женский потомок имеет 50% шанс быть носителем, как и ее мать. (на рисунке ниже X представляет нормальный ген а X представляет дефектный ген)
Возможные преимущества генетического анализа
Преимплантационная генетическая диагностика позволяет отобрать и перенести не измененные (хромосомно нормальные) эмбрионы, которые могут привести к большей частоте имплантации на эмбрион, сокращению потерь беременности и рождению большего числа здоровых детей. Генетическая диагностика предлагает парам альтернативу мучительному выбору по поводу того, чтобы прервать пострадавшую беременность после пренатальной диагностики, производимой путем амниоцентеза или биопсии ворсин хориона (CVS) на более поздних стадиях беременности. Почти все генетически связанные заболевания, которые могут быть диагностированы в перинатальном периоде либо амниоцентезом или CVS, могут быть обнаружены и ПГД. Процедура должна уменьшить психологическую травму для пар, которые несут повышенный риск генетических заболеваний для потомства.
Преимущества преимплантационной генетической диагностики (ПГД) могут включать в себя:
- Была выдвинута гипотеза, что негативный отбор анеуплоидных эмбрионов позволит улучшить частоту имплантации, из-за корреляции между старшим возрастом матери и хромосомно аномальными эмбрионами. Хромосомно нормальные эмбрионы имеют в перспективе более высокие шансы на развитие. При переносе только хромосомно нормальных эмбрионов в матку, ваши шансы на невынашивание могут уменьшиться, а ваши шансы забеременеть могут увеличиться. Двадцать один процент спонтанных абортов обусловлены численными хромосомными нарушениями, и основным фактором риска является возраст матери. Трисомии увеличиваются с 2% у женщин 25 лет до 19% у женщин старше 40 лет. По данным ASRM-SART, 52% циклов ЭКО в США осуществляется для женщин 35 лет и старше, что показывает, что популяция ЭКО может получить большую пользу от скрининга хромосомных анеуплоидий. Важно отметить, что вероятность наступления беременности и родов здоровым ребенком, однако, снижается у пациентов старше 34 лет (как правило, менее 50%) из-за проблем, связанных с процедурой ЭКО.
- ПГД в состоянии идентифицировать большинство хромосомных аномалий с риском развития до родов. В настоящее время применяется ПГД хромосомных аномалии для X, Y, 13, 14, 15, 16, 18, 21 и 22 хромосом. Это составляет 70% анеуплоидий, обнаруживаемых при спонтанных абортах.
- Вполне возможно, что некоторая информация о ваших собственных яйцеклетках и эмбрионах может быть полезной для вас в случае дальнейших попыток ЭКО, или поможет объяснить прошлые неудачи при естественном зачатии или ЭКО.
- Будущие пациенты могут извлечь выгоду из информации, полученной от ПГД о связи между хромосомами, неразвивающимися или неимплантирующимися эмбрионами.
Возможные риски генетического анализа
- В лучшем случае, с помощью методов ПГД могут быть обнаружены около 90% от аномальных эмбрионов.
- Относительно большое число яйцеклеток или эмбрионов могут быть признаны ненормальными и поэтому для переноса останется только несколько эмбрионов. В некоторых случаях (11%), может не быть нормальных яйцеклеток или эмбрионов. В этих случаях перенос эмбриона не рекомендуется. Хотя это и разочаровывающий результат, вполне вероятно, что цикл ЭКО без ПГД не привел бы к беременности или привел бы к аномалиям у плода.
- Клетки, которые будут удалены, изучаются с помощью специализированных новых методов. Такие процедуры иногда не могут быть проведены из-за технических сложностей.
- Не все хромосомные или генетические отклонения могут быть определены пир помощи данных методов, так как в ходе одной процедуры может быть диагностировано только ограниченное число хромосом.
- Вполне возможно, что нормальный эмбрион может быть неправильно определен как ненормальный, и не перенесен, или что аномальный эмбрион неправильно определен как нормальный и будет перенесен в матку. (ПГД в настоящее время не является заменой для пренатальной диагностики. Рекомендуется проведение пренатальной диагностики для подтвердения диагноза).
- При удалении клеток может случайно произойти повреждение эмбриона (0,1%).
- Неявные технические обстоятельства в лаборатории могут привести к неудаче процесса тестирования, что приводит к отсутствию результатов. Неудача процесса тестирования не оказывает никакого влияния на ваш эмбрион. В этом случае, эмбрионы для переноса будут отобраны на основе существующих критериев.
- Анализ одной клетки имеет свои ограничения. Иногда, хромосомные аномалии находятся в одной клетке, но не в других клетках того же эмбриона, или наоборот, что выражается мозаицизмом. Это может привести к переносу аномального эмбриона, или к отказу от нормального эмбриона.
- ПГД для определения транслокаций может определить наличие или отсутствие определенных хромосомных нарушений, но не может ни определить генетическое заболевание, ни предсказать генетические уродства.
- Даже после успешной процедуры ПГД беременность может не наступить.
Кандидаты для биопсии эмбриона и ПГД
Кандидаты для биопсии эмбриона и ПГД включают в себя:
- Женщины старше 34 лет: женщины рождаются со всеми яйцеклетками, которые они будут когда-нибудь иметь, и по мере старения женщины ее яйцеклетки подвергаются также воздействию этого процесса старения. Таким образом, вероятность зачатия хромосомно аномального потомство с возрастом увеличивается. В целом риск анеуплоидии увеличивается с 1 на 385 в возрасте 30 лет, до 1 на 179 в возрасте 35 лет, до 1 на 63 в возрасте 40 лет, и в возрасте до 45 лет возможность рождения больного ребенка составляет 1 к 19. В результате использования ПГД при ЭКО стало известно, что в действительности больее чем 20% эмбрионов у женщин в возрасте от 35 до 39 анеуплоидны, и страдают почти 40% эмбрионов у женщин старше 40 лет. Большинство из этих эмбрионов в случае переноса в матку либо не имплантируются или приводят к невынашиванию. Это считается основной причиной низкой частоты наступления беременности и родов женщин в возрасте 40 лет и старше. До внедрения ПГД, для увеличения шансов на зачатие в матку переносилось большее число эмбрионов. По-прежнему настоятельно рекомендуется проведение пренатальной диагностики после цикла ЭКО, поскольку это подтверждает прогноз нормального потомства. Возможно также, что аномальные эмбрионы могут быть ошибочно определены как нормальные и перенесены в матку.
- Женщины с рецидивирующей потерей беременности (привычным невынашиванием): мужчина или женщина пары может иметь ненормальную упаковку хромосом, что может вызвать фатальные аномалии в некоторых беременностях, но не в других.
- Пары с транслокациями: транслокации – это изменения в конфигурации хромосом, при которых хромосомы прикрепляются друг к другу (робертсоновские) или участки разных хромосомах меняются местами (взаимные или реципрокные). Примерно 1 из 900 человек имеет робертсоновские транслокации с участием хромосом 13, 14, 15, 21, 22. Примерно 1 из 625 человек имеет взаимные транслокации. Для выявления наличия транслокаций может быть проведено кариотипирование обоих партнеров. Пары с транслокациями могут иметь периодические потери беременности, или потомство с психическими или физическими проблемами. При сбалансированной транслокации, когда нет дополнительного или отсутствия хромосомного материала, и разрыв в хромосоме не нарушает функции генов, человек не страдает. Носители сбалансированных транслокаций могут быть затронуты сложными врожденными пороками развития, которые могут или не могут быть связаны с наследственным заболеванием. При несбалансированной транслокации, при которой существует или отсутствует дополнительный материал хромосом, отдельные личности, как правило, не будут затронуты, хотя у некоторых будет наблюдаться снижение фертильности. Однако существует риск того, что яйцеклетки или сперматозоиды от такого человека могут иметь несбалансированные транслокации, в результате чего эмбрион будет несбалансированным. Это может привести к неудаче имплантации, повторному невынашиванию, или потомству с психическими или физическими проблемами.
- Пары с аутосомно-доминантными заболеваниями, при которых будут затронуты 50% эмбрионов. Пары, которые имеют данные нарушения в семейном анамнезе, или являются носителями, или страдают от наследуемых заболеваний.
Пары с повторными неудачами ЭКО.
- Пары с историей бесплодия могут быть в состоянии определить этиологию, и, следовательно, выбрать соответствующее лечение.
- Парам из группы риска для наследования потомством болезни с угрозой для жизни, болезни с поздним началом (болезнь Хантингтона), предпочтительно планировать, выбрать соответствующие методы лечения, или ускорить процесс диагностики (например, ранней диагностики рака молочной железы)
- Пары, желающие потомство для производства HLA-совпадающих стволовых клеток, для страдающего ребенка со смертельным заболеванием.
Используемые методы
Для анализа на наличие генетических дефектов эмбриона, из него необходимо удалить либо первое полярное тельце из неоплодотворенной яйцеклетки и/или 1 или 2 клетки от каждого эмбриона. Это называется биопсией яйцеклетки или эмбриона и обычно делается перед тем, как происходит оплодотворение, или через 3 дня после оплодотворения. Биопсия на 6-10 клеточной стадии не оказывает отрицательного влияния на преимплантационное развитие. На этом этапе каждая клетка имеет полный набор хромосом. Обычно из эмбриона удаляется только одна клетка, так как ожидается, что будут одинаковыми со всеми другими клетками в эмбрионе. Иногда необходимо удалить вторую клетку из эмбриона, например, если сигнал в первой не обнаружен. Для диагноза предрасположенности с помощью первого и второго полярных телец, как показателей генетического статуса яйцеклетки, используется анализ методом FISH. Недостатком анализа полярных телец заключается в том, что он не принимает во внимание отцовские анеуплоидии.
Анализ биопсированной клетки использует один из двух методов:
- Флуоресцентная гибридизация in situ (FISH): биопсированная клетка фиксируется на предметном стекле, нагревается и охлаждается, и ее ДНК "помечается" цветными флуоресцентными красителями, называемыми зондами (маленькие кусочки ДНК, которые соответствуют исследуемым хромосомам), по одному для каждой определяемой хромосомы. В настоящее время может быть идентифицировано 8 из 23 хромосом. После завершения эмбриолог учитывает цвета под мощным микроскопом и в состоянии, в большинстве случаев, отличить нормальные от аномальных клеток. Этот процесс занимает около суток. Нормальные эмбрионы будут либо перенесены в матку на 4-й день после поиска яйцеклеток, или подвергнутся продленному культивированию и будут перенесены на 5-й день, как бластоцисты. Клетки, использовавшиеся для ПГД, больше не жизнеспособны, и не будут возвращены в эмбрион, но могут быть сохранены для будущих исследований.
- Полимеразная цепная реакция (ПЦР): методика, которая увеличивает количество копий специфичных регионов ДНК, чтобы произвести достаточное для анализа количество ДНК. ДНК является двухцепочечной (за исключением некоторых вирусов), и две цепи соединяются очень специфическим образом. "Последовательность кирпичиков" генов представляет собой определенный порядок появления 4-х различных дезоксирибонуклеотидов в сегменте ДНК. Эти 4 компонента: аденин (А), тимидин (T), цитозин (C), и гуанин (G). Последовательность этого 4-буквенного алфавита генерирует состав гена. При этой методике ДНК нагревают (денатурируют), чтобы разделить 2 нити. Далее добавляются праймеры и ДНК охлаждается, с тем чтобы опять образовались двойные нити. Затем в циклы добавляют ферменты, которые могут "прочитать" последовательность гена, что приводит к умножению ДНК. ПЦР используется для диагностики ген-специфических заболеваний, так же как и для выявления болезнетворных вирусов и/или бактерий, или в криминалистике в связи с подозрением в совершении преступления.
Вся информация носит ознакомительный характер. Если у вас возникли проблемы со здоровьем, то необходима консультация специалиста.

Согласно оценкам экспертов Всемирной организации здравоохранения, около 50 миллионов супружеских пар во всем мире (что составляет примерно 7% от их общего количества) не могут завести ребенка из-за мужского и/или женского бесплодия. На данный момент считается, что в 50% случаев причиной являются генетические нарушения.
Существует множество генов, влияющих на мужскую и женскую репродуктивную функцию. Например, в одних только яичках мужчины экспрессируется около 2300 генов. Наука продолжает развиваться, и список доступных анализов ежегодно пополняется новыми генетическими тестами.
Генетические изменения, способные приводить к невозможности зачатия и вынашивания беременности, бывают разными:
- хромосомные аномалии;
- изменения в отдельных генах (моногенные заболевания);
- эпигенетические изменения, когда меняется активность гена без нарушения последовательности ДНК;
- мультифакториальные заболевания – наследственная предрасположенность, которая реализуется при воздействии определенных факторов окружающей среды.
Хромосомные аномалии
Хромосомные нарушения представляют большой интерес в аспекте вопросов бесплодия, так как они ответственны более чем за половину всех выкидышей в первом триместре беременности. В большинстве случаев хромосомные аномалии не наследуются – они возникают случайно в половых клетках или клетках эмбриона. При этом происходят выкидыш, мертворождение, либо ребенок рождается с серьезными пороками развития.
В каждой клетке человеческого тела содержится 46 хромосом. В яйцеклетке и сперматозоиде их по 23 – соответственно, ребенок получает половину набора от матери и половину от отца. Состояние, при котором меняется количество хромосом, называется анеуплоидией. Некоторые примеры, связанные с бесплодием:
- синдром Тернера – Шерешевского, когда у девочки отсутствует одна X-хромосома (45, X);
- синдром Дауна – трисомия, при которой имеется одна добавочная 21 хромосома;
- синдром Клайнфельтера – добавочная X-хромосома у мужчины (47, XXY); это нарушение обнаруживается у 13% бесплодных мужчин с азооспермией – отсутствием сперматозоидов в эякуляте;
- 47, XYY – добавочная Y-хромосома, встречается у 0,1% мужчин, чаще всего у бесплодных;
- 47, XXX – добавочная X-хромосома, которая встречается у 0,1% женщин – это одна из наиболее распространенных причин преждевременной недостаточности яичников.
Помимо изменений количества хромосом, встречаются нарушения их структуры – аберрации.
Их основные разновидности:
- Делеция – выпадение участка хромосомы. При этом теряется часть генетического материала. Например, распространенная причина бесплодия у мужчин – микроделеции Y-хромосомы. Микроделеции встречаются у 15% пациентов с азооспермией (отсутствием сперматозоидов в эякуляте) и у 5% пациентов с олигозооспермией (снижением числа живых сперматозоидов в 1 мл эякулята).
- Дупликация – удвоение участка хромосомы.
- Инверсия – поворот участка хромосомы на 180 градусов.
- Транслокации – перенос участка одной хромосомы в другую.
Моногенные заболевания
Моногенные заболевания характеризуются возникновением мутации в одном гене, отвечающем за синтез определенного белка. Эти патологии передаются от родителей детям, причем типы наследования бывают разными.
- Аутосомно-доминантный. Все хромосомы в клетках человека являются парными (кроме XY у мужчин). Таким образом, каждый ген представлен двумя копиями. Если мутация произошла в доминантном гене, то для развития заболевания достаточно одной его копии.
- Аутосомно-рецессивный. В данном случае чтобы проявились симптомы заболевания, ребенок должен получить две копии дефектного гена – по одной от каждого из родителей. При этом сам родитель может быть здоров.
- X-сцепленный – мутация находится в X-хромосоме. От отца ее могут получить только дочери.
- Y-сцепленный – мутация в Y-хромосоме. Заболевание передается только от отцов к сыновьям.
- Митохондриальные заболевания. В клетках человека есть особые органеллы – митохондрии. Они содержат собственную ДНК, отдельно от той, что находится в хромосомах. И в ней тоже могут возникать нарушения. Ребенок наследует митохондриальную ДНК только от матери.
В настоящее время известно много моногенных мутаций, связанных с бесплодием. Их список постоянно пополняется.
Мультифакториальные заболевания
Типичные примеры мультифакториальных заболеваний – сахарный диабет и сердечно-сосудистые патологии. Среди причин женского бесплодия важное значение имеют следующие заболевания:
- Эндометриоз, который встречается у 5–10% женщин. Если это заболевание выявлено у ближайших родственников женщины (мать, родная сестра), то риски повышаются в 5–7 раз.
- Синдром поликистозных яичников (СПКЯ) диагностируют примерно у 7% женщин репродуктивного возраста. Обнаружен целый ряд генов, связанных с развитием этой патологии, также известно, что женщины с СПКЯ часто страдают ожирением, сахарным диабетом II типа.
Эпигенетические изменения
Эпигенетические изменения возникают в результате различных процессов, когда последовательность ДНК остается нормальной, но меняется активность генов. Например, это происходит в результате метилирования – прикрепления особых метильных групп к определенным участкам ДНК. Некоторые научные исследования показали, что эпигенетические механизмы играют роль в развитии бесплодия.

В каких случаях рекомендуется пройти генетическое тестирование?
Обычно врачи направляют пациентов на консультации к клиническим генетикам в следующих случаях:
- бесплодие, причину которого не удается установить;
- выкидыши и мертворождения во время всех предыдущих беременностей;
- генетические нарушения у предыдущего ребенка;
- генетические нарушения у родственников;
- возраст матери старше 35 лет и отца старше 40 лет.
Генетик собирает семейный анамнез, анализирует родословную и при необходимости назначает анализы. Для диагностики причин генетического бесплодия применяют разные методы: цитогенетический анализ, полимеразную цепную реакцию (ПЦР), флуоресцентную гибридизацию in situ (FISH), микрочипирование, секвенирование нового поколения.
Чтобы выявить распространенные аномалии у плода, на 16–20-й неделях беременности проводят тройной тест. По показаниям выполняют различные инвазивные исследования. Более современный и точный метод диагностики – неинвазивное пренатальное тестирование (НИПТ), во время которого изучают ДНК плода в крови матери.
Если у одного или обоих партнеров из пары, страдающей бесплодием, выявляют генетические нарушения, в ряде случаев могут помочь различные методы лечения или вспомогательные репродуктивные технологии (ЭКО, ИКСИ). Но иногда проблему не удается решить. В таких ситуациях врач предложит рассмотреть возможность использования донорских яйцеклеток или сперматозоидов.
Если вы решили сохранить собственные половые клетки или воспользоваться донорскими, важно подобрать надежный банк половых клеток. На данный момент Репробанк является одним из крупнейших на территории России и СНГ. Наше криохранилище оснащено новейшим оборудованием, а в каталоге представлено большое количество доноров, среди которых любая пара наверняка сможет подобрать подходящего.

Зиновьева Юлия Михайловна
Ведёт генетическое обследование доноров Репробанка, осуществляет подбор доноров для пар, имеющих ранее рождённых детей с установленной генетической патологией.
Появление на свет ребенка с врожденными дефектами развития всегда ошеломляет семью; эта тема - одна из самых тяжелых в акушерстве. Супруги в первый момент испытывают ни с чем не сравнимый психологический шок, который затем переходит в чувство вины, им кажется, что у них уже никогда не будет здорового ребенка.
Следует сразу сказать, что ребенок с врожденными пороками может появиться на свет абсолютно в любой семье - молодой, здоровой, без вредных привычек, с нормально протекающей беременностью. По данным многолетней статистики, во всем мире около 5% детей рождается с врожденными заболеваниями.
Врожденные пороки развития плода можно разделить на две большие группы - наследственно обусловленные (то есть заложенные в генах и хромосомах, передающиеся по наследству) и собственно врожденные (приобретенные в ходе внутриутробного развития). Такое деление довольно условно, так как большинство дефектов развития вызываются сочетанием наследственной предрасположенности и неблагоприятного внешнего воздействия, представляя собой мультифакториальные аномалии.
Проблема врожденных пороков развития плода очень многообразна, изучением этого вопроса занимаются различные специалисты - генетики, неонатологи, эмбриологи, специалисты по дородовой (пренатальной) диагностике. Разобраться в причинах всегда бывает непросто.
Наследственно обусловленные заболевания
В основе наследственно обусловленных заболеваний лежат мутации. Благодаря современным леденящим кровь триллерам, слово это вызывает сейчас у многих почти суеверный ужас. На самом деле латинское слово mutatio означает "изменение" - не более того. Мутация - это изменение наследственных свойств организма в результате перестроек в структурах, ответственных за хранение и передачу генетической информации. Заболевания, связанные с патологическими изменениями в хромосомах, обычно так и называют хромосомными заболеваниями. Под собственно наследственными заболеваниями понимают нарушения, обусловленные генными мутациями.
В ядрах соматических (неполовых) клеток содержится по 23 пары хромосом, из которых одна пара - половые хромосомы. У женщин эта пара состоит из двух одинаковых хромосом, условно называемых Х-хромосомами, у мужчин эти хромосомы разные - Х-хромосома и Y-хромосома. Неполовые хромосомы называются аутосомами.
В половых клетках хромосом в два раза меньше - не 23 пары, а 23 штуки.
При оплодотворении ядра яйцеклетки и сперматозоида сливаются, и будущий человечек получает полный набор хромосом, наследуя таким образом и материнские, и отцовские признаки.
Хромосомы состоят из генов. За каждый признак в организме отвечает пара генов - "мамин" и "папин". (Исключение составляет XY-пара половых хромосом у мужчин: не все гены Х-хромосомы имеют "напарников" в Y-хромосоме.) В каждой паре один ген доминирует (доминантный ген), т.е. проявляется обусловленный им вариант признака, другой - "уступает" (рецессивный ген). При неблагоприятном стечении обстоятельств оба гена в паре или один из них могут оказаться носителями патологического признака. В первом случае их "владелец", без сомнения, болен. Если же мы имеем дело лишь с одним "больным" геном, возможны два варианта: (1) за заболевание "отвечает" доминантный ген - тогда его носитель болен; (2) носитель патологического признака - рецессивный ген - тогда человек здоров (точнее, как говорят врачи, фенотипически здоров, т.е. при наличии "больного" гена в генотипе, отсутствуют какие-либо проявления болезни).
Аутосомно-доминантный тип наследования
Носитель патологического признака - доминантный ген, содержащийся в аутосоме (неполовой хромосоме). При этом типе наследования невозможно рождение больного ребенка у здоровых родителей - хотя бы один из родителей страдает от того же заболевания. При этом мальчики и девочки в равной степени подвержены заболеванию. Такие дефекты развития, как правило, бывают негрубыми и после успешной коррекции не препятствуют нормальной жизни.
Аутосомно-рецессивный тип наследования
Носитель патологического признака - рецессивный ген, содержащийся в аутосоме. При аутосомно-рецессивном механизме наследования ситуация выглядит парадоксально - у здоровых родителей вдруг появляется на свет ребенок с дефектами развития, порой тяжелейшими и даже несовместимыми с жизнью. Причина - носительство обоими супругами в скрытом состоянии мутантных рецессивных генов. При этом рождение больного ребенка не обязательно означает, что все следующие дети будут страдать тем же заболеванием. Так же, как и в аутосомно-доминантном типе, мальчики и девочки в равной степени подвержены заболеванию.
Сцепленное с полом рецессивное наследование
Пороки развития, сцепленные с полом, в основном обусловлены рецессивными мутациями в женской половой хромосоме (этот тип наследования называют еще Х-хромосомным). Такой признак всегда передается через мать - носительницу рецессивного "больного" гена (т.е. сама женщина здорова). Практически все пораженные - мужчины (у пораженного гена Х-хромосомы в Y-хромосоме отсутствует "партнер", который мог бы доминировать над ним). Больной мужчина никогда не передает заболевания своим сыновьям (ведь они получают от него "здоровую" Y-, а не мутантную Х-хромосому), однако все его дочери будут носительницами "рокового" гена.
Мы схематически описали типы наследования, чтобы дать читателю общее представление о сути этих механизмов. На самом деле все гораздо сложнее - куда менее однозначно и определенно.
В приведенной ниже таблице перечислены в качестве примера лишь некоторые из совместимых с жизнью наследственных аномалий
Механизм наследования
Лечебно-реабилитационные меры
Аутосомно-рецессивное наследование - возможно рождение ребенка-альбиноса от здоровых родителей. Частота в популяции 1:20 000
Отсутствие нормальной пигментации кожи, волос, радужной оболочки глаза
Эта наследственная аномалия не считается заболеванием в полном смысле этого слова и лечению не подлежит
Сцепленное с полом рецессивное наследование. Болеют главным образом мужчины. Передается от матери сыновьям
Заболевание обусловлено дефицитом некоторых факторов свертывания крови. Проявляется кровоточивостью
Лечение при кровотечении - переливание крови, плазмы; кровоостанавливающие средства общего действия; антигемофильный глобулин; профилактика травм и кровотечений
Сцепленное с полом рецессивное наследование. Наблюдается преимущественно у мужчин. Передается от матери сыновьям
Частичная цветовая слепота. Распространяется чаще всего на красный и зеленый цвета
Расстройство цветового зрения выявляют при помощи специальных таблиц или спектральных приборов. Дальтонизм лечению не подлежит
Хромосомная аномалия: у матери при созревании яйцеклетки под влиянием пока не выясненных причин в 21-й паре хромосом образуется 3 хромосомы вместо 2-х. Частота в популяции - 1:700
Одна из форм врожденного слабоумия. Степень психического недоразвития значительно колеблется. Больные в основном ласковы, добродушны, приветливы
Лечебная педагогика, основанная на склонности больных к подражательности. Обучение во вспомогательных школах, трудотерапия
Аутосомно-доминантное наследование, передается детям от родителей с врожденной формой заболевания
Опущение верхнего века вследствие недоразвития мышцы, поднимающей его
Врожденные мультифакториальные пороки развития
- Ионизирующее излучение (рентгеновские лучи, воздействие радиоактивных изотопов). Кроме прямого действия на генетический аппарат, ионизирующее излучение обладает токсическим эффектом и является причиной многих врожденных аномалий
- Тератогенные инфекции, т.е. инфекционные заболевания, передающиеся от матери плоду
- Медикаменты. Нет лекарств, которые могут быть безоговорочно признаны полностью безопасными, особенно на ранних стадиях беременности. Во время беременности лучше воздержаться от приема лекарств любого типа - за исключением, конечно, случаев, когда это необходимо для спасения жизни или ликвидации серьезной угрозы для здоровья матери или плода
- Алкоголь. Употребление алкоголя приводит к разнообразным врожденным нарушениям, выраженность которых зависит от количества употребляемого алкоголя - особенно на ранних стадиях беременности. Фетальный (т.е. поражающий плод) алкогольный синдром - тяжелейшее врожденное заболевание, порой несовместимое с жизнью.
- Никотин. Курение сигарет во время беременности приводит к отставанию ребенка в физическом развитии
- Воздействие токсических химических веществ
Зачастую, однако, в развитии врожденных пороков играет роль такой фактор, как наследственная предрасположенность: известно, что если у родителей или ближайших родственников наблюдались врожденные пороки развития, то риск родить ребенка со сходными дефектами повышается, то есть речь идет "о семейном накоплении" аномалий развития. Так, у женщины с врожденным пороком сердца шансы родить ребенка с дефектом развития сердечно-сосудистой системы несколько выше, чем у всех остальных женщин. Поэтому принято говорить не столько о просто врожденных, сколько о врожденных мультифакториальных пороках развития. Тем не менее, на большом статистическом материале показано, что повторный риск рождения ребенка с врожденным пороком развития невелик - в среднем 2-4%.
Приведем несколько примеров совместимых с жизнью врожденных мультифакториальных пороков развития
Дефект развития
Выхождение внутренних органов или глубоких тканей из полостей, обычно занимаемых ими, под кожу или в межмышечную клетчатку без нарушения целости покровов
Массаж, в случае его неэффективности - хирургическое лечение
Врожденный вывих и врожденная дисплазия тазобедренного сустава
Врожденная дисплазия тазобедренного сустава - недоразвитие тканей тазобедренного сустава, отсутствие соответствия между суставными поверхностями - состояние, предшествующее вывиху тазобедренного сустава
При дисплазии - применение различных ортезов (приспособлений для отведения бедер) у детей до года. При вывихе - вправление, наложение специальных ортезов в первые месяцы жизни. При безрезультатности такого лечения - хирургическая операция.
Незаращение верхней губы (заячья губа)
Несращение боковых частей верхней губы с ее средней частью. Может быть односторонним и двусторонним. Затрудняет сосание
Хирургическая операция в первые месяцы жизни
Незаращение неба (волчья пасть)
Незаращение верхней челюсти и твердого неба, в результате чего получается расщелина, соединяющая полости рта и носа. Вызывает нарушение питания (попадание пищи в дыхательное горло, в полость носа), дыхания и речи. Часто сочетается с расщелиной в верхней губе
Хирургическая операция и протезирование; диспансерное наблюдение (смена лечебных аппаратов) до 16 лет
Полидактилия - многопалость, наличие лишних пальцев на кисти или стопе. Наиболее частый из врожденных пороков развития; чаще всего встречается в форме шестипалости, обычно на одной конечности.
Врожденный порок сердца
Неправильное внутриутробное формирование перегородки сердца (например, незаращение межпредсердной или межжелудочковой перегородки) либо сохранение после рождения особенностей внутриутробного кровообращения (например, открытый боталлов проток)
При незначительных дефектах межжелудочковой перегородки по мере роста сердца относительный размер отверстия уменьшается - вплоть до полного спонтанного закрытия. В других случаях - хирургическое лечение
Хотелось бы еще раз подчеркнуть, что когда речь идет о врожденных пороках развития, вопрос "Кто виноват?" не только непродуктивен, но и вреден, потому что отвлекает внимание от главного вопроса - "Что делать?". Поговорим на эту тему.
Что делать, если вы планируете беременность
- мужчины и женщины, в чьих семьях уже встречалось то или иное наследственное заболевание, - даже если сами они не больны
- семьи, где уже есть дети, страдающие врожденными пороками развития
- семьи, в которых предыдущие беременности заканчивались выкидышами или мертворождениями
- супруги, состоящие в родстве (например двоюродные и троюродные братья и сестры)
- женщины старше 35 и мужчины старше 50 лет
- мужчины и женщины, в связи со своим родом деятельности, состоянием здоровья или по каким-то иным причинам подвергающиеся воздействию перечисленных выше тератогенных факторов
Во всех этих случаях мы настоятельно рекомендуем партнерам, планирующим беременность, посетить медико-генетическую консультацию. Специалисты-генетики составят родословную, определят риск рождения ребенка с наследственным заболеванием. Нынешний уровень развития медицинских технологий позволяет сегодня в случае неблагоприятного прогноза прибегнуть к искусственному осеменению спермой донора или оплодотворению донорской яйцеклетки. Кроме того, следует по возможности исключить или свести к минимуму воздействие тератогенных факторов.
Что делать, если вы ждете ребенка?
Если вы ждете ребенка и входите в одну из перечисленных "групп риска". Первым шагом и в этом случае должен быть визит в медико-генетическую консультацию. Говорить об этом невесело, но бывают - хотя и очень редко - ситуации, когда на основании одной только родословной генетики приходят к заключению, что плод поражен заболеванием, несовместимым с жизнью. В таком случае, конечно, рекомендуется прерывание беременности. Однако, повторимся, случаи эти очень и очень редки. Как правило, специалисты медико-генетической консультации занимаются не диагностикой, а оценкой риска рождения ребенка с тяжелыми аномалиями и на основании этой оценки рекомендуют тот или иной метод пренатальной диагностики . Далее решение принимается в зависимости от результатов исследования. Насколько на самом деле высок риск родить ребенка с пороками развития, может решить лишь специалист. Не торопитесь делать аборт, если вы прочитали в аннотации, что лекарственный препарат, который вы принимали в самом начале беременности, не рекомендуется использовать в этот период; если принимали алкоголь, наркотики или перенесли острую респираторную вирусную инфекцию, сделали рентгеновский снимок на фоне беременности и т.п. Обязательно обратитесь в медико-генетическую консультацию, где сумеют правильно оценить реальный риск и порекомендуют необходимый комплекс исследований.
Что делать, если у вас родился ребенок с врожденным пороком развития
За окончательной медико-генетической консультацией по поводу прогноза на будущее лучше обратиться через 2-3 месяца, когда спадет психологическая напряженность и супруги смогут более объективно воспринимать такого рода информацию. Для большинства семей последующие беременности бывают успешными. Возможности пренатальной диагностики добавляют уверенности в благополучном исходе и врачам, и пациентам.
Имеются противопоказания. Ознакомьтесь с инструкцией или проконсультируйтесь у специалиста.
Читайте также:

