В хемостатных процессах культивирования посевной материал подается
Добавил пользователь Алексей Ф. Обновлено: 19.09.2024
Классификация непрерывного культивирования микроорганизмов. Концентрации биомассы и лимитирующего рост субстрата. Критическая скорость разбавления. Хемостатный реактор с рециклом по биомассе и культуральной жидкости. Специальные цели хемостатной культуры.
Краткое сожержание материала:
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
Непрерывное культивирование микроорганизмов
Выполниластудентка группы 09БТ
Алексеева А.С.
к.б.н., доц. Кузьмин А.А.
д.т.н., профессор Таранцева К.Р.
Студенту Алексеевой А.С. Группа 09БТ
Непрерывное культивирование микроорганизмов
Исходные данные (задание на проектирование)
- 1. Кассификация непрерывного культивирования микроорганизмов
- 2. Непрерывный процесс культивирования
- 3. Общие принципы хемостата
- 3.2 Концентрации биомассы и лимитирующего рост субстрата
- 3.3 Критическая скорость разбавления
- 4.1 Хемостатный реактор с рециклом по биомассе и культуральной жидкости
- 4.2 Каскад хемостатов
5. Специальные цели хемостатной культуры
Руководитель ………………….………………Кузьмин А.А.
Введение
Биотехнология - это наука, изучающая получение продуктов с непосредственным участием биологических объектов, коими могут являться организмы, органы, ткани животных или человека. Тем не менее, как правило, в этих целях используются одноклеточные микроорганизмы, либо клетки растений или животных.
Биотехнология является механизмом, который, используя вышеназванные продукты жизнедеятельности в качестве сырья, помогает получать огромное количество очень важных веществ, а именно:
* В области медицины: витамины, аминокислоты, ферменты, вакцины, антибиотики, антитела, иммуномодуляторы, и другие не менее важные вещества.
* В области ветеринарии и сельского хозяйства: инсектициды, вакцины, гормоны, липиды, спирты и пр.
* В химической промышленности: бутанол, ацетон.
* В энергетической промышленности: этанол, биогаз.
Из этого можно сделать заключение, что главной целью биотехнологии является разработка и производство лечебный, профилактических и диагностических препаратов. Кроме того, важными задачами выступают такие, как: обеспечение всевозможных технологических механизмов в разных отраслях промышленности; возрастающее участие в экологических мероприятиях; решение различных вопросов продовольствия.
Роль промышленного производства в биотехнологии включает в себя следующие принципы: брожение, биоконверсия, культивирование клеток, вирусов и бактерий, а также различные генетические процессы. Так как подобные вещи требуют особого оборудования, на данный момент на благо биотехнологической промышленности служат различные специализированные учреждения, заводы, исследовательские институты. Несмотря на то, что благодаря биотехнологии ежегодно вырабатывается огромное количество антибиотиков, ферментов, кормового белка, аминокислот и многого другого, потребности в биотехнологической продукции постоянно растут. Поэтому биотехнология заслуженно получает огромное внимание к себе и хорошие ресурсы для дальнейшего развития.
1. Классификация непрерывного культивирования микроорганизмов
Культивирование продуцентов в промышленных условиях принято называть ферментацией. В зависимости от классификационного признака различают следующие типы ферментационных процессов:
· по отношению микроорганизмов продуцентов к кислороду: аэробные и анаэробные;
· по локализации продуцентов в питательной среде: глубинные и поверхностные;
· по условиям проведения процесса: периодические, полунепрерывные (отъемно-доливные, с подпиткой); непрерывные.
Непрерывные процессы. Различают два типа непрерывной (проточной) ферментации. Биореакторы полного смешения - жидкая фаза в них интенсивно перемешивается, постоянно подается питательная среда и отводится культуральная жидкость. Данные реакторы могут работать по принципу хемостата или турбидостата. В первом случае в системе поддерживается постоянная концентрация одного из компонентов среды, причем постоянный подвод клеток не обязателен, поскольку в начальном периоде проводят периодическое культивирование, а затем включают подачу жидкости с клетками или без них. Во втором случае в биореакторе поддерживают постоянную концентрацию клеток, регулируя скорость протока среды. При достижении определенной максимальной концентрации клеток подача среды может быть автоматически прекращена и процесс протекает некоторое время в периодических условиях. Биореакторы полного вытеснения (тубулярные). Среда протекает по турбулярному реактору без перемешивания, состав и концентрация питательных веществ, продуктивность неодинаково распределены по объему реактора; вместе со средой в реактор подаются клетки. Целью количественного описания процессов культивирования в биореакторах являются расчет и оптимизация производительности аппарата, определение рабочего объема.
2. Непрерывный процесс культивирования
Непрерывное культивирование перспективное. Его сущность заключается в том, что в ферментаторе поддерживаются постоянные условия среды, в результате чего микроорганизмы остаются в определенном физиологическом состоянии. Подается свежая питательная среда и удаляется избыток среды с продуктами метаболизма, поддерживается фаза экспоненциального роста.
Если для культивирования продуцента используется один ферментатор, то говорят о гомогенно-непрерывном процессе. Если же используется батарея, то это гетеро-непрерывный процесс, так как в каждом ферментаторе, соединенном в батарею, поддерживаются постоянные условия.
При непрерывном культивировании микроорганизмов отсутствует смена фаз развития культуры. В таких процессах скорость потока питательной среды и отвода культуральной жидкости из системы необходимо отрегулировать, чтобы концентрация клеток оставалась постоянной. В стерильных условиях непрерывный метод обеспечивает сохранение культуры в физиологически активном состоянии длительное время.
Поддержание динамики равновесия в реакторе осуществляется двумя методами: турбидостатным и хемостатным.
Хемостатный контроль проще, так как он происходит по входящему потоку. Этот метод регулирования применим ко всем типам микроорганизмов и клеток различных тканей животных и растений. Методы искусственного биосинтеза популяций микроорганизмов находят широкое применение в современной биологии и медицинской промышленности.
Выращивание полезной биомассы микроорганизмов (бактерий) производится в хемостатах. Биореактор в хемостатном режиме снабжен устройствами для вливания и выпуска питательной жидкости, имеет систему контроля скорости потока, перемешивание.
Термин хемостат (впервые был предложен Новиком и Сцилардом), обозначает лабораторное устройство микробиологии, в котором изучают динамику развития популяций микроорганизмов. Хемостат предназначен для непрерывного культивирования микроорганизмов и состоит из трех основных частей: герметичного резервуара, заполненного специальным раствором (субстратом), устройства подачи питающего субстрата и выходного отверстия для выхода приросшей биомассы.
Управление скоростью роста биомассы в хемостате осуществляется путем изменения концентрации питательного субстрата, которая регулируется либо скоростью подачи субстрата, либо скоростью вымывания (удаления) продуктов жизнедеятельности на выходе хемостата.
3. Общие принципы хемостата
Хемостат (рис. 1) представляет собой культуру, в которую с постоянной скоростью непрерывно подается свежая среда, а объем культуры поддерживается при этом на постоянном уровне путем непрерывного отлива части культуры. В идеале перемешивание в хемостате должно быть полным, т. е. капли поступающей в сосуд среды должны немедленно и однородно распределяться по всей культуре.
На практике это означает, что время, необходимое для перемешивания небольшого объема среды в культуре, должно быть значительно меньше, чем время замещения tr, равное V/F, где V -- объем, a F -- скорость течения среды.
Рассмотрим некую культуру, в которой рост биомассы лимитируется количеством одного-единственного субстрата, а все остальные компоненты среды находятся в избытке. Предположим, что вначале добавления среды не происходит и рост биомассы протекает так же, как и в периодической культуре. Затем, когда начнется поступление среды, рост культуры будет происходить в соответствии с одной из трех возможностей, изображенных на рис. 2. Первая возможность состоит в следующем: скорость вымывания биомассы окажется больше скорости роста и концентрация биомассы будет в результате пад.
Культивирование микроорганизмов в лабораторных условиях
Питательные среды в микробиологии, их классификация и разновидности, сферы и особенности использования. Культивирование аэробных и анаэробных микроорг.Непрерывное и периодическое культивирование микроорганизмов
По содержанию весь материал делится на три части:Статьи по математическому моделированию микробиологических процессов.Исследования свойств культур мик.Физиология и биохимия микроорганизмов. Принципы систематики микроорганизмов
Химический состав бактериальной клетки. Особенности питания бактерий. Механизмы транспорта веществ в бактериальную клетку. Типы биологического окислен.Управляемое культивирование микроводорослей
О конструировании культиваторовКонтроль и стабилизация физических параметров культивированияИнтенсивное стационарное культивирование хлореллыКультивир.В отличие от периодического культивирования в непрерывных процессах питательная среда подается непрерывно, удаление биомассы и продуктов ее жизнедеятельности также осуществляется непрерывно.
По такому принципу организуются 2 разновидности процессов непрерывного культивирования: процессы полного (идеального) смешения,или хемостатные процессы, и процессы полного вытеснения, или тубулярные процессы.
Установившиеся режимы непрерывного культивирования характеризуются постоян-ством концентрации микроорганизмов и удельной скорости роста популяции.
Непрерывное культивирование проводится в открытой динамической системе, которая может быть как гомогенной, так и гетерогенной. Эта система способна к длительной работе в постоянном установившемся режиме.
Хемостатные процессы непрерывного культивирования
Гомогенные системы идеального смешения
Любой периодический процесс можно перевести в непрерывно-проточный. Непрерывно-проточное культивирование открывает возможности для поддержания постоянных условий роста путем создания такого состава питательной среды, чтобы только один желаемый фактор лимитировал рост. Если в таком процессе плотность популяции определяется химическим составом среды (концентрацией лимитирующего рост фактора), его называют хемостатным культивированием.
Изменяя концентрацию лимитирующего рост фактора, можно изменять плотность популяции, т.е. изменяя скорость разбавления, можно получать режимы, обеспечивающие различную скорость роста популяции. При таком методе, регулируя скорость протока, можно воспроизвести любую точку роста периодической культуры.
В установившемся режиме скорость протока среды, отнесенная к единице объема культуры в ферментере, называется коэффициентом разбавления (D) и равняется удельной скорости роста. При этом культура находится в устойчивом стационарном состоянии динамического равновесия и обладает способностью самопроизвольно автоматически подстраиваться к изменениям условий.
При таком способе культивирования нельзя получить устойчивого состояния только при максимальной скорости роста. В хемостате практически можно только приблизиться к максимальной удельной скорости роста, но не достичь ее, потому что такая скорость роста соответствует критической скорости разбавления, при которой биомасса вымывается из ферментера, что является одним из существенных недостатков хемостата.
Одностадийный хемостат применяется при необходимости воспроизвести на протоке любую скорость роста клеток, кроме максимальной.
Двухстадийный хемостат позволяет создавать культуры при скорости роста, близкой к максимальной, и определять условия ее повышения. Для этого в первом ферментере ведется культивирование при скорости разбавления, меньшей чем удельная скорость роста, а во второй подается культура из первого.
Особенности двухстадийного хемостата:
1. Вымывания культуры во втором ферментере не происходит из-за непрерывного поступления культуры из первого. Следовательно, концентрация биомассы никогда не сможет стать равной нулю при любой скорости разбавления. Будет возрастать удельная скорость роста клеток и экономический коэффициент.
2. Концентрация субстрата во втором аппарате всегда меньше, чем в первом. Субстрат расходуется из запаса входящего потока. Это имеет значение в тех случаях, когда важен не только выход биомассы, но и ее чистота.
3. Концентрация биомассы во втором аппарате всегда выше, чем в первом (учитывается прирост биомассы).
4. Двухстадийный хемостат часто оказывается удобней для тех процессов, в которых целевым продуктом является не биомасса, а метаболиты.
Другой широко известный принцип управления процессом – турбидостат. В нем подача питательной среды осуществляется по команде фотоэлектрического элемента, регистрирующего оптическую плотность культуры. Скорость разбавления сама устанавливается в соответствии с заданной плотностью популяции. Этим
турбидостат отличается от хемостата, в котором фиксируется скорость разбавления, соответственно которой устанавливается концентрация биомассы.Хотя теоретически взаимосвязь между концентрацией биомассы и скоростью разбавления подчиняется одним и тем же закономерностям в хемостате и турбидостате, методы управления процессами различны. Турбидостат позволяет получать максимальные скорости роста, которые применяются при культивировании клеточных культур, фиксированных в стадии экспоненциального роста. Хемостаты же применяют при скоростях разбавления от самой низкой до только приближающейся к максимальной удельной скорости роста.
В настоящее время разработаны различные варианты непрерывного культивирования микроорганизмов, работающие по принципу турбидостата – pH-стат, оксистат, СО2-стат, теплостат, респиростат, вискозистат и т. д., названия которых соответствуют задаваемому параметру. Любой параметр, который изменяется в периодической культуре и на который существует датчик, может быть использован для управления ростом по типу турбидостата.
Управляющими параметрами могут быть комплексные параметры, например, содержание кислорода и углекислоты в отходящем воздухе, характеризующие дыхательный коэффициент.
Респиростат
Способ управления основан на использовании в качестве датчиков газоанализаторов кислорода или углекислого газа, измеряющих интенствность дыхания культуры. Эта величина пропорциональна росту, образованию продукта и поддержанию жизнедеятельности клеток, т.е. пропорциональна концентрации биомассы. Поэтому, регулируя интенсивность дыхания можно регулировать и концентрацию биомассы, а следовательно, скорость подачи субстрата (D). В респиростате задается определенная величина интенсивности дыхания, близкая к максимальной. В зависимости от этого при снижении интенсивности дыхания величину скорости разбавления повышают, и наоборот. Еще лучше не поддерживать дыхание на постоянном уровне, а все время искать скорость разбавления, обеспечивающую его максимум. Этот алгоритм управления легко реализуется с помощью современных систем управления процессами культивирования.
Оксистат
В этом способе управления подачу питательной среды в аппарат (скорость разбавления) осуществляют таким образом, чтобы поддерживать в среде постоянное, относительно малое значение концентрации растворенного кислорода, поскольку при минимальной концентрации растворенного кислорода достигается максимальная величина его потребления клетками микроорганизмов. Поддержанием потребления кислорода на минимально возможном уровне обеспечивается максимизация производительности процесса.
рН-стат. Активный рост микроорганизмов часто сопровождается закислением культуральной среды, в то время как замедление роста при недостатке субстрата вызывает защелачивание. Следовательно, величина рН может использоваться как параметр, в зависимости от которого в аппарат подается питательная среда. Скорость подачи регулируется таким образом, чтобы величина рН поддерживалась на некотором постоянном уровне. При этом исключают регулирование рН подачей в аппарат щелочи или кислоты.
Нутристат. В этом способе управления подача питательной среды в аппарат осуществляется так, чтобы поддерживать заданное значение концентрации субстрата на постоянном уровне для обеспечения максимальной скорости роста. Этот способ имеет неудобство: необходимо непрерывно измерять концентрацию субстрата в аппарате, что не всегда просто.
Теплостат
В обычных условиях культивирования температуру поддерживают на уровне оптимальной. Как правило, это обеспечивается путем регулирования подачи охлажденной воды в рубашку или змеевик аппарата. Когда при увеличении теплового потока повышается температура, регулятор увеличивает скорость подачи охлаждающей воды. При этом также увеличивается и скорость теплоотвода, что позволяет сохранять равновесие. В теплостате температура устанавливается самопроизвольно на уровне, при котором скорость биологического тепловыделения равна скорости отвода тепла в окружающую среду. Данный уровень обычно выше оптимального, что может замедлять процесс ферментации, хотя и обеспечивает его постоянную скорость. Способ управления широкого применения не имеет. Может быть использован, если по определенным причинам некий ценный целевой продукт выделяется при повышенных температурах.
В промышленности одностадийные хемостатные процессы ферментации применяется для получения микробной массы или тех продуктов, кинетика накопления которых повторяет кинетику роста биомассы.
Применение многостадийных систем позволяет получать культуру при любой скорости роста – от лаг-фазы до экспоненциальной и стационарной. Многостадийные системы обычно используются для получения вторичных продуктов микробного синтеза, кинетика накопления которых в той или иной степени отстает от кинетики роста биомассы.
Многостадийное культивирование с успехом применяется при получении органических кислот, этилового спирта и т. д. Батарея ферментеров применяется также для переработки высоких концентраций субстрата при получении продуктов как первой, так и второй фазы роста.
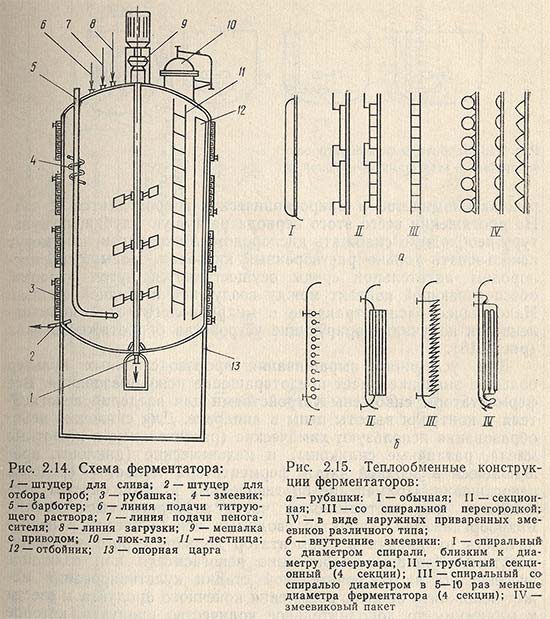
Получение конечного продукта метаболизма в производственном ферментаторе составляет основную и часто самую длительную стадию во всем технологическом цикле выращивания. Одно из основных требований, которое предъявляется к ферментатору, - сохранение стерильности при интенсивной аэрации питательной среды во время всего периода культивирования. Ферментатор (рис. 2.14) представляет собой герметичную цилиндрическую емкость со сферическими крышкой и днищем. Объем аппарата может быть от 0,01 до 100 м3. Высота ферментаторов в 2-2,5 раза превышает диаметр. Лучший материал для изготовления ферментатора - нержавеющая сталь.
Ферментатор снабжен термостатирующим, перемешивающим, аэрирующим и регулирующим pH среды устройствами, оборудован системой подачи питательной среды, пеногасителя, воды, пара и т. д. Тепло, выделяемое в период роста микроорганизмов, отводится с помощью различных теплообменных конструкций. Это прежде всего внутренние, спиральные, трубчатые змеевики (рис. 2.15).
С помощью змеевиков стерилизуют также ферментаторы, пропуская пар вместо охлаждающей воды. Для термостатирования процесса культивирования технологически наиболее выгодно использование теплоизоляционных материалов. Введение внутрь ферментатора дополнительных змеевиков затрудняет его стерилизацию и мойку.
Производственное культивирование проводят в стерильных условиях. Перед заполнением ферментатора питательной средой его моют, проверяют на герметичность, стерилизуют. Одновременно с ферментатором паром стерилизуют также всю систему трубопроводов. В ферментатор, заполненный стерильной питательной средой (объем обычно не превышает 70 % общего объема аппарата), вводят посевной материал. Предварительно температуру и pH питательной среды доводят до оптимальных значений для данного микроорганизма-продуцента.
![Схема ферментатора. Теплообменные конструкции ферментаторов]()
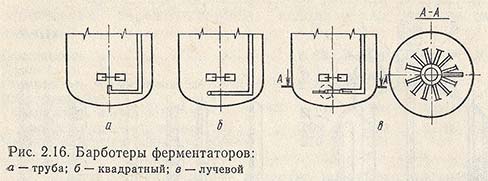
![Барботеры ферментаторов]()
Для успешного выращивания производственных культур большое значение имеет предотвращение пенообразования. Все ферментаторы снабжены устройствами для введения пеногасителя и контроля высоты пены в аппарате. Для снижения пенообразования используют химические (растительные и животные масла, различные силиконы) и механические (циклоны, вращающиеся в верхней части ферментатора лопасти) средства пеногашения. Применение противопенных агентов следует расценивать как неотъемлемую часть аэробного выращивания микроорганизмов. Характер вводимых пеногасителей и периодичность их подачи в ферментатор должны строго контролироваться. Излишнее добавление пеногасителя или излишнее внесение его на заключительной стадии культивирования может осложнить процесс выделения конечного продукта и свести к минимуму то дополнительное количество продукта, которое было получено во время производственного культивирования.
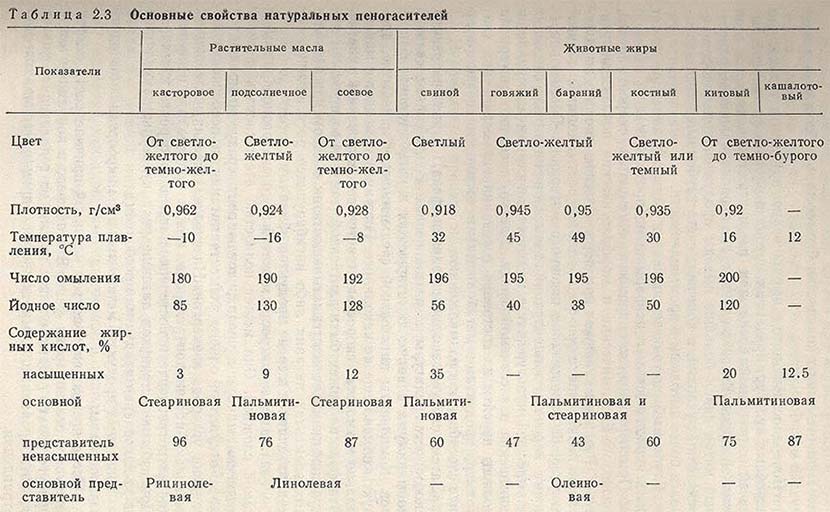
![Основные свойства натуральных пеногасителей]()
Характеристика некоторых натуральных пеногасителей приведена в табл. 2.3.
В процессе культивирования ведется постоянный контроль за состоянием культуры и накоплением продуктов биосинтеза, фиксируется потребление основных компонентов среды (углеводы, азот, фосфор), контролируется pH культуральной жидкости.
Методы культивирования
В микробиологической промышленности для выращивания микроорганизмов применяют поверхностный и глубинный методы. В общем виде их можно представить как ряд стадий, приводящих к получению из посевного материала (малое количество биомассы микроорганизмов) значительного количества биомассы или биомассы и продуктов метаболизма.
Поверхностный метод выращивания применим только для аэробных культур, причем их можно вырастить на твердой сыпучей питательной среде или на поверхности тонкого слоя жидкой среды. Во всех случаях, где первоначально поверхностный метод давал большие выходы продуктов при подборе определенных условий, в конечном счете глубинный метод оказывался более выгодным в промышленности.
Глубинный метод выращивания микроорганизмов может быть периодическим и непрерывным (проточным).
При периодическом процессе изменяются скорость роста, физиолого-биохимические и морфологические показатели культуры. Развитие культуры при периодическом способе выращивания начинается с лаг-фазы, длительность которой зависит от условий выращивания посевного материала. Обычно происходит перепад концентраций элементов питания - снижение в выросшей культуре, т. е. в готовом посевном материале, и повышение в засеваемой среде. Клетки посевного материала должны перейти из состояния голодания или отравления (например, продуктами метаболизма) в состояние, соответствующее способности к размножению.
Затем следует экспоненциальная фаза, характеризующая способность культуры к размножению. В этой фазе сведено до минимума влияние лимитирующих и ингибирующих факторов. Компоненты питательной среды имеются в избытке, продукты обмена еще не накопились. Рост культуры идет с максимально возможной скоростью, генетически заложенной в клетке. Эта фаза не может быть длительной, так как со временем популяция начинает испытывать недостаток в одном или нескольких элементах питания либо ингибирующее рост влияние накапливающихся в среде продуктов обмена.
Фаза замедления роста может быть очень разнообразной и самой сложной. Она может полностью отсутствовать на простых синтетических средах, когда рост сразу прекращается из-за отсутствия одного элемента питания, в особенности источника углерода и энергии. На сложных средах, содержащих несколько источников углерода, может происходить поочередное их потребление и постепенное замедление роста культуры. При избытке источников питания рост культуры замедляется из-за накопления продуктов метаболизма.
Токсичные продукты метаболизма у микроорганизмов очень разнообразны.
После прекращения по той или иной причине роста клеток наступает стационарная фаза. В этой фазе в популяции могут присутствовать разные клетки: живые, но голодающие, живые, но ингибированные, отмирающие по причине голодания или отравления.
Таким образом, микробные клетки при периодическом культивировании претерпевают значительные изменения в течение всего периода роста, обусловленные непрерывными изменениями окружающей среды и быстрой реакцией на них клеток.
Совсем другие условия развития культуры наблюдаются при непрерывном (проточном) культивировании, варианты которого различаются по способу поддержания культуры в динамическом равновесии.
Различают открытые и замкнутые системы непрерывного культивирования.
В открытых системах клетки постоянно вымываются вытекающей жидкостью со скоростью образования в системе новых клеток; в этих условиях легко достигается их устойчивая концентрация.
В замкнутых системах клетки в какой-то мере задерживаются в системе и их количество все возрастает. В этих условиях одни лимитирующие факторы сменяют другие, наконец, большая часть клеток отмирает, и такая система не в состоянии достигнуть установившегося динамического равновесия. Замкнутые системы значительно менее пригодны, чем открытые для осуществления точного регулирования всех условий культивирования, управления ими и автоматизации процесса.
Непрерывный процесс может быть гомогенно- и гетерогенно-непрерывным. При гомогенно-непрерывном процессе в ферментаторе с интенсивным перемешиванием все параметры (концентрация питательных веществ, скорость роста микроорганизмов) постоянны во времени. При гетерогенно-непрерывном процессе несколько ферментаторов соединяют в батарею. При этом не обеспечиваются постоянные условия роста клеток, так как в каждом ферментаторе поддерживаются постоянные условия культивирования, но отличные от условий в другом ферментаторе.
Метод проточного культивирования может быть организован как процесс полного вытеснения и как процесс полного смешения.
При процессе полного вытеснения сосуд для выращивания микроорганизмов представляет собой трубку (тубулярный ферментатор), в который подается питательная среда и посевной материал и из которого вытекает культура (рис. 2.17). Перемешивания культуры не производится. Этот процесс применим для культивирования анаэробных микроорганизмов. Когда среда и посевной материал поступают в ферментатор, клетки находятся в начале своего развития. По ходу трубки происходит развитие культуры, выражающееся в использовании субстрата, накоплении продуктов метаболизма, и перед вытеканием культура находится в состоянии, аналогичном стационарной фазе роста периодической культуры. Можно сказать, что в трубке воспроизводится полная кривая роста, но не во времени, а в пространстве. Подобная картина наблюдается в батарее проточных ферментаторов.
![Схема процессов непрерывного культивирования]()
В процессе полного смешения рост культуры происходит в емкости-ферментаторе при интенсивном перемешивании, достигаемом продуванием воздуха и работой мешалки. Во всей массе культуры, условия выращивания должны быть одинаковыми (гомогенно-непрерывный процесс).
При гомогенно-непрерывном процессе в ферментаторе могут быть созданы условия, соответствующие любой точке кривой роста культуры выращиваемой периодическим способом. При быстром протоке среды эти условия близки к условиям экспоненциального роста, при медленном - приближаются к условиям стационарной фазы. В установившемся режиме удельная скорость протока среды равна удельной скорости роста культуры. При этом культура находится в состоянии динамического равновесия и обладает способностью автоматически подстраиваться к изменениям условий. Если условия изменяются так, что рост ускоряется, то в ферментаторе повысится плотность популяции и установится новое стационарное состояние. Если рост замедлится, плотность популяции понизится. Если изменение условий будет временным, то при возвращении к исходным условиям установится первоначальное стационарное состояние.
При таком способе культивирования нельзя получить устойчивого состояния только при максимальной скорости роста. Незначительное повышение скорости протока или воздействие, замедляющее рост, приводят к тому, что скорость роста окажется меньше скорости протока и культура быстро вымоется из ферментатора.
Хорошо отработанный периодический процесс выращивания экономически выгодно воспроизводить проточным методом культивирования, так как культура непрерывно находится в состоянии максимальной активности и не тратится время на подготовку ферментатора, его заполнение, слив и на лаг-фазу.
При гомогенно-непрерывном культивировании можно осуществить недоступное при периодическом культивировании ограничение роста культуры одним элементом питания при нелимитируемых количествах остальных элементов. При медленном протоке ограничение роста будет сильным, при быстром - слабым. Такое непрерывное культивирование называется хемостатным (или хемостат), так как рост микроорганизмов регулируют химические факторы среды. При хемостатном культивировании соблюдаются два условия: 1) гомогенно-непрерывное культивирование ведется с определенной заданной скоростью протока среды; 2) компоненты среды подбираются таким образом, чтобы один элемент питания был в недостатке, тогда плотность популяции определяется его концентрацией. Все остальные элементы питания даются в избытке, а условия культивирования (температура, pH, аэрация) поддерживаются на оптимальном уровне.
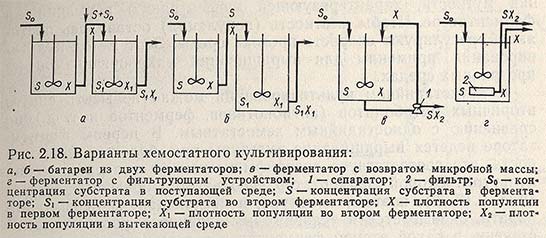
Хемостатный метод имеет большое число вариантов. Применение одностадийного культивирования позволяет воспроизвести любую скорость роста, кроме максимальной. Двухстадийное культивирование в двух последовательно соединенных ферментаторах позволяет достичь максимальной скорости роста и даже превзойти ее. Для этого в первом ферментаторе батареи ведется нормальное культивирование при скорости протока, меньшей максимально возможной скорости роста в одном аппарате, а во второй - подается культура из первого и свежая среда (рис. 2.18, а). Во втором ферментаторе повышается скорость протока вплоть до превышения максимально возможной скорости роста, а вымывания не происходит, так как из первого ферментатора непрерывно поступает культура.
![Варианты хемостатного культивирования]()
Максимальная скорость роста может быть достигнута при турбидостатном культивировании (в режиме турбидостата), при котором контроль за процессом осуществляется с помощью измерения концентрации микроорганизмов. Для этого ферментатор должен иметь устройство для нефелометрического измерения мутности, характеризующей концентрацию популяции в ферментаторе. Чтобы плотность (популяции) оставалась постоянной, регулируют скорость протока среды. Этот метод культивирования применим для выращивания микроорганизмов на прозрачных средах.
В двухстадийном культивировании можно повысить синтез вторичных метаболитов (антибиотиков, ферментов и т. д.) по сравнению с одностадийным хемостатным. В первом ферментаторе ведется выращивание культуры при большой скорости роста, что соответствует логарифмической фазе периодической культуры. Второй ферментатор используется большего объема (рис. 2.18, б), поэтому культура, поступающая из первого аппарата, оказывается в условиях замедленного роста в такой степени, в какой второй ферментатор содержит больше среды, чем первый. Это соответствует условиям стационарной фазы.
При низких концентрациях субстрата и невысокой плотности популяции можно возвратить в ферментатор часть клеток вместе с вытекающей из него культуральной жидкостью, чтобы повысить концентрацию клеток и ускорить процесс. Существует несколько вариантов возврата, например, сепарируют вытекающую культуру и сгущенную часть культуральной жидкости подают в ферментатор (рис.2.18,в).После ферментатора можно установить фильтрующее устройство, позволяющее вытекать культуральной жидкости, но задерживающее клетки (рис. 2.18, г).
Известны методы культивирования, занимающие промежуточное положение между непрерывным и периодическим:
1) отъемно-доливной - среда порциями подается в аппарат и также порциями отбирается из него;
2) добавление питания к периодической культуре без отбора культуры. Этот метод удлиняет время культивирования, но приводит к более полному использованию всех имеющихся в среде элементов питания, если постепенно добавлять, например, источник углерода.
В полунепрерывных системах полная загрузка и разгрузка ферментера осуществляются однократно, однако в процессе роста культуры часть ее сливается, а освободившийся объем заливается свежей питательной средой, т.е. функционирует отъемно-доливная или сливно-доливная система.
Следовательно, полунепрерывное культивирование характеризуется частотой и объемом сливаемой выросшей культуры и добавлением свежей питательной среды в рабочую емкость ферментера.
Установившиеся режимы полунепрерывного культивирования характеризуются колебанием концентрации микроорганизмов около одной итой же постоянной величиныи относительным постоянством средней удельной скорости роста популяции.
Полунепрерывное культивирование микроорганизмов осуществляется в открытой динамической гомогенной одностадийной системе в любом ферментере для периодического культивирования, оснащенном системой перемешивания и аэрации.
Различные варианты полунепрерывных систем используются в производстве дрожжей, водорослей, антибиотиков, лимонной кислоты и других.
Преимущества периодических и полунепрерывных процессов
Малая стоимость аппарата и системы управления.
Гибкость – возможность наработки в одном биореакторе разных продуктов.
Время культивирования можно произвольно менять.
Процесс меньше подвержен контаминации и мутациям клеток из-за отсутствия протока и относительно малого времени процесса.
Процесс удобен для получения малого количества продукта.
Условия культивирования можно поддерживать в оптимуме как в фазе роста биомассы, так и в фазе биосинтеза продукта, причем оптимальные условия для биомассы и продукта могут быть различны.
Процесс удобен для реализации биосинтеза вторичных метаболитов.
Недостатки периодических и полунепрерывных процессов
Необходимость частого приготовления посевного материала.
Большое непродуктивное время процесса.
В связи с необходимостью частой стерилизации быстрее изнашиваются измерительные приборы (датчики рН).
Производительность по биомассе и целевому продукту часто ниже, чем в непрерывных процессах.
Труднее поддерживать необходимые параметры.
Процесс более опасен для человека (аппарат чаще открывают, моют, что сопряжено с контактом с микроорганизмами и продуктами их жизнедеятельности).
Непрерывное культивирование
В отличие от периодического культивирования в непрерывных процессах питательная среда подается непрерывно, удаление биомассы и продуктов ее жизнедеятельности также осуществляется непрерывно.
По такому принципу организуются 2 разновидности процессов непрерывного культивирования: процессы полного (идеального) смешения,или хемостатные процессы, и процессы полного вытеснения, или тубулярные процессы.
Установившиеся режимы непрерывного культивирования характеризуются постоян-ством концентрации микроорганизмов и удельной скорости роста популяции.
Непрерывное культивирование проводится в открытой динамической системе, которая может быть как гомогенной, так и гетерогенной. Эта система способна к длительной работе в постоянном установившемся режиме.
Хемостатные процессы непрерывного культивирования
Гомогенные системы идеального смешенияЛюбой периодический процесс можно перевести в непрерывно-проточный. Непрерывно-проточное культивирование открывает возможности для поддержания постоянных условий роста путем создания такого состава питательной среды, чтобы только один желаемый фактор лимитировал рост. Если в таком процессе плотность популяции определяется химическим составом среды (концентрацией лимитирующего рост фактора), его называют хемостатным культивированием.
Изменяя концентрацию лимитирующего рост фактора, можно изменять плотность популяции, т.е. изменяя скорость разбавления, можно получать режимы, обеспечивающие различную скорость роста популяции. При таком методе, регулируя скорость протока, можно воспроизвести любую точку роста периодической культуры.
При таком способе культивирования нельзя получить устойчивого состояния только при максимальной скорости роста. В хемостате практически можно только приблизиться к максимальной удельной скорости роста, но не достичь ее, потому что такая скорость роста соответствует критической скорости разбавления, при которой биомасса вымывается из ферментера, что является одним из существенных недостатков хемостата.
![]()
Одностадийный хемостат применяется при необходимости воспроизвести на протоке любую скорость роста клеток, кроме максимальной.
Двухстадийный хемостат позволяет создавать культуры при скорости роста, близкой к максимальной, и определять условия ее повышения. Для этого в первом ферментере ведется культивирование при скорости разбавления, меньшей чем удельная скорость роста, а во второй подается культура из первого.
Особенности двухстадийного хемостата:
1. Вымывания культуры во втором ферментере не происходит из-за непрерывного поступления культуры из первого. Следовательно, концентрация биомассы никогда не сможет стать равной нулю при любой скорости разбавления. Будет возрастать удельная скорость роста клеток и экономический коэффициент.
2. Концентрация субстрата во втором аппарате всегда меньше, чем в первом. Субстрат расходуется из запаса входящего потока. Это имеет значение в тех случаях, когда важен не только выход биомассы, но и ее чистота.
3. Концентрация биомассы во втором аппарате всегда выше, чем в первом (учитывается прирост биомассы).
4. Двухстадийный хемостат часто оказывается удобней для тех процессов, в которых целевым продуктом является не биомасса, а метаболиты.
Турбидостат. В нем подача питательной среды осуществляется по команде фотоэлектрического элемента, регистрирующего оптическую плотность культуры. Скорость разбавления сама устанавливается в соответствии с заданной плотностью популяции. Этим турбидостат отличается от хемостата, в котором фиксируется скорость разбавления, соответственно которой устанавливается концентрация биомассы.
Хотя теоретически взаимосвязь между концентрацией биомассы и скоростью разбавления подчиняется одним и тем же закономерностям в хемостате и турбидостате, методы управления процессами различны. Турбидостат позволяет получать максимальные скорости роста, которые применяются при культивировании клеточных культур, фиксированных в стадии экспоненциального роста. Хемостаты же применяют при скоростях разбавления от самой низкой до только приближающейся к максимальной удельной скорости роста.
В настоящее время разработаны различные варианты непрерывного культивирования микроорганизмов, работающие по принципу турбидостата – pH-стат, оксистат, СО2-стат, теплостат, респиростат, вискозистат и т. д., названия которых соответствуют задаваемому параметру. Любой параметр, который изменяется в периодической культуре и на который существует датчик, может быть использован для управления ростом по типу турбидостата.
Управляющими параметрами могут быть комплексные параметры, например, содержание кислорода и углекислоты в отходящем воздухе, характеризующие дыхательный коэффициент.
Особенности получения и поддержания культивируемых линий животных клеток.
Культуры животных клеток
Идея о том, что клетки тканей животных можно выделить из организма и затем создать условия для роста и воспроизводства их in vitro, возникла на базе концепции, принадлежащей К. Бернару.
Чуть позже, в 1885 г., Рупоказал возможность сохранения вне организма живых тканей на практике. Он в течение нескольких дней поддерживал в жизнеспособном состоянии нервную пластинку куриного эмбриона в теплом солевом (физиологическом) растворе.
. Инкубация клеток сердца куриного эмбриона была начала 17 января 1913 г. Пересев клеток продолжил Эблинг, работая с ними 34 года. Поскольку Каррель был хирургом, весьма сведущим в вопросах асептики, он смог внести существенный вклад в культивирование клеток животных in vitro.
В этот же период был разработан очень существенный подход в технике работы с клетками – трипсинизация – для высвобождения клеток из тканевой матрицы. Впервые клоны клеток в культуре из одиночной клетки были получены Эрлом с сотрудниками в 1948 г.
Первые суспензионные культуры клеток животных, полученные в 1953 г. Оуенсом и сотрудниками, основывались на клетках злокачественных тканей. Это – клетки HeLa, выделенные из раковой опухоли шейки матки человекаИгл (1955)систематически исследовал пищевые потребности клеток человека и мыши.
До тех пор, пока в1961 г. ХейфликиМурхед не выделили линию диплоидных клеток человека (НDС) WI-38, считалось, что один раз установившаяся клеточная линия имеет неограниченное время жизни. Относительно линии WI-38 было показано, что период ее существования в культуре ограничивается приблизительно 50 генерациями. Перед отмиранием популяции для клеток этой линии характерен феномен старения. Однако при отмирании эти клетки оставались диплоидными и не имели признаков злокачественных изменений.
Предел,илилимит, Хейфлика – граница количества делений соматических клеток. Эта граница была найдена в культурах всех полностью дифференцированных клеток человека и других животных. Максимальное число делений различно в зависимости от типа клеток и еще сильнее различается в зависимости от организма. Для большинства человеческих клеток предел Хейфлика составляет 52 деления.
Последующий этап в истории культивирования диплоидных клеток человека связан с установлением факта, что они являются генетически стабильными и свободными от всех известных латентных и онкогенных вирусов. Поэтому линии диплоидных клеток человека разрешено применять для получения продуктов, предназначаемых для людей. Эта догма остается действующей и в настоящее время, хотя дальнейшие исследования отчетливо показали присутствие в клетках, выделенных из нормальных тканей, потенциальных онкогенов, идентичных тем, которые найдены в таких известных онкогенных вирусах, как вирус саркомы Рауса и вирус саркомы Молони.
В настоящее время практически любые клетки человека и животных могут быть введены в культуру и, тем самым, служить средством и объектом во многих исследованиях. Благодаря культивированию клеток возможности исследования и диагностики расширяются почти беспредельно, так как имеется возможность оценки не только морфологических и биохимических изменений, но и изменений в поведении клеток, их реакции на различные агенты, в том числе и на лекарственные воздействия.
Наиболее часто культивируются следующие элементы:
соединительной ткани – фибробласты;
скелетной – кость и хрящи;
мышечной – скелетные, сердечные и гладкие мышцы;
эпителиальной – печень, легкие, кожа, мочевой пузырь, почки, молочная железа;
нервной – глиальные клетки и нейроны (хотя они лишены способности к пролиферации);
эндокринной системы – гипофиз, надпочечники, клетки островков Лангерганса;
Читайте также: