Трансгенные растения устойчивые к насекомым вредителям
Добавил пользователь Евгений Кузнецов Обновлено: 19.09.2024
Об авторах
Все это так, но в изменении генома растений на самом деле нет ничего нового и революционного! Человек всегда так или иначе оказывал влияние на генетику растений, которые выращивал, хотя и понятия не имел о генах.
Путь к современным культурным растениям, которые мы употребляем в пищу, начался примерно 10 тыс. лет назад, когда появилось сельское хозяйство. Человек выбирал самые здоровые и пригодные для еды растения и планомерно их выращивал. В сельском хозяйстве нет места закону естественного отбора: согласно закону человека (искусственному отбору), выживает только то растение, которое отвечает его запросам.
Ярким примером расхождения целей естественного отбора и селекции служит кукуруза. У предка этого злака зерна при созревании легко отделялись от початка и падали на землю. Такая кукуруза прекрасно размножалась, но человек неизбежно терял большую часть урожая. Что же мы видим теперь? Ядра современной кукурузы на момент зрелости прочно прикреплены к початку. Так же обстоит дело и с другими зерновыми культурами — рисом, ячменем, пшеницей.
Все эти новые виды культурных растений, по сути, являются результатом модификации генома разными способами, например, путем скрещивания разных сортов, что приводит к появлению совершенно новых культурных форм. Огромный материал для искусственного (так же как и для естественного) отбора предоставляет природный мутационный процесс. Ведь спонтанные мутации (изменения) в ДНК растений происходят постоянно, например, в результате действия солнечного излучения. И если такая мутация приводит к появлению особей с заметными положительными отличиями, их остается только тиражировать — вот и вся селекция. Примером служит большое разнообразие современных овощей семейства крестоцветных: брокколи, цветная и белокочанная капуста происходят от одного общего предка (Kempin et al., 1995).
Дальше — больше. За последние 80 лет люди получили более 3 тыс. новых сортов растений, воздействуя на исходные формы излучением или химическими реагентами, чтобы вызвать непредсказуемые мутации в ДНК. Растения, полученные в результате такого искусственно вызванного ненаправленного мутагенеза, успешно возделывают и поныне. Более того, как это ни парадоксально, они никогда не считались ГМО. Впоследствии в обществе распространилось крайне ошибочное мнение, что первые генетически модифицированные растения появились лишь в результате использования методов генной инженерии, целенаправленно воздействующих на ДНК.
В любом случае оценивать новый сорт следует исходя из его характеристик, а не того или иного пути селекции. А чтобы составить собственное мнение об опасности ГМО, нужно как минимум понимать, откуда они берутся.
Рецепт ГМО: режь, исправляй, сшивай
На первый взгляд, все просто, если не задумываться о том, как вставить новый генный фрагмент именно в тот участок ДНК растительной клетки, который нам нужен. А ведь в этом и заключается самая сложная задача редактирования генома, результатом которого являются современные ГМО.
Насколько остры генетические ножницы?
На основе бактериальных CRISPR/Cas-систем ученые создали упрощенные искусственные молекулярные конструкции, включающие белок Cas9 и обеспечивающие невероятную точность при разрезании цепей ДНК (Закиян, 2014). С их помощью стало возможным проводить все виды модификаций генома: вносить точечные мутации, встраивать, исправлять, заменять или удалять крупные ДНК-последовательности и фрагменты выбранных генов.
Но несмотря на подтвержденную эффективность системы CRISPR/Cas9 все еще остается риск неспецифичного воздействия на ДНК и нарушения последовательности кодирующих генов. Неудивительно, что настоящий взрыв в мировом сообществе вызвала публикация китайских ученых из Университета Сунь Ятсена (КНР), несколько лет назад впервые применивших CRISPR/Cas9 для исправления генома эмбрионов человека с целью лечения генетического заболевания талассемии. При этом лишь для 4-х из 86 подопытных оплодотворенных яйцеклеток удалось достичь положительного результата (Liang et al., 2015).
Систему CRISPR/Cas9 можно использовать не только для разрезания ДНК и встраивания трансгена. Если инактивировать белок Cas9, соединив его с круппель-доменом, кодирующим белок KLF — своеобразный контроллер экспрессии генов, то такой комплекс остается на целевой ДНК, влияя на активность соседних участков генома (а). Если слить Cas9 с ферментом гистонацетилтрансферазой, то комплекс будет влиять на упаковку ДНК в этом участке (б). Cas9, слитый с флуоресцентным белком, может играть роль метки для микроскопии, обозначая определенный участок ДНК (в). Визуализация от Visual Science и Сколтеха
Сегодня ряд специалистов призывают к мораторию на любые эксперименты, связанные с редактированием генов человеческих эмбрионов или половых клеток. Их опасения можно понять: когда речь идет о геноме человека, успех должен быть гарантирован. И все же прогресс не остановить: недавно Великобритания стала второй страной, где исследователям было позволено проводить подобные эксперименты (Ершов, 2016).
Тем не менее страх человека перед вмешательством в геном живых организмов не только не убывает, но и в некоторых случаях даже продолжает расти. Вследствие этого оборот и потребление продуктов геномного редактирования растений строго контролируются на законодательном уровне, что препятствует переходу мирового сельского хозяйства на использование продвинутых методов селекции. Однако ученые не сдаются и предлагают сократить до минимума и даже исключить возможные риски негативных последствий введения новых генов в организм растений.
Снижаем риски: от ТРАНС к ЦИС и ниже
С помощью генного редактирования можно получать высокоурожайные растения, устойчивые к вредителям и гербицидам. Слева — посевы генетически модифицированной сои, устойчивой к гербициду глифосату, справа — обычной культурной сои, засоренные сорняками. Фото В. Дорохова. По: (Дорохов, 2004)
В свою очередь, мировое ученое сообщество считает, что нужно различать ГМО по способу получения и делать послабления для продуктов, полученных умеренным вмешательством. Так появилась система деления ГМО на три вида: ТРАНС, ЦИС и ИНТРА.
По способу получения ГМ-растения делят на три вида: ТРАНС, содержащие вставку чужеродной ДНК; ЦИС, содержащие гены того же или родственного вида; ИНТРА, в геном которых введены их же собственные гены, но с другими регуляторными участками
Трансгенными сегодня называют организмы с искусственно введенными генами, которые в принципе не могут быть приобретены путем естественного скрещивания. Это могут быть гены растений других видов или животных, например рис, в геном которого встроен ген кукурузы. Потенциальная опасность трансгенных культур в том, что приобретенные таким образом новые качества могут повлиять на пригодность к использованию в пищевых или кормовых целях, а затем передаться диким родственникам, что может иметь непредсказуемые последствия для природных экосистем. По этой причине законодательные и регулирующие органы развитых стран уделяют большое внимание биобезопасности таких культур, чтобы снизить риск экологических сдвигов.
В геном цисгенных растений могут быть введены гены организмов того же или близких видов, с которыми возможно скрещивание в естественных условиях. При этом сам целевой ген не должен быть видоизменен или оторван от своих регуляторных последовательностей. Пример цисгенного растения — картофель, не подверженный картофельной гнили благодаря встраиванию генов диких видов картофеля из Анд, устойчивых к этому заболеванию. Такой картофель сейчас создается в Бельгии (VIB’s fact series, 2015). Важно, что цисгенезис не привносит в организм растения принципиально новых для него признаков и, по сути, аналогичен традиционному скрещиванию с родственными дикими формами.
Интрагенезис можно считать продолжением концепции цисгенезиса, но в этом случае в ДНК растения встраивают его собственный ген, совмещенный с регуляторными участками других его генов. В ходе такой модификации искусственно создаются новые комбинации из уже имеющихся в растении участков ДНК (Holme, 2013). Подобное изменение регуляции активности генов позволяет усиливать полезные признаки (например, способность накапливать витамины в листьях) или, напротив, устранять или сводить к минимуму нежелательные.
Между тем при современном регулировании оборота ГМО-различия между трансгенными и цисгенными растениями не учитываются, хотя эти типы кардинально различаются. Из-за жестких рамок, установленных законодательством, получение и использование цисгенных растений серьезно затруднено, что может заблокировать или значительно отсрочить проведение дальнейших исследований по улучшению сортов сельскохозяйственных культур. Пока лишь в Канаде контроль за цисгенными растениями менее строг по сравнению с трансгенными (Schouten, 2006).
Соматический Франкенштейн
Использование соматических клеток при гибридизации позволяет успешно работать с отдаленными, обычно нескрещиваемыми видами и полностью стерильными растениями. Иными словами, этот метод используют, если возникает необходимость преодолеть несовместимость культурных и дикорастущих видов. Таким способом можно получать межклассовые гибридные клеточные колонии: рис + соя, ячмень + табак и даже табак + мышь (Makonkawkeyoon, 1995)! Правда, большинство таких регенерантов сами размножаться уже не способны, а иногда и вовсе представляют собой скорее скопление клеток, чем полноценный организм.
Что скрывается под прививкой
В ходе прививки возможно и появление настоящих мутаций, спровоцированных специфическими веществами (этилметансульфонатом, этилимином и др.), которые поступают к привою от подвоя. Однако частота появления мутаций после прививок крайне низка. Неоспоримым преимуществом прививок является возможность размножать мутации, не передающиеся по наследству, а основным недостатком — большой объем исходного материала.
Прививка растений — это, безусловно, метод проверенный и безопасный. Но что произойдет, если в качестве подвоя использовать растение, перенесшее генетическую модификацию? Будет ли полученное растение ГМО? Оказывается, нет: согласно законам, плоды таких гибридов не входят в перечень ГМО, так как ДНК привоя остается неизмененной. Однако мы не можем быть уверены в том, что никакого обмена наследственной информацией между привоем и подвоем не происходит. К примеру, от корневища к привою могут перейти молекулы РНК, регулирующие работу генома, а это означает, что нельзя предсказать и уровень производства тех или иных белков в привитом растении.
Берем генетический разбег!
Но прививка — это далеко не единственный окольный путь для создания новых сортов с измененной активностью ДНК. Ускоренное скрещивание деревьев и кустарников (fast-track breeding) — это даже не метод, а целый комплекс методик, направленных на сокращение сроков получения новых сортов, что особенно важно для многолетних культур. Ведь цикл размножения деревьев с крупными плодами (например, ореха или сливы) может доходить до 10 лет и более (van Nocker, 2014). Это означает, что после посадки первого гибрида селекционер вынужден ждать 5–10 лет, пока тот вырастет и повзрослеет, чтобы продолжить работу. Если же необходимо провести несколько последовательных скрещиваний, выведение нового сорта дерева может занять и 30 лет. В современных условиях никто не готов столько ждать.
Для ускорения селекции применяются различные методики скрещивания растений. При использовании методик ускоренного и возвратного скрещивания для получения устойчивого к болезням гибрида восприимчивый сорт модифицируют генами раннего цветения, а затем скрещивают с устойчивой культурой (слева). Полученное ГМ-потомство может быть скрещено с оригинальным сортом, чтобы удалить трансген. Ветвь элитарного сорта можно привить на трансгенное дерево с ранним цветением (вверху). Белки, вызывающие цветение, будут перемещаться в привой и стимулировать цветение. Полученные цветы затем могут быть в дальнейшем использованы как доноры пыльцы. По: (VIB’s fact series, 2016)
Чтобы максимально ускорить процесс, ученые давно поливают своих подопытных гормонами роста, выращивают их при высоких температурах и прибегают к другим уловкам, таким как ДНК-технологии. Среди безобидных можно отметить маркер-вспомогательный отбор, который заключается в анализе генома новых ростков или даже семян и отборе лучших гибридов задолго до того, как они превратятся во взрослые растения. Теперь растение уже не нужно обрабатывать патогеном, чтобы понять, насколько оно к нему устойчиво, достаточно найти нужный ген в семечке. Основной недостаток такой селекции — ее высокая стоимость, поскольку скрининг ДНК — вещь недешевая.
Чтобы растение быстрее повзрослело, селекционеры иногда хитрят. Например, искусственно активируют гены, отвечающие за запуск механизма размножения, после чего начинает цвести и приносить плоды совсем молодое растение. Иногда в геном дерева вводят дополнительные гены, которые ускоряют процессы цветения и плодоношения, и время ожидания первого цветения саженцев сокращается до 1 года. При сочетании методик ускоренного и возвратного (когда гибрид скрещивают с одним из родителей) скрещиваний ген быстрого цветения можно сначала ввести в исходный сорт, а на последнем этапе селекции удалить его путем скрещивания генетически измененного гибрида с родительским растением.
Ускоренное скрещивание осуществляют также путем прививания на ГМ-подвой. Секрет в этом случае кроется в генетически измененном корневище, в котором активно работают гены, отвечающие за цветение. В результате из корневища к листьям поступают специфические белки, запускающие механизм взросления, и привой начинает цвести.
Таким образом, современные методы прививки и ускоренного скрещивания растений за внешней традиционностью таят в себе много настоящих генетических секретов. В то же время ученые, сталкиваясь с общественным мнением и жестким регулированием распространения ГМО, все чаще пытаются избежать внесения изменений непосредственно в растительную ДНК. И здесь мы вплотную подходим к самой загадочной группе современных методов селекции.
Эпигенетика: чуть-чуть не считается
Подавить работу генов в клетке можно с помощью природного механизма — РНК-зависимого ДНК-метилирования, суть которого состоит в присоединении метильной группы (СН3) к нуклеотиду цитозину, стоящему в определенном положении. В результате блокируется процесс считывания информации с ДНК на молекулу РНК (Zhang, 2013).
Метилирование ДНК у растений и животных осуществляется ферментами ДНК-метилтрансферазами. Сами по себе эти ферменты метилировать ДНК не могут: им нужны специальные некодирующие РНК, которые направляют метилтрансферазы к конкретным участкам ДНК. Более того, считается, что в метилировании ДНК участвуют еще два вида РНК: малые интерферирующие РНК и микроРНК. Все вместе эти молекулы и определяют, какой именно участок ДНК цепи нужно метилировать. Сегодня такие РНК можно ввести в растение с помощью разных методик, например, посредством вирусов растений или с помощью техник генной инженерии (Deng, 2014).
Интересно, что если ученый изменяет признак растения с помощью ДНК-метилирования и при этом не вносит в геном никаких мутаций, то такое растение не считается ГМО. Если же некодирующие РНК не вводятся извне, а производятся самим растением благодаря геномному редактированию, то оно уже относится к генно-модифицированному.
Но и тут можно схитрить. Дело в том, что у растений метилирование определенных областей ДНК может наследоваться, т. е. передаваться от родителей к следующим поколениям (Jones, 2001). Благодаря ряду скрещиваний ГМ-растения с его природной формой можно получить гибрид, у которого нет измененной ДНК, но метилирование сохраняется. Такой гибрид уже не будет считаться генетически модифицированным.
Насколько метилирование безопасно? Достаточно, ведь метильные группы присоединяются к ДНК совсем не в случайных местах. Поэтому, в отличие от традиционных методов селекции, результаты такого воздействия предсказуемы: мы можем заранее выбрать ген, кодирующий определенный белок, и просто заставить его замолчать. Но делать это нужно аккуратно, так как механизмы метилирования ДНК довольно сложны. Иначе в результате мы можем получить растение, подверженное болезням или преждевременному старению.
Иногда ДНК-метилирование, наоборот, является обязательным условием для начала работы гена. Ученые и это научились использовать: с помощью изменения метилирования ДНК можно увеличить активность генов, отвечающих за производство растением запасных белков. Например, регулируя метилирование, можно повысить содержание белков в зерне пшеницы, а путем обработки риса ингибитором метилирования (5-азацитидином) — получить растения с наследуемым признаком карликовости (Ванюшин, 2013).
Молчание РНК как заслон от аллергии
Успешное считывание гена на матричную РНК вовсе не означает, что кодируемый им белок будет построен: эта мРНК может быть разрушена в цитоплазме клетки. Такое явление, названное посттранскрипционным молчанием, часто наблюдается при внесении дополнительных генов в ДНК растений. Впервые оно было описано еще в 1990 г., когда при введении в геном петунии дополнительных копий гена, отвечающего за красную окраску цветков, количество красного пигмента не только не возросло, но и значительно снизилось (Napoli et al., 1990).
Среди успешных примеров применения этого метода — получение двух сортов кофейного дерева, содержащих в плодах пониженный на 30–50% алкалоид кофеина. Схожий эксперимент был проведен и с табаком с целью понизить в растении содержание никотина (Рябушкина, 2009).
Голубая роза веками была недостижимой мечтой, пока сотрудники японской компании Suntory не пересадили ей ген анютиных глазок, кодирующий синий пигмент дельфинидин, обычный для дельфиниума, баклажана и других растений. Но розы необычной сиренево-голубой окраски получали и раньше путем обычной селекции, как, например, выведенный в 1964 г. популярный сорт Blue Moon (на фото), который при выращивании на свету приобретает насыщенный голубой оттенок. © CC BY-SA 2.0. Some rights reserved by yamada
Другая возможность использования этого подхода — подавление синтеза аллергенов. И это уже не сказка: генетикам из испанского Института сельского хозяйства в Кордове почти полностью удалось освободить зерна пшеницы от глиадина — одного из составляющих глютена. Именно из-за глиадина группа запасающих белков пшеницы вызывает у многих людей иммунную реакцию. Правда, и без использования системы редактирования генома CRISPR/Cas9 тут не обошлось (Sanchez-Leon et al., 2017).
Сегодня, когда общество проявляет большую озабоченность безопасностью пищевых продуктов, селекционеры находятся в ситуации, вынуждающей их использовать альтернативные пути получения новых сортов растений. В силу тех или иных причин эти методы не относятся к запрещенным, но в ряде случаев являются не менее рискованными, чем традиционные методики получения ГМО.
Также не стоит забывать, что грамотный подход к селекции растений с использованием техник редактирования генома позволяет минимизировать использование пестицидов и удобрений — что это означает для экологии, нет нужды объяснять. В любом случае, какие продукты мы будем есть завтра, в огромной степени зависит уже не от природы, а от нас самих.
При возделывании сельскохозяйственных растений хорошо было бы иметь сорта устойчивые к насекомым – вредителям и получить такие сорта можно с помощью генной инженерии. В одном случае использован ген инсектицидного протоксина. В других – гены растительных белков типа ингибиторы амилазы или протеаз. Протоксин – белок из бактерий ( В. thuringinsis ). Сверху распылять его раствор неэффективно, так как многие насекомые питаются внутренними тканями растения. Нужны трансгенные растения. Однако гены протоксина cry А (а); cry А (в); cry А (с); не экспресируются в растениях. Чтобы добиться экспрессии в растениях ген уменьшили, оставив N-концевую часть. Количество синтезируемого токсина увеличилось, и растения получили некоторую защиту. Была поставлена задача, найти минимальный размер N-концевой части без потери токсичности. Оказалось, что у разных видов бактерий протоксин консервативен с N-конца, а с С-конца – гомология только 45%. Оказалось, что инсектицидная активность обеспечивается 646 N-концевыми аминокислотами (из 1156 аминокислот всей молекулы). Такой укороченный ген синтезировался в растении и давал некоторую защиту, но не полную, и в разной степени у разных растений. Для повышения степени защиты растения стали менять участки молекулы протоксина, которые могли ограничивать его синтез в растении. Получили слабо модифицированные молекулы, что увеличило синтез протоксина в 10 раз. Далее получили сильно модифицированные молекулы (гомология с молекулами дикого типа составляет 78,9%). Такие гены растения обеспечивали в 100 раз больший синтез протоксина. Далее ген, ответственный за синтез протоксина поставили под контроль промотора малой субъединицы РБФК и внедрили в хлоропластную ДНК. Это давало следующие преимущества. Протоксина стало 1% от общего содержания белка растительной ткани. Ген в хлоропластах находился во многих копиях (хлоропластов много) и передавался по материнской линии, поэтому с пыльцой не разносился и не попадал на другие растения.
Получены трансгенные томаты, табак, картофель, рис, кукуруза, яблоня, люцерна, орех, тополь. Картофель разрешено использовать в коммерческих целях. Для снижения селекционного давления ген поставлен под промотор PR – I (pathogenesis-relates), который индуцируется любым патогеном или салициловой кислотой. Таким образом, ген можно включать на короткое время. Протоксин не может быть эффективен против всех насекомых – вредителей. Насекомые в эволюции приспосабливаются к условиям среды. Поэтому одного протоксина для защиты растений мало. Некоторые растения синтезируют ингибиторы протеинкиназ, например, ингибитор трипсина синтезирует вишня китайская. Теплокровным – ингибитор не токсичен. Ген перенесен в рис, картофель. Устойчивость к насекомым-вредителям повысилась в 5 раз. Протоксин в процессе приготовления пищи инактивируются. Для повышения эффективности, вводят 2 гена, которые обеспечивают синтез протоксина и другого вещества, защищающего от насекомых, например ингибитор трипсина в малых количествах. При таких комбинациях эффективность защиты повышается в 20 раз по сравнению с защитой одного протоксина.
Большой ущерб зерновкам приносит долгоносик лучистый питающийся семенами. Если в рацион личинок этих насекомых включить фасоль (Phaseolus vulgaris), то рост насекомых замедляется. Это связано с присутствием в семенах фасоли ингибитора амилаз. Ген ингибитора амилаз выделен из фасоли, помещен под семяспецифичный промотор и использован для трансформации гороха . Это обеспечило защиту семян гороха от поедания долгоносиком лучистым. Причем эффект оказался пропорциональным количеству ингибитора, синтезированного горохом.
Устойчивость к вирусам
Природный иммунитет растений к вирусным болезням состоит в блокировании проникновения, предотвращении распространения по растению вируса либо в подавлении симптомов болезни.
Для иммунизации использовали гены белков оболочки вируса, а также антисмысловые гены. Если растение синтезирует белок оболочки вируса, то способность вируса проникать в растение и распространяться в нем снижается. Механизм ингибирования размножения вируса в присутствии генов белка оболочки в растительной клетке точно не установлен, однако ясно , что противовирусное действие начинает проявляться на ранних стадиях репликации вируса так, что вирусы не образуются. С помощью этого подхода были получены устойчивые к различным вирусам многие культуры: табак, картофель, помидор, рис. Абсолютной устойчивости достичь не удается, но уровень устойчивости высок.
Кроме иммунизации защита может осуществляться белками, которые синтезирует растение. Например, у Патолаки американской обнаружено 3 противовирусных белка РАР1 (синтезируется весной в листьях), РАР2 (синтезируется в листьях летом), РАР S (синтезируется в семенах). Если немного белка нанести на другое растение, то оно тоже станет устойчиво к нескольким вирусам. Ген РАР1 ввели в растения табака и картофеля. Если растения синтезировали белков более 10 нг на 1мг суммарного белка, то они были чахлыми и бесплодными, а если 1-5 нг на 1 мг белка – имели нормальный внешний вид и были фертильными. Белок обеспечивал меньшее число повреждений на растении. Поскольку противовирусное действие РАР проявляется при относительно небольших его концентрациях, можно попытаться создать трансгенные растения, синтезирующие этот белок в малом количестве и параллельно использовать другие виды защиты.
Растения устойчивые к грибам и бактериям
В юго-восточной Азии рисоводству грибы наносят ущерб более чем на 5 млрд. долларов в год. Борьба ведется опрыскиванием химическими веществами, которые накапливаются в окружающей среде. Поэтому актуально обеспечить биологическую защиту растений. В ответ на проникновение патогена растение синтезирует PR-белки, один из которых (тауматин) – небольшой, очень сладкий белок. Другие растения синтезируют хитиназу, а также ингибиторы ферментов.
Для защиты от грибных болезней с помощью генноинженерных методов в рис ввели ген, обеспечивающий синтез белка лизоцима бактериофага Т-4. Растения приобрели высокую устойчивы к бактериальным болезням.
Растения устойчивые к неблагоприятным климатическим условиям среды
Суппероксидный кислород. Важное значение в развитии стресса имеет накопление окислительных радикалов. Опасным радикалом является суппероксидный кислород. Фермент суппероксиддисмутаза (СОД) – нейтрализует и превращает суппероксидный кислород в перекись водорода, которая разрушается пероксидазой или каталазой. У растений есть несколько изоформ суппероксиддисмутазы.
О 2 Н 2 O 2 Н 2 О + О 2
Так, выделено Cu/Zn-содержащую суппероксиддисмутазу – из хлоропластов, и Mn-содержащий фермент из митохондрий. Обнаружена
У трансгенных растений табака ген синтеза Cu/Zn-содержащей суппероксиддисмутазы поставили под контроль 35 S промотора и такие растения были устойчивы к яркому свету, в условиях, при которых обычные растения погибали. Повышенное содержание этого фермента способствует сохранению срезанных цветов. При транспортировке, цветы завядают от радикалов кислорода. Но, чтобы получить такие трансгенные цветы, нужен промотор специфичный для цветов.
§ 42. Трансгенные организмы — будущее современной биотехнологии. Трансгенные бактерии и грибы. Трансгенные растения
*Как вы уже знаете из предыдущего параграфа, генетическая инженерия дает возможность комбинировать в лабораторных условиях фрагменты ДНК различного происхождения. Это привело к переходу селекционной работы на принципиально новый уровень. До возникновения технологии создания рекомбинантных ДНК селекционеры могли использовать для получения новых пород, сортов и штаммов гены только тех видов организмов, с которыми осуществляется селекция. Теперь же, благодаря достижениям генетической инженерии, селекционерам предоставляется возможность создавать организмы с признаками, которые изначально отсутствуют у представителей данного вида.*
Организмы, генóм которых был изменен с помощью методов генетической инженерии и содержит хотя бы один активно функционирующий ген другого организма, называют трансгенными (генетически модифицированными, или ГМО).
Применение трансгенных бактерий и грибов. С развитием генетической инженерии именно бактерии стали первыми объектами для внедрения в их клетки не свойственной им изначально генетической информации.
С использованием такого метода получают бактерии, синтезирующие белки человека (рис. 42.1).
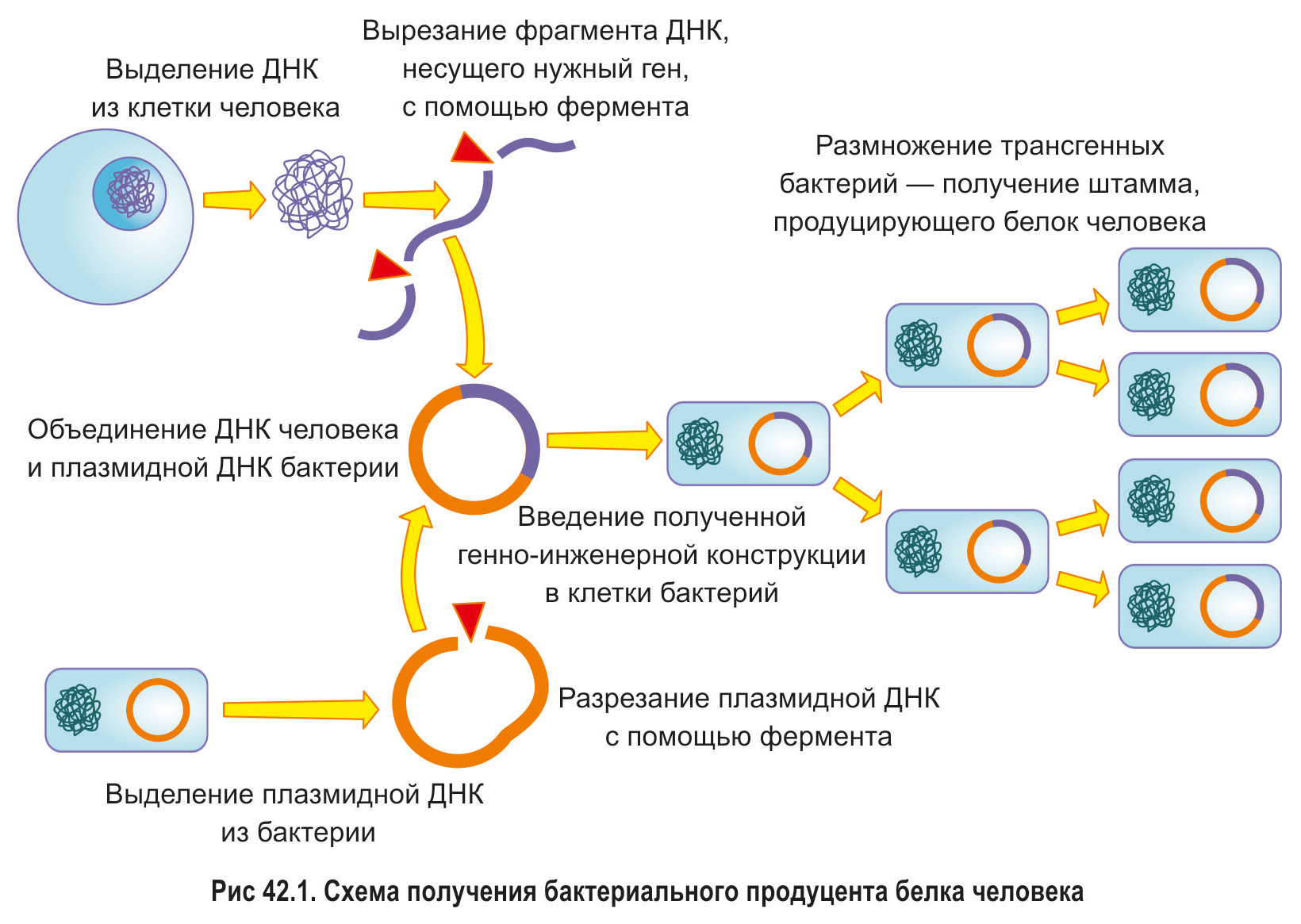
Одним из первых успешно реализованных проектов, доказавших полезность такого биотехнологического направления, было получение бактерий, продуцирующих инсулин человека.
*В настоящее время в мире осуществляется производство более сотни белковых препаратов медицинского и ветеринарного назначения с использованием трансгенных бактерий и дрожжей.*
1. Что такое ГМ растения?
Это растения, в которые встраивают чужеродные гены с целью развития устойчивости к гербицидам и пестицидам, увеличения сопротивляемости к вредителям, повышения их урожайности.
2. Как получают ГМ растения?
Их получают путем внедрения в ДНК растения гена другого организма. Донорами могут быть микроорганизмы, вирусы, другие растения, животные и даже человек. Например, получен морозоустойчивый помидор, в ДНК которого встроен ген североамериканской морской камбалы. Для создания сорта пшеницы, устойчивой к засухе, использовался ген скорпиона.
4. Чем ГМО опасны для здоровья человека?
Многие ученые опасаются, что ГМО увеличивают риск возникновения опасных аллергий, пищевых отравлений, мутаций, а также вызывают развитие невосприимчивости к антибиотикам.
Многие ученые опасаются, что ГМО увеличивают риск возникновения пищевых аллергий, отравлений, мутаций, способствует образованию опухолей, а также вызывают невосприимчивость к антибиотикам. Не исключена вероятность того, что чужеродная ДНК способна накапливаться во внутренних органах человека, а также попадать в ядра клеток эмбрионов, что может привести к врожденным уродствам и даже гибели плода.
В группу риска попадают дети до 4-х лет, они меньше всего защищены от воздействия чужеродных генов.
5. Аллергенность и токсичность
Более половины трансгенных белков, обеспечивающих устойчивость растений к насекомым, грибковым и бактериальным заболеваниям токсичны и аллергенны .
Например, использование альбумина - гена из ДНК бразильского ореха при создании сорта ГМ сои с улучшенным аминокислотным составом привело к тому, что значительное количество людей пострадало от обострения аллергических заболеваний.
Вещества, предназначенные для борьбы с насекомыми, могут блокировать ферменты пищеварительного тракта не только у насекомых, но и у человека, а также влияют на поджелудочную железу.
Ряд трансгенных сортов кукурузы, табака и помидоров, устойчивых к насекомым вредителям, вырабатывают лигнин – вещество, препятствующее поражению растений. Он может разлагаться на токсичные и мутагенные фенолы и метанол. Поэтому увеличение содержания лигнина в плодах и листьях растений опасно для человека.
Самым ярким примером токсичности ГМО стал случай с Японской Компанией Showa Denko K..K., которая стала поставлять на рынок пищевую добавку ГМ триптофан полагая, что он является эквивалентом не модифицированному аналогу. ГМ аминокислота стала причиной смерти 37 человек, еще около полутора тысяч остались инвалидами на всю жизнь.
6. Канцерогенность и мутагенность
ГМО могут стать мутагенными и канцерогенными за счет их способности накапливать гербициды, пестициды и продукты их разложения. Например, гербицид глифосат, используемый при возделывании трансгенных сахарной свеклы и хлопчатника, является сильным канцерогеном и может вызывать лимфому.
Некоторые гербициды могут оказывать негативное влияние на выживаемость и здоровье человеческих эмбрионов, а также вызывать мутации.
В результате внутриклеточных процессов в сортах ГМ табака и риса, отличающихся повышенной урожайностью, накапливаются биологически активные вещества, способные спровоцировать развитие рака. Исследования показали, что у крыс, питавшихся трансгенным картофелем, ухудшился состав крови, были выявлены аномалии в размерах внутренних органов, практически у всех погибших животных была выявлена патология тонкого и толстого кишечников.
7. Возникновение устойчивости к антибиотикам
Большинство сельскохозяйственных ГМ-культур помимо генов, придающим им желаемые свойства, содержат гены устойчивости к антибиотикам в качестве маркеров. Обычные антибиотики, как например ампициллин (инфекции дыхательных путей, синуситы и инфекции мочевыводящих путей) и канамицин(туберкулез, инфекции верхних и нижних дыхательных путей обработке ран) используются при производстве пищи. Существует опасность того, что они могут быть перенесены в болезнетворные микроорганизмы, что может вызвать их устойчивость к антибиотикам. В этом случае традиционные методы лечения воспалительных процессов с помощью антибиотиков будут малоэффективны.
Устойчивость к группе антибиотиков, которые используются для лечения легочных инфекций, хламидиозов и инфекций мочевыводящих путей в Испании, Нидерландах и Великобритании достигла 82%.
8. Чем опасны ГМО для окружающей среды?
Научно зафиксированы отдельные факты уничтожения в местах выращивания ГМ растений целых групп насекомых, возникновения новых мутантных форм сорных растений и насекомых, биологического и химического загрязнения почв и постепенной потери биоразнообразия, особенно в центрах возникновения культурных растений.
Генной инженерии не более 20 лет. Оценить, как влияют генно-модифицированные организмы (ГМО) на окружающую среду за столь короткий промежуток времени очень сложно. Поведение новых генов в открытых экосистемах, их реакция на паразитов, болезни совершенно непредсказуемы.
Большинство ученых считают, что ГМО могут быть опасны для окружающей среды.
Распространение трансгенов угрожает, как минимум, сохранению естественного биоразнообразия в природе, а также здоровью человека.
9. Снижение сортового разнообразия
Особо опасно выращивание ГМО в центрах происхождения сельскохозяйственных культур. К примеру, если выращивать ГМО рис в Китае, где зародилась эта культура, из-за перекрестного опыления могут исчезнуть дикие сорта риса. Образующиеся в результате скрещивания культуры постепенно вытесняют природные разновидности. Малочисленные популяции и редкие виды могут быть потеряны навсегда.
10. Сокращение видового разнообразия
Производство ГМО приводит к сокращению видового разнообразия растений, животных, грибов и микроорганизмов обитающих на полях, где они выращиваются и вокруг них. Например, ГМ-бактерия, созданная как переработчик растительных отходов, уменьшила популяцию полезных грибов. Быстрорастущие виды трансгенных организмов могут вытеснить обычные виды из естественных экосистем.
Нарушение естественного контроля вспышек численности вредителей.
В природе у каждого вида есть естественные враги и паразиты, не позволяющие ему виду чрезмерно размножаться. Воздействие токсинов ГМ растений на хищных и паразитических насекомых может привести к серьезным нарушениям в экосистемах, в том числе к неконтролируемым вспышкам численности одних видов и вымиранию других. Например, медоносные пчелы очень чувствительны к высоким дозам многих токсинов. Известны случаи нарушения процессов роста и жизнедеятельности представителей одного вида божьих коровок, основной пищей которых являлись личинки, выращенные на трансгенном картофеле.
12. Появление устойчивых разновидностей насекомых
В результате производства сортов, устойчивых к вредителям, появляются насекомые, на которых смертоносные токсины просто не действуют. Так появились колорадские жуки, устойчивые к Bt картофелю. В других случаях вредители просто перестраиваются на другие растения – томаты, перцы, баклажаны.
13. Нарушение естественного плодородия почвы
Растения со встроенными генами, ускоряющими рост и развитие, в большей степени, чем обычные истощают почву и нарушают ее структуру. Токсины ГМ растений подавляют жизнедеятельность почвенных беспозвоночных, микрофлоры и микрофауны. Происходит нарушение естественного плодородия.
В будущем внедрение чужеродных природе ГМ-растений может поставить под угрозу все сельское хозяйство, поскольку селекция и создание новых сортов зависит от разнообразия естественных генетических ресурсов.
14. Чем ГМО опасны для сельского хозяйства России?
Привнесение ГМО в сельское хозяйство России грозит, во-первых, сокращением и обеднением сортового и породного биоразнообразия; во-вторых, попаданием в экономическую зависимость от производителей ГМ-культур и утратой такой важной отрасли отечественного производства как семеноводство; в-третьих, подрывом нашей продуктовой безопасности и, в четвертых, – ухудшением экологической ситуации в масштабах страны.
15. Разрешены ли ГМО в России?
Да. В нашей стране разрешено использование 13 видов ГМО для продажи и производства продуктов питания, в т. ч. детского питания. Промышленное производство ГМО не разрешено, а для того, чтобы получить разрешение, каждый сорт должен пройти экологическую экспертизу.
17. Позиция Гринпис
Необходимо маркировать все продукты питания, полученных из трансгенных растений, в том числе корма, растительных масла, готовую продукцию и ввозимое сырье.
Гринпис считает особенно важным ввести мораторий на использование генетически модифицированных ингредиентов в детском питании, пока не будет доказана их биобезопасность.
Гринпис требует установить мораторий на промышленное выращивание ГМ растений в открытых системах для предотвращения негативного воздействия на окружающую среду.
Гринпис также считает необходимым широкое освещение всех проблем, связанных с выращиванием и использованием ГМО.
Читайте также:

