При посевах перитонеального экссудата чаще всего отмечается рост
Обновлено: 05.07.2024
Шапкина В.А. 1 Первова О.В. 1 Черданцев Д.В. 1 Трофимович Ю.Г. 1 Дятлов В.Ю. 2 Пирова А.Ш. 1 Тахтобин Е.Г. 1
В статье представлен клинический опыт успешного лечения тяжелого распространенного гнойного перитонита. Широко используемая традиционная техника выполнения лапаростомии при лечении распространенного гнойного перитонита имеет большое количество недостатков, часто ведущих к неблагоприятному исходу заболевания. Наряду с несовершенством хирургического пособия стоит отметить, что немаловажным фактором при прогрессировании распространенного гнойного перитонита и абдоминального сепсиса является патологическая реакция иммунной системы пациента, что также может привести к неблагоприятному исходу заболевания. Описанный случай иллюстрирует комплексный подход в лечении распространенного гнойного перитонита, включающий в себя усовершенствованную методику лапаростомии и санирующих операций брюшной полости с применением проточно-инстилляционной системы по оригинальной методике, а также ведение периоперационного периода с учетом иммунных нарушений пациента.

1. Багдасарова Е.А. Влияние интраабдоминальной гипертензии на выбор хирургической тактики при распространенном перитоните / Е.А. Багдасарова, В.В. Багдасаров, А.И. Чернооков и др. // Инфекции в хирургии. – 2010. – № 4. – С. 47–52.
2. Бузунов А. Ф. Лапаростомия: Лечение хирургических заболеваний живота методом открытого ведения брюшной полости / А.Ф. Бузунов. – М.: Практическая медицина, 2008. – 207 с.
3. Савельев С.В. 80 лекций по хирургии: учебно-практическое пособие / С.В. Савельев, М.М. Абакумов, А.А. Адамян. – М.: Литтерра, 2008. – 912 с.
4. Черданцев Д.В. Современные возможности санации брюшной полости при распространенном гнойном перитоните / Д.В. Черданцев, О.В. Первова, В.Ю. Дятлов и др. // Хирургия. Журнал им. Н.И. Пирогова. — 2013. — № 10. — С. 32–37.
5. Kirkpatrick AW, Roberts DJ, Faris PD. Active Negative Pressure Peritoneal Therapy After Abbreviated Laparotomy: The Intraperitoneal Vacuum Randomized Controlled Trial // Ann Surg. 2015. Vol. 262(1). P. 38–46.
6. Roberts DJ, Ball CG, Kirkpatrik A.W. Increased pressure within the abdominal compartment: intra-abdominal hypertension and the abdominal compartment syndrome // Curr Opin Crit Care. 2016. Vol. 22 (2).P. 174 – 185.
На современном этапе развития хирургии перитонит остается одним из наиболее тяжелых осложнений абдоминальной хирургии, сохраняя высокие показатели летальности, которые, по данным разных исследований, достигают 20–35% при вторичном перитоните, 60% и выше при третичном перитоните [3, 4, 2].
Несмотря на совершенствование методов диагностики и хирургической тактики, достижения анестезиологии и реаниматологии, расширение возможностей антибактериальной терапии, перитонит осложняет течение хирургических вмешательств в 0,5–8% случаев [3, 4, 2].
По материалам Красноярского краевого гнойно-септического центра (ККГСЦ), от острых хирургических заболеваний в 2015 г. погибли 350 человек. Из них у 18 пациентов причиной летального исхода были кровотечения, у 105 пациентов — острый панкреатит, у 227 пациентов причиной смерти стали перитонит и абдоминальный сепсис. Таким образом, проблема распространенного гнойного перитонита не теряет своей актуальности и представляет собой сложную задачу, требуя комплексного подхода к лечению, поиска хирургической тактики и путей ее модификации.
Применение вакуум-ассистированной лапаростомии представляется нам многообещающим методом, позволяющим решить многие задачи в лечении разлитого гнойного перитонита. На сегодняшний день существует много различных систем локального отрицательного давления, таких как Renasys Go, PICO, Vivano и др. В своем клиническом наблюдении мы использовали технологию VivanoTec® S 042 NPWT фирмы Hartmann.
Диагностический этап для объективизации состояния больного включал: развернутый анализ крови, биохимический анализ крови, общий анализ мочи, обзорную рентгенографию брюшной полости и грудной клетки, мультиспиральную компьютерную томографию (МСКТ) брюшной полости с внутривенным болюсным контрастным усилением.
По результатам лабораторных исследований отмечались нейтрофильный лейкоцитоз до 25,29*10*9/л, повышение СОЭ до 58 мм/ч, повышение уровня активности трасаминаз, щелочной фосфотазы, увеличение уровня фибриногена, септические изменения.
По данным УЗИ в брюшной полости и малом тазу определялась свободная жидкость.
На обзорной рентгенограмме брюшной полости определялись единичные горизонтальные уровни жидкости (рис. 1).
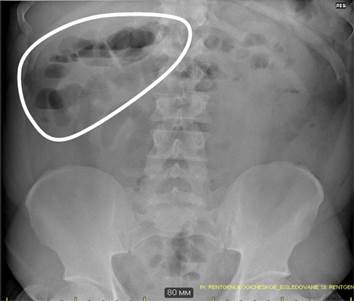
Рис. 1. Обзорная рентгенография органов брюшной полости (отмечаются расширенные петли кишечника в верхнем этаже брюшной полости с горизонтальными уровнями жидкости — чаши Клойбера)
По результатам МСКТ брюшной полости на уровне входа в малый таз, межпетельно, определялось ограниченное скопление содержимого высокой плотности, порядка 35 ед.Н (гной?), с большим содержанием газа, отграниченное от петель кишки тяжистыми уплотнениями (соединительнотканные тяжи), интимно прилежащее к сигмовидной кишке (рис. 2), общим размером 81х25х25 мм, что позволило заподозрить межпетельный абсцесс.

Рис. 2. МСКТ брюшной полости с внутривенным болюсным контрастным усилением (определяется ограниченное скопление содержимого высокой плотности, интимно прилежащее к сигмовидной кишке, — межпетельный абсцесс)
Таким образом, проведенные диагностические мероприятия позволили выявить острую хирургическую патологию органов брюшной полости, осложненную перитонитом. После минимальной предоперационной подготовки, в экстренном порядке пациент был оперирован. Выполнены лапаротомия, ревизия брюшной полости. Интраоперационно: в брюшной полости до 1000 мл фибринозно-гнойного экссудата, петли тонкой кишки делатированы до 4–4,5 см, перистальтика крайне вялая, париетальная и висцеральная брюшины инъецированы, с единичными нитями фибрина. Источник перитонита — перфорация дивертикула сигмовидной кишки. Мангеймский индекс перитонита (МИП) составил 28 баллов, индекс брюшной полости (ИБП) = 19 баллов. При оценке интегральных шкал тяжести степень полиорганной недостаточности (SOFA) составила 2 балла, тяжесть состояния (SAPS) — 11 баллов.
Выполнена обструктивная резекция сигмовидной кишки с последующим выведением сигмостомы на переднюю брюшную стенку. Брюшная полость санирована водным раствором антисептика, физиологическим раствором, осушена. Выполнена назоинтестинальная интубация тонкой кишки. Учитывая тяжесть перитонита и выраженность эндотоксикоза, было принято решение о завершении операции с наложением лапаростомы по традиционной методике.
В послеоперационном периоде пациент проходил лечение в условиях отделения реанимации ККГСЦ. На третьи сутки была выполнена программируемая санационная релапаротомия, в брюшную полость установлена вакуум-ассистированная лапаростома с использованием абдоминального набора VivanoMed® Abdominal Kit и аппарата отрицательного давления VivanoTec® (рис. 3).
На фоне многократно проводимых санирующих операций у пациента наблюдалась демедиализация мышц передней брюшной стенки с диастазом до 15 см. Во избежание формирования гигантской послеоперационной вентральной грыжи, значительно снижающей качество жизни пациента и приводящей к инвалидизации, потребовалось закрытие брюшной полости с помощью спиц Киршнера (рис. 7).
Регулярно производился посев перитонеального выпота с коррекцией антибактериальной терапии. На 7-й санации у пациента был установлен диагноз третичного перитонита. Из экссудата брюшной полости были высеяны Enterococcus faecalis ++, Proteus mirabilis ++. ++). Из инфицированной лапаротомной раны передней брюшной стенки был высеян Citrobacter species. Также были диагностированы выраженные нарушения иммунной системы. Для коррекции иммунного статуса был проведен курс иммунотропной терапии иммуноглобулином человека нормальным [IgG+ IgM+ IgA] в течение 3 суток.
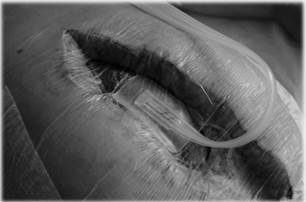
Рис. 3. Вакуум-ассистированная лапаростома

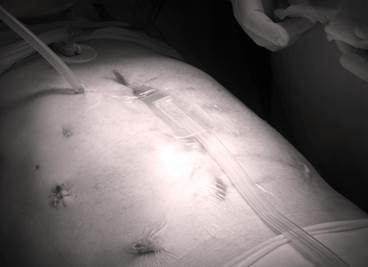
Рис. 5. Лапаростомия с применением проточно-аспирационной системы по оригинальной методике

Рис. 6. Закрытие брюшной полости при помощи спиц Киршнера
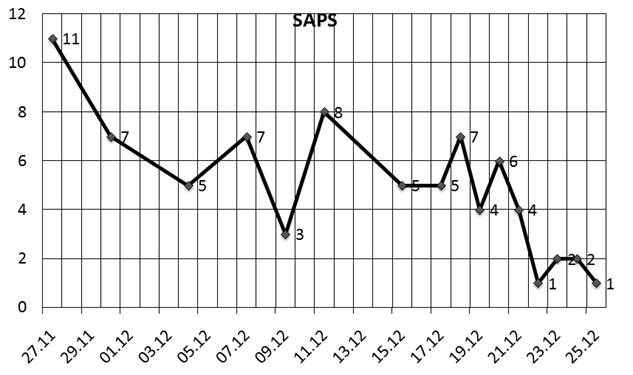
Рис. 7. Динамика изменения показателей интегральной шкалы оценки степени тяжести полиорганной недостаточности – SOFA
В результате комбинированного лечения, включающего в себя хирургические вмешательства с применением вакуум-ассистированной лапаростомы при помощи аппарата локального отрицательного давления VivanoTec®, технологии лапаростомии с применением проточно-аспирационной системы по оригинальной методике с использованием антисептика Лавасепт (рис. 5), массивную инфузионную, антибактериальную (Merexidi 6.0, Ampicillini — sulbactam 1.5 gr, Vancomicini 6,0), дезинтоксикационную терапию, коррекцию эндотоксикоза, у пациента был достигнут положительный результат. На 24-е сутки отмечались нормализация температуры, снижение лейкоцитоза до 10*9*10/л, нормализация уровня трансаминаз, отсутствие азотемии. На 27-е сутки после первичной операции пациент переведен из отделения реанимации в отделение хирургии ГСЦ.
Активизирован на 30-е сутки после первичной операции. Выписан в удовлетворительном состоянии. Общая продолжительность лечения составила 57 дней.
По истечении одного, трех месяцев и полугода после выписки пациент являлся на динамический осмотр в удовлетворительном состоянии.
Timeweb - компания, которая размещает проекты клиентов в Интернете, регистрирует адреса сайтов и предоставляет аренду виртуальных и физических серверов. Разместите свой сайт в Сети - расскажите миру о себе!
Виртуальный хостинг
Быстрая загрузка вашего сайта, бесплатное доменное имя, SSL-сертификат и почта. Первоклассная круглосуточная поддержка.
Производительность и масштабируемые ресурсы для вашего проекта. Персональный сервер по цене виртуального хостинга.
Выделенные серверы
Быстрая загрузка вашего сайта, бесплатное доменное имя, SSL-сертификат и почта. Первоклассная круглосуточная поддержка.
Проблема выбора тактики лечения при распространенном гнойном перитоните (РГП) в связи с высокой частотой и чрезвычайно высокой летальностью, несмотря на применение новых лекарственных препаратов и современных медицинских технологий, остается актуальной. Исход перитонита определяется не только адекватностью оперативного вмешательства, медикаментозного лечения, но и существенно зависит от изменений, происходящих в иммунной системе [9, 10, 31, 32]. В зависимости от состояния иммунитета и особенностей его реагирования значительно различается характер течения, прогноз развития и исход заболевания. В связи с этим стратификация больных в подгруппы со сходными показателями иммунной системы является первым важнейшим шагом в реализации индивидуального подхода к лечению этой категории пациентов [1, 2, 28, 34]. В настоящее время наиболее активно этот подход применяется при лечении бронхиальной астмы и хронической обструктивной болезни легких. Для этих заболеваний определены клинические фенотипы, объединенные различными специфическими молекулярно-генетическими и функциональными особенностями организма (эндотипы), которые диагностируются с использованием различных подходов [8, 25, 30]. На основании кластерного анализа нами ранее определены разновидности иммунных нарушений при инфекционно-воспалительных заболеваниях [2]. Подобное распределение отмечается при псориазе [7], ургентных хирургических заболеваниях [11], вирусных инфекциях [3]. Этим объясняется важность применения подобного метода при дифференцировке РГП в персонифицированном подходе к лечению таких больных.
Таким образом, целью исследования явились оценка типов иммунного реагирования у больных РГП и характеристика течения заболевания в этих группах.
Материал и методы
В качестве контроля были обследованы 123 практически здоровых человека. Все группы обследуемых были сопоставимы по возрасту и полу.
Результаты
Объем операции определяли в зависимости от источника перитонита. После устранения источника перитонита оперативным путем производили безаппаратную санацию брюшной полости, назоинтестинальную интубацию, дренирование брюшной полости четырьмя и более силиконовыми дренажами. Операцию заканчивали наложением лапаростомы. Число повторных санаций и сроки открытого ведения брюшной полости зависели от особенностей послеоперационного периода, тяжести перитонита, причин, его вызвавших, а также от индивидуальных особенностей организма больного. Купирование РГП с очищением раны брюшной стенки от некротизированных тканей и появлением грануляций служило показанием к закрытию лапаростомы.
Для оценки клинической эффективности проводимого лечения анализировали характер местных и системных осложнений, количество релапаротомий, сроки купирования перитонита, регресс ССВР, показатель летальности.
Анализ частоты местных и системных осложнений показал, что у 75,86% пациентов с РГП развивались такие системные осложнения, как третичный перитонит (33,3%), стрессовая перфорация полых органов (25,9%), абсцессы брюшной полости (22,2%), полиорганная недостаточность, септический шок и пневмония (14,8%). Летальность в группе обследованных больных составила 32,0%.
При исследовании иммунологических показателей обнаружено, что у больных РГП в периферической крови повышено количество лейкоцитов, нейтрофилов и моноцитов при снижении процентного и абсолютного содержания лимфоцитов (табл. 1). Понижение содержания лимфоцитов происходит за счет популяции NK-клеток (CD16 + CD56 + ) и цитотоксических Т-лимфоцитов (CD3 + CD8 + ), что подтверждается снижением их относительного и абсолютного количества. Не выявлены изменения относительного и абсолютного содержания Т-хелперов, В-лимфоцитов и иммуноглобулинов всех классов.

Таблица 1. Основные лабораторные показатели, характеризующие иммунную систему больных РГП (Ме, С25-С75)
Вместе с тем при индивидуальном изучении иммунологических показателей обнаружено, что у 19 (24,1%) больных количество лейкоцитов, нейтрофилов и моноцитов находится в пределах среднестатистических показателей или понижено. Относительное количество моноцитов в 39,2% наблюдений было повышено, но в 48,1% наблюдений - понижено. Абсолютное количество лимфоцитов оказалось пониженным только у 52 (65,8%) больных, а у 19% больных, несмотря на пониженные относительные параметры, оно было повышено. У 58,93% больных РГП определяется снижение абсолютного количества Т-хелперов, у 47,3% - понижение абсолютного количества В-лимфоцитов. У 20,0% больных регистрируется повышенное абсолютное и относительное содержание цитотоксических Т-клеток (см. рисунок). Все это свидетельствует о вариабельности иммунологического реагирования при РГП и служит основанием для типирования иммунных реакций.

Индивидуальная оценка основных иммунологических показателей у больных РГП.
Для типирования больных РГП и лиц контрольной группы применяли метод кластерного анализа. В качестве иммунологических показателей, по которым осуществляли типирование, были выбраны параметры, характеризующие врожденный иммунитет (абсолютное количество нейтрофильных гранулоцитов и NK-клеток), состояние регуляторного звена иммунитета (Т-хелперы), адаптивный клеточный (цитотоксические Т-лимфоциты) и адаптивный гуморальный иммунитет (В-лимфоциты и IgG). Выбор абсолютного количества клеток в качестве параметров для кластеризации связан с тем, что механизмы иммунного реагирования реализуются по принципам гомеостатической пролиферации клеток иммунной системы. При этом нарушения функционирования иммунной системы происходят при изменении количества клеток, что в свою очередь и приводит к развитию иммунопатологических состояний [4, 13].
В зависимости от количества нейтрофилов, NK-клеток, цитотоксических Т-лимфоцитов, Т-хелперов, В-лимфоцитов и концентрации IgG было получено 4 кластера (табл. 2). Распределение больных РГП и лиц контрольной группы по кластерам представлено в табл. 3. В контрольной группе 33,5% лиц (41 человек) не были определены в кластеры. Для лиц, отнесенных к кластеру 1, характерно увеличение числа клеток врожденного иммунитета, прежде всего нейтрофилов. В кластере 2 отмечается увеличение концентрации IGG. Для кластера 3 характерно снижение иммуноглобулинов и нейтрофилов. Кластер 4 характеризуется показателями, не выходящими за контрольный диапазон.

Таблица 2. Иммунологические показатели у больных РГП и лиц контрольной группы в сформированных кластерах (Ме, С25-С75) Примечание. Статистически значимые различия: р1 - с показателями кластера 1; р2 - c показателями кластера 2; р3 - с показателями кластера 3.

Таблица 3. Распределение по кластерам лиц контрольной группы и больных РГП
Анализируя особенности клинического течения в этих группах, установили, что исходная степень тяжести по шкале SAPS II выше у больных в группах, отнесенных к кластерам 1 и 2 (табл. 4). Величина МИП у больных с РГП кластеров 1 и 2 также значительно повышена, в то время как ИБП снижен по сравнению с таковыми у пациентов, отнесенных к кластерам 3 и 4. Не обнаружено значимых изменений по индексам SOFA и SIRS, однако число больных с показателем SOFA, превышающим 6, гораздо больше в кластере 3 (36,8%), чем в кластерах 1 и 2 (соответственно 4,6 и 11,1%). Также не выявлено различий между группами по числу осложнений. Однако тяжелая степень перитонита чаще всего регистрировалась в кластере 3 (52,6%), 2 (44,4%) и 1 (31,8%). При этом у больных, отнесенных к кластеру 4, чаще всего диагностировали перитонит средней тяжести (95,0% наблюдений). Особый интерес вызывает анализ летальности. Самая низкая летальность отмечена в группе больных, отнесенных к кластеру 2 (16,7%), самая высокая - в кластере 3 (47,4%). Промежуточное положение занимают показатели в кластерах 1 (27,3%) и 4 (35,0%).

Таблица 4. Клинические показатели, характеризующие течение заболевания у больных РГП (Ме, С25-С75) Примечание. Статистически значимые различия: р1 - с показателями кластера 1; р2 - c показателями кластера 2.
В соответствии с определенными иммунотипами нами проанализированы особенности течения РГП. Установлено, что течение первых двух иммунотипов более тяжелое по шкале SAPS II и МИП, однако это является благоприятным признаком активности работы иммунной системы, так как в конечном итоге общая тяжесть и неблагоприятный исход заболевания чаще всего регистрируются в группе с иммунодефицитами (кластер 3). Особый интерес вызывает группа, отнесенная к кластеру 4 (с ареактивностью иммунной системы). В этой группе практически у всех больных отмечается среднетяжелое течение РГП, но при этом и довольно высокая смертность, что свидетельствует о неадекватной реакции иммунитета.
Таким образом, показатели, определяющие функциональное состояние различных звеньев иммунной системы при распространенном гнойном перитоните (РГП), характеризуются существенным разнообразием значений. Использование кластерного анализа позволило выделить у больных РГП 4 иммунотипа, определяемых различным состоянием врожденного и адаптивного иммунитета. Эти иммунотипы можно рассматривать как различные патогенетические варианты течения РГП. Неблагоприятными при этом являются иммунодефицитный и (несмотря на нетяжелое течение) ареактивный иммунотипы. Наиболее благоприятны иммунотипы с активацией адаптивного и врожденного иммунитета. Стратификация пациентов с РГП по иммунотипам может послужить основой для назначения иммунотропных препаратов, так как позволит повысить эффективность лечения и реализовать персонифицированный подход в диагностике и лечении больных с нарушениями функции иммунной системы.

Пациенты с туберкулезным аппендицитом (ТА) — редкое явление в клинической практике. Тем не менее врачи должны проявлять клиническую настороженность для раннего выявления пациентов с такой патологией.
Диагностика затруднена
Американские клиницисты из Western Reserve Hospital привели наиболее частые признаки туберкулезного аппендицита и наиболее эффективные методы его диагностики. В основе опубликованной в Journal of clinical tuberculosis and other mycobacterial diseases работы – ретроспективный анализ клинических случаев заболевания за 10 лет.
| Туберкулезный аппендицит — редкое внелегочное проявление туберкулеза, встречается у 1,5–3% больных туберкулезом. Пациенты, госпитализируемые с этим заболеванием, часто не имеют в анамнезе туберкулеза легких и симптомов, вызывающих подозрения. Лишь у 14% пациентов с кишечным туберкулезом признаки ТА выявляются на рентгенограмме грудной клетки. Таким образом, такие больные могут контактировать с другими пациентами и медицинскими работниками в течение длительного времени. |
Патофизиология аппендикулярного туберкулеза может предполагать несколько механизмов: контакт аппендикса с инфицированным содержимым кишечника, прямое гематогенное распространение из отдаленного источника (например, легкие) или распространение илеоцекального туберкулеза, ретроградное лимфатическое распространение по подвздошной/восходящей ободочной кишке или аппендикулярный серозит/периаппендицит из-за поражения брюшины. Первичная инокуляция происходит при проглатывании откашливаемой инфицированной мокроты.
Авторы публикации проанализировали клинические случаи за 2010–2021 годы, отобрав пациентов только с ТА. Из 34 пациентов большинство (28) предъявляли жалобы на острую боль или ее усиление в правом нижнем квадранте живота, реже (12 человек) говорили о генерализованной боли в животе более 7 дней. Хронические симптомы кашля, ночного потоотделения или слабости/утомляемости отмечали только 11 пациентов.
По лабораторным данным, у 19 участников анализа выявлен лейкоцитоз. В числе характерных гистологических признаков ТА отмечены казеозные гранулемы, эпителиоидные гистиоциты и гигантские клетки Лангханса.
Возможные методы диагностики
Диагноз туберкулеза выставляли, как правило, после инструментального обследования — УЗИ (14 человек), КТ брюшной полости/таза (10) — и врачебного осмотра (4). Рентгенологические доказательства туберкулеза легких получены только у части пациентов.
По мнению авторов исследования, в отсутствие предоперационного диагностического обследования большинства экстренных пациентов быстрое выявление туберкулеза во многом зависит от высокой настороженности с учетом демографических данных пациента, анамнеза и наличия характерных симптомов. И в этих случаях необходимы рентгенологические и лабораторные исследования, которые могут подтвердить клинические подозрения.
В первую очередь следует рассмотреть возможность предоперационного рентгена грудной клетки. При неотложном характере вмешательства, молодом возрасте пациента и отсутствии типичных клинических признаков туберкулеза рентген грудной клетки часто не выполняют. Тем не менее при высокой степени подозрения на туберкулезную этиологию у гемодинамически стабильного пациента с аппендицитом этот метод исследования должен быть рекомендован. Наличие инфильтратов, уплотнений, кавитирующих узелков, особенно в сочетании со средостенной/внутригрудной лимфаденопатией, дают основание подтвердить диагноз туберкулеза.
Имплантационные внутрибрюшные метастазы были отмечены у четверти участников анализа, что также служит хорошим диагностическим критерием. Можно рекомендовать цитологическое исследование перитонеального экссудата у молодых пациентов с ТА.
Обзор клинических случаев показал, что хотя окрашивание кислотоустойчивых бактерий из брюшной жидкости отмечалось только у 30% пациентов, следует отправлять образцы перитонеального экссудата и аппендикулярной ткани в лабораторию для окрашивания по Цилю — Нильсену (кислотоустойчивость). Этот метод обычно дает результат в течение 24 часов с момента поступления образца в лабораторию, что ускоряет диагностику ТА. Посев перитонеального экссудата занимает больше времени, но тоже помогает в постановке окончательного диагноза.
Полезным дополнением к классическому способу гистологической диагностики может служить амплификация нуклеиновых кислот при получении перитонеального экссудата. Эти тесты очень чувствительны и специфичны для туберкулеза и рекомендуются в качестве дополнительных данных для раннего выявления туберкулезной инфекции. Однако результаты тестирования должны быть подтверждены последующим посевом.
В основе клиническая настороженность
Отсутствие чувствительной экспресс-диагностики визуализационных исследований, по мнению авторов, существенно затрудняет постановку предоперационного диагноза. Менее трети пациентов имеют идентифицируемые поражения на периоперационном рентгеновском снимке грудной клетки. Рентгенологические признаки туберкулезного и нетуберкулезного аппендицита, как правило, сходны; единственное заметное отличие — некротические лимфатические узлы, отмеченные на компьютерной томографии в 5 случаях. Во время операции в четверти случаев могут быть выявлены туберкулезные бугорки на аппендиксе, брыжейке или брюшине.
После постановки диагноза пациенты с ТА должны получать стандартную противотуберкулезную терапию. Аппендэктомия у таких больных выполняется, как правило, открытым способом, через разрез в правом нижнем квадранте. Последующая фармакотерапия проводится по схеме HRZE (изониазид, рифампицин, пиразинамид и этамбутол) или альтернативным препаратом, рекомендованным ВОЗ. Средняя продолжительность лечения составляет 7,2 ± 1,7 месяца.
Читайте также:

