Презентация микроклональное размножение растений
Обновлено: 05.07.2024

Гипотеза: в основе микроклонального размножения земляники лежит способность изолированных частей растений восстанавливать недостающие органы и регенерировать целые растения.
Цель работы: доказать, что в основе микроклонального размножения земляники лежит способность растений к регенерации
| Вложение | Размер |
|---|---|
| mikroklonalnoe_razmnozhenie_rasteniy.doc | 94 КБ |
Предварительный просмотр:
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ
для участия в Шестой научно-практической конференции проектных и исследовательских работ учащихся медико-биологических классов
школ-партнеров Первого МГМУ им. И.М. Сеченова.
Предметная область - биология
Козявина Кристина Юрьевна
Раковский Александр Александрович
Калошина Алёна Александровна
Руководитель: Бабич Елена Викторовна
Должность: учитель биологии
- Введение………………………………………………………………….….3
- Гипотеза, цель и задачи исследования…………………………………….3
- Объект и методы исследования……………………………………. …3
- Обзор литературы по выбранной теме
- Регенерация и микроклональное размножение растений………. 4
- Этапы и методы микроклонального размножения растений………………………………………………………………6
5. Практическая часть
5.1 Приготовление питательной среды для культивирования изолированных органов, тканей и клеток растений……………. 7
Биотехнология – наука о методах и технологиях создания и использования генетических трансформированных биологических объектов. Один из методов биотехнологии – это микроклональное размножение (клеточная биотехнология), основанное на способности клеток и тканей к регенерации, что обеспечивает ускоренное получение ценных форм и линий сельскохозяйственных растений. Оно не зависит от сезона, позволяет получать оздоровленный посадочный материал от вирусной и бактериальной инфекции, дает возможность выращивать сотни тысяч растений из одной меристемы, размножать ценные генотипы, получать биологические препараты пищевого, кормового и медицинского направления.
2. Гипотеза, цель и задачи исследования
Гипотеза: в основе микроклонального размножения земляники лежит способность изолированных частей растений восстанавливать недостающие органы и регенерировать целые растения.
Цель работы: доказать, что в основе микроклонального размножения земляники лежит способность растений к регенерации
Задачи работы: изучить метод микроклонального размножения растений и его значение по литературным источникам; овладеть технологией приготовления питательных сред для культивирования изолированных органов и тканей; провести микроклональное размножение растений на основе их способности к регенерации; сделать выводы о проделанном исследовании.
3. Объект и методы исследования
Объект исследования: меристематические верхушки растений земляники.
Методы исследования: метод индукции адвентивных почек тканей эксплантата; наблюдение; экспериментальный метод.
Работа выполнялась в лаборатории Брянской Сельскохозяйственной Академии под руководством заведующего лабораторией биотехнологии Сковородникова Дмитрия Николаевича.
4. Обзор литературы по выбранной теме
В ходе работы были изучены публикации отечественных авторов по сельскохозяйственной биотехнологии, биотехнология сельскохозяйствен-ных растений, а так же методическое пособие по биотехнологии.
4.1. Регенерация и микроклональное размножение растений
Регенерация — способность живых организмов восстанавливать повреждённые ткани, целые органы. Значение регенерации заключается в том, что на основе клеточного и внутриклеточного обновления органов обеспечивает восстановление и компенсация функций, нарушенных в результате различных патогенных факторов.
Широкое распространение регенерации в царстве растений обусловлено сохранением у них меристем (тканей, состоящих из делящихся клеток) и недифференцированных тканей. На кончике нормального стебля имеется верхушечная почка (адвентивная), обеспечивающая непрерывное образование новых листьев и рост стебля в длину в течение всей жизни данного растения. Если отрезать эту почку и поддерживать ее во влажном состоянии, то из имеющихся в ней паренхимных клеток или из каллуса, образующегося на поверхности среза, часто развиваются новые корни, почка при этом продолжает расти и дает начало новому растению [4].
В природе существует два способа размножения растений: семенной и вегетативный. К особенностям семенного размножения следует отнести генетическую пестроту получаемого посадочного материала и длительность вегетационного периода. При вегетативном размножении сохраняется генотип материнского растения и сокращается продолжительность вегетационного периода.
Достижения с области культуры клеток и тканей привели к созданию нового метода вегетативного размножения – микроклонального размножения (получение в условиях in vitro (в пробирке), неполовым путём растений, генетически идентичны исходному экземпляру). В основе метода лежит уникальная способность растительной клетки давать начало целому растительному организму и регенерации. Первые исследования начались в конце 50-х годов 20 века, нашей стране работы проводились в лаборатории культуры тканей и морфогенеза Института физиологии растений им. К.А. Тимирязева. Этот метод имеет ряд преимуществ:
- Получение генетически однородного посадочного материала;
- Освобождение растений от вирусов;
- Высокий коэффициент размножения;
- Сокращение продолжительности селекционного процесса;
- Ускорение перехода растений от ювенальной к репродуктивной фазе развития;
- Получение растений, трудноразмножаемых традиционными способами;
- Возможность проведения работ в течение круглого года и экономия площадей, необходимых для выращивания посадочных материалов;
- Возможность автоматизировать процесс выращивания.
Область применения микроразмножения разнообразна и имеет тенденцию к постоянному расширению:
- Размножение взрослых древесных пород (каштан, дуб, клён, осина);
- Сохранение редких и исчезающих лекарственных видов растений;
- Получение вторичных метаболитов, используемых для производства лекарств (алкалоидов, глюкозидов, стероидов), вкусовых добавок (сахаров); гормонов, витаминов, белков;
- Использование культурных клеток в качестве источника новых химических веществ;
- Размножение и промышленное производство плодоовощных и декоративных растений [3].
Таким образом, клеточная биотехнология, основанная на способности клеток и тканей к регенерации, позволяет человеку решать многие актуальные вопросы селекции, связанные с проблемой растущего населения Земли.
4.2. Этапы и методы микроклонального размножения растений
Процесс микроклонального размножения можно разделить на 4 этапа: 1. Выбор растения-донора и получение хорошо растущей стерильной культуры;
2. Собственно микроразмножение, когда достигается максимальное количество микропобегов;
3. Ускорение развития размноженных побегов с последующей адаптацией их к почвенным условиям;
4. Выращивание растений в условиях теплицы и подготовка их к реализации и посадке в поле [3].
Изучив предложенные в литературе методы микроразмножения растений, мы выбрали метод, используемый в биотехнологической лаборатории Брянской Государственной Сельскохозяйственной Академии - индукции адвентивных почек эксплантата.
Он основан на способности изолированных частей растений при благоприятных условиях питательной среды, восстанавливать недостающие органы и регенерировать целые растения из разных частей (изолированного зародыша, листа стебля, семядолей, чешуек сегментов корней и зачатков соцветий) [3].
Мы проводили микроклональное размножение земляники. При этом изолировали меристематические верхушки этих растений и выращивали их на питательной среде Мурасиге-Скуга. Через 3-4 недели культивирования меристема развивалась в проросток, в основании которого формировались адвентивные почки, которые быстро росли и давали начало новым почкам. В течение 6-8 недель образовались конгломераты почек, связанные между собой соединительной тканью и находящиеся на разной стадии развития. Появились листья на коротких черешках, в нижней части которых сформировались новые адвентивные почки. Это почки мы разделили и, затем пересадили на свежую питательную среду. Таким образом, от одного материнского растения можно получать несколько миллионов растений-регенератов в год.
5. Практическая часть
5.1 Приготовление питательной среды для культивирования изолированных органов, тканей и клеток растений
Для обеспечения роста и развития любой растительной ткани или органа растения требуется соблюдение внешних физико-химических условий (освещённости, температуры, влажности, кислорода для дыхания, углекислого газа для фотосинтеза), поступление элементов минерального и органического питания. При культивировании растительных эксплантатов в закрытых пробирках фотосинтез затруднён, поэтому требуются более сложные по составу среды, обеспечивающие все потребности тканей или органов [2].
Культурные среды для растительных эксплантатов содержат следующие группы компонентов:
- Неорганические макроэлементы в виде солей (N, P, K, S, Fe, Ca, Mg) и микроэлементы (Co, Cu, Zn, B, Mo, Mn, J, Ni);
- Углеводы – сахароза, глюкоза – основа гетеротрофного питания растений in vitro, обеспечивает рост эксплантата.
- Аминокислоты, получаемые при гидролизе молочного белка казеина. Они синтезируются in vitro из сахара и минеральных веществ, их добавка оказывает положительное влияние на эксплантаты из меристем.
- Витамины (В1, В6, С, никотиновая кислота, и др.) – являются коферментами, обеспечивающих активность, улучшают адаптацию тканей и их рост.
- Фитогормоны – стимулируют рост и деление клеток растений, направляет развитее эксплантата в нужную сторону: ауксины – получение корней, цитокинины – побеги, гиббереллин – ростстимурирующий гормон.
- Желирующее вещество (агар-агар) регулирует консистенцию среды [2].
Самой популярной и универсальной минеральной основой для питательных сред является минеральная часть среды Мурасиге-Скуга (МС).








Смотреть слайды презентации Микроклональное размножение растений

Процесс клонального микроразмножения можно разделить на 4 этапа:
1. Выбор растения-донора, изолирование эксплантов и получение хорошо растущей стерильной культуры.
2. Собственно микроразмножение, когда достигается получение максимального количества меристематических клонов.
3. Укоренение размноженных побегов с последующей адаптацией их к почвенным условиям, а при необходимости депонирование растений-регенерантов при пониженной температуре (+2 о С, +10 о С).
4. Выращивание растений в условиях теплицы и подготовка их к реализации или посадке в поле.
Для культивирования тканей на каждом из четырех этапов требуется применение определенного состава питательной среды.
На первом этапе необходимо добиться получения хорошо растущей стерильной культуры. В тех случаях, когда трудно получить исходную стерильную культуру экспланта, рекомендуется вводить в состав питательной среды антибиотики (тетрациклин, бензилпенициллин и др.) в концентрации 100—200 мг/л. Это в первую очередь относится к древесным растениям, у которых наблюдается тенденция к накоплению внутренней инфекции.
На первом этапе, как правило, используют среду, содержащую минеральные соли по рецепту Мурасига и Скуга, а также различные биологически активные вещества и стимуляторы роста (ауксины, цитокинины) в различных сочетаниях в зависимости от объекта. В тех случаях, когда наблюдается ингибирование роста первичного экспланта, за счет выделения им в питательную среду токсичных веществ (фенолов, терпенов и других вторичных соединений), снять его можно, используя антиоксиданты. Это возможно двумя способами: либо омывкой экспланта слабым его раствором в течение 4—24 ч, либо непосредственным добавлением в питательную среду. В качестве антиоксидантов используют: аскорбиновую кислоту (1 мг/л), глютатион (4—5 мг/л), дитиотриэтол (1—3 мг/л), диэтилдитиокарбомат (2—5 мг/л), поливинилпирролидон (5000—10000 мг/л). В некоторых случаях целесообразно добавлять в питательную среду адсорбент - древесный активированный уголь в концентрации 0,5—1%. Продолжительность первого этапа может колебаться от 1 до 2 месяцев, в результате которого наблюдается рост меристематических тканей и формирование первичных побегов.
2 этап — собственно микроразмножение. На этом этапе необходимо добиться получения максимального количества мериклонов, учитывая при этом, что с увеличением субкультивирований увеличивается число растений-регенерантов с ненормальной морфологией и возможно наблюдать образование растений-мутантов.
Как и на первом этапе, используют питательную среду по рецепту Мурасига и Скуга, содержащую различные биологически активные вещества, а также регуляторы роста. Основную роль при подборе оптимальных условий культивирования эксплантов играют соотношение и концентрация внесенных в питательную среду цитокининов и ауксинов. Из цитокининов наиболее часто используют БАП в концентрациях от 1 до 10 мг/л, а из ауксинов—ИУК и НУК в концентрациях до 0,5 мг/л.
При долгом культивировании растительных тканей на питательных средах с повышенным содержанием цитокининов (5—10 мг/л) происходит постепенное накопление их в тканях выше необходимого физиологического уровня, что приводит к появлению токсического действия и формированию растений с измененной морфологией. Вместе с тем, возможно наблюдать такие нежелательные для клонального микроразмножения эффекты, как подавление пролиферации пазушных меристем, образование витрифицированных (оводненных) побегов и уменьшение способности растений к укоренению. Отрицательное действие цитокининов возможно преодолеть, по данным Н.В. Катаевой и Р.Г. Бутенко, путем использования питательных сред с минимальной концентрацией цитокининов, обеспечивающих стабильный коэффициент микроразмножения, или путем чередования циклов культивирования на средах с низким и высоким уровнем фитогормонов.
3 и 4 этапы — укоренение микропобегов, их последующая адаптация к почвенным условиям и высадка в поле являются наиболее трудоемкими этапами, от которых зависит успех клонального микроразмножения. На третьем этапе, как правило, меняют основной состав среды: уменьшают в два, а иногда и в четыре раза концентрацию минеральных солей по рецепту Мурасига и Скуга или заменяют ее средой Уайта, уменьшают количество сахара до 0,5—1% и полностью исключают цитокинины, оставляя один лишь ауксин. В качестве стимулятора корнеобразования используют β-индолил-3-масляную кислоту (ИМК), ИУК или НУК.
Укоренение микропобегов проводят двумя способами:
1) выдерживание микропобегов в течение нескольких часов (2—24 ч) в стерильном концентрированном растворе ауксина (20—50 мг/л) и последующее их культивирование на агаризованной среде без гормонов или непосредственно в подходящем почвенном субстрате (импульсная обработка);
2) непосредственное культивирование микропобегов в течение 3—4 недель на питательной среде, содержащей ауксин в невысоких концентрациях (1—5 мг/л в зависимости от исследуемого объекта). В последнее время предложен метод укоренения пробирочных растений в условиях гидропоники. Этот метод позволяет значительно упростить этап укоренения и одновременно получать растения, адаптированные к естественным условиям. Для картофеля возможно использовать безсубстратную гидропонику для получения мини-клубней. Затенение нижней части культуральных сосудов плотной черной материей или добавление в питательную среду активированного угля способствует укоренению микропобегов.
Пересадка растений-регенерантов в субстрат является ответственным этапом, завершающим процесс клонального микроразмножения. Наиболее благоприятное время для пересадки пробирочных растений — весна или начало лета.
Растения с двумя-тремя листьями и хорошо развитой корневой системой осторожно вынимают из колб или пробирок пинцетом с длинными концами или специальным крючком. Корни отмывают от остатков агара и высаживают в почвенный субстрат, предварительно простерилизованный при 85—90° С в течение 1—2 ч. Для большинства растений в качестве субстратов используют торф, песок (3:1); торф, дерновую почву, перлит (1:1:1); торф, песок, перлит (1:1:1). Исключение составляют семейство орхидных, для которых готовят субстрат, состоящий из сфагнового мха, смеси торфа, листьев бука или дуба, сосновой коры (1:1:1).
Приготовленным заранее почвенным субстратом заполняют пикировочные ящики или торфяные горшочки, в которых выращивают растения-регенеранты. Горшочки с растениями помещают в теплицы с регулируемым температурным режимом (20—22° С), освещенностью не более 5 тыс. лк и влажностью 65—90%. Для лучшего роста растений создают условия искусственного тумана. В тех случаях, когда нет возможности создать такие условия, горшочки с растениями накрывают стеклянными банками или полиэтиленовыми пакетами, которые постепенно открывают до полной адаптации растений.
Через 20—30 дней после посадки хорошо укоренившиеся растения подкармливают растворами минеральных солей Кнудсона, Мурасига и Скуга, Чеснокова, Кнопа (в зависимости от вида растений) или комплексным минеральным удобрением. По мере роста растений их рассаживают в большие емкости со свежим субстратом. Дальнейшее выращивание акклиматизированных растений соответствует принятой агротехнике выращивания для каждого индивидуального вида растений.
Процесс адаптации пробирочных растений к почвенным условиям является наиболее дорогостоящей и трудоемкой операцией. Нередко после пересадки растений в почву наблюдается остановка в росте, опадение листьев и гибель растений. Эти явления связаны, в первую очередь, с тем, что у пробирочных растений нарушена деятельность устьичного аппарата, вследствие чего происходит потеря большого количества воды. Во-вторых, у некоторых растений в условиях in vitro не происходит образования корневых волосков, что приводит, в свою очередь, к нарушению поглощения воды и минеральных солей из почвы. Поэтому целесообразно на третьем или четвертом этапах клонального микроразмножения применять искусственную микоризацию растений (для микотрофных), учитывая их положительную роль в снабжении растений минеральными и органическими питательными веществами, водой, биологически активными веществами, а также в защите растений от патогенов.
Индийскими учеными предложен простой метод предотвращения быстрого обезвоживания листьев растений, выращенных in vitro, во время их пересадки в полевые условия. Метод заключается в том, что листья в течение всего акклиматизационного периода следует опрыскивать 50%-ным водным раствором глицерина или смесью парафина, или жира в диэтиловом эфире (1:1). Применение этого метода помогает избежать длинных и затруднительных процессов закаливания пробирочных растений и обеспечивает 100%-ную их приживаемость.
Микроклональное размножение и оздоровление растений Методы микроклонального размножения
Методы клонального микроразмножения
Существует много методов клонального микроразмножения, а также различных их классификаций. Согласно одной из них, предложенной Мурасиге в 1977 году, процесс можно осуществлять следующими путями:
1. Активация пазушных меристем.
2. Образование адвентивных побегов тканями экспланта.
3. Возникновение адвентивных побегов в каллусе.
4. Индукция соматического эмбриогенеза в клетках экспланта.
5. Соматический эмбриогенез в каллусной ткани.
6. Формирование придаточных эмбриоидов в ткани первичных соматических зародышей (деление первичных эмбриоидов).
Н. В. Катаева и Р. Г. Бутенко (1983) выделяют два принципиально различных типа клонального микроразмножения:
1. Активация уже существующих в растении меристем (апекс стебля, пазушные и спящие почки стебля).
2. Индукция возникновения почек или эмбриоидов de novo :
а) образование адвентивных побегов непосредственно тканями экспланта;
б) индукция соматического эмбриогенеза;
в) дифференциация адвентивных почек в первичной и пересадочной каллусной ткани.
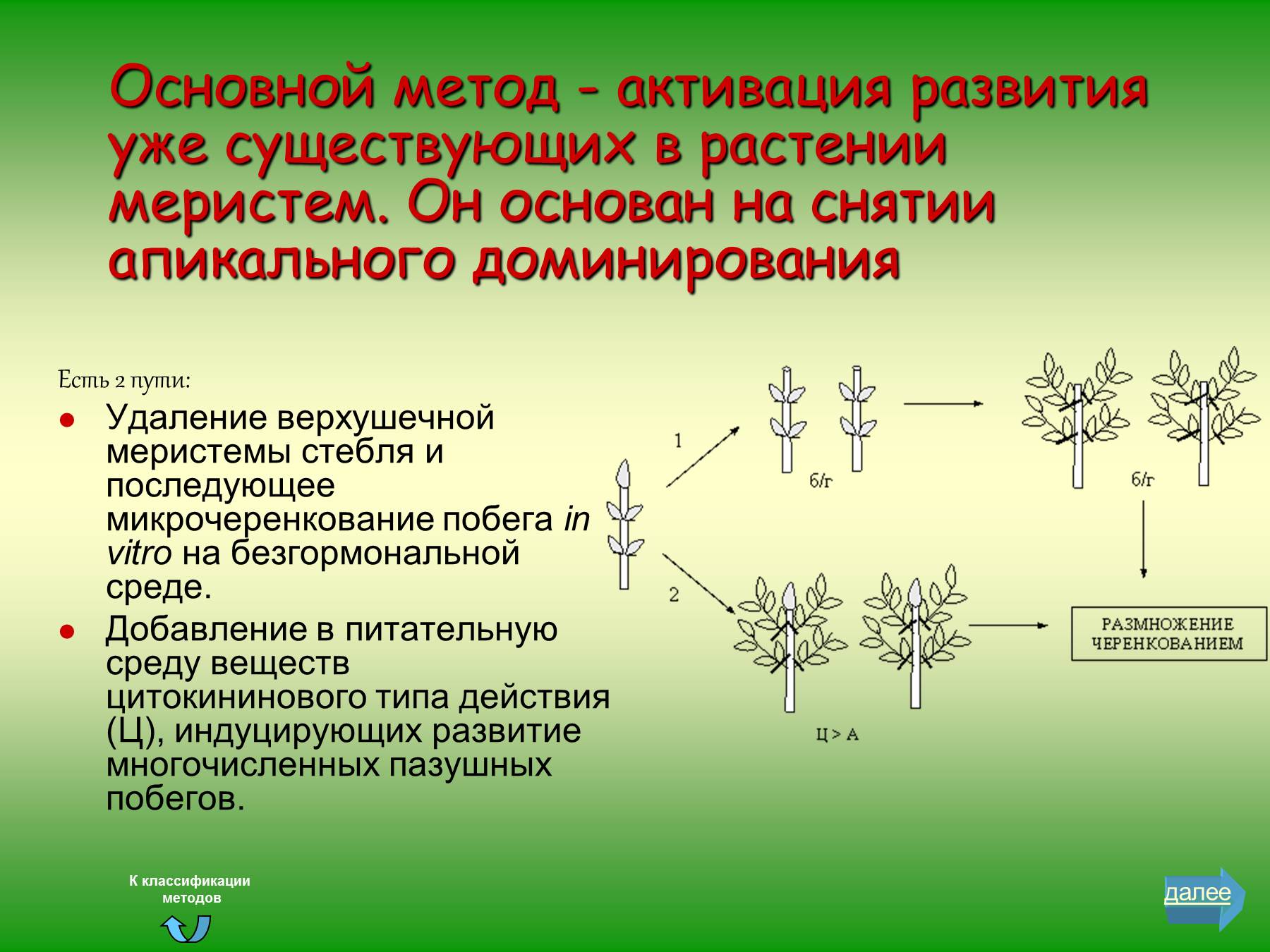
Основной метод, использующийся при клональном микроразмножении растений - активация развития уже существующих в растении меристем. Он основан на снятии апикального доминирования (рис. 18).
Этого можно достичь двумя путями: а) удалением верхушечной меристемы стебля и последующим микрочеренкованием побега in vitro на безгормональной среде; б) добавлением в питательную среду веществ цитокининового типа действия, индуцирующих развитие многочисленных пазушных побегов. Как правило, в качестве цитокининов используют 6-бензиламинопурин (БАП) или 6-фурфуриламинопурин (кинетин) и зеатин.

Рис. 18. Схема размножения растений методом активации уже существующих меристем (по А. Р. Родину, Е. А. Калашниковой, 1993): 1 – путем удаления верхушечной меристемы: 2 – добавлением цитокининов в среду (б/г – среда без гормонов, Ц – цитокинин, А – ауксин)
Полученные таким образом побеги отделяют от первичного экспланта и вновь самостоятельно культивируют на свежеприготовленной питательной среде, стимулирующей пролиферацию пазушных меристем и возникновение побегов более высоких порядков.
Часто в качестве экспланта используют верхушечные или пазушные почки, которые изолируют из побега и помещают на питательную среду с цитокининами. Образующиеся пучки побегов делят, при необходимости черенкуют и переносят на свежую питательную среду. После нескольких пассажей, добавляя в питательную среду ауксины, побеги укореняют in vitro (рис. 19), а затем переносят в почву, где создают условия, способствующие адаптации растений (рис. 20).

Рис. 19. Образование корней побегами розы при добавлении в питательную среду 2 мг/л 2,4-Д


Рис. 20. Адаптация пробирочных роз к почвенным условиям
В настоящее время этот метод широко используется в производстве посадочного материала сельскохозяйственных культур, как технических, так и овощных, а также для размножения культур промышленного цветоводства (например, гвоздики, рис. 21), тропических и субтропических растений, плодовых и ягодных культур, древесных растений. Для некоторых культур, таких как картофель, технология клонального размножения поставлена на промышленную основу. Применение метода активации развития существующих меристем позволяет получать из одной меристемы картофеля более 100000 растений в год, причем технология предусматривает получение в пробирках микроклубней - ценного безвирусного семенного материала.
Рис. 21. Пробирочная гвоздика
Второй метод - индукция возникновения адвентивных почек непосредственно тканями экспланта. Он основан на способности изолированных частей растения при благоприятных условиях питательной среды восстанавливать недостающие органы и таким образом регенерировать целые растения. Можно добиться образования адвентивных почек почти из любых органов и тканей растения (изолированного зародыша, листа, стебля, семядолей, чешуек и донца луковиц, сегментов корней и зачатков соцветий). Этот процесс происходит на питательных средах, содержащих цитокинины в соотношении с ауксинами 10:1 или 100:1. В качестве ауксина используют ИУК или НУК. Таким способом были размножены многие представители семейства лилейных, томаты, древесные растения (из зрелых и незрелых зародышей).
Достаточно хорошо разработана технология клонального размножения земляники, основанная на культивировании апикальных меристем. Меристематические верхушки изолируют из молодых, свободных от вирусных болезней растений, и выращивают на питательной среде МС, содержащей БАП в концентрации 0,1 - 0,5 мг/л. Через 3 - 4 недели культивирования меристема развивается в проросток, в основании которого формируются адвентивные почки, быстро растущие и дающие начало новым почкам. В течение 6-8 недель образуется конгломерат почек, связанных между собой соединительной тканью и находящихся на разной стадии развития. Появляются листья на коротких черешках, в нижней части которых формируются новые адвентивные почки. Эти почки разделяют и пересаживают на свежую питательную среду. На среде без регуляторов роста за 4 - 5 недель формируются нормальные растения с корнями и листьями. От одного материнского растения таким образом можно получить несколько миллионов растений-регенерантов в год.
Третий метод, практикуемый при клональном микроразмножении, основывается на дифференциации из соматических клеток зародышеподобных структур, которые по своему виду напоминают зиготические зародыши (рис. 22). Этот метод получил название соматического эмбриогенеза. В отличие от развития in vivo, соматические зародыши развиваются асексуально вне зародышевого мешка и по своему внешнему виду напоминают биполярные структуры, у которых одновременно наблюдается развитие апикальных меристем стебля и корня. Согласно Стеварду, соматические зародыши проходят 3 стадии развития: глобулярную, сердцевидную, торпедовидную и в конечном итоге имеют тенденцию развития в проросток. На рисунке 3 показан конечный результат развития – растение пшеницы.

Рис. 22. Соматический эмбриогенез в каллусной ткани
Наиболее впечатляющим применением метода соматического эмбриогенеза стало размножение гвинейской масличной пальмы (Elaeis guineensis), масло которой широко используется при производстве маргарина и пищевого масла. Масличная пальма в природе не образует побегов и боковых ростков, что затрудняет ее вегетативное размножение. Культивирование черенков in vitro также невозможно. Было решено получить скопления клеток недифференцированной ткани (каллусы) путем дедифференцировки специфических тканей, а затем культивировать их до регенерации целых проростков. В первой культуральной среде каллусы из фрагментов листьев развивались в течение 90 дней, при переносе во вторую и третью культуральные среды превращались в "эмбриоиды". Эмбриоиды размножались самопроизвольно, в течение месяца число эмбриоидов возрастало втрое, а за год из 10 эмбрионов можно было получить потомство численностью 500000 растений.
Формирование эмбриоидов в культуре тканей осуществляется в несколько этапов. Сначала происходит дифференциация клеток под влиянием ауксинов, добавленных в питательную среду (2,4-Д) и превращение их в эмбриональные. Получить эмбриоиды из этих клеток можно уменьшая концентрацию ауксинов или исключая их из питательной среды. Соматические зародыши представляют собой полностью сформированные зародыши, из которых путем соответствующего капсулирования можно получить искусственные семена.
Четвертый метод клонального микроразмножения - дифференциация адвентивных почек в первичной и пересадочной каллусной ткани (рис. 23).

Рис. 23. Дифференциация придаточных почек в каллусной ткани
Практически он мало используется с целью получения посадочного материала in vitro. Это связано с тем, что при частом пассировании каллусной ткани может изменяться плоидность регенерируемых растений, наблюдаются структурные перестройки хромосом и накопление генных мутаций. Наряду с генетическими изменениями отмечаются и морфологические: низкорослость, неправильное жилкование листьев, образование укороченных междоузлий, пониженная устойчивость к болезням и вредителям. В то же время, некоторые недостатки этого метода в селекционной работе оборачиваются преимуществами.

Рис. 24. Формирование побегов каллусной тканью пшеницы
Кроме того, в некоторых случаях он является единственно возможным способом размножения растений в культуре тканей. Через каллусную культуру успешно размножаются сахарная свекла, злаковые (рис. 24), представители рода Brassica, подсолнечник и другие культуры.

Для каждого огородника, хоть профессионала, хоть любителя, важно знать, каким образом можно размножать свои посадки. Способов существует достаточно много, и одним из наиболее интересных и действенных является метод микроклонального размножения. Что это такое, как работает и все основные его премудрости - в нашем материале.
Что же это?
Начнем сразу с самого главного. В словосочетании "микроклональное размножение" второе слово понятно всем, а вот первое - только избранным. Проясним ситуацию. Что же есть такое "микроклональное"?
Если говорить "умным" научным языком, то это особый подвид вегетативного размножения с использованием техники под названием "инвитро" (in vitro), который дает возможность получить растения в более короткие сроки. Понятнее и подробнее будем разбираться дальше, и для этого сначала напомним о том, что представляет собой вегетативное размножение, и поясним, что означает термин "инвитро".
В научных дебрях
Из курса школьной биологии нам известно, что размножать растения можно двумя путями: семенным (когда мы разбрасываем в почву семена) и вегетативным. Вегетативное размножение является бесполым, оно происходит с помощью отделения некой части от растения-родителя. Почкование, укоренение молодых побегов, пересадка луковиц - все это вегетативное размножение.
Казалось бы, с помощью семян увеличивать численность растений гораздо проще - нет такой мороки. Однако у этого метода есть немало минусов; в отдельных случаях воспользоваться семенами вообще невозможно - и вегетативный способ, неоспоримое преимущество которого перед первым состоит в сохранении совокупности генов растения-родителя, остается единственно доступным и удобным. Но к сожалению, недостатков хватает и у него. Например, отсутствие нужной эффективности (у таких, допустим, растений, как дуб, сосна и так далее), "пожилые" древесные породы (которым больше 15 лет) не способны размножаться черенкованием, подобные процедуры довольно трудоемки и энергозатратны, не всегда полученные растения соответствуют норме и образцу (могут быть зараженными) - ну и так далее.

И именно для этих случаев существует технология микроклонального размножения растений, которая, как Чип и Дейл, спешит на помощь. Как уже говорилось выше, она осуществляется в технике "инвитро", что с латинского языка переводится как "в пробирке". Таким образом, данная методика позволяет "клонировать" в "пробирке" растение с генами точь-в-точь такими, как и у родительской особи. Это происходит благодаря тому, что клетка способна давать жизнь новому организму под влиянием внешних факторов.
У технологии микроклонального размножения есть, бесспорно, целый ряд достоинств и преимуществ. О них далее и поговорим.
Чем метод микроклонального размножения лучше
Многим! И в первую очередь отсутствием вирусов и инфекций у выведенных растений (потому, что для этого используются особые клетки - они называются меристемными, особенность их заключается в непрестанном делении и наличии физиологической активности на протяжении всей жизни). Также у растений, "добываемых" таким способом, присутствует достаточно высокий объем размножения, а весь селекционный процесс проходит гораздо быстрее. С помощью технологии микроклонального размножения возможно осуществить эту процедуру и для тех растений, для которых обычными, "традиционными" методами это сделать крайне проблематично. Наконец, в технике "инвитро" выращивать растения можно в течение всего года, не ограничиваясь каким-либо одним промежутком. Так что плюсов у подобной методики действительно много. И прежде чем углубляться в суть микроклонального размножения растений, коснемся немного истории возникновения данного способа. Кому и как пришла в голову такая идея?
История метода
Первым успешный опыт над орхидеями произвел ученый-француз еще в пятидесятых годах прошлого столетия. При этом не он стал изначально заниматься техникой "инвитро" - ее разрабатывали и до него, и вполне успешно. Однако именно Жан Морель - таково имя француза-экспериментатора - решился на подобный опыт и осуществил его вполне удачно. Работы же, рассказывающие про данную технику, появились еще на несколько десятилетий до него - в двадцатых годах прошлого же столетия.

"Пробирочный клон" древесного растения - конкретно осины - был получен в шестидесятых годах. Работать с деревом оказалось труднее, нежели с цветами и иными видами растений, однако и эти трудности через определенный промежуток времени были преодолены. В настоящее время более 200 видов деревьев из более чем сорока семейств можно получать "пробирочным" способом. Технология микроклонального размножения растений оправдывает себя и дает свои плоды.
Подробнее о методе
Как уже можно было догадаться, в разработке и применении микроклонального размножения растений существует много своих тонкостей. Так, например, есть особые этапы у данной технологии, соблюдать которые для получения желаемого результата просто необходимо. Нужно понимать, что пренебрежение последовательностью действий или каким-то этапом может принести абсолютно не тот итог, на который рассчитывает селекционер. Итак, об этапах данной методики мы и поговорим далее.
Этапы микроклонального размножения растений
Подобная технология предполагает четыре "ступеньки" на пути к получению заветных "клонов". Постараемся рассказать о них как можно более ненаучно, поскольку термины биотехнологии - вещь все же не самая понятная для широкой аудитории. И, кстати, один из этих терминов тут же и поясним: эксплант - так ученые в данной области именуют отделенный от родительского организма новый организм. То есть тот самый "подопытный", который и будут выращивать далее.
Итак, перейдем к нашим "ступенькам". Первый шажок - это выбор собственно родителя - или донора. К этому вопросу следует подойти с максимальной серьезностью и ответственностью, потому что для получения хорошего, крепкого, здорового растения мы и "оригинал" должны подобрать такой же. Яблоко-то от яблони, как известно, недалеко падает.
На этом же этапе необходимо изолировать и стерилизовать экспланты, после чего организовать такие условия, чтобы рост этих самых эксплантов в технике "инвитро" происходил максимально комфортно.
Вторая "ступенька" проще некуда - это само размножение. Оно возможно через месяц-полтора, когда мини-череночки уже достигли размера горошинок и имеют зачатки всех вегетативных органов. За ним, в свою очередь, следует укоренение побегов, которые получились на предыдущем этапе. Его проводят, когда растение уже образовало хорошую корневую систему.

Последний шаг - помощь растениям в адаптации к "жизни" в почве, выращивание их в теплице, последующая пересадка в землю либо реализация - так сказать, "отправление в большой мир". Этот этап, как это ни странно, наиболее трудоемкий и многозатратный, поскольку очень часто, к сожалению, бывает такое, что, оказавшись в почве, растение начинает терять листья, останавливаться в росте – а затем и вовсе оно может погибнуть. Все это происходит потому, что пробирочные растения при пересадке в грунт теряют очень много воды. Следовательно, необходимо в процессе пересаживания предотвратить подобную возможность – для чего рекомендуется опрыскивать листья 50-процентным водным раствором глицерина или смесью парафина. Делать это необходимо на протяжении всего акклиматизационного периода. Кроме того, в некоторых случаях целесообразной является намеренная микоризация – то есть искусственное внедрение в ткани растения грибов, которые заражают его. Проводится это для того, чтобы растение получило как можно больше полезных питательных и органических веществ, а также было защищено от различных патогенов.
Вот и все этапы микроклонального размножения, в которых, как мы видим, нет ничего глобально сложного или сверхъестественного, однако, повторим еще раз, все это мероприятие требует большой ответственности и внимания.
Влияющие факторы
- Сортовые, видовые и физиологические особенности растения-родителя – оно должно быть здоровым, интенсивно расти, при необходимости обработано температурным воздействием.
- Возраст, строение и происхождение экспланта.
- Длительность культивирования.
- Эффективность стерилизации.
- Удачная питательная среда.
- Гормоны, минеральные соли, углеводы, витамины.
- Температура и освещение.
Что нужно для микроразмножения
К растениям, которые будут размножать вышеуказанным образом, предъявляется одно очень важное требование - помимо того, что они должны быть здоровы. Это непременное сохранение генетической стабильности на протяжении всех вышеупомянутых этапов. Такому требованию лучше всего отвечают апикальные меристемы, а также пазушные почки стеблевого происхождения, поэтому именно их и предпочитают использовать для интересующей нас процедуры.
Вышеупомянутые термины должны быть непонятны простому обывателю. Ниже попробуем растолковать, что это за звери такие и с чем их подавать к столу.
Апикальные меристемы
Выше мы уже упоминали о существовании особых меристемных клеток - иначе говоря, образовательных. Это клетки, которые непрестанно делятся, всегда находятся в состоянии физической активности - благодаря чему нарастает масса растения и образуется особая ткань этого самого растения. Она и называется меристемой. Видов меристем бывает много разных. В целом их можно поделить на общие и специальные. В понятие общих меристем входят три группы, которые как бы вытекают одна из другой. Самая первая меристема у растения - меристема зародыша, из которой как раз-таки и берет начало интересующая нас апикальная меристема.
Слово "апикальный" произошло от латинского "апикс" и переводится оно как "вершина". Таким образом, это верхушечная система тканей, находящаяся на самом кончике зародыша - и именно из нее впоследствии формируется побег и начинается его рост и развитие. Значит, говоря об апикальной меристеме как об объекте для микроклонирования, мы должны понимать, что берем для наших нужд верхушечку зародыша.

С пазушными почками немного проще. Что такое почки, знают все. Пазушная почка - та, что родилась из пазухи листа. Пазуха листа, в свою очередь, это угол между листом и его стеблем; оттуда будет как раз и расти почка либо же побег. Вот эту самую часть, то есть будущий боковой побег, и берут тоже для последующего микроразмножения.
Теперь, когда свет над завесой тайны немного пролит, можно перейти, наконец, и к методам микроклонального размножения растений.
Способы размножения микро-образом
Микроклональное размножение тем еще хорошо, что предполагает в своей основе возможность использования сразу нескольких различных техник. Постараемся как можно проще осветить каждую из них. Всего насчитывается четыре метода микроклонального размножения растений.
Первый. Активация уже существующих в растении меристем
Что это значит? В растении, даже таком крошечном микрокусочке, уже заложены определенные меристемы. Это верхушка стебля и пазушные его почки. Для того чтобы микроклонировать растение, можно "в пробирке" "разбудить" эти спящие доселе меристемы. Достигается это либо удалением верхушечной меристемы микроросточка, вернее, его стебля, а затем черенкованием побега в технике "инвитро" либо же внедрением в питательную среду растения особых веществ, которые активизируют рост и развитие пазушных побегов. Метод активации "спящих" меристем является основным, наиболее популярным и действенным, а разработан он был еще в семидесятых годах минувшего столетия. Первым "подопытным кроликом" в применении микроклонального размножения растений подобного типа стала земляника. Важно заметить, впрочем, что бесконечно размножать культуры подобным образом запрещено, поскольку это чревато потерей способности к укоренению, а в некоторых случаях – гибелью растения.
Второй. Появление адвентивных почек силами самого растения
У любой изолированной части растения есть поистине волшебная способность, своя суперсила. Если при микроклональном размножении питательная среда растения и все прочие условия жизни благоприятны и комфортны, то оно может восстанавливать недостающие части. Происходит своеобразная регенерация - ткани растения образуют адвентивные, или придаточные почки - то есть такие, что возникают как бы "из старых запасов", а не из новых тканей. Такие почки необычны тем, что появляются, как правило, в тех местах, откуда их возникновения никак не ждешь - на корнях, к примеру. Именно подобным способом часто размножают многие цветы, опять же - землянику. Это второй по популярности и действенности метод микроклонального размножения растений.
Третий. Соматический эмбриогенез
Активно подобным методом микроклонального размножения растений пользуются при размножении масличной пальмы. Все дело в том, что, поскольку у нее нет ни побегов, ни боковых ростков, вегетативное размножение ее невозможно (ну или, во всяком случае, весьма и весьма затруднительно), как невозможно и черенкование. Таким образом, вышеуказанная методология единственная из всех наиболее доступна и оптимальна при работе с данным растением.
Четвертый. Работа с каллусной тканью
Данный метод из всех четырех вышеприведенных является, пожалуй, наименее востребованным. В первую очередь, это связано с тем, что слишком частое разделение клеток каллусной ткани способно привести к генным нарушениям и мутациям разного уровня. Поскольку сохранение генотипа очень важно для микроклонального размножения, и культура тканей должна соблюдаться на высшем уровне. Кроме того, при вышеуказанных нарушениях проявляются и иные недостатки: низкорослость, восприимчивость к болезням и так далее. Впрочем, в некоторых случаях исключительно подобным способом и возможно размножение – например, для сахарной свеклы иного метода попросту не подобрать.
Далее мы для примера скажем пару слов о клонировании конкретных растений, но прежде –нужно поделиться информацией об оздоровлении растений, использующихся в качестве посадочного материала. Каким образом этого можно добиться?
Оздоровление
О клонировании картофеля

При микроклональном размножении картофеля его выращивают в пробирках по два черенка, пробирки помещаются под свет люминесцентных ламп силой от шести до восьми тысяч люкс, температура сохраняется ночью в пределах восемнадцати градусов, днем – приблизительно двадцать пять. В России именно картофель выращивают с помощью клонирования наиболее активно.
О клонировании яблони: что нужно знать
В микроклональном размножении яблони широко применяется первый способ – размножение с помощью пазушных почек. Отмечается высокая способность данной культуры к укоренению и приживаемость большего количества эксплантов.

Их помещали в жидкую питательную среду, которая постоянно – ежедневно – обновлялась. Температура для пробирочных растений также поддерживалась на уровне двадцати пяти градусов днем, эксперимент проводился в течение трех-четырех недель.
Интересные факты

Такова информация о микроклональном размножении растений – теме насколько сложной, настолько и интересной.
Читайте также:

