Практическая работа 4 по химии кислород ель получить и собрать кислород
Добавил пользователь Евгений Кузнецов Обновлено: 19.09.2024
Краткое описание: Цель – закрепить и усовершенствовать знания учащихся об основных способах получения кислорода в лабораторных условиях и изучить его свойства.Задачи:Образовательные:· изучить способы получения кислорода (способом вытеснения воздуха и способом вытеснения воды),
План - конспекта урока
Учебник: Химия: Неорганическая химия. 8 класс. Рудзитис Г. Е., Фельдман Ф. Г.
Цель - закрепить и усовершенствовать знания учащихся об основных способах получения кислорода в лабораторных условиях и изучить его свойства.
развить кругозор учащихся;
умения составлять уравнения химических реакций;
соблюдение правила техники безопасности во время проведения химических экспериментов;
Тип урока: Урок совершенствования и применения знаний (практическая работа).
Необходимое оборудование и реактивы: лабораторный штатив с пробирками, пробка с газоотводной трубкой, колба плоскодонная, ложечки для сжигания веществ (с пробкой), горелка и спички, лучины, кристаллизатор с водой, стеклянная пластинка; перманганат калия KMnO4, уголь С (порошок), известковая вода Ca(OH)2.
Основные этапы урока:
1. Организационная часть (2 мин)
2. Вводная часть (10 мин)
3. Основная часть (20 мин)
4. Заключительная часть (13 мин).
Основные этапы урока, время
Содержание учебного материала, деятельность учителя
Содержание учебного материала, деятельность учащихся
Организационная часть (2 мин)
Приветствую учащихся. Отмечаю отсутствующих. Проверяю готовность к уроку.
Приветствуют учитель. Староста называет отсутствующих.
Вводная часть (10 мин)
- Целью сегодняшнего урока является получить кислород в лабораторных условиях способом вытеснения воздуха, также изучить его физические и химические свойства.
- До того, как приступить к выполнению практической работы учитель должен ознакомить учеников с правилами техники безопасности (см. Приложение 1).
- Затем учитель показывает, как правильно собирать и использовать прибор для получения кислорода.
Прибор для собирания кислорода методом вытеснения воздуха.
Во время сбора прибора, учитель задает следующие вопросы ученикам:
1. Почему стакан для сбора кислорода расположен вниз дном, а не вверх дном? Объясните?
2. Перечислите физические свойства кислорода? Может ли кислород быть жидким или твердым?
3. Как доказать, что в стакане находится кислород?
Ученики внимательно слушают правила техники безопасности. Задают вопросы по поводу работы. Записывают правила в тетрадь.
Ученики зарисовывают прибор, должны обозначить на рисунке: штатив, пробирку с перманганатом калия, горелку, стакан.
Ответы на вопросы:
1. Кислород тяжелее воздуха. При н. у. 1 л кислорода весит 1, 43 г, а воздух 1, 29 г.
2. Кислород - бесцветный газ, без запаха и вкуса, малорастворимый в воде, тяжелее воздуха. При давлении 760 мм. рт. ст. и температуре - 183 °С кислород сжижается, а при снижении температуры до - 218, 8 °С затвердевает.
3. Доказать присутствие кислорода в стакане можно с помощью лучинки.
Основная часть (20 мин)
После того, как учитель объяснил правила сборки прибора, он делит учеников на группы и раздает карты - инструкции (см. Приложение 2).
Учитель во время практической работы наблюдает за правильностью выполнения приемов и операций учащимися.
Ученики читают карты - инструкции к практической работе, задают вопросы, если не понятен ход выполнения практической работы.
После ознакомления с картой - инструкцией, ученики приступают к выполнению практической работы.
После проведения экспериментов, ученики заполняют итоговый отчет и делают общий вывод.
Учитель может показать отчет на отдельном слайде или же включить его в карту - инструкцию.
Заключительная часть (13 мин)
Учитель в конце занятия раздает ученикам демонстрационные карточки с самостоятельной работой (см. Приложение 3).
Выполняют самостоятельную работу в тетрадях для самостоятельных/ контрольных работ. Сдают тетради учителю.
В задании 4 ученики делятся на 3 варианта, к каждому варианту соответствующая задача.
Приложение к конспекту урока
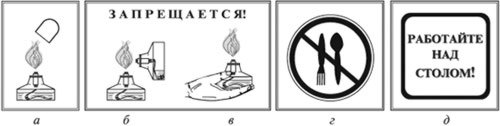
Приложение 1. Правила техники безопасности.
Осторожно обращайтесь с химическим оборудованием!
Помните! Пробирку прогревают, держа ее в наклонном положении, по всей длине двумя-тремя движениями в пламени спиртовки. При нагревании направляйте отверстие пробирки в сторону от себя и соседей.

Тушите спиртовку только колпачком (а).
Запрещается зажигать одну спиртовку с помощью другой (б).
Запрещается передавать спиртовку в зажженном виде (в).
Запрещается пробовать вещество на вкус (г).
Работу проводить только над столом (д).
Цель - научить использовать лабораторное оборудование и посуду для получения, собирания и доказательства наличия кислорода, соблюдать правила техники безопасности.
В этой работе вам предстоит изучить один из лабораторных способов получение кислорода и его свойства. Выяснить роль катализатора. Совершенствовать умение работать с приборами. Научиться собирать кислород различными способами, формировать навыки нагревания и пользования нагревательными приборами, соблюдая правила техники безопасности при работе с нагревательными приборами, при нагревании, при собирании приборов.
Лабораторный штатив с пробирками
Пробка с газоотводной трубкой
Ложечки для сжигания веществ (с пробкой)
Горелка и спички, лучины
Кристаллизатор с водой
Перманганат калия KMnO4
Пероксид водорода (20 % - ный) H2O2
Оксид марганца (IV) MnO2
Железная проволока (или игла)

Соберите прибор для получения кислорода, состоящий из пробирки и газоотводной трубки.
Проверьте прибор на герметичность! Зажмите пробирку в ладони, опустите конец трубки в воду: появление пузырьков воздуха указывает на герметичность прибора.
Задача 2. Получение кислорода нагреванием перманганата калия

В пробирку до 1/ 5 ее объема насыпьте перманганат калия, введите в пробирку небольшой рыхлый тампон из ваты и плотно закройте ее пробкой с газоотводной трубкой, держа пробирку пальцами у отверстия.
Снова испытайте прибор на герметичность (см. задача 1).
Прогрейте пробирку пламенем спиртовки (равномерно перемещая пламя спиртовки вдоль пробирки); поставьте спиртовку под ту часть, где находится перманганат калия.
Соберите кислород вытеснением воздуха из стакана.
Наденьте на конец газоотводной трубки стеклянный наконечник.

Опустите трубку с наконечником в стакан с водой (не более 1/ 2 высоты стакан).
Наполните пустую пробирку с водой, и закройте ее пробкой с держателем.
Опустите пробирку в стакан с водой; выньте пробку с держателем. Наденьте пробирку на наконечник газоотводной трубки, не вынимая пробирку из воды.
Закройте конец газоотводной трубки кусочком ваты.
Нагрейте вновь пробирку с перманганатом калия и соберите кислород вытеснением воды из пробирки.

Выньте газоотводную трубку из стакана с водой, не прекращая нагревания пробирки с перманганатом калия, в противном случае воду из стакана может перебросить в раскаленную пробирку!
Затем кусочек угля укрепите на конце проволоки, которую держите тигельными щипцами при внесении угля в пламя; раскаленный уголек внесите в сосуд с кислородом. Обратите внимание на беспламенное горение угля.
Оформите отчет о работе:
Выполняемые операции
(что делали)
Рисунки с обозначениями исходных и полученных веществ
Наблюдения. Условия
проведения реакций.
Уравнения реакций
Объяснения наблюдений. Выводы
Сборка прибора для получения кислорода. Проверка прибора на герметичность
Получение кислорода
из KMnО4 при нагревании
Доказательство получения кислорода c помощью
тлеющей лучинки
Характеристика физических свойств О2. Собирание О2 двумя методами:
вытеснением воздуха,
вытеснением воды
Характеристика
химических свойств О2. Взаимодействие
с простыми веществами:
горение угля.
Образец отчета о проделанной практической работе
Выполняемые операции
(что делали)
Рисунки с обозначениями исходных и полученных веществ
Наблюдения.
Условия
проведения реакций. Уравнения реакций
Объяснения наблюдений.
Выводы
Сборка прибора для получения кислорода.
Проверка прибора на герметичность
Выделяются пузырьки воздуха
Прибор собран герметично
Получение кислорода из KMnO4
при нагревании
При нагревании KMnO4происходит реакция:
О2 получают в лаборатории разложением KMnO4 при нагревании
Доказательство получения кислорода при помощи
тлеющей лучинки
Тлеющая лучинка
(уголь) ярко загорается
в О2
Полученный газ О2поддерживает горение
Характеристика
физических свойств О2. Собирание О2 двумя методами:
вытеснением воздуха (а),
вытеснением воды (б)
Кислород вытесняет воздух и воду из сосудов
Кислород - газ без цвета и запаха,
немного тяжелее воздуха, поэтому
его собирают в сосуд, поставленный на дно. Кислород малорастворимый в воде
Характеристика химических свойств О2. Взаимодействие с простыми веществами: горение угля.
Раскаленный уголек ярко горит в О2:
Известковая вода мутнеет, т. к. образуется нерастворимый в воде осадок СaСО3:
СО2 + Са(ОН)2 СaСО3 + H2O.
О2взаимодействует
с простыми
веществами - металлами и неметаллами. Образование осадка белого цвета подтверждает наличие в колбе СО2
ВЫВОД: Один из способов получения кислорода в лаборатории - разложение КMnO4. Кислород - газ без цвета и запаха, тяжелее воздуха в 1,103 раза (Mr(O2) = 32, Mr(возд.) = 29, из чего следует 32/29 1,103), малорастворим в воде. Вступает в реакции с простыми веществами, образуя оксиды.
Приложение 3. Карточка для самостоятельной работы (Демонстрационная карточка).
1) Заполните пропуски в таблице:
Уравнение реакции, условия течения
При нагревании KMnO4 выделяется ___________.
2. Распознавание кислорода
При внесении ________ лучины в стакан (колбу) с O2 она ________________.
3. Физические свойства O2
При комнатной температуре O2 находится в ____________ состоянии. O2 __________________воздуха.
4. Горение угля в O2
Уголь горит в O2 более ___________, чем в воздухе.
5. Исследование продукта горения в O2
Известковая вода_________, чем так как при горении угля в O2 образуется_________________.
2) Какие из физических свойств можно отнести к кислороду (н. у.): легче воздуха, тяжелее воздуха, твердый, жидкий, газ, бесцветный, зеленый, голубой, хорошо растворим в воде, мало растворим в воде, электропроводен, с резким запахом, сладкий, кислый.
3) Допишите схемы реакций, лежащих в основе лабораторных способов получения кислорода. Расставьте коэффициенты:
4) Задача 1: Определите, какое из соединений железа - Fe2О3 или Fe3О4 - богаче железом?
Задача 2: Какое число молекул содержится в 2, 5 моль кислорода?
Задача 3: Определите количество вещества и число молекул, составляющие 12 г. кислорода?
1. Карты - инструкции для практических занятий по химии 8 -11 класс. Т. С. Назарова, В. Н. Лаврова.
2. Рабочая тетрадь по химии 8 класс. Гузей Л. С.
3. Ерыгин Д.П., Шишкин Е.А. Методика решения задач по химии: Учеб. пособие для студентов пед. ин-тов по биол. и хим. спец. - М.: Просвещение, 1989.
4. Катаева Л.Г., Толкачева Т.К. Карточки-задания по неорганической химии: 8 класс - 96 с.
· Продолжить формирование умений по составлению уравнений химических реакций, расстановке коэффициентов в уравнениях химических реакций. Развивать практические умения и навыки в ходе выполнения лабораторных опытов;
· способствовать формированию культуры учебного труда, аккуратности, внимания при проведении эксперимента, совершенствовать технику безопасного труда;
· способствовать развитию у школьников интереса к химической науке, к исследовательской деятельности
Оборудование и реактивы:
· штатив лабораторный с лапкой;
· пробка с газоотводной трубкой;
· перманганат калия (твердый) KMnO4;
| Вложение | Размер |
|---|---|
| prakt_rabota_poluchenie_i_sv_kisloroda.docx | 25.6 КБ |
Предварительный просмотр:
Тип урока: комбинированный
- научить использовать лабораторное оборудование и посуду для получения, собирания и доказательства наличия кислорода;
- Продолжить формирование умений по составлению уравнений химических реакций, расстановке коэффициентов в уравнениях химических реакций. Развивать практические умения и навыки в ходе выполнения лабораторных опытов;
- способствовать формированию культуры учебного труда, аккуратности, внимания при проведении эксперимента, совершенствовать технику безопасного труда;
- способствовать развитию у школьников интереса к химической науке, к исследовательской деятельности
Оборудование и реактивы:
- штатив лабораторный с лапкой;
- спиртовка;
- пробирки 2 шт;
- пробка с газоотводной трубкой;
- спички;
- лучинка;
- вата.
- перманганат калия (твердый) KMnO 4 ;
1 . Организационный момент . Приветствие учащихся, настрой на урок.
2. Актуализация знаний :
Сегодня на уроке мы с вами продолжим изучать кислород, вещество, вокруг которого, как говорил шведский химик Якоб Берцелиус, вращается вся земная химия. (Слайд 1) Мы уже достаточно много узнали о кислороде и, что бы вы проверили и оценили свои знания, предлагаю вам химический диктант. (Слайд 2) Если утверждение соответствует простому веществу – кислороду, и вы с утверждением согласны, то ставим “да”, если нет - “нет”.
- В промышленности получают из воздуха.
- Хорошо растворим в воде.
- При обычных условиях – бесцветный газ.
- Сложное вещество.
- Газ, имеющий запах.
- В природе встречается только в связанном виде.
- Простое вещество.
- Легче воздуха.
- Собирают в сосуд, поставленный обычно на дно.
- Малорастворим в воде.
- В природе встречается в свободном и связанном виде.
- Собирают в перевёрнутый вверх дном сосуд.
- Тяжелее воздуха.
- Необходим для дыхания.
- Применяют для сварки и резки металлов.
Проводится проверка. Учащиеся оценивают друг друга
Перед вами на доске записи, распределите их на две группы:
(газ, простое вещество, жидкость голубого цвета, кристаллы синего цвета, окисление, без запаха, без вкуса, горение)
1 – физические свойства ( газ, простое вещество, жидкость голубого цвета, кристаллы синего цвета, без запаха, без вкуса );
2 – химические свойства ( окисление, горение )
Записываем тему урока в тетрадь.
Mg, P 2 O 5 , S, SO 2 , H 2 , CO 2 , Fе 2 O 3 , C, H 2 O, CuO
А теперь подумайте и скажите, как их можно получить?
Но, чтобы убедиться, что такие реакции действительно идут, я предлагаю вам посмотреть их протекание. Демонстрация горения серы и фосфора в кислороде с последующей записью соответствующих химических реакций на доске (слайд-видео)
А вот оксид СО 2 я предлагаю вам получить самостоятельно в ходе лабораторной работы. Что с чем должно прореагировать? (Слайд 6)
Перед тем, как учащиеся приступят к выполнению опыта повторить ТБ с нагревательными приборами.
Перед учащимися поставить задачу не просто проделать опыт, но и описать его.
Лабораторная работа 10-15 минут.
Записать уравнение реакции С + О 2 = СО 2 в тетрадь.
Сегодня мы на уроке наблюдали получение кислорода путем нагревания
2KMnO 4 -- t --→ K 2 MnO 4 + MnO 2 + O 2 ↑ ,
еще кислород можно получать методом нагревания KClO 3 ( хлорат калия )
2KClO 3 -- t --→ 2KCl +3O 2 ↑,
и из 2H 2 O 2 ---- cat --→ 2 H 2 O + O 2 ↑
4. Домашнее задание
5. Закрепление: решение задачи
Задача . Определите, какое из соединений железа – Fe 2 О 3 или Fe 3 О 4 – богаче железом?
Fe 2 O 3 ,
Fe 3 O 4 .
(Fe) в Fe 2 O 3 ,
' (Fe) в Fe 3 O 4
(Х) = n • A r (X)/ M r , где n – число атомов элемента Х в формуле вещества.
M r (Fe 2 O 3 ) = 56•2 + 16•3 = 160,
(Fe) = 56•2/160 = 0,7,
(Fe) = 70%,
M r (Fe 3 O 4 ) = 56•3 + 16•4 = 232,
' (Fe) = 56•3/232 = 0,724,
' (Fe) = 72,4%.
Ответ . Fe 3 O 4 богаче железом, чем Fe 2 O 3 .
7 . Сказать, что оценивание будет проведено индивидуальной карте учебных достижений с учетом работы на уроке. Перечислить наиболее активных учащихся.
8. Рефлексия (Слайд 20)
Цель работы: научиться использовать лабораторное оборудование и посуду для получения, собирания и доказательства наличия кислорода, соблюдать правила техники безопасности.
Оборудование и реактивы: штатив лабораторный с лапкой, спиртовка, пробирки 2 шт., пробка с газоотводной трубкой, спички, лучинка, вата, перманганат калия (твердый) KMnO 4 .
Правила техники безопасности.
Осторожно обращайтесь с химическим оборудованием!
Помните! Пробирку прогревают, держа ее в наклонном положении, по всей длине двумя-тремя движениями в пламени спиртовки. При нагревании направляйте отверстие пробирки в сторону от себя и соседей.
1. Собрать прибор для получения кислорода.
2. Насыпать в пробирку перманганат калия ( KMnO 4). Твердого вещества должно быть 1-1,5 см по высоте пробирки.
3. Прогрейте пробирку, а потом нагревайте перманганат калия.
4. Подожгите лучинку, дождитесь появления на конце красного уголька и тут же погасите. Поднесите тлеющую лучинку к краю стакана. Если лучинка вспыхнет, прекратите нагревание перманганата калия. Погасите спиртовку
5. Оформите отчет о работе.
1.Сбо рка прибора для получения кислорода (указать название оборудования и посуды)
FOR-DLE.ru - Всё для твоего DLE ;)
Привет, я Стас ! Я занимаюсь так называемой "вёрсткой" шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и "статейки" для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
ГДЗ Химия 8 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А. 2019 ПРАКТИЧЕСКАЯ РАБОТА 2019 №4 Получение, собирание и распознавание кислорода ОТВЕТЫ

Рабочий лист содержит инструкцию по выполнению работы и дополнительные задания.
Муниципальное общеобразовательное бюджетное учреждение
подготовила учитель химии
Сидоренко Светлана Викторовна
Цель работы:
С правилами ТБ ознакомлен: (подпись)

Оборудование и реактивы:
штатив с лапкой, прибор для получения газов, стакан, шпатель, лучинка, спички; раствор пероксида водорода (3%-ый), оксид марганца (IV).
Отчет по работе:
Соберите прибор для получения газа. Налейте в пробирку 2-3 мл раствора пероксида водорода, добавьте в нее немного (на кончике шпателя) оксида марганца (IV). Что наблюдаете? Сразу же закройте пробирку пробкой с газоотводной трубкой.
Соберите кислород в химический стакан.
Наличие кислорода проверьте тлеющей лучинкой.

Дополнительные задания:
Опишите физические свойства кислорода, непосредственно наблюдаемые при выполнении опыта.
Опишите способ распознавания кислорода.
Какую роль в указанном процессе выполняет оксид марганца (IV)? Можно ли использовать вместо него сырой картофель? Почему?
Будет ли различаться скорость реакции при использовании мелко порезанного картофеля или одного целого кусочка той же массы? Почему?
Можно ли использовать сырую морковь, вареный картофель? Почему?
Будет ли протекать данная реакция без участия катализатора?
Если для реакции использовать 0,5 г оксида марганца (IV), какая масса его останется после проведения реакции? Почему? Как это можно доказать?
Какими еще способами (не менее 2) можно получить кислород в лаборатории? Ответ подтвердите уравнениями реакций.
Почему кислород, получаемый в лаборатории, можно собирать не только способом вытеснения воздуха, но и способом вытеснения воды?
Наблюдали ли вы в процессе работы реакцию горения?
Дайте определение реакций горения.
Список использованной литературы
1. Габриелян О.С., Яшукова А.В. Химия. 9 класс. Учебник - М.: Дрофа, 2013.
3. Габриелян О.С., Яшукова А.В. Химия. 8 - 9 классы. Методическое пособие - М.: Дрофа, 2004.
Читайте также:

