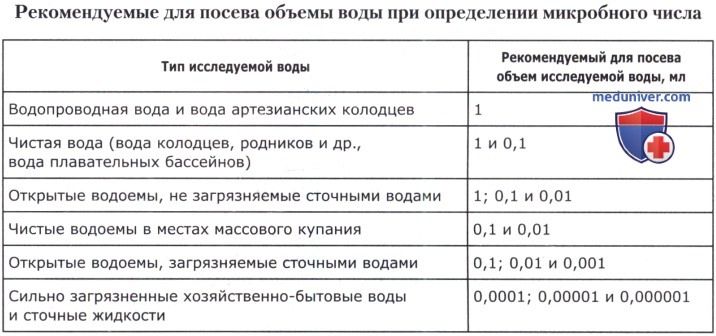
Посев воды на омч
Добавил пользователь Alex Обновлено: 19.09.2024
18.3. Методы определения общих и термотолерантных колиформных бактерий в воде
Общие колиформные бактерии (ОКБ) – это грамотрицательные, оксидазоотрицательные палочки, не образующие спор, растущие на дифференциальных лактозных средах, ферментирующие лактозу до кислоты, альдегида и газа при температуре 37±1 °С в течение 24–48 ч. Термотолерантные колиформные бактерии (ТКБ) входят в число ОКБ, обладают всеми их признаками и, кроме того, способны ферментировать лактозу до кислоты, альдегида и газа при температуре 44±0,5 °С в течение 24 ч.
ОКБ и ТКБ в воде, согласно действующим МУ 2.1.4.1018–01, определяют мембранным и титрационным (бродильным) методами. Титрационный метод используют только при отсутствии материалов и оборудования, необходимых для выполнения анализа методом мембранной фильтрации, наличии в воде большого количества взвешенных веществ и в случае преобладания посторонней микрофлоры, препятствующей получению на фильтрах изолированных колоний.
18.3.1. Определение общих и термотолерантных колиформных бактерий методом мембранной фильтрации
Сущность метода заключается в концентрировании бактерий из определенного объема воды на мембранных фильтрах с подращиванием их на среде Эндо при 37±1,0 °С, дифференцировании по культуральным и биохимическим тестам и подсчете выросших колоний.
Первый день. 1. Подготовка мембранных фильтров. Мембранные фильтры с диаметром пор не более 0,45 мкм и размером диска 35 или 47 мм (ацетатцеллюлозные, нитратцеллюлозные, ядерные и др.), имеющие сертификат качества, выпускаются стерильными, в противном случае их стерилизуют методом кипячения по инструкции, предложенной изготовителем.
- Подготовка фильтровального аппарата. Фильтровальный аппарат, воронку и столик фильтровального аппарата обтирают и фламбируют марлевым (ватным) тампоном, смоченным спиртом. После охлаждения на столик фильтровального аппарата кладут фламбированным пинцетом стерильный мембранный фильтр, прижимают его воронкой. Если вода содержит большое количество взвешенных веществ или клеток, ее сначала фильтруют через фильтр с большим диаметром пор, помещая его поверх основного фильтра с диаметром пор 0,45 мкм.
- Фильтрование воды. В воронку прибора для фильтрования наливают отмеренный объем воды, затем создают вакуум. При посеве нескольких объемов одной пробы следует фильтровать через один фильтровальный аппарат без обеззараживания сначала меньшие, а затем большие объемы воды, меняя каждый раз фильтры. Перед фильтрованием каждой новой пробы прибор обеззараживают. Вначале фильтруют пробы обеззараженной воды или предположительно незагрязненные, а затем фильтруют загрязненные пробы. При фильтровании 1 мл исследуемой воды в воронку наливают предварительно не менее 10 мл стерильной воды, а затем вносят анализируемую воду.
После окончания фильтрования и осушения фильтра отключают вакуум, воронку снимают, фильтр осторожно поднимают за край фламбированным пинцетом и переносят его, не переворачивая, на питательную среду Эндо (рецепты 96, 97), разлитую в чашки Петри, избегая пузырьков воздуха между средой и фильтром. Поверхность фильтра с осевшими на ней бактериями должна быть обращена вверх.
Под каждым фильтром на дне чашки делают надпись с указанием объема профильтрованной воды, номера пробы и даты посева. На одну чашку помещают 3–4 фильтра с условием, чтобы фильтры не соприкасались. Чашки с фильтрами ставят в термостат дном вверх и инкубируют посевы при температуре 37±1 °С в течение 24±2 ч.
При исследовании питьевой воды анализируют 3 объема по 100 мл. При получении стабильных отрицательных результатов допустима фильтрация 300 мл воды через один фильтр.
Объем воды водоемов для посева выбирают в зависимости от степени ее предполагаемого загрязнения. Рассчитывают, чтобы не менее чем на двух фильтрах выросли изолированные колонии. Из них не более 30 колоний на фильтрах диаметром 35 мм или не более 50 колоний на фильтрах диаметром 47 мм должны быть образованы колиформными бактериями. При этом можно ориентироваться на результаты предыдущих исследований.
При исследовании воды неизвестной степени бактериального загрязнения следует засевать не менее четырех-десяти-кратных ее объемов.
Так, например, для воды водоемов, загрязняемых сточными водами, рекомендуется брать объемы 10; 1; 0,1; 0,01 мл. При анализе воды водоемов в зоне влияния выпуска сточных вод – 0,1; 0,01; 0,001; 0,0001 мл; для чистых водоемов – 100; 50; 10; 1 мл. При анализе воды незагрязненных шахтных колодцев фильтруют 100; 10; 1 и 0,1 мл.
Второй день. По окончании инкубации производят просмотр посевов:
- • отсутствие микробного роста или обнаружение колоний, не характерных для ОКБ (пленчатые, губчатые, плесневые, прозрачные, расплывчатые), позволяет на этом этапе анализа закончить исследования с выдачей отрицательного результата (отсутствие ОКБ и ТКБ в исследуемом объеме воды). Анализ заканчивают через 24 ч;
- • при обнаружении на фильтрах типичных лактозоположительных колоний (темно-красных, красных с металлическим блеском или без него либо других подобного типа колоний с отпечатком на обратной стороне фильтра) исследования продолжают. Подсчитывают число колоний каждого типа отдельно и приступают к подтверждению их принадлежности к ОКБ и ТКБ.
Каждую выбранную изолированную колонию исследуют на наличие оксидазной активности (см. гл. 9, рецепт 75). Оксидазный тест предложен для дифференциации бактерий семейства Enterobacteriaceae от грамотрицательных бактерий семейства Pseudomonadaceae и других водных сапрофитов, которые в отличие от кишечных бактерий вырабатывают фермент оксидазу.
Готовят мазки, окрашивают их по Граму, микроскопируют или определяют принадлежность к грамотрицательным бактериям постановкой теста Грегерсена, не требующего использования оптики (см. гл. 6). Подтверждают ферментацию лактозы до кислоты и газа.
Оставшуюся часть оксидазоотрицательной грамотрицательной изолированной колонии засевают параллельно в две пробирки с лактозной средой (рецепт 99).
- — для подтверждения наличия ОКБ посев инкубируют при температуре 37±1 °С в течение 48 ч;
- — для подтверждения наличия ТКБ посев осуществляют в среду, предварительно прогретую до температуры 43–44 °С, и инкубируют при температуре 44±0,5 °С в течение 24 ч.
Первичный учет образования кислоты и газа на подтверждающих полужидких средах и СИБ-лактозы (коммерческие полоски) возможен через 4–6 ч. При обнаружении кислоты и газа в среде с лактозой дают положительный ответ. При отсутствии кислоты и газа или при наличии только кислоты пробирки с посевами для окончательного учета ТКБ оставляют до 24 ч. Пробирки с посевами для подтверждения наличия ОКБ после просмотра через 24 ч и получения отрицательного результата оставляют для окончательного учета до 48 ч.
При лабораторно-производственном контроле качества воды поверхностных водоемов анализ может быть завершен подсчетом колоний, которые отнесены к ОКБ по двум признакам: отрицательному оксидазному тесту и ферментации лактозы на среде Эндо до кислоты и альдегида. Дальнейшее подтверждение ОКБ по способности образовывать газ на лактозных средах проводят только при отсутствии достаточно четкой дифференциации лактозоположительных колоний, при росте мелкоточечных или мелких плоских колоний, не характерных для колиформных бактерий, при небольшом опыте работы выполняющего анализ.
Учет результатов. Грамотрицательные колонии учитываются как ОКБ при отрицательном оксидазном тесте и ферментации лактозы при температуре 37 °С с образованием кислоты и газа.
Грамотрицательные колонии учитываются как ТКБ при отрицательном оксидазном тесте и ферментации лактозы при температуре 44 °С с образованием кислоты и газа.
При анализе питьевой воды, воды водоемов число колониеобразующих единиц ОКБ и ТКБ подсчитывают на всех фильтрах и выражают результат анализа в КОЕ на 100 мл воды.
Вычисление проводят по формуле:
где X – число колоний в 100 мл; V – профильтрованный через фильтры объем воды; а – число подсчитанных на этих фильтрах колоний в сумме.
- При посеве по 100 мл воды на 3 фильтрах выросло две колонии на одном фильтре, на остальных двух фильтрах нет роста. Число общих или термотолерантных колиформных бактерий будет:
- При посеве 10, 40, 100 и 150 мл воды на фильтрах с профильтрованным объемом 40 мл выросло 4 изолированные колонии, с профильтрованным объемом 100 мл – 3 ОКБ. Фильтры с объемами 10 и 150 мл заросли и учету не подлежат. Суммируют общее число колоний ОКБ (ТКБ) на тех фильтрах, где получены изолированные колонии, пересчитывают это число на объем 100 мл.
Питьевая вода, вода водоемов удовлетворяют требованиям в том случае, когда ОКБ и ТКБ не обнаруживают в 100 мл воды. При установлении бактериальной загрязненности воды свыше допустимых норм прибегают к повторному исследованию воды.
18.3.2. Определение общих и термотолерантных колиформных бактерий титрационным методом
Первый день: а) при исследовании питьевой воды засевают 3 объема по 100 мл (качественный метод). При исследованиях воды с целью количественного определения ОКБ и ТКБ при повторном анализе производят посев: трех объемов по 100 мл, трех объемов по 10 мл, трех объемов по 1 мл;
б) посев воды водоемов производят в двух или трех повторностях. Воду водоемов, не загрязняемых сточными водами, засевают в объемах по 10; 1; 0,1; 0,01 мл; воду водоемов, загрязняемых сточными водами, – по 1; 0,1; 0,01; 0,001 мл; воду водоемов в зоне влияния выпусков сточных вод – в объеме по 0,1; 0,01; 0,001; 0,0001 мл.
Каждый объем исследуемой воды засевают в лактозопептонную среду (рецепт 95). Посев 100 и 10 мл воды производят в 10 и 1 мл концентрированной лактозопептонной среды, посев 1 мл пробы проводят в 10 мл среды обычной концентрации.
Второй день. Посевы инкубируют при 37±1 °С. Не ранее 24 ч инкубации проводят предварительную оценку посевов. Из емкостей, где отмечено наличие роста (помутнение) и образование газа, производят высев бактериологической петлей на сектора среды Эндо (рецепты 96, 97) для получения изолированных колоний.
Емкости без наличия роста и образования газа оставляют в термостате и окончательно просматривают через 48 ч. Посевы без признаков роста считают отрицательными, и дальнейшему исследованию они не подлежат. Из емкостей, где отмечено помутнение и образование газа или только помутнение, делают высев на сектора среды Эндо.
Посевы на среде Эндо инкубируют при температуре 37±1 °С в течение 18–20 ч.
При образовании помутнения и газа в среде накопления и росте на среде Эндо колоний, типичных для лактозоположительных бактерий (темно-красных или красных, с металлическим блеском или без него, выпуклых с красным центром и отпечатком на питательной среде), дают положительный ответ на присутствие ОКБ в данном объеме пробы.
Отрицательный ответ выдается, если в среде накопления и на секторах среды Эндо не отмечено роста; на секторах среды Эндо выросли не характерные для колиформных бактерий колонии; все колонии оказались оксидазоположительными; все бактерии оказались грамположительными; не отмечено газообразования в подтверждающем тесте на среде с углеводом.
Для определения секторов среды Эндо, где выросли типичные лактозоположительные колонии, делают посев 2–3 изолированных колоний каждого типа с каждого сектора в пробирки с любой из лактозных сред (рецепты 99, 100).
Среду перед посевом нагревают на водяной бане или в термостате до 44 °С. Немедленно после посева пробирки помещают в термостат и инкубируют при температуре 44±0,5 °С в течение 24 ч. Допускается просмотр посевов через 4–6 ч.
При образовании газа в среде накопления, росте на среде Эндо лактозоположительных бактерий и выявлении способности этих бактерий ферментировать лактозу до кислоты и газа в течение 24 ч при температуре 44 °С дают положительный ответ на наличие в этом объеме пробы воды ТКБ. Во всех остальных случаях выдают отрицательный ответ.
Для ускорения выдачи ответа на присутствие ТКБ производят высев 1 мл из объемов среды накопления, где отмечено помутнение и газообразование в пробирке с лактозо-пептонной средой с поплавком и прогретой предварительно до температуры 44 °С. Посевы выдерживают в термостате при температуре 44±0,5 °С в течение 24 ч. При обнаружении кислоты и газа дают положительный ответ.
Учет результатов. При обнаружении ОКБ и ТКБ хотя бы в одном из трех объемов питьевой воды выдается ответ об обнаружении ОКБ и ТКБ в 100 мл.
При исследовании количественным методом определяют наиболее вероятное число (НВЧ) ОКБ и ТКБ питьевой воды (табл. 18.1), воды водоемов (табл. 18.2).
е) воду для приготовления стерильных растворов (инъекций, глазных капель).
а) общее микробное число (ОМЧ) – количество мезофильных аэробных и факультативно-анаэробных бактерий в 1 мл воды (КОЕ/мл).
б) общие колиформные бактерии (ОКБ).
в) термотолерантные колиформные бактерии (ТКБ) .
г) коли-фаги – по эпидемическим показаниям.
д) споры сульфитредуцирующих клостридий – для оценки технологий обработки воды.
е) патогенные микроорганизмы – по эпидемическим показаниям.
ОМЧ воды определяют у всех видов воды. Для определения микробного числа водопроводной воды ее берут из уличных водозаборов или кранов внутренних водопроводов. Краны обжигают, полностью открывают и 10 минут спускают воду, а затем отбирают не менее 500 мл воды с соблюдением требований асептики. Затем производят посев воды глубинным методом Коха: по 1 мл воды вносят в стерильные чашки Петри, после чего добавляют 12-15 мл расплавленного и остуженного до 45 °C МПА, быстро и тщательно перемешивают, а после застывания помещают чашки в перевёрнутом виде в термостат. Инкубируют при 37°С 24 часа, а затем при комнатной температуре еще 24 часа. Посев осуществляет не менее, чем в 2 чашки Петри. Подсчитывают число выросших колоний на 2-х чашках и рассчитывают среднее арифметическое значение. Для выявления плесневых и дрожжевых грибов воду засевают по 0,5 мл на среду Сабуро и инкубируют при комнатной температуре 3-4 суток Подсчитывают число выросших колоний и также рассчитывают среднее арифметическое. Результат (ОМЧ) вычисляют путем суммирования среднего арифметического бактерий, дрожжевых и плесневых грибов и выражают в КОЕ/мл. КОЕ – колониеобразующие единицы. Учитывают только те чашки, где выросло не более 300 колоний. Если более 300 – делают 10-ти кратные разведения (1:10,1:100 и т.д.). При расчете умножают на степень разведения.
Дистиллированную воду, используемую для приготовления инъекционных растворов, отбирают в стерильные флаконы по 15-20 мл из ёмкостей, в которых проводится стерилизация. Посев производят так же, как и для водопроводной воды. Речную воду и воду других открытых водоёмов и бассейнов берут в объеме 100 мл.
Расчет проводят по формуле:
Х = а х 100/300, где
• Х- число колоний в 100 мл;
• V- профильтрованный объем воды;
• а – число колоний в сумме.
• Например, при посеве 3 фильтров по 100 мл:
• на одном фильтре - 2 колонии,
• на остальных 2-х фильтрах - нет роста.
• Число общих или термотолерантных колиформных бактерий будет:
КОЕ ОКБ (ТКБ) в 100 мл

Требования к микробиологической чистоте воды приведены в таблице.
Роль химии в жизни человека: Химия как компонент культуры наполняет содержанием ряд фундаментальных представлений о.
В приложениях даны методы определения санитарно-микробиологических показателей для комплексной оценки качества воды при выборе новых источников водоснабжения и решении вопроса во время проведения оздоровительных мероприятий или закрытия пляжа в зонах рекреации в соответствии с требованиями ГОСТ 2761-84 "Источники централизованного хозяйственно-питьевого водоснабжения" и ГОСТ 17.1.5.02-80 "Охрана природы. Гидросфера. Гигиенические требования к зонам рекреации водных объектов".
К общему числу микроорганизмов (ОМЧ) относят мезофильные аэробы и факультативные анаэробы (МАФАМ), способные образовывать на питательном агаре колонии, видимые при увеличении в 2 раза при температуре 37°С в течение 24 ч (ОМЧ 37°С) и при температуре 22°С в течение 72 ч (ОМЧ 22°С).
Общее число микроорганизмов не нормируется в воде водоемов в местах действующих водозаборов централизованного питьевого водоснабжения, черте населенных мест, зонах рекреации, поскольку уровень этой группы микроорганизмов в большей мере зависит от природных особенностей каждого объекта, времени года и т.п.
Однако при выборе нового источника водоснабжения или места рекреации в воде водоемов дополнительно следует определять число колоний, вырастающих:
ОМЧ при температуре инкубации 37°С - индикаторная группа микроорганизмов, в числе которых определяют в большей мере аллохтонную микрофлору, внесенную в водоем в результате антропогенного загрязнения, в т. ч. фекального.
ОМЧ при температуре инкубации 20-22°С - индикаторная группа микроорганизмов, в числе которых, помимо аллохтонной, определяют водную микрофлору данного водоема (автохтонную).
При температуре 22°С, как правило, вырастает больше сапрофитных микроорганизмов, чем при температуре 37°С. Соотношение численности этих групп микроорганизмов позволяет судить об интенсивности процесса самоочищения, активными участниками которого они являются. Эта разница более выражена при завершении процесса самоочищения (коэффициент соотношения ОМЧ 22°С : ОМЧ 37°С равен четырем и выше). В местах загрязнения хозяйственно-бытовыми сточными водами численные значения обеих групп близки.
Показатель позволяет получать дополнительную информацию о санитарном состоянии водоемов, источниках загрязнения, процессах самоочищения.
При производственном контроле исходной воды, поступающей на сооружения водопроводных станций, определяют ОМЧ 37°С с целью установления эффективности очистки и обеззараживания.
Из каждой пробы делают посев 1 мл и по 1 мл из одного или двух разбавлений, выбирая объем воды для посева из расчета, чтобы не менее чем на 2-х чашках выросло от 20 до 300 колоний. Выбранный объем засевают в 2-х повторностях.
При исследовании заведомо чистых вод с содержанием сапрофитов до 300 КОЕ в 1 мл делают посевы пробы воды без разбавления по 1 мл в 2 повторностях. При исследовании воды неизвестной степени микробного загрязнения производят посев 3-4 десятикратных объемов, начиная с 1 мл.
Тонкий слой агара увеличивает эффективность учета сапрофитной микрофлоры водоемов за счет лучших условий для роста аэробных и факультативно анаэробных бактерий, преобладающих в водоемах. Колонии вырастают более крупные, легко подсчитываемые на фоне прозрачного тонкого слоя агара. Ограничен рост расплывчатых колоний.
Две чашки Петри с посевами одной повторности помещают в термостат и инкубируют при температуре (37 +- 1)°С в течение (24 +- 2) ч.
После инкубации подсчитывают все выросшие на чашке колонии, видимые при увеличении в 2 раза. Подсчет следует производить только на тех чашках, на которых выросли изолированные колонии в количестве от 20 до 300. При посеве 1 мл неразбавленной воды ведут подсчет на чашках с любым количеством колоний, меньшим 300, и не менее чем на двух чашках.
Подсчитанное число колоний на каждой чашке суммируют и делят на объем воды в мл, засеянной на те чашки, на которых производился подсчет. Результат выражают в числе колониеобразующих единиц (КОЕ) в 1 мл исследуемой воды, округляя до 2-3 значимых чисел.
Результат можно представить на основании подсчета колоний на одной чашке (с отметкой в протоколе анализа), если на других чашках:
Если на всех чашках имеет место рост расплывчатых колоний, не распространившийся на всю поверхность, или выросло более 300 колоний и анализ нельзя повторить, подсчитывают колонии на секторе чашки с последующим пересчетом на всю поверхность. В этих случаях в протоколе отмечают "число КОЕ ОМЧ в 1 мл ориентировочно".
Если рост расплывчатых колоний распространился на всю поверхность чашки, и подсчет невозможен, то в протоколе анализа отмечают "ползучий рост". Если подсчет невозможен из-за слишком многочисленного роста, то в протоколе записывают "сплошной рост".
В примечании отмечают особые обстоятельства, которые могут повлиять на результат (превышение срока хранения пробы, изменение температуры и времени инкубации посевов, отклонения от правил при учете результатов и т. д.).
Воспроизводимость результатов метода может быть достигнута при строгом соблюдении деталей техники анализа, а также при использовании питательного агара одинакового состава. Каждую новую партию агара проверяют при посеве воды водоемов (по сравнению с предыдущей партией) в соответствии с МУ 2.1.4.1057-01 "Организация внутреннего контроля качества санитарно-микробиологических исследований воды", отмечая кроме числа колоний их размер и скорость образования видимого роста.
С флаконов с пробой воды снимают бумажные колпачки, вынимают пробки, горлышки фламбируют, после чего воду тщательно перемешивают.
Из каждой пробы делают посев не менее двух различных объемов, отобранных с таким расчетом, чтобы число выросших на чашках колоний колебалось в пределах от 30 до 300.
Для посева 0,1 мл и меньших объемов исследуемую воду разводят стерильной водой. Готовят последовательно десятикратные разведения, используя для каждого разведения отдельную стерильную пипетку.
По 1 мл каждого разведения вносят в две стерильные чашки Петри, после чего их заливают 10-15 мл расплавленного и остуженного до 45-50 °С МПА, который тщательно круговыми движениями перемешивают. Среде дают застыть на строго горизонтальной поверхности. Посевы выращивают в течение суток при 37° С. Воду из открытых водоемов засевают параллельно на две серии чашек, одну из которых инкубируют при 37 °С в течение суток, а другую — 2 суток при 20 °С.
Далее находят среднее арифметическое число колоний на 1 см 2 и умножают его на площадь чашки. За окончательное значение ОМЧ принимают среднее арифметическое результатов, полученных при подсчете на двух параллельных чашках. Питьевая вода считается хорошей, если общее количество бактерий в 1 мл не превышает 100, сомнительной— 100-150, загрязненной, если содержание бактерий в 1 мл составляет 500 и более.
Санитарно-микробиологический контроль над водами открытых водоёмов, качества питьевой воды.
В контроль над поверхностными водоёмами входят исследование и заключение о возможности использовать водоём (для питьевых, хозяйственных или других нужд), выяснение причин фекального загрязнения, определение способности водоёма к самоочищению. Проводят определение ОМЧ, выделяют БГКП, кишечную палочку, энтерококки, стафилококки и патогенные микроорганизмы (сальмонеллы, холерные вибрионы, лептоспиры, шигеллы и энтеровирусы).
Количество последних не должно превышать 100 в 1 л в зоне купания и не более 20 в 1 л воды бассейнов и морской воды. В последние годы разработаны и предложены дополнительные критерии оценки санитарного состояния водоёмов, в которые включены показатели титра энтерококков и Clostridium petfringens, а также индекс бактериофагов.
>
Санитарно-микробиологический контроль качества питьевой воды
Санитарно-микробиологическое исследование питьевой воды включает определение ОМЧ, количества энтеробактерий, спор сульфитредуцирующих клостридии и колифагов.
Определение ОМЧ при оценке качества питьевой воды. ОМЧ позволяет оценить уровень микробного загрязнения питьевой воды, дополняя показатели фекального загрязнения, и одновременно позволяет выявить загрязнение из других источников (например, промышленные сбросы). Неожиданное увеличение ОМЧ (даже в пределах норматива), выявленное повторно, служит сигналом для поиска причины загрязнения. Также этот показатель незаменим для срочного обнаружения в питьевой воде массивного микробного загрязнения неизвестной природы. Из каждой анализируемой пробы должен быть сделан посев не менее чем на две чашки Пётр и объёмом 1 мл. Через 24 ч проводят подсчёт выросших колоний на обеих чашках, результаты суммируют и делят на два. Окончательный результат выражают числом колониеобразующих единиц (КОЕ) в 1 мл исследуемой пробы воды. В 1 мл питьевой воды должно быть не более 50 КОЕ.
Определение количества энтеробактерий. При проведении исследований не ограничиваются обнаружением БГКП, но используют более широкое понятие — бактерии семейства Enterobacteriaceae и термотолерантные колиформные бактерии.
• Бактерии семейства Enterobacteriaceae включают грамотрицательные, оксидаза-отрицатель-ные, споронеобразующие палочки, растущие на средах с лактозой (например, Эндо) и ферментирующие глюкозу до кислоты и газа при температуре 37 °С в течение 24 ч. Обнаружение в питьевой воде бактерий семейства Enterobacteriaceae указывает на потенциальную эпидемическую опасность водопользования. Показатель «бактерии семейства Enterobacteriaceae* — основной нормируемый показатель, обеспечивающий наиболее надёжный контроль присутствия в воде практически всех представителей кишечных бактерий.
• Термотолерантные колиформные бактерии обладают всеми признаками бактерий семейства Enterobacteriaceae, и, кроме того, ферментируют лактозу с образованием альдегида, кислоты и газа при температуре 44 °С в течение 24 ч. Термотолерантность быстро утрачивается, поэтому обнаружение бактерий с таким свойством свидетельствует о недавнем попадании в воду кишечных бактерий (свежее фекальное загрязнение).
Численное выражение результата анализа характеризует степень фекального загрязнения воды. Бактерии семейства Enterobacteriacea и термотолерантные бактерии должны отсутствовать в 300 мя питьевой воды.
Выявление спор сульфитредуцирующих клостридий. Споры сульфитредуцирующих клостридий более устойчивы к обеззараживанию и действию неблагоприятных факторов окружающей среды, чем другие индикаторные бактерии. На основании этого свойства показатель рекомендован для оценки эффективности технологических процессов очистки воды. Особое значение этот показатель имеет при оценке первичного хлорирования, так как оно инактивиру-ет практически все индикаторные бактерии. Обнаружение клостридий в воде перед поступлением в распределительную сеть указывает на недостаточную очистку и на то, что устойчивые к обеззараживанию патогенные микроорганизмы, вероятно, не погибли при очистке. Споры сульфитредуцирующих клостридий должны отсутствовать в 20мл исследуемой питьевой воды.
Определение количества колифагов. Наиболее часто содержание колифагов в питьевой воде определяют титрационным методом, включающим предварительное подращивании их в среде обогащения (культура Escherichia coli на питательном агаре) с последующим выявлением бляшек колифага на газоне Е. coli В 100 мл исследуемой воды должны отсутствовать БОЕ колифагов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

