Посев в среду китта тароцци
Добавил пользователь Владимир З. Обновлено: 18.09.2024
Посев по Фортнеру. Кровяной питательный агар разливают в чашки Петри толстым слоем, после застывания по диаметру агар вырезают в виде узкой щели. На одну половину чашки засевают культуру аэробного микроба, жадно поглощающего кислород (кишечную палочку, чудесную палочку), а на другую половину засевают исследуемый материал. Чашку закрывают, заливают парафином. Аэробные бактерии быстро используют кислород воздуха в герметически закрытой чашке, затем начинают размножаться анаэробы, через 24-48 часов чашку открывают и из отдельных колоний анаэробов выделяют чистую культуру.
Посев по Вейон-Виньялю в пастеровских пипетках. Пастеровские пипетки представляют собой длинные трубки (20-25 см) диаметром около 5 мм, приготовленные из легкоплавкого стекла. Один конец пипетки открыт, а другой вытянут в виде капилляра и запаян. Перед стерилизацией в широкий конец вставляют вату. Исследуемый материал разводят полужидким агаром с небольшим содержание глюкозы, затем из каждого разведения насасывают агар в стерильную пастеровскую пипетку, предварительно обломив запаянный конец капилляра, и избегая попадания пузырьков воздуха. Затем капилляр запаивают и пипетки помещают в термостат. Через 24-48 часов в среде можно обнаружить ясно видимые колонии бактерий в виде пушинок, комочков ваты, зерен чечевицы и т.д. Нужные колонии можно извлечь, распилив трубку.
Выделение чистых культур анаэробных бактерий
1 этап. Накопление материала.
Исследуемый материал, предварительно прогретый в течение 15 мин при 80°С для уничтожения вегетативной флоры (споры анаэробов при этом не гибнут), засевают на среду Кита-Тароцци и ставят в термостат.
2 этап. Выделение чистой культуры.
После суточного инкубирования в результате роста микробов среда мутнеет, иногда в ней видны пузырьки газа. Выделение культуры проводят или по методу Цейсслера или по методу Вейнберга.
Метод Цейсслера. Каплю материала со среды Китта-Троцц помещают в чашку с кровяным сахарным агаром, тщательно распределяют его по поверхности среды шпателем, затем этим же шпателем делают посев во второй и третьей чашке. Сутки инкубируют чашки в термостате в анаэробных условиях. На следующий день по форме колоний и морфологии микробов, изученной в мазках, окрашенных по Граму, ориентировочно определяют вид бактерий, изученные колонии пересевают на среду Кита-Тароцци для выделения чистой культуры и точного определения виды микроорганизмов.
Метод Вейнберга. 1-2 капли материала со среды Кита-Тароцци вносят в пробирку с МПБ для разведения. Затем пастеровской пипеткой с запаянным концом переносят материал последовательно в 3-5 узких пробирок с сахарным МПА, предварительно расплавленным и прокипяченным в течение 20 мин и остуженным до 50°С, погружая капилляр пипетки в расплавленный агар до дна пробирки. Засеянные пробирки быстро охлаждают под струей холодной воды, при этом агар застынет и зафиксирует разобщенное положение отдельных микробных клеток. Инкубируют в анаэробных условиях. Через сутки отбирают колонии, на уровне колонии пробирку распиливают, колонию отсасывают пипеткой и переносят в среду Китта-Троцци для накопления и идентификации.
ТЕМА: СТЕРИЛИЗАЦИЯ
План занятия
2. Методы и способы проведения стерилизации
3. Режим работы и устройство парового стерилизатора
4. Стерилизация текучим паром
Цель занятия: Ознакомить студентов с методами стерилизации, научить пользоваться этими методами
Методические указания к демонстрации
Стерилизация – это комплекс мероприятий, направленных на полное уничтожение вегетативных форм микробов и их спор в объектах внешней среды. Стерилизации подвергают инструменты, аппараты, лекарственные препараты, перевязочный материал и белье, питательные среды, растворы, лабораторную посуду. Стерилизацию проводят физическими и химическими методами, а также механическим путем.
Физические методы стерилизации основаны на действии ультрафиолетовых лучей, применении высокой температуры. Летальное действие высокой температуры обусловлено денатурацией белков, деградацией нуклеиновых кислот, липидов, мембран. Существуют различные способы стерилизации при помощи высокой температуры.
Прокаливание в пламени спиртовки – самый быстрый и достаточно надежный метод стерилизации. Метод имеет ограниченное применение, т.к. при его использовании портятся стерилизуемые предметы. Прокаливанием стерилизуют бактериальные петли и иглы, мелкий инструментарий.
Кипячение – это простой метод, но он не обеспечивает полного обеспложивания, т.к. споры бактерий не погибают. Стерилизуют кипячением в воде с добавлением 1% бикарбоната натрия в течение 45 мин иглы, шприцы, инструменты.
Стерилизация сухим жаром – проводится в особых аппаратах-печах Пастера или сухожаровых печах. Метод основан на бактерицидном действии нагретого до 165-180°С воздуха. Стерилизуют сухим жаром только сухие предметы, размещая их так, чтобы они не касались стенок шкафа и между ними свободно проникал нагретый воздух. Сухим жаром стерилизуют всю стеклянную посуду, градуированные и пастеровские пипетки, вату, марлю, обернутые в бумагу в течение 1 часа при 160-170°С. Применение температуры выше 170°С приводит в выгонке жирных и смолистых веществ из ваты и некоторых сортов оберточной бумаги, что может вызвать подавление роста микробов, поэтому при использовании температуры выше 170°С посуду стерилизуют в металлических пеналах.
Стерилизация паром не требует такой высокой температуры, как стерилизация сухим жаром, т.к. пар из-за большой теплопроводности действует на микробы эффективнее. Обеспложивание паром проводится при температуре 100-120°С. Существуют два способа стерилизации паром:
3) при выделении чистой культуры микробов в целях всестороннего изучения их свойств и определения видовой принадлежности и т.д.
Основным методом бактериологического исследования является посев анализируемого материала на питательные среды.
Посевом в микробиологической практике называется внесение в стерильную питательную среду какого-либо исследуемого материала для обнаружения в нем микроорганизмов.
Пересев - это перенос выращенных микроорганизмов в свежую стерильную питательную среду. При выполнении этих приемов требуется перенести тот или иной материал в питательную среду так, чтобы в нее из воздуха не попали посторонние микроорганизмы.
При посевах и пересевах с одной питательной среды на другую пользуются платиновой проволокой в виде петли или иглы, так как они допускают быструю стерилизацию на огне без повреждения металла. Платиновая проволочка накаливается очень быстро и так же быстро остывает. Над пламенем горелки иглу или петлю следует держать вертикально, чтобы проволока на всем протяжении была одновременно накалена докрасна. Затем слегка обжигают прилегающий к проволоке отрезок стеклянной или металлической палочки, в которую впаяна или заделана проволочка. Нужно строго следить за тем, чтобы до внесения в огонь стеклянная палочка была совершенно сухая, в противном случае стекло треснет и петля (или игла) из него выпадет. После нагревания до красного каления платиновая проволочка будет простерилизована. Лишь после такой стерилизации петлю или иглу можно вносить в пробирку с бактериальной культурой. Но прежде чем захватить ею бактериальную культуру, петелькой или концом иглы касаются части среды, свободной от микробного налета (если имеют дело с твердой средой), или внутренней стенки пробирки с жидкой средой. Это делается для того, чтобы удостовериться, что прокаленная петля достаточно остыла. Если проволочка имеет еще высокую температуру, то среда на данном участке расплавляется или кипит. Этим создается гарантия, что бактерии, снятые проволочкой, будут вполне жизнеспособны.
Посев на жидкую питательную среду (бульон)
Посев на жидкую питательную среду производится с помощью петли и стерильных трубок и пипеток.
Посев петлей (иглой). Прокаленной петлей или иглой, которую держат в руке между указательным, средним и большим пальцами (подобно карандашу или ручке), захватывают небольшое количество налета с поверхности сырья или каплю посевного материала из исследуемой жидкости, слегка погрузив в нее петлю. В левой руке держат пробирку (или колбочку) с питательной средой. На пламени горелки обжигают верхнюю часть пробирки (колбы) непосредственно у пробки. При этом сосуд со средой слегка наклоняют, но так, чтобы жидкость не выливалась и не смачивала пробки и краев посуды. Мизинцем и безымянным пальцем правой руки вынимают пробку из пробирки и зажимают ее до конца посева между этими пальцами и ладонью так, чтобы входящая в пробирку часть пробки не прикасалась к руке. Все манипуляции производят над пламенем горелки. В открытую и наклоненную пробирку вводят петлю с посевным материалом, слегка погружая петельку в среду и размазывая внесенный материал по стенке пробирки, осторожно размешивают петлей питательную среду. Закончив посев, не изменяя наклонного положения пробирки, закрывают ее ватной пробкой, обжигая в пламени горелки конец пробирки и ту часть ватной пробки, которая входит в пробирку. Лишь после этого возвращают пробирку в вертикальное положение. По окончании посева петлю немедленно стерилизуют в пламени горелки.
Техника посева петлей бактериологического материала из одной пробирки в другую почти аналогична. Обе пробирки - с культурой и стерильной питательной средой - держат в наклонном положении между большим и остальными пальцами левой руки (рис. 56, положение а). При этом пробирку с культурой микробов следует держать ближе к себе. Вся работа, как и в первом случае, выполняется под защитой пламени горелки, а наклонное положение пробирок предохраняет питательную среду от оседания в нее микроорганизмов из воздуха.
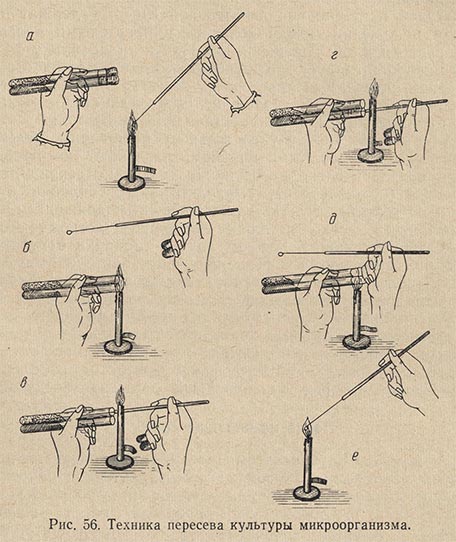
Петлю держат между указательным и большим пальцами правой руки, а свободными пальцами извлекают из пробирок пробки, предварительно внеся их на несколько секунд в пламя горелки (положение б). Извлекать ватные пробки нужно плавно, не рывком, а легким винтообразным движением.
Прокалив на огне петлю и подвергнув легкому обжигу верхние концы пробирок, вводят внутрь пробирки с культурой петлю, забирают петлей ничтожную часть бактериального материала (положение в) и переносят его во вторую пробирку со стерильной средой (положение г). Когда посев закончен, края пробирок и нижние концы ватных пробок проводят сквозь пламя горелки и легким движением закрывают пробирки пробками (положение д). Петля стерилизуется и откладывается (положение е). Работать нужно быстро, но избегая резких движений, вызывающих усиленное движение воздуха.
Посев на плотную среду
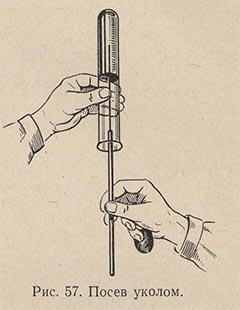
Посев уколом делают в желатиновые среды с целью выявления протеолитической способности микробов. Засеянные пробирки выдерживают 2-3 дня при температуре 22-23 °С, наблюдая за быстротой и формой разжижения столбика желатиновой среды. У различных видов микробов форма разжижения желатины различна: послойная, в форме гвоздя, чулка и пр. Затем пробирки опускают в холодную воду. Если среда в пробирке с микроорганизмом остается жидкой, а среда в контрольной пробирке застынет, это значит, что микроб обладает протеолитической способностью.
Можно установить протеолитическую способность микроба, фиксируя также образующиеся при распаде белка продукты - сероводород, аммиак, индол, являющиеся показателями протекающего процесса гниения. Наличие этих продуктов определяют с помощью цветных реакций. Сероводород дает почернение полоски фильтровальной бумаги, смоченной раствором основного уксуснокислого свинца, благодаря превращению H2S в PbS. Появление серебристой побежалости (оттенка) свидетельствует об образовании при гниении тиоспиртов и меркаптанов.
Раствор основного уксуснокислого свинца готовят приливанием к 10%-ной взвеси РЬ(СН3СОО)2 10%-ного раствора едкого натра до растворения осадка. Полоски фильтровальной бумаги пропитывают этим раствором, высушивают при комнатной температуре и хранят в склянке с притертой пробкой. При проведении опыта подготовленную полоску фильтровальной бумаги смачивают стерильной дистиллированной водой и помещают в пробирку с изучаемой культурой между ватной пробкой и стенками пробирки. Полоска бумаги должна свободно свешиваться внутрь пробирки, а не касаться ни ее стенок, ни среды. Пробку сверху плотно закрывают целлофановым колпачком (можно надеть резиновую соску), что предотвращает улетучивание выделяющихся при гниении газов.
Для выявления в продуктах гниения аммиака в пробирку с культурой микроорганизма аналогично помещают влажную красную лакмусовую бумажку, синеющую от присутствия NH3.
Индолообразование выявляется добавлением к 5 мл бульонной культуры микроба 5 мл специфического раствора Эрлиха и 2,5 мл насыщенного раствора пиросульфита калия (K2S2O7). При наличии индола появляется интенсивное красное окрашивание. Реактив Эрлиха приготовляют растворяя 4 г парадиметиламидобензальдегида в 30 мл 96%-ного спирта-ректификата, приливая затем сюда же 80 мл концентрированной соляной кислоты.
Посев уколом в высокий столбик сахарного агара дает возможность выявить у микроорганизмов степень анаэробности. Аэробы растут только в верхней части укола; анаэробы, наоборот, - только в нижней; факультативные анаэробы - по всему уколу. Укол должен проходить по возможности посредине столбика среды в пробирке на равном расстоянии от краев и доходить почти до дна. Внесение материала в толщу питательной среды можно также производить после предварительного ее расплавления и вносить материал в остуженную до 45 °С, но еще жидкую среду, а затем дать ей остыть.
Техника посева в чашки Петри
Питательный агар в колбах, флаконах, пробирках расплавляют в кипящей водяной бане. Сосуд со средой следует погружать в баню так, чтобы уровни среды и воды совпадали или уровень среды был чуть ниже уровня воды в бане. Затем среде дают несколько остыть - до 50-60 °С и разливают ее в стерильные чашки Петри, установив их на горизонтальной поверхности. Техника розлива среды в чашки Петри следующая (рис. 58). Над пламенем горелки, слегка наклоняя сосуд, содержащий расплавленный агар, вынимают пробку и края сосуда обжигают. Левой рукой приподнимают с одной стороны крышку чашки и, вводя в образовавшийся просвет открытый конец сосуда со средой, выливают среду в чашку. Совсем открывать чашку Петри нельзя. Ее лишь слегка приоткрывают с одной стороны. Это предохраняет среду от оседания в нее микробов из воздуха.
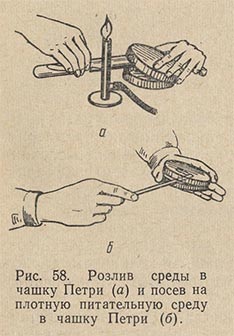
Опустив крышку и наклоняя чашку в разные стороны, распределяют налитый в нее агар ровным слоем по всему дну. Когда агар застынет, чашки ставят в термостат вверх дном для подсушивания и удаления конденсационной воды. Посев на агаровые среды в чашки Петри производится штрихом при помощи платиновой петли или стеклянным шпателем.
При посеве штрихом платиновой петлей забирают небольшое количество материала и легко проводят по поверхности агара, нанося ряд линий. При этом один край крышки чашки Петри следует лишь осторожно приподнять левой рукой, не дотрагиваясь пальцами до нижнего ранта. Закрыв первую чашку Петри той же петлей, не набирая материала, наносят штрихи на поверхность агара во второй, затем в третьей чашке с соблюдением тех же предосторожностей, предупреждающих попадание микробов из воздуха на поверхность среды.
После посева чашки ставят в термостат вверх дном на 24 ч и по истечении указанного срока рассматривают выросшие колонии микроорганизмов. В первой чашке, куда попало много материала, может получиться сплошной рост, во второй и третьей чашках вырастут единичные изолированные колонии. Каждая колония представляет собой обособленное скопление однородных микробов.
При посеве на твердую среду можно пользоваться и одной чашкой Петри, разделив ее на несколько секторов. Для этого на стекле с нижней стороны дна чашки наносят линии карандашом для стекла. Каждый отдельный сектор в данном случае будет заменять соответствующую чашку Петри.
При посеве шпателем на поверхность агаровой среды наносят платиновой петлей одну небольшую каплю исследуемого материала. Затем прокаленным и остуженным шпателем растирают эту каплю по всей поверхности среды, совершая легкие зигзагообразные движения во все стороны. Этим же шпателем засевают вторую и третью чашки.
Посев жидких материалов на твердую среду в чашки Петри пипеткой. Определенный объем исследуемой жидкости (обычно 1 или 0,1 мл) вносят в стерильную чашку. Затем в эту же чашку вливают расплавленный и остуженный до температуры 45 °С мясопептонный агар и плавными движениями чашки на горизонтальной плоскости тщательно перемешивают среду с исследуемой жидкостью. После застывания агара чашку Петри, как обычно, перевертывают вверх дном и ставят в термостат. Выращивание микробов производят 24-48 ч при температуре, оптимальной для изучаемого вида микроорганизмов, чистую культуру которых выделяют.
Каждая микробная клетка, а также спора, попавшая в питательную среду из посевного материала, при застывании среды оказывается закрепленной на одном месте, начинает развиваться и дает колонию. Чем меньше колоний выросло на чашке и чем изолированнее одна от другой эти колонии, тем успешнее можно выделить чистую культуру микроба. Поэтому при посевах желательно брать посевной материал, содержащий как можно меньше микроорганизмов. С этой целью производят разбавление (разведение) материала.
Для разведения исследуемых материалов необходимо иметь достаточное количество стерильных пипеток емкостью 1 мл и стерильную воду в пробирках по 9 мл.
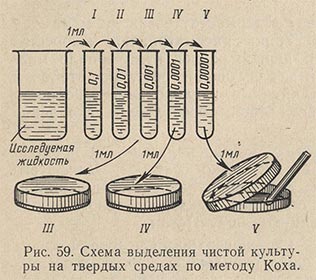
Техника разведения следующая (рис. 59). После тщательного перемешивания исследуемой пробы стерильной пипеткой отбирают 1 мл материала и вносят в пробирку с 9 мл стерильной воды. Работу проводят над пламенем горелки с соблюдением правил стерильности. Получают первое разведение в 10 раз. Осторожно перемешивают содержимое пробирки. Перемешивание можно произвести повторным всасыванием жидкости в пипетку и выпусканием ее обратно в пробирку. Из пробирки с первым разведением второй стерильной пипеткой переносят 1 мл в следующую пробирку, содержащую 9 мл стерильной воды. Получают второе разведение (в 100 раз). Эту операцию при необходимости производят и дальше, получая третье, четвертое, пятое разведения. Производить разведение более чем в 100 000 раз (пятое разведение) не рекомендуется, так как при слишком больших разведениях изучаемые микробы могут не попасть в отбираемую пробу, особенно в том случае, если количество их составляло относительно небольшой процент по отношению ко всей микрофлоре субстрата.
Выделение чистых культур аэробных микроорганизмов
Из каждого разведения 1 мл жидкости высевают в стерильную чашку Петри, заливая 10-15 мл расплавленного и охлажденного до 45 °С мясопептонного агара. Посев выращивают в термостате при температуре, оптимальной для изучаемых микроорганизмов, в течение 24-48 ч. Просматривая чашки Петри после выращивания, отбирают ту чашку, в которой выросшие колонии оказываются наиболее изолированными.
Однородность по внешнему виду выросших на чашке колоний свидетельствует о том, что посевной материал содержал микроорганизмы одного вида. Если же колонии оказываются неоднородными, то, следовательно, в посевном материале находилась смесь разнообразных микробов. Все выросшие колонии в этом случае нужно разбить на группы по однородности и изучать каждую группу однородных колоний в отдельности.
Из однородных колоний в чашке Петри выбирают одну изолированную колонию, из нее делают мазок и устанавливают чистоту культуры. Об этом будет свидетельствовать морфологическая однородность микробных клеток, наблюдаемых в поле зрения микроскопа. Оставшуюся часть колонии прокаленной и остуженной петлей с соблюдением правил стерильности пересевают (отвивают) на поверхность скошенного агара. Выросшая на косом агаре культура также должна давать однородный рост и при микроскопировании однородные клетки. В противном случае пересевы колоний с чашек Петри повторяют до тех пор, пока не убедятся в чистоте выделенной культуры.
Выделение чистых культур анаэробных микроорганизмов
Одним из основных условий при культивировании анаэробных микробов является удаление из питательной среды молекулярного кислорода, оказывающего токсическое действие на анаэробные культуры. Вторым обязательным условием, обеспечивающим выделение анаэробов из исследуемого субстрата, является внесение большого количества посевного материала в питательную среду.
Изолированные колонии анаэробных микробов можно получить в глубине плотной питательной среды - в трубках Вейона. Средой накопления для анаэробов является среда Китта-Тароцци. Уже указывалось, что для создания анаэробных условий при приготовлении среды Китта-Тароцци на дно пробирок помещают кусочки печени. Можно использовать и круто сваренный белок куриного яйца.
Анаэробные микроорганизмы являются спорообразующими, поэтому при исследовании материалов, где предполагается наличие вегетативных форм, необходимо засеянные пробирки прогреть в водяной бане при 80 °С в течение 30 мин.
Посевы выдерживают в термостате при 37 °С в течение 5 суток. При наличии роста отмечают наступившее в среде Китта-Тароцци изменение: помутнение или помутнение и газообразование; из проросших пробирок делают мазки и окрашивают по Граму. Материал для мазков берут пастеровской пипеткой, которую опускают до дна пробирки.
Высев из среды Китта-Тароцци можно производить и в чашки Петри, применяя метод последовательного разведения. В этом случае посевы необходимо выдерживать в анаэростатах или эксикаторах, на дно которых помещаются кислородпоглощающие вещества (смесь гидросульфита натрия с двууглекислой содой или щелочной раствор пирогаллола).
Для культивирования анаэробов необходимо создать с помощью физических, химических и биологических методов условия анаэробиоза - пониженного содержания кислорода в среде и окружающем ее пространстве.
· механическое удаление воздуха из сосудов, в которых выращиваются анаэробные микроорганизмы – анаэростатов (рис. 26, см. приложение), с помощью разрежающих насосов. Анаэростат представляет собой цилиндр из ударопрочного полимерного материала или металла с хорошо притертой крышкой, снабженный отводящим краном и вакуумметром. После размещения засеянных чашек или пробирок воздух из анаэростата удаляют с помощью вакуумного насоса;
· посев в среды, содержащие редуцирующие и легко окисляемые вещества, которые связывают растворенный в среде кислород. С целью уменьшения содержания кислорода в питательной среде, ее перед посевом кипятят 10—15 мин, затем быстро охлаждают, после чего заливают небольшим количеством стерильного вазелинового масла. Легко окисляемыми веществами являются глюкоза, лактоза и др. Лучшей жидкой питательной средой с редуцирующими веществами является среда Китта — Тароцци, которая с успехом используется для накопления анаэробов при первичном посеве из исследуемого материала и для поддержания роста выделенной чистой культуры анаэробов;
· посев микроорганизмов в глубину плотных питательных сред производят по способу Виньяль — Вейона, который состоит в механической защите посевов анаэробов от кислорода воздуха. Для этого берут стеклянную трубку длиной 30 см и диаметром 3—6 мм. Один конец трубки вытягивают в капилляр в виде пастеровской пипетки, а у другого конца делают перетяжку. В оставшийся широкий конец трубки вставляют ватную пробку. В пробирки с расплавленным и охлажденным до 50 0 С питательным агаром засевают исследуемый материал. Затем насасывают засеянный агар в стерильные трубки Виньяль — Вейона. Капиллярный конец трубки запаивают в пламени горелки и трубки помещают в термостат. Для выделения отдельной колонии трубку надрезают напильником, соблюдая правила асептики, на уровне колонии ломают, а колонию захватывают стерильной петлей и переносят в пробирку с питательной средой для дальнейшего выращивания и изучения в чистом виде;
· замена воздуха в анаэростатах или эксикаторах индифферентным газом (азотом, водородом, аргоном, углекислым газом) путем вытеснения его газом из баллона.
Химические методы основаны на поглощении кислорода воздуха в анаэростате или эксикаторе такими веществами, как пирогаллол или гидросульфит натрия;
Биологические методы основаны на совместном выращивании анаэробов со строгими аэробами. На одну половину чашки Петри с МПА засевают культуру аэробов, на другую - анаэробов. Края чашки заклеивают пластилином или заливают расплавленным парафином, посев ставят в термостат. Сначала вырастают аэробы, потом (через 3-4 дня) - анаэробы.
Комбинированные методы основаны на сочетании физических, химических и биологических методов создания анаэробиоза.
САМОСТОЯТЕЛЬНАЯ РАБОТА СТУДЕНТОВ
1. Выделение чистой культуры аэробных бактерий от потенциального носителя золотистого стафилококка (самостоятельная работа). Продолжить работу по бактериологическому исследованию, начатую на предыдущем занятии: рассмотреть чашку с выросшими колониями и обвести карандашом по дну различные типы колоний, у которых изучить культуральные свойства в соответствии с таблицей 3.
Учитываются следующие признаки колоний:
· размер (измеряется миллиметровой полоской со стороны дна диаметр колонии);
· форма (круглая, неправильная);
· цвет (красный, желтый и т.д.). Беспигментные колонии имеют оттенок среды, например сероватый на МПА;
· поверхность (выпуклая, плоская, блестящая, матовая, гладкая, шероховатая);
· край (ровный, изрезанный, волнообразный, фестончатый). Колонии зарисовать.
Таблица 3. Характеристика колоний бактерий
| Признаки колоний | Описание свойств колоний |
| Размер | Проводится измерение диаметра колоний |
| Форма | Круглая, неправильная |
| Цвет | Красный, желтый и т.д. Беспигментные колонии имеют оттенок среды, например, сероватый на МПА |
| Поверхность | Выпуклая, плоская, блестящая, матовая, гладкая, морщинистая, шероховатая, исчерченная и т.д. |
| Структура | Чашка Петри с ростом колоний кладется дном вверх на предметный столик микроскопа и колония изучается у ее края при малом увеличении с опущенным конденсором. Структура может быть гомогенной, мелко-, крупно-, неравномерно-зернистой, волокнистой |
| Край | Изучается вместе со структурой. Может быть ровным, изрезанным, волнообразным, фестончатым |
| Консистенция | Определяется при взятии петлей для приготовления мазка. Консистенция может быть слизистой (культура тянется – подозрение на наличие капсулы), влажная (легко берется) и сухая (крошится – подозрение на спорообразующие бактерии) |
| Тинкториальные (отношение к окраске) и морфологические свойства | Изучаются соответствующие свойства бактерий, находящихся в колонии |
Для дальнейшего изучения выбирают одну из колоний. С целью сохранения и накопления выделенной чистой культуры сделать пересев из колонии на скошенный МПА.
Техника пересева: снять крышку чашки, взять чашку в левую руку в вертикальном положении, посевом обратив к себе. Стерильной петлей взять из центра колонии культуру и засеять на скошенный МПА зигзагообразной линией, двигаясь снизу вверх. Прокалить петлю в пламени спиртовки, аккуратно подписать пробирку в верхней трети и поместить ее в термостат на сутки. Результаты исследования занести в протокол. Работа будет продолжена на следующем занятии.
6. Изучение методов культивирования анаэробов и ознакомление с аппаратурой, используемой с этой целью (демонстрация).
Культивирование анаэробов проводят в бескислородных условиях, для чего с целью удаления кислорода к питательным средам добавляют кусочки печени, а также редуцирующие вещества (сульфат железа, глюкоза и др.).
Наиболее широко в бактериологической практике применяются следующие методы культивирования анаэробов:
· Метод Вейнберга (на сахарном МПА столбиком). В расплавленный МПА в пробирке бактериологической иглой или петлей добавляют исследуемый материал, тщательно перемешивают содержимое пробирки, охлаждают. В нижней части пробирки создаются оптимальные условия для роста анаэробов,
· Метод Вейон-Виньяля. Готовят разведения исследуемого материала в нескольких пробирках с МПА, затем содержимое каждой пробирки набирают в специальную стеклянную трубку, один конец которой вытянут в виде капилляра (как у пастеровской пипетки), а другой конец имеет сужение. После заполнения трубки капилляр запаивают в пламени спиртовки, а суженную часть трубки закрывают кусочком ваты. Трубку охлаждают, помещают в термостат. Через 2-3 дня в столбике МПА вырастают колонии анаэробов. Напильником делают надрез выше уровня намеченной колонии, трубку надламывают, колонию извлекают из агара петлей и пересевают на среду Китт-Тароцци.
· Выращивание в анаэростатах - в металлических или пластмассовых сосудах с герметически закрывающейся крышкой, воздух из которых отсасывается с помощью разрежающего насоса или заменяется газовым составом.
· Создание анаэробных условий в эксикаторах (герметически закрывающиеся стеклянные сосуды) с использованием химических поглотителей кислорода или заменой кислорода инертным газом.
· Биологический метод культивирования анаэробов (по Фортнеру). На одну половину чашки Петри с МПА засевают культуру аэробов, на другую - анаэробов. Бортики чашки оклеивают лейкопластырем, посев ставят в термостат. Сначала вырастают аэробы, потом анаэробы.
2. Выделение чистой культуры анаэробных бактерий из почвы (демонстрация):
· изучение характера роста на среде Китт-Тароцци;
· изучение морфологических и тинкториальных свойств микроорганизмов, выросших на среде Китт-Тароцци; приготовление мазка, окраска его по Граму, микроскопия. Обратить внимание на наличие в микропрепарате крупных, расположенных беспорядочно или короткими цепочками, грамположительных палочек; выполнить посев одной петли материала со среды Китт-Тароцци в высокий столбик МПА, расплавленного на водяной бане и остуженного до 45° С. Результаты исследования занести в протокол.
3. Выделение чистой культуры протея по методу Шукевича (самостоятельная работа). Произвести посев исследуемого материала петлей в конденсационную воду скошенного МПА. Ход исследования отразить в протоколе.

Для культивирования анаэробов необходимо понизить окислительно-восстановительный потенциал среды, создать условия анаэробиоза, т. е. пониженного содержания кислорода в сред окружающем ее пространстве. Это достигается применением физических, химических и би логических методов.
Физические методы.
Основаны на выращивании микроорганизмов в безвоздушной среде, что достигается:
1) посевом в среды, содержащие редуцирующие и легко окисляемые вещества;
2) посевом микроорганизмов в глубину плотных питательных сред;
3) механическим удалением воздуха из сосудов, в которых выращиваются анаэробные микроорганизмы;
4) заменой воздуха в сосудах каким-либо индифферентным газом.
В качестве редуцирующих веществ обычно используют кусочки (около 0,5 г) животных или растительных тканей (печень, мозг, почки, селезенка, кровь, картофель, вата). Эти ткани связывают растворенный в среде кислород и адсорбируют бактерии. Чтобы уменьшить содержание кислорода в питательной среде, ее перед посевом кипятят 10-15 мин, а затем быстро охлаждают и заливают сверху небольшим количеством стерильного вазелинового масла. Высота слоя масла в пробирке около 1 см.
В качестве легко окисляемых веществ используют глюкозу , лактозу и муравьинокислый натрий.
Лучшей жидкой питательной средой с редуцирующими веществами является среда Китта-Тароцци, которая используется с успехом для накопления анаэробов при первичном посеве из исследуемого материала и для поддержания роста выделенной чистой культуры анаэробов.
Посев микроорганизмов в глубину плотных сред производят по способу Виньяль-Вейона, который состоит в механической защите посевов анаэробов от кислорода воздуха. Берут стеклянную трубку длиной 30 см и диаметром 3-6 мм. Один конец трубки вытягивают в капилляр в виде пастеровской пипетки, а у другого конца делают перетяжку. В оставшийся широкий конец трубки вставляют ватную пробку.
В пробирки с расплавленным и охлажденным до 50°С питательным агаром засевают исследуемый материал. Затем насасывают засеянный агар в стерильные трубки Виньяль-Вейона. Капиллярный конец трубки запаивают в пламени горелки и трубки помещают в термостат. Так создаются благоприятные условия для роста самых строгих анаэробов. Для выделения отдельной колонии трубку надрезают напильником, соблюдая правила асептики, на уровне колонии, ломают, а колонию захватывают стерильной петлей и переносят в пробирку с питательной средой для дальнейшего выращивания и изучения в чистом виде.
Удаление воздуха производят путем его механического откачивания из специальных приборов — анаэростатов, в которые помещают чашки с посевом анаэробов. Переносный анаэростат представляет собой толстостенный металлический цилиндр с хорошо притертой крышкой (с резиновой прокладкой), снабженный отводящим краном и вакуумметром. После размещения засеянных чашек или пробирок воздух из анаэростата удаляют с помощью вакуумного насоса.
Замену воздуха индифферентным газом ( азотом , водородом , аргоном , углекислым газом) можно производить в тех же анаэростатах путем вытеснения его газом из баллона.
Химические методы.
Основаны на поглощении кислорода воздуха в герметически закрытом сосуде (анаэро-стате, эксикаторе) такими веществами, как пирогаллол или гидросульфит натрия Na2S204.
Биологические методы.
Основаны на совместном выращивании анаэробов со строгими аэробами. Для этого из застывшей агаровой пластинки по диаметру чашки вырезают стерильным скальпелем полоску агара шириной около 1 см. Получается два агаровых полудиска в одной чашке. На одну сторону агаровой пластинки засевают аэроб, например часто используют S. aureus или Serratia marcescens. На другую сторону засевают анаэроб. Края чашки заклеивают пластилином или заливают расплавленным парафином и помещают в термостат. При наличии подходящих условий в чашке начнут размножаться аэробы. После того, как весь кислород в пространстве чашки будет ими использован, начнется рост анаэробов (через 3-4 сут). В целях сокращения воздушного пространства в чашке питательную среду наливают возможно более толстым слоем.
Читайте также:

