Посев на кмафанм молока
Добавил пользователь Владимир З. Обновлено: 19.09.2024
КОЕ — колонию образующая единица — жизнеспособный микроорганизм, способный в результате размножения на твердой питательной среде сформировать колонию.
Микробиологические показатели кулинарной продукции характеризуют соблюдение технологических и санитарно-гигиенических требований при ее производстве. Условия хранения и реализации, транспортирования. Они обуславливаются тремя группами микроорганизмов:
1 – санитарно-показательные: мезофильные, аэробные и факультативно анаэробные микроорганизмы (КОЕ/г) и бактерии группы кишечных палочек (колиформы);
2 – потенциально-патогенные микроорганизмы: кишечная палочка (E. coli), коагулазоположительные стафилококк (S. aureus) и бактерии рода протея (Proteus);
3 – патогенные микроорганизмы, в том числе сальмонеллы.
Микробиологические показатели нестандартизированной кулинарной продукции приведены в приложении.
КМАФАнМ – наиболее распространенный тест на микробную безопасность. Данный показатель применяется повсеместно для оценки качества продуктов, за исключением тех, в производстве которых используются специальные микробные культуры (например, пиво, квас, кисломолочные продукты и т.п.). Величина показателя КМАФАнМ зависит от многих факторов. Наиболее важные – режим термической обработки продукта, температурный режим в период его транспортировки, хранения и реализации, влажность продукта и относительная влажность воздуха, наличие кислорода, кислотность продукта и т.д. Увеличение КМАФАнМ свидетельствует о размножении микроорганизмов, в числе которых могут оказаться патогены и микроорганизмы, вызывающие порчу продукта (например, плесени).
Ход работы:
Метод КМАФАнМ
Определение общей обсемененности по ГОСТу следует производить путем посева 0,5 мл в разведении 1 : 5 и 1 : 50 в расплавленный и остуженный, как обычно, агар и чашки с посевами в термостат на 48 часов при 37°С.
После инкубации подсчитывают количество характерных колоний на каждой чашке Петри. Для подсчета используют чашки, на которых выросло от 10 до 300 колоний.
Подсчитанное число колоний умножают на степень разведения продукта (на 10 или 100), т. е. определяют количество микробов в 1 г продукта.
1.1.1 Метод подсчета колоний.
Количество выросших колоний подсчитывают на каждой чашке, поместив ее вверх дном на темном фоне, и пользуясь лупой с увеличением в 4–10 раз с
Таким образом находят общее количество колоний, выросших на одной чашке и вычисляют общее количество бактерий в 1,0 см 3 или 1,0 г продукта по следующей справке:
Лабораторный практикум подготовлен в соответствии с рабочей программой по микробиологии молока и молочных продуктов. Содержит сведения об основных группах микроорганизмов, используемых в технологии молочных продуктов, о микробиологическом исследовании сырого и пастеризованного молока, заквасок и готовых молочных продуктов. Предназначен для студентов, обучающихся по специальности 260303 Технология молока и молочных продуктов, и бакалавров направления 260200 Продукты питания животного происхождения.
Приведенный ниже текст получен путем автоматического извлечения из оригинального PDF-документа и предназначен для предварительного просмотра.
Изображения (картинки, формулы, графики) отсутствуют.
Метод основан на способности мезофильных аэробов и факультативных анаэробов расти на питательных средах определенного состава при температуре 30 град. C с образованием колоний, видимых при увеличении в 2 раза.
Для определения количества мезофильных бактерий следует выбирать разведения, при посеве которых на чашках вырастает не менее 30 и не более 300 колоний.
Из каждой пробы делают посев глубинным методом на 2 параллельные чашки Петри из 2 - 3 последовательных разведений в количестве 1,0 мл, используя для этого 2-процентный агар, приготовленный из сухого питательного агара. Контролировать температуру надежнее и проще, если агар разливают небольшими порциями в пробирки (12 - 15 мл). Агар в пробирках быстрее расплавляется и охлаждается более равномерно до нужной температуры. Чашки заливают расплавленным и остуженным до 45 град. C агаром сразу же после внесения материала. В противном случае может наблюдаться неравномерное распределение колоний в виде отдельных скоплений в толще агара; для более равномерного распределения посевного материала, кроме того, содержимое чашки перемешивают вращательными движениями.
После застывания агара чашки с посевами помещают в термостат дном вверх, инкубируют по рекомендации ФАО/ВОЗ при 30 град. C в течение 72 часов; при необходимости предварительный учет производят через 48 часов. Количество колоний подсчитывается на каждой из засеянных чашек. Счет колоний на чашках производят с помощью прибора для счета колоний бактерий или лупы. Для лучшей видимости считают колонии на темном фоне (под чашку кладут темную бумагу), чашки помещают дном кверху. Каждую колонию отмечают на дне чашки чернилами или тушью.
При подсчете придерживаются следующих правил:
а) если на чашке выросло небольшое количество колоний, примерно 100, подсчитывают все колонии;
б) если колонии распределены равномерно и их количество измеряется несколькими сотнями (200 - 300 колоний), допускается подсчет колоний не менее чем на 1/3 площади чашки. В этих случаях дно чашки делят карандашом на 6 секторов и считают колонии в 3 секторах. Затем делают пересчет на всю площадь чашки: вычисляют среднее количество колоний на площади одного сектора и полученное количество колоний на одном секторе умножают на 6;
Пример. Если среднее число колоний на 1 кв. см составляет 18, диаметр чашки 10 см, то число колоний на всей площади чашки 18 x 78,5 = 1413, округляя в ответе, указывают 1400.
Число колоний, выросших на чашке, должно отражать количество жизнеспособных микроорганизмов, содержащихся в засеянном объеме исследуемого материала. Поскольку последний, как правило, засевают в разведенном виде, число выросших на чашке колоний умножают на степень взятого разведения, рассчитывают среднее арифметическое и устанавливают количество мезофильных аэробных и факультативно анаэробных микроорганизмов в 1 г (мл) продукта.
При установлении количества мезофильных бактерий не все чашки могут быть использованы для вычисления среднего арифметического:
а) нельзя использовать посевы для вычисления среднего арифметического, если количество выросших колоний на чашках менее 30. В этом случае в протокол исследований вносят показатели обсемененности, полученные при подсчете колоний только по одной или двум чашкам, число колоний на которых больше 30. В случае роста колоний на засеянных чашках в количестве менее 30 в результатах анализа рекомендуется следующая формулировка: "Рост единичных колоний при посеве (указать количество засеянного продукта)";
б) не используются посевы для вычисления среднего арифметического показателя на тех чашках, на поверхности которых более чем на 1/2 площади отмечается ползучий рост спорообразующих микроорганизмов, последние могут маскировать рост прочих бактерий. Возможны случаи, когда на чашках из всех разведений получен рост споровых микроорганизмов и подсчет изолированных колоний практически не возможен. В этих случаях в протоколе исследования следует указывать: "Рост спорообразующих микроорганизмов".
Пример расчета. Если на чашках Петри при посеве 0,1 г продукта выросло в среднем 135 колоний, а при посеве 2-го разведения (0,01 г продукта) - 9 колоний, то в результатах исследования учитывают цифровые данные, полученные при посеве 1-го разведения, т.е. количество микроорганизмов 135 x 10 = 1350 в 1 г продукта.
Для получения более точных данных по количеству мезофильных бактерий целесообразно сопоставлять результаты подсчета колоний, полученные на чашках с посевами материала из последовательных разведений. Числа подсчитанных колоний должны примерно соответствовать кратности взятых разведений. Если количество колоний на чашках с посевами из последующих разведений (1:10, 1:100) почти совпадает или мало между собой разнится, то это указывает на недостаточное перемешивание посевного материала при приготовлении разведений и перед посевом.
Микробиологическое исследование пищевых продуктов проводят с целью выявления КМАФАнМ путем высева на чашки Петри с питательной средой (мясопептонным агаром) или отдельных групп микроорганизмов путем высева на элективные питательные среды. Количество микроорганизмов определяют в 1 см 3 продукта жидкой консистенции или в 1 г продукта плотной консистенции.
Отбор средней пробы. При анализе партии продукта готовят среднюю пробу. Для разных пищевых продуктов установлены нормы отбираемых средних проб и правила их отбора. Однако во всех случаях необходимо соблюдать условия, исключающие контаминацию исследуемого продукта посторонними микроорганизмами.
При исследовании жидкие и полужидкие продукты (молоко, сметана, соусы и др.) тщательно перемешивают и затем отбирают в стерильную посуду простерилизованным черпаком емкостью 50-100 см3. Пробы плотных продуктов (мясо, колбаса, рыба, кулинарные изделия и др.) отбирают из толщи продукта в разных местах. Предварительно поверхность исследуемых участков прижигают раскаленным ножом и по ней делают глубокий разрез стерильным скальпелем. Края разреза раздвигают стерильным пинцетом и вырезают стерильными ножницами небольшие кусочки продукта. Отобранные таким образом из разных мест образцы измельчают, собирают в стерильную тару и составляют из них среднюю пробу.
При оборе средней пробы таких продуктов, как сливочное масло, творог, сыр используют стерильный щуп, который вводят в продукт с одного края и доводят до противоположного вглубь и наискосок. Затем стерильным скальпелем из нескольких мест отобранной пробы берут кусочки, измельчают их и помещают в стерильную посуду.
Подготовка пробы к анализу. При исследовании плотных продуктов из средней пробы берут навеску массой от 1 до 10 г, переносят ее в стерильную ступку и тщательно растирают. Если продукт очень плотный, то его растирают в ступке с предварительно прогретым кварцевым песком. Растертый продукт вносят в колбу, содержащую от 90 до 99 см 3 стерильного физиологического раствора (0,5 %-й раствор хлорида натрия). Содержимое колбы осторожно взбалтывают в течение 5 мин. В колбе получается первое разведение продукта (1:10), из которого готовят последующие разведения.
Навеску сливочного масла расплавляют на водяной бане при температуре не выше 45 °С, после чего в 9 см 3 физиологического раствора вносят стерильной пипеткой 1 см 3 продукта, получая разведение 1:10.
Для исследования жидких и полужидких продуктов из полученной средней пробы после тщательного перемешивания отбирают стерильной пипеткой 1 см 3 продукта и вносят его в пробирку, содержащую 9 см 3 стерильного физиологического раствора.
Приготовление разведений. Пищевые продукты могут содержать значительное количество микроорганизмов, поэтому, чтобы получить изолированные колонии, необходимо приготовить десятикратные разведения продукта.
Полученное 1-е разведение продукта тщательно перемешивают новой стерильной пипеткой, вбирая в нее и выпуская из нее полученную взвесь. Эту процедуру выполняют 3-5 раз, затем той же пипеткой отбирают 1 см 3 суспензии и переносят её во 2-ю пробирку с 9 см 3 стерильного физиологического раствора. Получают 2-е разведение (1:100). Пипетку нельзя погружать в жидкость во избежание смывания микроорганизмов с ее наружной поверхности. Новой стерильной пипеткой тщательно перемешивают содержимое 2-го разведения, набирают из него 1 см 3 и переносят в следующую пробирку с 9 см 3 стерильной воды, получая третье разведение (1:1000). Таким же образом готовят последующие разведения до получения необходимого результата.
Внимание! Для приготовления каждого разведения следует использовать отдельную стерильную пипетку. Пренебрежение этим правилом может привести к получению ошибочного результата.
Посев в чашки Петри. Для определения КМАФАнМ используют метод глубинного посева на плотные питательные среды. Схема посева приведена на рис. 15.1. На крышках чашек стеклографом отмечают исследуемый вариант и разведение. Каждое разведение высевают не менее чем в 2-3 параллельные чашки. Разведения выбирают с таким расчетом, чтобы на чашке выросло от 30 до 300 колоний. Стерильной пипеткой отбирают из пробирки по 1 см 3 соответствующего разведения суспензии и переносят его в 2-3 пустые стерильные чашки Петри. После внесения разведения суспензии чашки заливают питательной средой не позднее чем через 15 мин. Для этого над пламенем спиртовки вынимают пробку из пробирки или колбы с расплавленной и остуженной до 45-50 °С питательной средой и обжигают края. Затем приоткрывают крышку чашки так, чтобы только вошло горлышко колбы, и осторожно вливают 10-15 см 3 питательного агара, толщина слоя которого должна быть около 5 мм. Чашку закрывают крышкой и сразу же легкими вращательными движениями перемешивают питательную среду с посевным материалом, после чего оставляют на 10-15 мин в горизонтальном положении для застывания среды. Засеянные чашки переворачивают вверх дном и помещают на 24-48 ч в термостат с температурой 37±1 °С.
Рис. 15.1. Схема посева продукта для определения КМАФАнМ

Подсчет выросших колоний. После инкубации отбирают чашки, на которых выросло от 30 до 300 колоний, подсчитывают их визуально или с помощью специального прибора для подсчета колоний. При подсчете колоний чашки просматривают в проходящем свете и отмечают подсчитанные колонии чернилами или тушью. В случае, если на чашке с максимальным разведением выросло более 300 колоний, можно вести их подсчет при помощи лупы и сетки из оргстекла со стороной квадрата 1 см при боковом освещении. Подсчет колоний проводят не менее чем в 20 квадратах, определяют среднее их число на 1 см 2 и умножают на площадь поверхности среды в чашке.
Количество микроорганизмов в 1 см (или в 1 г) продукта (КМАФАнМ) определяют, как произведение количества выросших колоний (N) на показатель разведения (n):
КМАФАнМ = N •10 n КОЕ/см 3 .
Примечание. Анаэробные микроорганизмы не определяются чашечным методом, так как для их выращивания необходимо создать анаэробные условия. Культивирование анаэробов осуществляют в анаэростатах (см. рис. 4.1) или используют питательные среды с редуцирующими веществами.
15.2. Определение бактерий группы кишечных палочек (БГКП) в пищевых продуктах
Определение БГКП в пищевых продуктах проводят в соответствии с ГОСТ Р 50474-93. Продукты пищевые. Методы выявления и определения количества бактерий группы кишечной палочки (колиформных бактерий).
Метод определения БГКП основан на обнаружении образования газа и кислоты при высеве определенного количества продукта (или смыва с его поверхности) в жидкие питательные среды, содержащие лактозу (среда Кесслера) с последующим подтверждением принадлежности выросших микроорганизмов к группе кишечных палочек по морфологическим и культуральным признакам.
Исследование на наличие БГКП проводят в несколько этапов:
I этап - приготовление разведений продукта. Если продукт плотный (колбаса, сыр, масло, творог и др.), то результат выражают в отсутствии БГКП в определенной его массе (г). Если продукт жидкий (молоко, кисломолочные напитки, сок и т. д.), то БГКП должны отсутствовать в определенном его объеме (см 3 или дм 3 ).
II этап - посев определенного количества продукта или его разведений в среду Кесслера. Среду Кесслера разливают в пробирки или колбы, в которые помещают поплавок (стеклянная трубочка
с одним запаянным концом). После стерилизации поплавок должен быть заполнен средой.
В пробирки со средой Кесслера вносят по 1 см 3 соответствующего разведения продукта (10 -1 ;10 -2 ;10 -3 )и ставят в термостат при температуре (37±1) °С. Через 24 ч инкубации посевы просматривают и отмечают образование газа в поплавке и изменение цвета среды из фиолетового в желто-зеленый. Записывают, в каких разведениях произошло газообразование.
После инкубации чашки просматривают. Бактерии группы кишечной палочки образуют на среде Эндо красные или розовые блестящие колонии с металлическим блеском или без него. Такой характер роста на среде Эндо эти бактерии дают за счет сбраживания лактозы и образования кислоты, вызывающей восстановление индикатора фуксина, окрашивающего колонии в красный цвет.
Из типичных колоний на среде Эндо готовят препараты, окрашивают их по Граму и микроскопируют. Если в препарате обнаруживаются мелкие грамотрицательные неспорообразующие палочки, то одновременно ставят оксидазный тест. Заключение о том, что обнаруженные в продукте микроорганизмы относятся к БГКП, делают на основании выявления в посевах грамотрицательных, не образующих спор палочек, сбраживающих лактозу с образованием кислоты и газа при температуре 37±1 °С с отрицательным тестом на оксидазу. При этом указывают массу навески продукта (в г) или его объем (в см 3 ). В случае отсутствия на среде Эндо типичных для БГКП колоний продукт считают не загрязненным кишечными палочками.
15.3. Определение количества дрожжей и плесеней
Для определения количества дрожжей и плесеней в пищевых продуктах делают посев соответствующих разведений в чашки Петри, которые заливают расплавленным и остуженным до температуры 45-50 °С сусло-агаром (СА) или средой Сабуро. Содержимое чашек перемешивают вращательными движениями и оставляют для застывания на 10-15 мин, после чего ставят в термостат с температурой 30±2 °С на 2-3 сут. После инкубации в чашках подсчитывают отдельно количество выросших колоний плесеней и дрожжей. Результат выражают числом КОЕ/ см3 (или г).
Контрольные вопросы
1. Что такое КМАФАнМ?
2. Для чего делают разведения пищевого продукта при определении количества микроорганизмов?
3. Какие питательные среды используют для определения КМАФАнМ, дрожжей и плесеней?
4. Из каких этапов состоит определение БГКП в пищевых продуктах?
5. Какие среды используют для определения БГКП в пищевых продуктах?
6. По каким признакам устанавливают рост БГКП в среде Кесслера?
7. Как выглядят колонии БГКП на среде Эндо?
8. В каком случае дают положительный ответ на присутствие в пищевом продукте БГКП?
Источник первичного обсеменения молочных продуктов микроорганизмами – молоко-сырье. Обсеменение молока сырого происходит на этапе его получения, хранения, транспортировки и зависит от здоровья животных, в том числе их вымени; санитарно-гигиенического состояния ферм (чистоты оборудования, воды, воздуха, личной гигиены персонала) и качества кормов.
Требования к молоку сырому по бактериальной обсемененности, установленные нормативными документами РФ, Таможенного союза и ЕЭС, представлены в табл. 1.
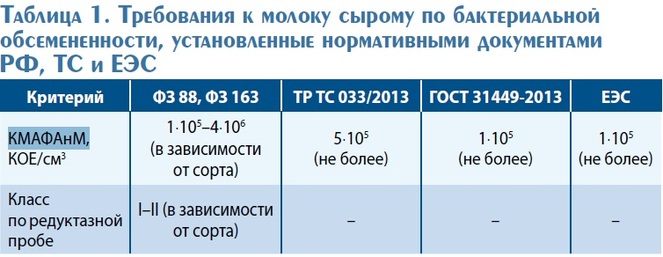
В цепи производственного контроля молочного сырья и готовой продукции микробиологические исследования – самый сложный элемент. Как правило, стандартные методы микробиологических исследований достаточно трудоемки и для получения результата требуется нескольких суток. В итоге результат продолжительного микробиологического исследования не может быть использован в производственном процессе и является формальным.
Для управления технологическими процессами в молочной промышленности необходимы количест венные экспресс-методы микробиологического конт роля, дающие результат в режиме реального времени и обеспечивающие возможность быстрой микробиологической диагностики поступающих потоков сырого молока разного качества.
Решение глобальной проблемы нехватки качественного сырого молока состоит не только в увеличении продуктивности молочного стада, но и в оптимизации существующей производственной инфраструктуры. Наличие быстрых методов оценки гигиены производства, в том числе сырья, позволяет локализовать риски для оперативной санации и значимо улучшить качество поставляемого молока.
Работа с поставщиками сырого молока – эффективный путь повышения безопасности всей производственной цепи. Поэтому она должна сводиться не к формальному декадному контролю, а к объективной оценке микробиологического качества молока в реальном вре мени и помощи поставщикам в устранении текущих проблем. Под реальным временем оценки микробиологического качества молока следует понимать диапазон в несколько минут. В этом случае быстрый количественный микробиологический результат становится ключом к инновационной системе управления современным производством, где цифровые данные немедленно поступают в информационную систему для оперативного принятия решения.
По этой причине быстрые количественные микробиологические методы находятся в зоне пристального внимания ведущих специалистов молочной индуст рии. До последнего времени о такой возможности переработчики молока могли только мечтать.
Основной недостаток чашечного метода – длительность анализа, так как большинству микроорганизмов для образования видимых колоний необходимо не менее 2–3 сут.
Питательная среда, используемая для определения бактериальной обсемененности молока, должна обеспечивать рост единичных клеток, не ограничивая и не создавая условий для опережающего развития каких-либо отдельных групп микроорганизмов, а также обеспечивать должную выявляемость тех микроорганизмов, которые способны расти и размножаться в молоке и молочных продуктах. Большое значение для точности метода имеет размер колоний, образуемых на чашках и подлежащих подсчету. Чем больше диаметр колонии, тем выше вероятность того, что она будет визуально замечена и учтена при подсчете
Точность и воспроизводимость результатов определения бактериальной обсемененности молока чашечным методом зависит от ряда причин:
- ростовых характеристик питательной среды и правильности ее приготовления;
- точности работы микробиолога при приготовлении разведений продукта и проведении посева;
- правильности подсчета колоний и обработке результатов.
Для определения уровня бактериальной обсемененности молока сырого ГОСТ 32901-2014 предполагает возможность применения косвенного экспресс-метода – редуктазной пробы .
В процессе жизнедеятельности бактерии выделяют в окружающую среду, наряду с другими окислительновосстановительными ферментами, анаэробные дегидразы, по старой классификации называемые редуктазами. Существует зависимость между количеством мезофильных аэробных и факультативно-анаэробных микроорганизмов (КМАФАнМ) в молоке и содержанием в нем редуктаз, что дает возможность использовать редуктазную пробу как косвенный показатель уровня бактериальной обсемененности сырого молока.
Метод основан на восстановлении резазурина окислительно-восстановительными ферментами, выделяемыми в молоко микроорганизмами. По интенсивности изменения окраски резазурина через 1 ч оценивают уровень бактериальной обсеменности сырого молока.
Основные преимущества оценки уровня бактериальной обсемененности молока по редуктазной пробе:
- метод крайне прост в исполнении и не требует специального оборудования;
- метод малозатратный, не предполагающий дорогостоящих реактивов;
- метод, проверенный многолетним опытом применения в промышленности.
Основные недостатки метода:
- низкая чувствительность (порог чувствительности составляет 3⋅10 5 КОЕ/см 3 );
- дает возможность отнести молоко к тому или иному классу (до 500 тыс. в 1 см 3 молока – I класс; более 500 тыс. в 1 см 3 молока – II класс) без конкретных показателей количества бактериальных клеток.
Результаты определения могут быть представлены как в абсолютных значениях микробной биомассы, так и со-отнесены с результатами определения колониеобразую-щих единиц (КОЕ) или численностью клеток.
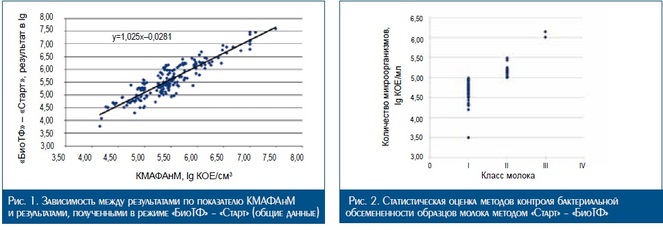
На рис. 2 и 3, а также в табл. 2 представлены результа ты статистической оценки методов контроля бактери альной обсемененности образцов молока, ранжирован ных по классам:
•• I класс – до 100 тыс. КОЕ/см3 ;
•• II класс – от 100 до 500 тыс. КОЕ/см3;
•• III класс – более 500 тыс. КОЕ/см3 .
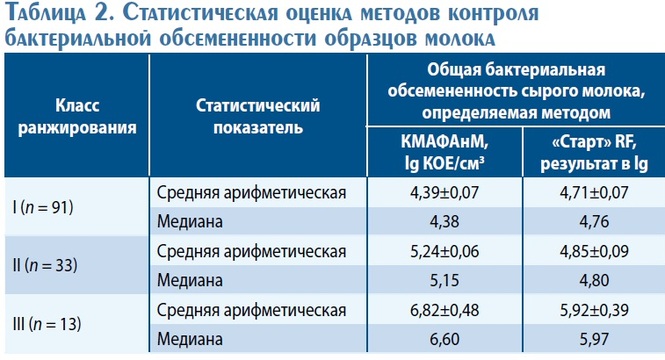
Среднее значение десятичного логарифма численности микроорганизмов в серии экспериментов стандартным и экспресс-методом составило 4,69 и 4,81 lg КОЕ/см3, со ответственно. Деление результатов, полученных в каждой серии экспериментов, на классы в соответствии с суще ствующей системой градации качества молока выявило тождественность методов.
Получите подробную консультацию по анализатору бактериальной обсемененности молока у специалистов компании Агролаб по телефону 8 (383) 280-42-38
Читайте также:

