Посев на хеликобактер пилори с чувствительностью к антибиотикам
Добавил пользователь Алексей Ф. Обновлено: 19.09.2024
Патоморфологическое исследование ткани желудка для выявления бактерии Helicobacterpylori в биоматериале.
Приём и исследование биоматериала
Когда нужно сдавать анализ Исследование эндоскопического материала на Helicobacter pylori?
- Подозрение на инфицирование Helicobacterpylori.
- Инфекция Helicobacter pylori у родственников .
- Наличие гастрита или язвенной болезни желудка при обследовании или в прошлом.
- Рак желудка у близких родственников.
Подробное описание исследования
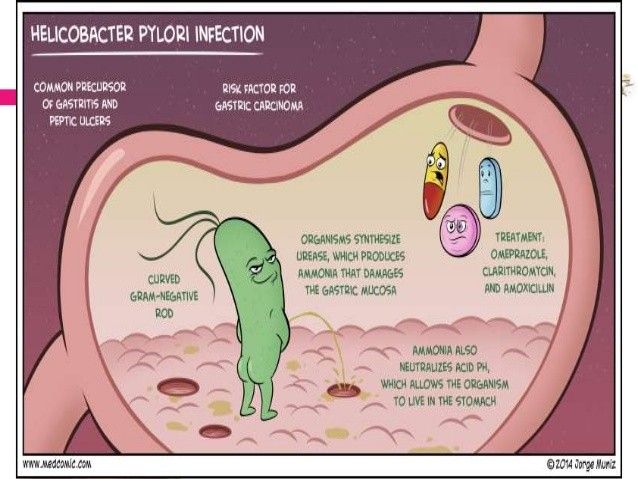
Helicobacter pylori (H. pylori) представляет собой спиралевидную бактерию, поражающую до 50% населения во всем мире, с более высокой распространенностью в развивающихся странах. H. pyloriслужит наиболее значимой причиной хронического гастрита, язвенной болезни, лимфомы и рака желудка.
Инфицирование H. pylori происходит в раннем детстве, далее бактерия в большинстве случаев продолжает оставаться в организме зараженного человека в течение жизни. Передача H. pylori осуществляется в основном фекально-оральным путем (обычно через грязные руки из-за несоблюдения гигиены), реже орально-оральным - при контакте с зараженной слюной, например, когда инфицированный родитель или родственник целует ребенка в детстве. Среди детей младше 10 лет в среднем 5%-10% заражены данной инфекцией. Распространенность H. pylori различается во всем мире: более высокий уровень инфицирования наблюдается в развивающихся странах. В России около 60% взрослого населения заражены H. pylori.
Выделяют четыре важных составляющих, которые приводят к формированию заболеваний, обусловленных H. pylori. Во-первых, данная бактерия имеет фермент уреазу, который нейтрализует химически агрессивный желудочный сок. Во-вторых, наличие жгутиков помогает H.pylori активно двигаться к эпителиальным клеткам желудка хозяина. Третьим преимуществом является выделение специальных белков-адгезинов, взаимодействующих с клетками желудка, что приводит к успешному закреплению возбудителя в организме хозяина. В-четвертых, бактерия продуцирует токсины, позволяющие ей выживать и размножаться в желудке. Все указанные факторы в итоге приводят к повреждению ткани желудка и развитию хронического воспаления.
У большинства людей инфекция H. pylori протекает бессимптомно. Клинические проявления, если таковые имеются, обычно связаны с такими симптомами как боли в животе преимущественно натощак, тошнота или тяжесть после еды. При обследовании часто обнаруживается нарушение целостности слизистой оболочки желудка - язвы или эрозии. Существуют различные внежелудочные проявления, связанные с инфекцией H. pylori, такие как анемия и хроническая иммунная тромбоцитопения. Длительное присутствие данной бактерии в организме повышает риск развития лимфомы и рака желудка. Этот риск выше среди тех, чьи близкие родственники страдали указанными заболеваниями.
При заражении H. pylori всегда наблюдается микроскопическое воспаление желудка.Изменения слизистой оболочки органов часто не видны при эндоскопическом исследовании. "Золотым стандартом" выявления инфекции H. pylori служит взятие биопсии из нескольких отделов желудка с последующим изучением полученных образцов под микроскопом.
Взятие небольшого фрагмента ткани желудка с последующим окрашиванием и фиксацией полученного микропрепарата на стекле позволяет детально изучить изменения клеток данного органа под микроскопом. Визуализация H. pylori при подобном исследовании имеет чувствительность и специфичность 90% и более.
Показания к обследованию. Хронический гастрит, язвенная болезнь желудка и двенадцатиперстной кишки, лимфомы, рак желудка.
Материал для исследований. Биоптаты слизистой оболочки желудка и двенадцатиперстной кишки; образцы фекалий, желудочный сок, зубной налет, сыворотка крови.
Этиологическая лабораторная диагностика включает посев клинического материала с дальнейшей культуральной и биохимической идентификацией возбудителя, определением антибиотикочувствительности; выявление ДНК микроорганизма; обнаружение специфических АТ к АГ Helicobacter pylori. Скрининговые экспресс тесты, такие как определение уреазной активности возбудителя в биоптатах желудка, гистологическое исследование биоптатов, дыхательные тесты, носят ориентировочный характер.
Сравнительная характеристика методов лабораторных исследований. Посев биопсийного материала слизистой оболочки желудка, полученного при эндоскопическом обследовании, является наиболее информативным из используемых методов, он позволяет проводить дополнительные исследования (определение чувствительности микроорганизма к антибиотикам), однако высокая трудоемкость такой диагностики делает ее малораспространенной. Принадлежность выделенной культуры к роду Helicobacter оценивается на основании морфологии колоний и культуры в мазке, окрашенном по Граму, а также по ферментативным свойствам (продукция уреазы, каталазы и оксидазы). Дифференциальная диагностика H.pylori проводится с Сampylobacter jejuni.
Наибольшее распространение на практике получили экспресс-методы исследования биоптатов слизистой желудка, основанные на выявлении уреазной активности микроорганизмов, присутствующей в таких препаратах. По диагностической специфичности и чувствительности они уступают прямым методам выявления возбудителя, кроме того, требуют инвазивной процедуры получения биоптатов при эндоскопии. Чувствительность и специфичность данных тестов существенно варьирует при использовании реагентов разных производителей.
Выявление ДНК методом ПЦР в сравнении с быстрыми уреазными тестами обладает более высокой чувствительностью и специфичностью, в сравнении с культуральными исследованиями – меньшей трудоемкостью, с гистологическими исследованиями – меньшей субъективностью. Наборы реагентов для диагностики инфекции с использованием ПЦР предназначены как для обнаружения ДНК H.pylori, так и для характеристики генов, кодирующих факторы вирулентности патогена.
Выявление в сыворотке крови пациента специфических АТ к АГ микроорганизма используется для первичной диагностики инфекции. Недостатком такого способа диагностики является отсутствие возможности контролировать результаты этиотропного лечения после его окончания, так как уровень специфических АТ медленно снижается после эрадикации H.pylori. При первичной диагностике инфекции положительный результат обнаружения АТ, клинические симптомы и эндоскопически выявленная язвенная болезнь желудка/двенадцатиперстной кишки или эрозивный гастрит достаточны для обоснования диагноза и использование дополнительных методов диагностики не требуется. В Европейских странах выявление АТ методом ИФА является наиболее распространенным методом диагностики инфекции Helicobacter pylori, позволяющим диагностировать наличие возбудителя без эндоскопического обследования.
Показания к применению различных лабораторных исследований. Посев материала, отобранного с использованием инвазивных процедур, с дальнейшей культуральной и биохимической идентификацией возбудителя, выполняют по клиническим показаниям. Выявление АТ используют для первичного скрининга.
Особенности интерпретации результатов лабораторных исследований. Выявление возбудителя культуральным методом или обнаружение ДНК возбудителя методом ПЦР являются достоверным подтверждением инфицированности. Обнаружение АТ к H.pylori свидетельствует об инфицированности данным возбудителем и может указывать на хронический гастрит типа В, язвенную болезнь желудка и двенадцатиперстной кишки. Уровень специфических АТ коррелирует с массивностью обсеменения слизистой желудка H.pylori и патоморфологической картиной процесса. Обнаружение АТ выявляют факт инфицирования при манифестных, субклинических формах, а также в стадиях ремиссии заболевания. Терапию не назначают на основании результатов выявления АТ к H.pylori, для уточнения диагноза рекомендуется проведение эндоскопического исследования.
При выявлении специфических АТ могут быть получены ложноотрицательные результаты, обусловленные несколькими причинами: особенностями иммунной системы пациента, не вырабатывающей АТ к АГ H.рylori, взятием проб крови на исследование на ранней стадией инфицирования возбудителем, недостаточной чувствительностью используемого метода. Ложноположительный результат может быть получен у новорожденных (трансплацентарная передача АТ от матери); после санации (эрадикации возбудителя и достоверном отсутствии его в тканях по результатам бактериологического исследования) в течение 6 месяцев.
Где поставить правильную запятую, если у пациента диагностирована Helicobacter pylori?
Дыхательный тест
Дыхательный тест – пациент дышит в специальные фольгированные мешки либо экзетейнеры. Перед анализом он выпивает препарат, меченый специальным изотопом . Далее наблюдают за реакцией радиоактивной метки. По количеству изотопного состава углерода в выдыхаемом воздухе, сравнивая ее с пробой до принятия изотопного препарата, врачи выясняют, есть ли в организме бактерия Helicobacter pylori. Это информативный и относительно дешевый тест. При отрицательных показателях считается, что бактерии у человека нет, и дальнейшие исследования не проводятся.
Анализ крови на иммуноглобулины G и M (IgG и IgM)
Если анализ крови на IgG к Helicobacter pylori положителен, то это говорит о том, что инфекция либо когда-то присутствовала в организме человека (т.е., человек лечился от хеликобактера ранее, после чего в крови остались антитела), либо человек является её носителем, то есть, заражён Helicobacter pylori. Положительный результат IgG может быть и на момент лечения. Но этот результат может быть, как ложноположительным, так и ложноотрицательным. Если пациент менее чем за 2 недели до сдачи анализа принимал ингибиторы протонной помпы или препараты висмута, то результат IgG может быть недостоверным. Точность этого исследования колеблется в пределах от 75% до 86%.
Эндоскопия
В отношении революционных методов типа капсульной эндоскопии существует некоторый скепсис. Это популярный и комфортный метод, но капсула с микровидеокамерой, проходя через ЖКТ, может не показать все его отделы. В сложных случаях она может застрять в грыжах, выпячиваниях, дивертикулах. А может их и не заметить. Так же с помощью этой капсулы не возможно взять биоптат на исследование.
Что дальше?
Лечение хеликобактера в любом случае – антибактериальное.
Существуют терапии первой линии и второй линии. Кроме того, бывают тройная терапия, которая назначается, если нет дефекта слизистой, и квадротерапия – если есть дефект слизистой (эрозии или язвы). Тогда врач назначает препараты висмута, они обладают местным ранозаживляющим действием.
Может так случится, что лечение терапией первой линии окажется малорезультативным. Обычно при правильном соблюдении рекомендаций врача эффективность терапии первой линии составляет 70-98%. Однако бывают индивидуальная резистентность, противопоказания или побочные эффекты. Например, довольно высокая резистентность к кларитромицину из первой линии, есть специальные схемы и для таких пациентов. Бывает и плохая переносимость препарата, появляется диарея, рвота, металлический привкус во рту. В таком случае кларитромицин можно заменить на левофлоксаци́н или нифурател. Если первые две линии лечения
окажутся неэффективными, то берется посев на чувствительность бактерии к антибиотикам, а терапия подбирается в соответствии с результатами посева. В таком случае говорят, что мы имеем дело с рефрактерной формой Helicobacter pylori.
Приходите к нам еще!
После того, как завершили курс, надо посмотреть, эффективен ли он. Этого не делают в 90% случаев. Через 2 недели после того, как закончили терапию, надо сдать кал на антиген к Helicobacter pylori. Отрицательный – все отлично! Если положительный результат, то при любой, даже минимальной концентрации надо признать, что терапия оказалась неэффективной и подбирать новую.
Неизлечимость Helicobacter pylori – это врачебный миф. По причине того, что пациенты не сдают контрольный анализ, а затем, к примеру, через год возвращаются с теми же жалобами, и вновь им диагностируют Helicobacter pylori, невозможно понять, повторное это заражение или же неэффективная терапия. Helicobacter pylori – это инфекция, микроорганизм. Нет микроорганизма – нет проблемы.
При этом не нужно упускать момента наличия резистентности, по причине которой первая линия терапии может оказаться неудачной. Проблема устойчивости есть, и в этом случае очень важны верная диагностика и обязательный контрольный визит после лечения.
Долгое время при абсолютных показаниях к лечению полагалось обязательно лечиться. К таким показаниям относились: язва желудка, атрофические изменения его слизистой у пациента, лимфома и рак желудка у кровных родственников. Все остальное считалось относительными показаниями, которые нужно было просто контролировать. Но эту тактику изменил Киотский глобальный консенсус по Helicobacter pylori-ассоциированным состояниям, который состоялся в 2015 году. Эксперты консенсуса признали онкогенность бактерии и теперь, оценивая все возможные риски осложнений от антибактерильной терапии, при обнаружении Helicobacter pylori рекомендуется проводить ее обязательную эрадикацию.
Эта бактерия может долго жить в организме, вызывать не только язвы и эрозии, требующие длительной терапии, но ее также в большой концентрации считают предраковым состоянием, вызывающем сперва атрофические гастриты, а потом и онкологию.
Другое дело, если у человека диагностирована язва, но наличие Helicobacter pylori под вопросом.
Действия врача при выборе терапии должны быть обоснованы. Стандарт при обнаружении язвы – противоязвенная терапия плюс определить, есть ли у пациента Helicobacter pylori.
В качестве врачебной ошибки и последствий бесконтрольного лечения антибиотиками можно привести пример, когда по телевизору активно рекламировался один из препаратов висмута.
У этого препарата нет прямого противомикробного действия, его назначали при язвах, гастритах, как ранозаживляющее. Но были исследования, подтверждающие, что в 3% он убивает Helicobacter pylori. И его стали рекламировать с такой точки зрения. Пациенты стали верить, что он убивает бактерию, и начали массово, бесконтрольно его применять.
Такая тактика лечения и самолечения и порождает мифы о неизлечимости Helicobacter pylori как таковой.
Самое главное, чтобы пациент не занимался самолечением и самодиагностикой, и при любых симптомах патологии желудочно-кишечного тракта обязательно обращался к специалисту-гастроэнтерологу.
Диагностические тесты, применяемые для выявления инфекции Helicobacter pylori, подразделяются на инвазивные (требующие проведения эндоскопического исследования) и неинвазивные, прямые (выявление бактерии бактериологическим, гистологическим и молекулярным методами) и непрямые (выявление уреазной активности бактерии или антител к ней). Выбор теста определяется клинической ситуацией, а также его доступностью и стоимостью. На чувствительность большинства тестов влияет применение антисекреторных препаратов и антибиотиков.

Enter the password to open this PDF file:
Полный текст статьи:
АГ – антиген
БУТ – быстрый уреазный тест
ГМ – гистологический метод
ИПП – ингибиторы протонной помпы
ИФА – иммуноферментный анализ
ИХА – иммунохроматографический анализ
МА – моноклональные антитела
ПА – поликлональные антитела
СОЖ – слизистая оболочка желудка
УДТ – уреазный дыхательный тест
ЭГДС – эзофагогастродуоденоскопия
DOB – дельта по сравнению с исходным значением
FISH – флюоресцентная гибридизация in situ
HP – Helicobacter pylori
LCI – узкоспектральная визуализация (linked color imaging)
WLE – эндоскопия в белом свете (white-light endoscopy)
Бактериологический метод
Метод основан на идентификации возбудителя путем посева из биоптата СОЖ. Полученные при эндоскопии биоптаты помещают в пробирки с транспортными средами (Cary-Blaer или Pylori-средой). Посев материала желательно проводить в день его поступления в лабораторию. Инкубация посевов осуществляется в микроаэрофильных условиях при содержании кислорода ≤5%. В дальнейшем проводится идентификация выделенных культур, определяются их морфологические, тинкториальные свойства, чувствительность к антибиотикам. Специфичность метода – 98%, чувствительность – 76–90% [16], по другим данным – 50–90% [17]. Определенное количество ложноотрицательных результатов возникает при несоблюдении или неточном соблюдении методики исследования. Несмотря на точность метода, он редко используется в обычной клинической практике из-за длительности анализа (средняя продолжительность исследования – 7 дней), сложности его постановки и высокой стоимости. Метод рекомендуется после двух неудачных курсов эрадикационной терапии, когда выбор антибиотиков определяется чувствительностью НР к ним [10, 13].
Гистологический метод
ГМ позволяет непосредственно визуализировать НP и может быть рекомендован для первичной диагностики у больных, которым показана ЭГДС. Материалом исследования является биоптат СОЖ. Преимуществами ГМ являются простота исполнения, удобство хранения, транспортировки. Специфичность гистологического метода может достигать 100%, а чувствительность – 91–93% [18].
Высокочувствительным (97%) и высокоспецифичным (100%) методом для диагностики инфекции НР является флюоресцентная гибридизация in situ (метод FISH) на гистологических препаратах. Метод FISH может идентифицировать кокковидную форму НР, которая обычно не обнаруживается путем рутинного гистологического исследования. Кроме того, FISH – это быстрый, точный и экономически эффективный метод обнаружения устойчивости к кларитромицину НР в образцах биопсии желудка [15].
Несмотря на высокую чувствительность гистологического метода, на его диагностическую точность могут оказать влияние количество биоптатов и место их забора. Для получения оптимальной информации рекомендуется множественная биопсия, которая также обеспечивает морфологическую оценку СОЖ [19]. Сиднейская система рекомендует исследование не менее пяти биоптатов: по два из антрального отдела (2–3 см от привратника по большой и малой кривизне), по два из тела желудка (по большой и малой кривизне, примерно в 8 см от кардии) и один из угла желудка. Ценность исследования повышается при оценке степени и стадии гастрита по системе OLGA или OLGIM, которые позволяют оценить прогноз заболевания [20].
При малой обсемененности НР, а также при утрате бактерий в процессе подготовки препаратов вероятны ложноотрицательные результаты. При слабой подготовке гистолога возможна идентификация в качестве НР других микроорганизмов – ложноположительный результат.
Чувствительность и специфичность ГМ у пациентов с кровотечением из верхних отделов ЖКТ в среднем составляют лишь 70% [21]. Поэтому к вопросу диагностики и лечения НР следует вернуться в период ремиссии в плановом порядке.
Следует учитывать, что обнаружить НР удается только на достаточно тонких и хорошо окрашенных срезах. При наличии атрофических изменений в СОЖ повышается частота ложноотрицательных результатов. Более того, в области кишечной метаплазии HР в большинстве случаев не обнаруживается ни при обычных, ни при специальных методах окрашивания, несмотря на серологические признаки инфекции. Исчезновение HР коррелирует с развитием кишечной метаплазии и снижением секреции желудка [22]. У пациентов, принимающих антисекреторные средства (H2-блокаторы, ИПП), препараты висмута и антибиотики, чувствительность и специфичность ГМ снижены [19, 22]. Универсальной рекомендацией является отмена ИПП за 2 нед до проведения исследования, антибиотиков и препаратов висмута – за 30 дней [23].
Цитологический метод является одним из вариантов гистологического исследования. Материалом являются мазки-отпечатки биоптатов СОЖ, взятых при эндоскопическом исследовании, которые в последующем высушиваются и окрашиваются по методу Романовского–Гимзы.
Быстрый уреазный тест
БУТ является непрямым методом диагностики НР на основе выявления уреазной активности бактерии. Тест требует взятия биоптата СОЖ, который помещается в пробирку (лунку) с мочевиной и индикатором на жидкостной, гелевой или сухой основе. По изменению цвета индикатора при повышении рН среды в результате расщепления мочевины микробной уреазой можно с достаточно высокой точностью идентифицировать НР. В клинической практике при наличии показаний к эндоскопии и отсутствии противопоказаний к проведению биопсии БУТ рекомендуется использовать в качестве диагностического метода первой линии [24].
Чувствительность БУТ в зависимости от количества биоптатов варьирует в пределах 80–90% [26] (по другим данным – от 61 до 74% [27]). Увеличение количества биоптатов, их забор из двух отделов желудка (из тела и антрума) позволяют увеличить чувствительность БУТ [28]. При использовании качественных тестов и нескольких гастробиоптатов, хорошей обработке биопсийных щипцов специфичность теста может достигать 95–100% [25, 26] (по другим данным – 90% [17]). Ложноположительные результаты наблюдаются редко и могут быть обусловлены присутствием других уреазосодержащих бактерий, таких как Proteus mirabilis, Citrobacter freundii, Klebsiella pneumoniae, Enterobacter cloacae и Staphylococcus aureus. Ложноотрицательные результаты теста наблюдаются чаще, чем ложноположительные, что не позволяет использовать отрицательный результат для исключения НР [10]. Ложноотрицательные результаты могут быть получены у пациентов, перенесших язвенное кровотечение, на фоне приема ИПП, антибиотиков, препаратов висмута, а также при выраженной атрофии или метаплазии СОЖ [29].
Таким образом, положительный результат БУТ свидетельствует о наличии НР и дает возможность назначать лечение, но отрицательный – не позволяет исключить НР, поэтому БУТ не рекомендован для оценки эффективности эрадикации [10].
13С/14С-уреазный дыхательный тест
Исследование кала на наличие антигена НР
Анализ кала на антиген HР (АГ HР) – это другой неинвазивный метод диагностики с высокой чувствительностью (94%) и специфичностью (97%) [35]. Существует два варианта исследования: иммуноферментный анализ (ИФА) и иммунохроматографический анализ (ИХА) с использованием поликлональных (ПА) или моноклональных (МА) антител. Тесты на основе МА более точны, а ИФА обеспечивают более надежные результаты, чем ИХА [35]. Наряду с 13С-УДТ моноклональный тест на основе ИФА рекомендован как для первичной диагностики НР-инфекции, так и для контроля эрадикации [10]. Моноклональный АГ в кале является удобным и эффективным тестом для диагностики НР у детей [36, 37]. Кроме того, исследование антигена HР можно применять для эпидемиологических исследований и программ скрининга ввиду относительно невысокой стоимости исследования и оборудования [21]. Причинами ложноотрицательных результатов могут являться неравномерное распределение АГ в каловых массах, разрушение АГ при замедлении эвакуации каловых масс (запоры), желудочно-кишечное кровотечение [37].
Серологический метод – выявление антител IgG к HР в плазме крови
Читайте также:

