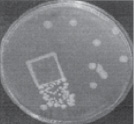
Посев холерного вибриона дает рост
Добавил пользователь Владимир З. Обновлено: 19.09.2024
Холера – это острое инфекционное заболевание, которое проявляется обильной диареей с последующим обезвоживанием организма.
Заражение происходит через воду, морепродукты и другую пищу, инфицированную фекалиями больных холерой. Возбудителем заболевания является вибрион холеры.
Современная система очистки воды позволяет предотвратить заражение, поэтому холера обычно встречается в развивающихся странах, где есть проблемы с водопроводными сетями.
Чаще всего холерой заболевают дети.
Болезнь легко устраняется с помощью вакцины, однако без лечения она может приводить к летальному исходу в течение нескольких часов.
Синонимы английские
Симптомы
У большинства людей, зараженных холерным вибрионом, не возникает выраженных симптомов. При этом в течение 7-14 дней вместе со стулом инфицированные люди выделяют вибрион холеры, который может заразить воду. Чаще всего после заражения бактерией возникает умеренная, быстро проходящая диарея. Лишь у 10 % больных симптомы заболевания, проявляясь через 2-3 дня после заражения, являются достаточно выраженными:
- обильная водянистая диарея с выделением белой непрозрачной жидкости без запаха,
- рвота,
- сильная жажда, сухость во рту, мышечные судороги, уменьшение количества мочи, слабость, вялость кожи, западение глазных яблок, сморщивание кожи пальцев – признаки, связанные с обезвоживанием организма и с потерей электролитов.
При отсутствии лечения могут возникать:
- шок – угрожающее жизни состояние, характеризующееся малым объемом циркулирующей в организме крови (гиповолемией), снижением количества кислорода и крайне низким кровяным давлением,
- тяжелое поражение почек (вследствие гиповолемии).
Для детей, кроме перечисленных симптомов, при холере характерны:
- сильная сонливость или кома,
- лихорадка,
- судороги.
Общая информация о заболевании
Холера – это острое инфекционное заболевание тонкого кишечника, которое проявляется диареей и последующим обезвоживанием. Оно вызывается холерным вибрионом. Заражение происходит через употребление содержащей бактерии воды, реже – через морепродукты, фрукты, овощи, зерна и другую пищу, инфицированную фекалиями больных людей.
Инфицированный человек, даже при отсутствии симптомов, выделяет бактерии со стулом в течение 7-14 дней. Бактерии, вызывающие холеру, могут сохраняться в стоячей воде (в колодце, озере) в течение длительного времени. Кроме того, попадая в открытые воды, вибрион холеры прикрепляется к крошечным ракообразным (копеподам), с которыми путешествует, распространяясь по всему миру, так как ракообразные следуют за своим источником питания – водорослями, растущими в различных местах.
Заболевание чаще всего встречается в районах с плохими санитарными условиями, где вода не проходит должной очистки. В развитых странах случаи холеры очень редки.
Чувствительность к бактерии может быть различной, она выше у людей с первой группой крови. Больше всего холере подвержены дети.
Вибрион холеры, попадая в организм, движется по пищеварительному тракту. Часть бактерий погибает под воздействием желудочного сока, часть проникает в тонкий кишечник, начинает размножаться и выделять холерный токсин, который при массивном заражении вызывает выделение жидкости и электролитов (натрия, калия, хлора и др.) в просвет тонкой кишки. Это приводит к диарее с последующим обезвоживанием и потерей электролитов.
Холера может вызывать следующие осложнения.
- Гипогликемия – низкий уровень сахара в крови. Глюкоза является основным источником энергии в организме, поэтому гипогликемия опасна для жизни.
- Гипокалиемия – низкий уровень калия в крови. При холере происходит потеря калия со стулом. Крайне низкий уровень калия ведет к нарушению работы сердца и нервной системы и представляет угрозу для жизни.
- Почечная недостаточность, которая может приводить к накоплению в организме азотистых шлаков и, как следствие, к шоку – угрожающему жизни состоянию.
- Смерть. Не получая лечения, больной может умереть от обезвоживания и шока в течение пары дней, а в наиболее тяжелых случаях – через несколько часов.
Кто в группе риска?
- Жители регионов с плохими санитарными условиями, где вода не проходит должных степеней очистки.
- Лица со сниженным уровнем выработки желудочного сока: вибрион холеры не является кислотоустойчивым, и бактерии, попадая в желудок, частично уничтожаются желудочным скоком.
- Люди, проживающие с больным холерой.
- Лица с первой группой крови. Риск развития холеры в данном случае будет выше в два раза.
- Те, кто употребляет сырых моллюсков и морепродукты.
Диагностика
Для постановки диагноза проводится анализ кала или рвотных масс, направленный на выявление в нем вибриона холеры (он имеет вид запятой). Также необходимо измерять уровни электролитов, остаточного азота и мочевины.
- Исследование под микроскопом испражнений или рвотных масс.
- Посев рвотных масс или отделяемого из кишечника. Анализ предполагает помещение кала или рвотных масс в питательную среду, где бактерии начинают быстро размножаться и становятся доступными визуальной оценке.
- Исследование мазка методом иммунофлюоресценции. В полученный материал добавляются меченые антитела (молекулы, специфически связывающиеся с вибрионом холеры). Под воздействием ультрафиолетового излучения комплекс из бактерий, "склеенных" с антителами, дает характерное зеленоватое свечение, что говорит о присутствии вибриона холеры во взятом материале.
В целях оценки степени обезвоживания организма и функции почек проводятся следующие анализы.
-
.
- Калий, натрий, хлор в сыворотке. Необходимо контролировать уровень электролитов в крови, так как их выраженное снижение может приводить к тяжелым осложнениям.
- Креатинин и мочевина в сыворотке. Снижение уровня креатинина и мочевины указывает на развитие почечной недостаточности.
- Адгезия клеток холерных вибрионов на поверхности покровных стекол.
- Последовательное формирование скоплений клеток.
- Изменение соотношения между единично адгезированными клетками и скоплениями клеток в сторону последних.
- Формирование матрикса клетками холерных вибрионов в скоплениях.
- Увеличение скоплений в ширину и в высоту и формирование пустых мест в виде дорожек.
-
– содержащийся в эритроцитах белок, который переносит кислород от легких к органам и тканям. При холере за счет уменьшения жидкой части крови в результате обезвоживания относительный уровень гемоглобина может быть повышен. – показатель вязкости крови. При холере он будет повышенным, отражая сгущение крови.
Лечение
Холера требует незамедлительного лечения, являясь опасным для жизни заболеванием.
Лечение включает в себя регидратацию – восполнение потерянной жидкости и электролитов. Регидратация может проводиться орально или внутривенно в виде капельниц. После восполнения воды ее нормальный уровень продолжает поддерживаться специальными растворами.
Также проводится терапия антибиотиками, снижающими длительность заболевания и диареи (тетрациклином, доксициклином, фуразолидоном).

1. Kulikalova E.S. Sposobnost kholernykh vibrionov O1 i O139 serogrupp k obrazovaniu bioplenok v eksperimente // Kholera I patogennye dlya cheloveka vibriony: Mater.probl.komis. 2009. Vyp. № 22. Р. 90–92.
2. Polyakova E.M., Bozhkova S.A., Krasnova M.V. Fenotipicheskie I genotipicheskie aspekty bioplenkoobrazovaniya u shtammov S. аureus osnovnikh vozbuditeley implant-assotsiirovannikh infektsiy // Mater. VI ezhegod. Vseros. Kongr. po inf. Boleznyam. Moskva, 2014. Р. 247–248.
4. Romanova Yu.M. Sposobnost k formirovaniyu bioplenok v iskusstvennykh sistemakh u razlichnykh shtammov Salmonella tiphimurium // Zhurn. mikrobiol.,epidemiol. i immunobiol. 2006. № 4. Р. 38–42.
5. Smirnova T.A. Strukturno-funktsionalnaya kharakteristika bakterialnykh bioplenok // Mikrobiologiya. 2010. T.79. № 4. Р. 435–446.
6. Tets G.V. Vliyanie ekzogennykh proteoliticheskikh fermentov na peredachu plazmidnykh genov v smeshannykh bakterialnykh bioplenkakh // Antibiotiki I khimioterapiya.2009. T. 54. № 9–10. Р. 3–5.
7. Alam M., Sultana M., Nair G.B. et all Toxigenic Vibrio cholerae in the aquatic environment of Mathbaria, Bangladesh // Appl. Environ. Microbiol. 2006. Vol. 72, № 4. Р. 2849–2855; 97.
8. Hall-Stoodley Z., Stoodley P. Biofilm formation and dispersal and the transmission of human pathogens // Trends Microbiol. 2005. Vol. 13. № 7–10.
9. Marschall K.C. Mechanisms of bacterial adhesion at solid-water interfaces // Bacterial adhesion (mechanisms and physiological significance) / Eds. Savage D.C., Fletcher M.NY-L.: Plenum Press, 1985. P. 133–155.
10. Mitik-Dineva N., Wang J., Mocanasu R.C. et al. Impact of nano-topography on bacterial attachment // Biotechnol. J. 2008, Vol. 3. P. 536–544.
11. O”Toole G.A., Kalpan H., Kolter R. Biofilm formationas microbial development// Ann.Rev. Microbiol. 2000. Vol. 54. P. 49–79.
12. O”Toole G.A., Kolter R. Flagellar and twitching motilitu are necessary for Pseudomonas aeruginosa biofilm development // Mol. Microbiol. 1998. Vol. 30. P. 295–304.
14. Watnick P.I., Kolter R. Steps in the development of a Vibrio cholerae biofilm // Mol. Microbiol. 1999. Vol. 34. P. 586–595.
15. Watnick P.I., Lauriano C.M., Klose K.E., Kolter R. The absence of a flagellum leads to altered colony morphology, biofilm development and virulence in Vibrio cholerae O139 // Mol.Microbiol. 2001. Vol. 39(2). P. 223–35.
Способность патогенных микроорганизмов к образованию биопленок является важнейшей составляющей не только их выживаемости в различных экологических нишах, но также механизмов передачи инфекции и колонизации организма хозяина [11, 2]. Способность факультативно патогенных для людей бактерий Vibrio cholerae формировать биопленки является ключевым фактором персистенции вибрионов в водных экосистемах; биопленки могут становиться источником новых вспышек холеры [7, 8] По этой причине более глубокое понимание процесса формирования биопленок имеет большое значение для борьбы с холерой. На сегодняшний день предложено несколько способов изучения биопленок in vitro. Самым распространенным является метод, основанный на использовании полистироловых планшетов с последующей окраской генцианвиолетом адгезированных к полистиролу сформировавших биопленку бактерий [4]. Количественный учет способности микроорганизмов к образованию биопленки проводят по фотометрическим показателям.
Другой подход состоит в применении пробирок из стекла или пластика (типа эппендорф) также с использованием для визуализации спиртового раствора генциан- либо кристалвиолета [4, 1]. Метод позволяет визуально (качественно) оценить образование биопленки по наличию ободка на стенках пробирок.
В обоих случаях полученные биопленки практически не поддаются исследованию под микроскопом. Микроскопическое изучение биопленок, образовавшихся на других биотических (хитин, раковины моллюсков, натуральные почечные камни) и абиотических (камни, песок) поверхностях, возможно, но сопряжено с риском повреждения нативной структуры при искусственном отслаивании и приготовлении препаратов.
В связи с этим целью настоящей работы явилась разработка оптимального способа получения биопленок микроорганизмов II группы патогенности (холерных вибрионов) на стекле в условиях эксперимента для последующих морфофункциональных исследований.
Материалы и методы исследования
В качестве твердого субстрата использовали покровные стекла (20×20), средой инкубации служила стерильная водопроводная либо речная вода. Эксперименты проводили при комнатной температуре в 100 мл флаконах.
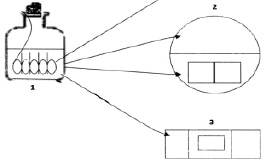
Рис. 1. Экспериментальная модель для изучения биопленок холерных вибрионов в динамике: 1 – стеклянная емкость, внутри которой размещено специальное устройство с покровными стеклами; 2 – чашка Петри с агаром для отпечатков на покровных стеклах и для высева планктонной культуры; 3 – предметное стекло, на которое помещены покровные стекла с биопленкой и накрыты покровным стеклом, большего размера (препарат раздавленная капля)
Для исследования динамики процесса адгезии клеток на поверхности покровных стекол, через определенные промежутки времени вынимали пинцетом по 2 стекла из каждой пробы, трехкратно промывали их в забуференном фосфатами физиологическом растворе (PBS) и в вертикальном положении помещали на листы фильтровальной бумаги для стекания с их поверхности оставшейся жидкости. После этого одно из стекол накладывали на поверхность агара Мартена и через 15 минут переворачивали на другую сторону, чашки с агаром помещали в термостат при 37 °С и на следующие сутки регистрировали наличие роста колоний холерных вибрионов в местах отпечатков. Второе стекло помещали на предметное стекло, добавляли раствор акридинового оранжевого (АО) в концентрации 20 мкг/мл (прижизненное флуорохромирование), накрывали покровным стеклом большего размера и исследовали методом люминесцентной микроскопии. Число адгезированных клеток определяли прямым подсчетом в ЛЮМ-микроскопе (МЛД-1) при увеличении 90×7.
Результаты исследования и их обсуждение
На первом этапе работы были использованы взвеси холерных вибрионов в концентрации 10 1 –10 2 м.к./мл. Рис. 2 визуально иллюстрирует прямо пропорциональную зависимость между экспозицией нахождения покровных стекол (4, 10, 20 ч) в опытных пробах, концентрацией холерных вибрионов в образовавшихся биопленках (отпечатки) и в планктонной части проб (изолированные колонии и сливной рост).
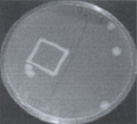
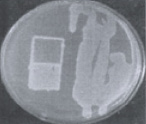
через 4 часа через 10 часов через 20 часов
Рис. 2. Результаты отпечаток на агаре Мартена покровных стекол и высевов планктонной части культуры холерных вибрионов (V. choleraе Еl Тor Р-5392)
С первого дня эксперимента холерные вибрионы адгезировались на поверхности покровных стекол в виде отдельных клеток, цепочек и небольших скоплений. Возможно, эта стадия соответствует стадии 1, описанной в литературе, когда твердая поверхность покрывается первичной пленкой, или как стадия 2 – собственно микробная адгезия, когда микроорганизмы обратимо прикрепляются к твердой поверхности (рис. 3, а, б). Взаимодействие структур на поверхности микроорганизмов и твердого субстрата обусловлено, по-видимому, неспецифическими физико-химическими силами [13, 3]. Нельзя исключить и определенной роли двигательной активности холерных вибрионов, поскольку подвижные клетки активно перемещаются по направлению к поверхностям и окончательно удерживаются притягивающими силами, действующими вблизи поверхности [9].
Исследования в динамике показали, что к четвертым суткам на покровных стеклах скопления состояли из клеток с сохраненной подвижностью, а также скоплений из слипшихся друг с другом клеток, между которыми находилось аморфное вещество, по-видимому, это экзополисахарид, такие структуры занимали всю площадь покровных стекол (рис. 3, в). Описанная картина, согласно литературным данным, характеризует третью стадию, в свою очередь, состоящую из нескольких этапов и по времени занимающую от нескольких часов до четырех суток [12, 14]. Клетки сохраняют способность к передвижению по поверхности стекла и формируют внеклеточный матрикс. Затем клетки холерных вибрионов склеиваются друг с другом, образуя скопления разных размеров, расположенные в один слой. В этот период обратной адгезии клеток не происходит, об этом свидетельствует уменьшение свободных мест на покровных стеклах. Образование матрикса – между клетками способствует их склеиванию друг с другом и образованию слоев, из которых формируются объемные фигуры.
а б в г
Рис. 3. Оценка формирования на покровных стеклах биопленок холерных вибрионов на разных стадиях V. choleraе Еl Тor Р-5392 (увеличение 7×90, окраска АО 20 мкг/мл): а – 1 стадия; б – 2 стадия; в – 3 стадия; г – 4 стадия
Аналогичное описание приводится в литературе, как 4 стадия – вторичных колонизаторов. Микроорганизмы прикрепляются к тем, которые уже сформировали биопленку, на этой же стадии формируются полости, каналы, выросты, поры [15].
Продолжение исследований позволило установить, что в течение следующих двух месяцев микроскопические препараты отличались количеством скоплений клеток и их ростом, как в ширину, так и в высоту, между скоплениями образовывались свободные места в виде дорожек. В планктонной части опытных и контрольных проб концентрация холерных вибрионов через два месяца от начала эксперимента снизилась на два порядка и составляла 10 4 КОЕ/мл.
Экспериментальные данные свидетельствовали, что все токсигенные штаммы холерных вибрионов образовывали биопленки поэтапно. Адгезия к покровным стеклам (1–2 стадия) проходила в течение первых трех суток. Однако дальнейшие стадии биопленок проходили с разной скоростью. Формирование скоплений и вещества между клетками (третья стадия), с последующим формированием дорожек и многослойности (4 стадия) в основном (у 14 штаммов из них 8 – V. choleraе Еl Тor и 6 – V. choleraе O139) наблюдалось на 4–7 сутки. Исключение составили штаммы, сформировавшие биопленку четвертой стадии к третьим суткам (V. choleraе Еl Тor 18210 и V. choleraе O139 17259). Штаммы, не сформировавшие к 21 дню (срок наблюдения) четвертую стадию биопленки, V. choleraе Еl Тor 18336 и V. choleraе O139 16064, 16486, 16070. У штамма V. choleraе Еl Тor 18337 произошла только стадия адгезии. Ряд штаммов образовал четвертую стадию биопленки на второй неделе: V. choleraе Еl Тor 18335, 18338 и V. choleraе O139 16485, 16073 и один штамм на третьей неделе V. choleraе O139 16075. В течение срока наблюдения пятой стадии (регрессии биопленки) не наблюдалось.
На втором этапе мы увеличили концентрацию холерных вибрионов до 10 6 –10 8 м·кл./мл.
Для исследования динамики процессов не только адгезии холерных вибрионов к поверхности покровных стекол, но и их размножения в планктонной пробе, через 6, 9, 24, 48 часов, далее 1 раз в неделю, 1 раз в месяц исследовали покровные стекла, как описано выше, и делали высевы по 0,1 мл на пластины с агаром Мартена.
Начиная с 6 часов (начальный срок наблюдения) покровные стекла, извлеченные из всех проб, были покрыты налетом и выглядели мутными. Эти данные позволили предположить, что первая стадия образования биопленки происходит сразу после внесения культуры микроорганизмов. В микроскопических препаратах присутствовали подвижные и неподвижные палочковидные клетки зеленого и оранжевого цветов, цепочки клеток и скопления из 4–10 клеток. Как было отмечено выше, это вторая стадия – собственно микробная адгезия, когда микроорганизмы обратимо прикрепляются к твердой поверхности. В конце первой недели во всех экспериментальных пробах биопленки соответствовали 3–4 стадиям, в течение второй недели во всех исследуемых пробах – четвертой стадии.
В течение второго и к концу третьего месяцев (срок наблюдения) концентрация холерных вибрионов в планктонных пробах, как в экспериментальных, так и в контрольных, оставалась в пределах 2•10 5 –4•10 6 КОЕ/мл. На покровных стеклах в этот же период биопленки сохраняли свою многомерную/многослойную структуру с пустыми местами в виде дорожек.
Концентрация клеток холерных вибрионов в биопленках, формирующихся на покровных стеклах во всех экспериментальных пробах, не поддавалась подсчету, так как в отпечатках покровных стекол на пластинах агара Мартена наблюдался сливной рост.
Таким образом, при использовании разработанного нами способа во всех экспериментальных системах регистрировались одни и те же стадии формирования холерными вибрионами биопленок на твердых субстратах:
Заключение
Итогом проведенных исследований является разработка способа для изучения способности к формированию биопленок холерными вибрионами как III, так и II группы патогенности. Предлагаемая схема исследования соответствует режимным требованиям и сводит к минимуму риск контаминации возбудителем окружающего пространства. Кроме того, использование сконструированного нами специального устройства позволяет проследить динамику образования биопленок в одной пробе, а также одновременно проводить микроскопию и получать рост культуры либо непосредственно из отпечатков на агаре, либо после обогащения в пептонной воде, что значительно повышает достоверность получаемых результатов.
Рецензенты:
Холера xe "Холера" — антропонозное, особо опасное острое карантинное инфекционное заболевание, протекающее с тяжёлой диареей, рвотой, приводящими к обезвоживанию организма.
Этиология. Возбудитель — подвижная грамотрицательная бактерия Vibrio cholerae (холерный вибрион, или запятая Коха). Выделяют 3 типа возбудителей — V. cholerae asiaticae (возбудитель классической холеры), V. cholerae eltor (возбудитель холеры Эль-Тор) и серовар О139 (Бенгал) (возбудитель холеры в Юго-Восточной Азии). Подвижность бактерий весьма выражена, и её определение (методом висячей или раздавленной капли) — важный диагностический признак. Деление клеток происходит очень быстро и на щелочной пептонной воде возбудитель даёт видимый невооружённым глазом рост уже через 6 ч. Быстро погибает при кипячении в кислой среде.
Эпидемиология. Холера — типичная кишечная инфекция. Единственный природный резервуар — больные и бактерионосители, основные пути передачи — водный и пищевой, реже контактно-бытовой. Факторы передачи: пищевые продукты, вода, объекты окружающей среды. Определённую роль играют мухи, способные переносить возбудитель с испражнений на пищевые продукты. Несмотря на то, что выделение возбудителя в окружающую среду происходит в течение короткого времени, большое число скрытых форм поддерживает циркуляцию возбудителя. Единственный исторический эндемичный очаг холеры — дельта Ганга и Брахмапутры. Выделяют 2 типа эпидемий холеры: эпидемии-вспышки с едиными источником инфекции и путями распространения, характеризующихся одномоментным появлением большого числа больных, и вялотекущие эпидемии с небольшой постоянной заболеваемостью и трудно выявляемыми путями передачи возбудителя. В большинстве случаев подъём заболеваемости наблюдают в тёплое время года.
Патогенез. В организме человека большая часть вибрионов погибает под действием кислой среды желудка, и лишь их небольшая часть достигает тонкой кишки. В ответ на проникновение бактерий кишечный эпителий выделяет щелочной секрет, насыщенный жёлчью (жёлчь — идеальная среда для размножения возбудителя). Клинические проявления холеры обусловлены образованием экзотоксинов • Экзотоксин (холероген) — термолабильный белок, молекула токсина включает 2 компонента: компонент В взаимодействует с моносиаловым ганглиозидным рецептором, что обусловливает проникновение в клетку компонента А. Компонент А составляют субъединица А1 (активный центр) и субъединица А2, связывающая оба компонента. Субъединица А1 катализирует рибозилирование гуанилзависимого компонента аденилат циклазы, приводит к повышению внутриклеточного содержания циклического 3,5-аденозинмонофосфата и выходу жидкости и электролитов из клеток либеркюновых желёз в просвет кишечника. Токсин не способен реализовать своё действие на любых других клетках. Бактерии серовара О139 также продуцируют экзотоксин с аналогичными свойствами, но в меньших количествах; токсинообразование кодируют как хромосомные, так и плазмидные гены • Определённую роль в поражениях, вызываемых биотипом Эль-Тор, играют гемолизины.
Клиническая картина
• Инкубационный период продолжается от нескольких часов до 5 дней (чаще 2–3 дня).
• У большинства инфицированных лиц заболевание протекает бессимптомно, либо возможна лёгкая диарея. Соотношение тяжёлых поражений к количеству стёртых проявлений для классической холеры — 1:5–1:10, для холеры Эль-Тор — 1:25–1:100.
• Клинически выраженные случаи характеризуются общим недомоганием, рвотой и развитием выраженного диарейного синдрома, отсутствием интоксикации (температура тела не повышается). Для последнего характерно выделение значительного количества (до 10 л/сут) водянистых, бесцветных испражнений. Другая характерная черта — сладковатый, рыбный (но не фекальный) запах испражнений.
• Тяжёлые случаи болезни обусловлены развитием обезвоживания: у больных резко снижается диурез с развитием ОПН. Характерна охриплость голоса или афония. Ведущий патогенетический фактор — гиповолемия и дефицит электролитов. Как следствие развиваются артериальная гипотензия, коронарная недостаточность, нарушение сознания и гипотермия. Подобное состояние определяют как холерный алгид (Алгид — симптомокомплекс, обусловленный обезвоживанием организма (потеря натрия хлорида, калия, бикарбонатов): гипотермия, гемодинамические расстройства, анурия, тонические судороги, выраженная одышка). Отмечают характерное проявление — facies hippocratic a (запавшие глаза, заострённые черты лица с резко выступающими скулами). Продолжительность проявлений зависит от своевременно начатого, адекватно проводимого лечения и варьирует от нескольких часов до нескольких дней. При отсутствии лечения летальность больных в алгидной стадии может достигать 60%.
• Выздоровление сопровождается выработкой непродолжительного иммунитета, нередко отмечают случаи повторного заражения.
Методы исследования • Выделение и идентификация возбудителя; цели исследований — выявление больных и бактерионосителей, установление окончательного диагноза при исследовании погибших, контроль за эффективностью лечения больных и санации носителей, контроль над объектами внешней среды и эффективностью дезинфекционных мероприятий. Материалы для исследования — испражнения, рвотные массы, жёлчь, секционный материал (фрагменты тонкой кишки и жёлчный пузырь), постельное и нательное бельё, вода, ил, сточные воды, гидробионты, смывы с объектов окружающей среды, пищевые продукты, мухи и др. Наиболее объективные результаты даёт исследование проб, взятых до начала антибактериальной терапии • Анализ крови — признаки дегидратации (ацидоз, гипокалиемия, гипонатриемия, гипохлоремия, гипогликемия, полицитемия, незначительный нейтрофильный лейкоцитоз).
Дифференциальную диагностику проводят с различными тяжёлыми диареями (например, вызванными видами S almonella , E. coli или энтеропатогенными вирусами), отравлением грибами, мышьяком.
Лечение • Этиотропная терапия •• Взрослым и детям старше 8 лет — доксициклин по 300 мг 1 р/сут, либо по 100 мг 2 р/сут или тетрациклин по 50 мг/кг/сут в течение 3 дней. В качестве альтернативного препарата возможно использование ципрофлоксацина в среднетерапевтической дозировке •• Детям до 8 лет — ко-тримоксазол (по 4 мг/кг триметоприма и 20 мг/кг сульфаметоксазола каждые 12 ч) или фуразолидон 5–10 мг/кг/сут в 4 приёма через 6 ч в течение 3 дней •• Беременным — фуразолидон по 100 мг 4 р/сут в течение 7–10 дней • Возмещение потери жидкости и электролитов в соответствии со степенью обезвоживания больного •• При лёгкой и среднетяжёлой формах — пероральная регидратация (р-р регидратационной соли [натрия хлорида 3,5 г, калия хлорида 1,5 г, глюкозы 20 г, тринатрия цитрата 2,9 г в 1 л воды], глюкосолана или цитраглюкосолана) •• При тяжёлой форме — введение солевых р-ров в/в (натрия ацетат+натрия хлорид+калия хлорид).
Синонимы • Азиатская холера • Эпидемическая холера • Диарея рисовым отваром
МКБ-10 • A00 Холера
Код вставки на сайт
Холера xe "Холера" — антропонозное, особо опасное острое карантинное инфекционное заболевание, протекающее с тяжёлой диареей, рвотой, приводящими к обезвоживанию организма.
Этиология. Возбудитель — подвижная грамотрицательная бактерия Vibrio cholerae (холерный вибрион, или запятая Коха). Выделяют 3 типа возбудителей — V. cholerae asiaticae (возбудитель классической холеры), V. cholerae eltor (возбудитель холеры Эль-Тор) и серовар О139 (Бенгал) (возбудитель холеры в Юго-Восточной Азии). Подвижность бактерий весьма выражена, и её определение (методом висячей или раздавленной капли) — важный диагностический признак. Деление клеток происходит очень быстро и на щелочной пептонной воде возбудитель даёт видимый невооружённым глазом рост уже через 6 ч. Быстро погибает при кипячении в кислой среде.
Эпидемиология. Холера — типичная кишечная инфекция. Единственный природный резервуар — больные и бактерионосители, основные пути передачи — водный и пищевой, реже контактно-бытовой. Факторы передачи: пищевые продукты, вода, объекты окружающей среды. Определённую роль играют мухи, способные переносить возбудитель с испражнений на пищевые продукты. Несмотря на то, что выделение возбудителя в окружающую среду происходит в течение короткого времени, большое число скрытых форм поддерживает циркуляцию возбудителя. Единственный исторический эндемичный очаг холеры — дельта Ганга и Брахмапутры. Выделяют 2 типа эпидемий холеры: эпидемии-вспышки с едиными источником инфекции и путями распространения, характеризующихся одномоментным появлением большого числа больных, и вялотекущие эпидемии с небольшой постоянной заболеваемостью и трудно выявляемыми путями передачи возбудителя. В большинстве случаев подъём заболеваемости наблюдают в тёплое время года.
Патогенез. В организме человека большая часть вибрионов погибает под действием кислой среды желудка, и лишь их небольшая часть достигает тонкой кишки. В ответ на проникновение бактерий кишечный эпителий выделяет щелочной секрет, насыщенный жёлчью (жёлчь — идеальная среда для размножения возбудителя). Клинические проявления холеры обусловлены образованием экзотоксинов • Экзотоксин (холероген) — термолабильный белок, молекула токсина включает 2 компонента: компонент В взаимодействует с моносиаловым ганглиозидным рецептором, что обусловливает проникновение в клетку компонента А. Компонент А составляют субъединица А1 (активный центр) и субъединица А2, связывающая оба компонента. Субъединица А1 катализирует рибозилирование гуанилзависимого компонента аденилат циклазы, приводит к повышению внутриклеточного содержания циклического 3,5-аденозинмонофосфата и выходу жидкости и электролитов из клеток либеркюновых желёз в просвет кишечника. Токсин не способен реализовать своё действие на любых других клетках. Бактерии серовара О139 также продуцируют экзотоксин с аналогичными свойствами, но в меньших количествах; токсинообразование кодируют как хромосомные, так и плазмидные гены • Определённую роль в поражениях, вызываемых биотипом Эль-Тор, играют гемолизины.
Клиническая картина
• Инкубационный период продолжается от нескольких часов до 5 дней (чаще 2–3 дня).
• У большинства инфицированных лиц заболевание протекает бессимптомно, либо возможна лёгкая диарея. Соотношение тяжёлых поражений к количеству стёртых проявлений для классической холеры — 1:5–1:10, для холеры Эль-Тор — 1:25–1:100.
• Клинически выраженные случаи характеризуются общим недомоганием, рвотой и развитием выраженного диарейного синдрома, отсутствием интоксикации (температура тела не повышается). Для последнего характерно выделение значительного количества (до 10 л/сут) водянистых, бесцветных испражнений. Другая характерная черта — сладковатый, рыбный (но не фекальный) запах испражнений.
• Тяжёлые случаи болезни обусловлены развитием обезвоживания: у больных резко снижается диурез с развитием ОПН. Характерна охриплость голоса или афония. Ведущий патогенетический фактор — гиповолемия и дефицит электролитов. Как следствие развиваются артериальная гипотензия, коронарная недостаточность, нарушение сознания и гипотермия. Подобное состояние определяют как холерный алгид (Алгид — симптомокомплекс, обусловленный обезвоживанием организма (потеря натрия хлорида, калия, бикарбонатов): гипотермия, гемодинамические расстройства, анурия, тонические судороги, выраженная одышка). Отмечают характерное проявление — facies hippocratic a (запавшие глаза, заострённые черты лица с резко выступающими скулами). Продолжительность проявлений зависит от своевременно начатого, адекватно проводимого лечения и варьирует от нескольких часов до нескольких дней. При отсутствии лечения летальность больных в алгидной стадии может достигать 60%.
• Выздоровление сопровождается выработкой непродолжительного иммунитета, нередко отмечают случаи повторного заражения.
Методы исследования • Выделение и идентификация возбудителя; цели исследований — выявление больных и бактерионосителей, установление окончательного диагноза при исследовании погибших, контроль за эффективностью лечения больных и санации носителей, контроль над объектами внешней среды и эффективностью дезинфекционных мероприятий. Материалы для исследования — испражнения, рвотные массы, жёлчь, секционный материал (фрагменты тонкой кишки и жёлчный пузырь), постельное и нательное бельё, вода, ил, сточные воды, гидробионты, смывы с объектов окружающей среды, пищевые продукты, мухи и др. Наиболее объективные результаты даёт исследование проб, взятых до начала антибактериальной терапии • Анализ крови — признаки дегидратации (ацидоз, гипокалиемия, гипонатриемия, гипохлоремия, гипогликемия, полицитемия, незначительный нейтрофильный лейкоцитоз).
Дифференциальную диагностику проводят с различными тяжёлыми диареями (например, вызванными видами S almonella , E. coli или энтеропатогенными вирусами), отравлением грибами, мышьяком.
Лечение • Этиотропная терапия •• Взрослым и детям старше 8 лет — доксициклин по 300 мг 1 р/сут, либо по 100 мг 2 р/сут или тетрациклин по 50 мг/кг/сут в течение 3 дней. В качестве альтернативного препарата возможно использование ципрофлоксацина в среднетерапевтической дозировке •• Детям до 8 лет — ко-тримоксазол (по 4 мг/кг триметоприма и 20 мг/кг сульфаметоксазола каждые 12 ч) или фуразолидон 5–10 мг/кг/сут в 4 приёма через 6 ч в течение 3 дней •• Беременным — фуразолидон по 100 мг 4 р/сут в течение 7–10 дней • Возмещение потери жидкости и электролитов в соответствии со степенью обезвоживания больного •• При лёгкой и среднетяжёлой формах — пероральная регидратация (р-р регидратационной соли [натрия хлорида 3,5 г, калия хлорида 1,5 г, глюкозы 20 г, тринатрия цитрата 2,9 г в 1 л воды], глюкосолана или цитраглюкосолана) •• При тяжёлой форме — введение солевых р-ров в/в (натрия ацетат+натрия хлорид+калия хлорид).
Синонимы • Азиатская холера • Эпидемическая холера • Диарея рисовым отваром

Этиология. Возбудителем является холерный вибрион – Vibrio cholerae. Имеет вид изогнутых палочек размерами 1,5-3,0 мкм в длину и 0,2-0,6 мкм в ширину. За счет полярно расположенного жгутика обладает подвижностью. Представляет грамотрицательный, аэроб, спор и капсул не образует. Возбудитель холеры подразделяется на 2 биовара: 1) классический – Vibrio cholerae asiaticae; 2) Эль-Тор – Vibrio cholerae eltor. Существует мнение, что между биоварами нет существенных различий. Холерные вибрионы содержат соматические термостабильные О-антигены и жгутиковые термолабильные Н-антигены. Оба биовара по О-антигену подразделяются на 3 серологических варианта: Огава, Инаба, Гикошима. На основании чувствительности к холерным фагам выделяют 8 фаговаров классического вибриона и вибриона Эль-Тор. Холерные вибрионы обладают несколькими токсическими субстанциями. При разрушении возбудителей образуется термостабильный эндотоксин. Вирулентность в значительной мере связана с продукцией термолабильного экзотоксина. По способности к продукции экзотоксина популяция холерного вибриона весьма разнородна и в ней выделяются как высокотоксигенные, так и нетоксигенные вибрионы. Для вибрионов Эль-Тор характерной является высокая вибриоциногенность, т. е., способность продуцировать вещества (вибриоцины), обладающие бактерицидными свойствами в отношении энтеробактерий. Это свойство обеспечивает высокую антагонистическую активность вибрионов Эль-Тор и дает им селективные преимущества для выживания в микробных ассоциациях. В последние годы все чаще выделяются холерные вибрионы, обладающие устойчивостью к антибиотикам.
Во внешней среде холерные вибрионы сохраняются в течение различного времени. При комнатной температуре в мясных, рыбных продуктах и на поверхности овощей возбудитель обнаруживается от 2 до 5 суток. При благоприятных температурных условиях и реакции среды холерные вибрионы в мясных и молочных продуктах не только сохраняются, но и размножаются. В условиях рассеянного дневного С на поверхности арбузов и помидоров°света при температуре 20-26 вибрионы Эль-Тор отмирают через 8 ч.. В воде открытых водоемов возбудитель холеры способен переживать несколько месяцев. Губительное действие оказывают на вибрионов высушивание, кипячение (погибают через несколько секунд), кислая среда и дезинфицирующие средства в обычных концентрациях.
Среди холерных вибрионов выделяются вибрионы, не агглютинирующиеся специфической противохолерной сывороткой. Такие вибрионы определяются как Vibrio cholerae, не относящиеся к группе О1.
Эти же вибрионы называются неагглютинирующимися вибрионами (НАГ-вибрионами). НАГ-вибрионы подразделяются на 90 сероваров, отдельные из которых (О5, О8, О9, О17, О34, О47, О50, O139) способны вызывать холероподобные заболевания. Особое место среди НАГ-вибрионов занимает Vibrio cholerae О139, который является причиной не только спорадических случаев, но и крупных вспышек.
Эпидемическую значимость имеет парагемолитический вибрион Vibrio parahaemolyticus, являющийся этиологическим агентом двух клинических синдромов – дизентериеподобного и холероподобного. Заболевания протекают, как правило, доброкачественно и в течение трех дней заканчиваются выздоровлением.
Механизм развития эпидемического процесса. Источник инфекции. Холера является классической антропонозной инфекцией, при которой единственным источником инфекции является человек – больной или вибриононоситель. Больной становится заразным с начала заболевания и наибольшее количество возбудителя выделяется в первые 4-5 дней, что связано с обильным жидким стулом. При заболевании холерой, обусловленной классическим холерным вибрионом, в подавляющем большинстве случаев (до 99%) освобождение от возбудителя наступает через 15-20 дней от начала болезни. Лишь в 1% случаев классический холерный вибрион выделяется свыше одного месяца. Больные холерой Эль-Тор от возбудителя освобождаются гораздо медленнее и впоследствии от переболевших этой инфекцией вибрионы могут выделяться в течение нескольких лет. При холере Эль-Тор в структуре источников инфекции количественно доминируют больные стертыми атипичными формами и здоровые вибриононосители. В прошлом при классической холере соотношение больных и вибриононосителей составляло 5:1, в настоящее время в регионах распространения холеры Эль-Тор это соотношение колеблется от 1:10 до 1:100. Активность и поздняя выявляемость больных с легкими клиническими формами и вибриононосителей существенно повышают их эпидемическую значимость как источников инфекции при холере Эль-Тор.
Механизм передачи. Местом первичной локализации холерных вибрионов в организме человека является кишечник. Этой локализации соответствует фекально-оральный механизм передачи. В качестве факторов передачи выступают пищевые продукты, предметы обихода и вода. Эпидемиологические наблюдения свидетельствуют о том, что из пищевых продуктов наибольшее значение в передаче инфекции имеют изделия из рыбы, моллюски, устрицы, креветки, молоко и молочные продукты, кондитерские изделия. Бытовой фактор (предметы обихода) способствует распространению холерных вибрионов: при уходе за больным холерой; в коллективах, находящихся в неблагоприятных санитарно-гигиенических условиях (теснота, скученность, отсутствие водопровода и канализации и т.д.); среди лиц, не соблюдающих санитарно-гигиенические правила (пациенты учреждений психиатрического профиля, домов престарелых и т.д.). Наиболее значимым фактором передачи возбудителя холеры является вода открытых водоемов. Ведущая роль водного фактора передачи определяется многими обстоятельствами, важнейшие из которых: холерные вибрионы неизбежно попадают в открытые водоемы в составе сточных жидкостей; отмечается высокая устойчивость вибрионов Эль-Тор в водной среде; происходит интенсивное загрязнение воды открытых водоемов поверхностно-активными веществами, сдвигающими рН среды в щелочную сторону (благоприятную для вибрионов); вибрионы попадают в организм рыб, устриц, моллюсков и других обитателей водоемов, что способствует сохранению их жизнеспособности в течение длительного времени; наблюдается трансформация вибрионов в L-формы (при температуре С), существенно повышающая их возможности противостояния°воды ниже 18 неблагоприятным факторам окружающей среды.
В результате анализа информации следует определить риск завоза и распространения холеры на территории. На этом же этапе оценивают готовность медицинской службы к проведению противохолерных мероприятий, а также выявляют недостатки в профилактической работе и разрабатывают мероприятия по их устранению.
- выезжал ли больной (вибрионоситель) в течение последних 5 дней (куда, когда);
- кто, когда, откуда приезжал к больному (вибрионосителю) в течение последних 5 дней;
- прием антибиотиков и других химиотерапевтических препаратов до госпитализации (когда, длительность приема);
- имелись ли случаи аварий на водопроводной сети, перебоев в подаче воды, нестандартных по санитарно-микробиологическим показателям проб воды, на каком конкретном участке и когда;
- пользовался ли больной (вибрионоситель) водой поверхностных водоемов на протяжении последних 5 дней (наименование водоема, места, когда, характер водопользования);
- количество изолированных, находящихся под медицинским наблюдением из числа контактировавших и находившихся в одинаковых условиях по риску инфицирования (по датам начала и окончания наблюдения);
- результаты лабораторного обследования контактных.
В очаге холеры осуществляется оперативный эпидемиологический анализ эпидемической обстановки (единичные случаи, эпидемическая вспышка, эпидемия) от момента его возникновения до ликвидации.
Очаг считается локализованным через 10 дней после госпитализации последнего больного (вибрионосителя) и проведения заключительной дезинфекции. Госпитали, провизорные госпитали для больных холерой (вибрионосителей) и бактериологические лаборатории, в которых проводятся исследования материала от больных, продолжают работу до выписки последнего больного (вибрионосителя). Очаг считается ликвидированным после выписки последнего больного холерой (вибрионосителя) и проведения заключительной дезинфекции в стационаре.
Оперативный эпидемиологический анализ проводят с целью выяснения возможных путей завоза холеры в населенный пункт, причин и условий, способствующих возникновению местных случаев, установления действующих путей распространения и факторов передачи возбудителя инфекции, а также для обоснования тактики и объема профилактических и санитарно-противоэпидемических мероприятий, направленных на локализацию и ликвидацию очага, оценки их эффективности.
Результаты эпидемиологического анализа оформляются в виде объяснительной записки с графиками, таблицами, картами, докладываются ежедневно в КЧС и являются основанием для внесения соответствующих корректив в направленность, объем и организацию санитарно-противоэпидемических мероприятий..
Руководители территориальных организаций здравоохранения на основании результатов оперативного эпидемиологического анализа в очаге холеры разрабатывают на период после ликвидации очага комплекс мероприятий, направленных на устранение причин возможного возникновения эпидемических осложнений и оформляют их совместным приказом. В комплексный план по санитарной охране территории вносят соответствующие коррективы.
До получения результатов определения степени токсигенности культур холерных вибрионов, выделенных из объектов окружающей среды, проводится комплекс мероприятий, предусмотренных при выделении токсигенных культур холерных вибрионов.
Обеспечивается активное выявление больных острыми кишечными инфекциями на этапах оказания медицинской помощи.
Проводится эпидемиологическое обследование с целью выяснения причин контаминирования объектов окружающей среды.
Проводится однократное бактериологическое обследование на холеру всех больных острыми кишечными инфекциями, находящихся на стационарном лечении и оставленных на дому.
Исследование на холеру проб из объектов окружающей среды проводится не реже двух раз в неделю до 3-х последовательных отрицательных анализов.
Усиливается контроль за соблюдением санитарных норм и правил на водопроводных и канализационных сооружениях, в местах массового отдыха, на предприятиях пищевой промышленности, общественного питания и торговли пищевыми продуктами, в детских дошкольных, оздоровительных, лечебно-профилактических учреждениях и т.п.
Временно запрещается использование для питьевых целей воды непосредственно из водоема, запрещается купание и рыбная ловля на контаминированном участке водоема на срок, определяемый территориальными ЦГЭ, в зависимости от конкретных санитарно-гигиенических условий и эпидемической обстановки.
Читайте также:

