Посев это в биологии
Обновлено: 07.07.2024
ПОСЕ́В, 1) сев, равномерное размещение посевного материала в верхнем слое почвы для прорастания, важнейший агротехнич. приём при возделывании многих с.-х. культур. Способы П. и его глубину выбирают с учётом требований с.-х. культур к величине площади питания, влагообеспеченности, освещённости, а также необходимости механизировать уход за посевами (обработка междурядий). Различают разбросные и рядовые способы П. Разбросные способы наиболее древние. Суть их в том, что семена распределяют на поверхности почвы более или менее равномерно путём разбрасывания, а заделку в почву производят спец. орудиями. Разбросной П. бывает ручным и машинным, осуществляемый сеялками , без заделки в почву, или с помощью авиации (рассев семян с невысоко летящего самолёта). Недостатки разбросного способа П.: необходимость заделки семян после их разбрасывания; неравномерность распределения семян в глубину и по поверхности почвы (вследствие чего появление всходов и созревание растений происходят неравномерно); высокие нормы П. Разбросной способ используют при П. очень мелких семян некоторых газонных и кормовых трав с последующей заделкой их в почву боронами или катками.
Сухие семена находятся в состоянии покоя. Для того чтобы семя начало прорастать, внутрь него должна проникнуть вода. Когда семя набухнет, то зародыш начнёт развиваться, так как потреблять питательные вещества он может только в виде раствора.
3. Чем объяснить гибель семян в кипячёной воде?
В кипячёной воде отсутствует растворённый кислород. Зародышу становится нечем дышать и он погибает, а семя загнивает.
4. Почему семена надо высевать в рыхлую почву?
В хорошо прорыхлённой почве имеется большое количество кислорода. Это благотворно влияет на прорастание семени, поскольку в этот период зародыш энергично дышит и ему требуется постоянный приток кислорода.
5. Почему семена разных растений высевают в разные сроки?
Для прорастания семян различных растений требуются различные условия окружающей среды: температура, влажность и т.д. Если посадить растение раньше или позже наступлений этих условий, то у семян может снизиться всхожесть, в у выросших растений — урожайность.
6. Какие теплолюбивые и холодостойкие растения выращивают в вашем районе?
В Средней полосе России очень распространено выращивание растений:
- теплолюбивых: томатов, огурцов, кукурузы, дыни, тыквы и фасоли;
- холоднолюбивых: гороха, редиса, ржи, пшеницы, ячменя и овса.
7. Какие семена — лука или гороха — глубже заделывают в почву при посеве и почему?
Семена лука рекомендуется сеять на глубину 1 — 2 см, а семена гороха — на глубину 4 — 5 см. То есть горох надо сеять глубже, чем семена лука.
Это связано с тем, что глубина заделки зависит от размера семян и свойств почвы. В крупных семенах достаточно питательных веществ, и ростки не погибают, пробиваясь с большой глубины в течение долгого времени.
8. Почему в песчаную почву семена высевают глубже, чем в глинистую?
Воздух в песчаной почве проникает га большую глубину, а влага лучше сохраняется с более глубоких слоях. Поэтому в песчаной почве семена сажают поглубже, где есть и воздух и вода.
На глиняных почвах, наоборот, воздух может проникнуть только в самые верхние слои, а в более глубоких слоях наблюдается не только недостаток воздуха, но и избыток влаги. Поэтому на глиняных почвах семена сажают как можно ближе к поверхности — влаги там достаточно и кислород также может поступать постоянно.
9. Как будет развиваться проросток фасоли, лишённый одной или двух семядолей?
Проросток фасоли, лишённый одной, сначала будет развиваться также, как и обычные проростки фасоли, но буквально через несколько дней рост проростка замедлится или вовсе прекратиться. Дело в том, что проросток очень быстро начнет страдать от нехватки питательных веществ, которые должны поступать к нему из отсутствующей семядоли. Без этих питательных веществ растение либо будет очень чахлым, либо вовсе погибнет.
При отсутствии обеих семядолей растение всегда погибает, причем практически сразу. Это происходит потому, что у зародыша нет запаса питательных веществ, необходимых ему для роста и жизни.
10. Почему для посева отбирают крупные семена?
В крупных семенах находится больший запас питательных веществ, необходимых зародышу для развития. Именно поэтому из самых крупных семян развиваются самые крепкие и здоровые растения.
Подумайте
1. В живых клетках растений постоянно происходит обмен веществ и энергии. Проанализируйте рисунок 88. Какой вывод вы можете сделать? Обсудите ваш вывод с остальными учащимися класса.
Каждое растение постоянно взаимодействует с окружающей его средой и в нём постоянно происходят процессы обмена веществ и энергии, которые необходимы для обеспечения жизнедеятельности растения.
Например, корни растения высасывают из почвы воду с растворёнными в ней минеральными веществами. Эта вода питает растение, наполняет его клетки жизнью и участвует в процессе дыхания и фотосинтеза. В свою очередь корни получают от листьев растения запас питательных веществ, который позволяет им расти и развиваться.
Стебель растения служит опорой и главной транспортной магистралью, по которой вода с минеральными и питательными веществами перемещается от одной части растения к другой. При этом от корней стебель получает воду, а от листьев — питательные вещества.
Листья растения — это место где происходят процессы дыхания и фотосинтеза. Но без поступающих от других частей растения воды, минеральных веществ и кислорода прохождение этих процессов было бы не возможно. В свою очередь только в листьях под воздействием солнечных лучей и при помощи воды углекислый газ может преобразовываться в кислород, а кислород и вода — в органические питательные вещества, которые необходимы всем частям растения.
Цветы, семена и плоды — также важный участник обмена веществ, поскольку они позволяют продолжить произрастание вида и расширить территорию его произрастания.
Вывод: Обмен веществ в растении — это совокупность всех происходящих в нем процессов, необходимых для обеспечения жизнедеятельности как целого растения, так и его отдельных частей.

2. Что необходимо учитывать при посеве семян разных видов растений?
При посеве семян обязательно необходимо создать наиболее благоприятные для прорастания конкретного растения условия. А именно, обеспечить комфортную температуру окружающей среды, достаточно и не избыточное количество воды и постоянный приток воздуха .
Задания
Положите семена фасоли и зерновки пшеницы в банку с увлажнёнными опилками и следите за их прорастанием. По мере необходимости увлажняйте опилки водой; чтобы проростки не пересыхали. Каждый день вынимайте из опилок по одному проростку фасоли и пшеницы и засушивайте их, записывая, сколько дней проростку. Через 15—18 суток опыт прекратите, а из засушенных проростков сделайте коллекцию, показывающую рост и развитие проростков.

Коллекция проростков гороха

Коллекция проростков зерновки пшеницы
Задания для любознательных
Перед посевом важно знать всхожесть семян.
Возьмите пробы в 100 семян зерновок пшеницы, ржи или кукурузы. Разложите их на специальных керамических пластинах или в тарелках на влажной тряпочке или фильтровальной бумаге. Накройте пластины стеклом, чтобы влага не испарялась, и поместите их в тёплое место.
Подсчитайте, сколько семян прорастёт за первые 10 дней. Эта цифра и есть процент всхожести. Нормальная всхожесть семян для посева не должна быть ниже 95%. Определите всхожесть семян, которые вы будете высевать на пришкольном участке.
Растение
Процент всхожести семян
Фенологические наблюдения
Проведите наблюдения за весенними явлениями в жизни растений.
Весна — пора пробуждения растений (рис. 89). В природе она вступает в свои права с началом сокодвижения у растений. Это первый признак весны. Раньше, чем у других деревьев, начинается весеннее сокодвижение у клёна остролистного, чуть позднее — у берёзы. Отметьте, когда началось сокодвижение у этих растений в вашей местности.
Цветение ветроопыляемых деревьев и кустарников — второй признак весны. В средней полосе европейской части страны первой зацветает ольха (рис. 90). Цветки её невзрачны, но распустившиеся серёжки из тычиночных цветков хорошо заметны. Почти одновременно с ольхой зацветают орешник, мать-и-мачеха. Запишите в тетрадь, когда зацвели эти растения. Какова продолжительность цветения этих растений в вашей местности? Ранней весной цветут многолетние травянистые растения лиственного леса. Они часто зацветают до того, как сойдёт снег, поэтому их называют подснежниками. Все они светолюбивы и цветут под пологом леса, когда на деревьях и кустарниках ещё нет листвы. Выясните, какие раннецветущие растения (первоцветы) растут в вашей местности.
Наблюдая за жизнью растений в природе, составьте календарь весны для своей местности. Запишите в календаре сроки цветения ольхи, мать-и-мачехи, орешника и раннецветущих многолетних растений — подснежников. Затем запишите сроки распускания листьев у берёзы и липы, зацветания одуванчика, вишни, сирени.
Если вы живёте в сельской местности, выясните, какие виды сельскохозяйственных работ проводят во время того или иного весеннего явления, замеченного вами (например, посев огурцов — во время цветения акации). Записывайте в дневник наблюдения в виде таблицы.
Дневник наблюдений для средней полосы России
Дата
Сельскохозяйственные работы, проводимые в это время
Начало цветения ольхи и орешника
Внесение в почву органических удобрений
Начало сокодвижения берёзы
Продолжение цветения ольхи и орешника
Начало цветения мать-и-мачехи
Внесение минеральных удобрений
Освобождение деревьев и кустарников от обвязки и штамбов
Посадка саженцев плодовых деревьев
Продолжение сокодвижения берёзы
Продолжение цветения ольхи и орешника
Окончание цветения ольхи и орешника
Посадка базилика, мелиссы, тимьяна, майорана.
Продолжение цветения берёзы
Распускание листьев у берёзы
Окончание цветения мать-и-мачехи
Окучивание деревьев и кустарников
Посадка картофеля, лука репчатого, свеклы.
Продолжение цветения берёзы
Распускание листьев у липы
Начало цветения одуванчика
Опрыскивание плодовых деревьев и кустарников против вредителей
Подкормка грядок с овощами.
Высадка рассады цветов — однолетников
Борьба с вредителями
Борьба с вредителями
Словарик
Проросток — это растение в начальной стадии своего развития (от прорастания зародыша до момента развертывания листа главного побега).
Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 17.04.2019
- Время чтения: 1 mins read
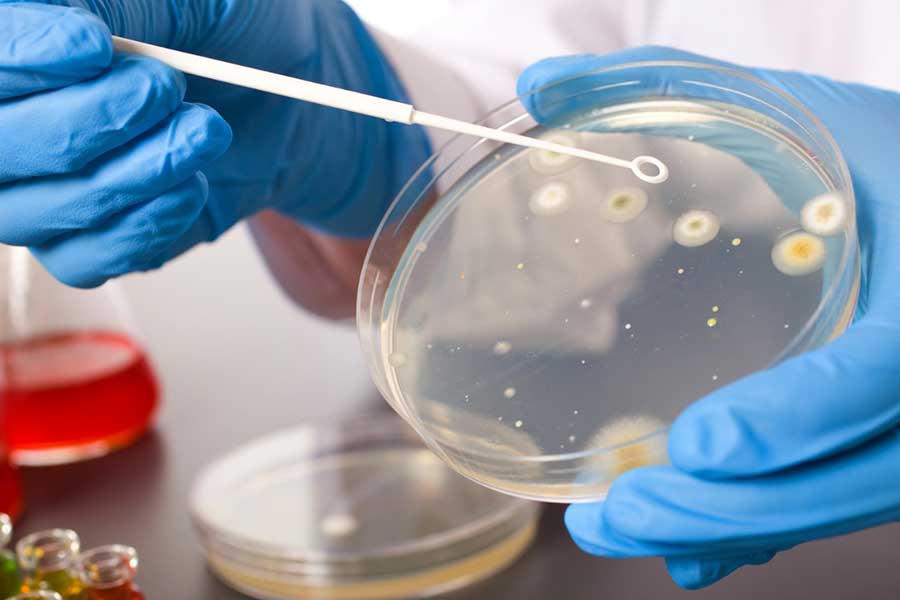
Как проводится выявление микроорганизмов методом посева и для чего нужен этот анализ
При инфекционном поражении следует узнать, какой микроб вызвал болезнь и с помощью какого антибиотика от него лучше избавиться. Поэтому нужно, чтобы возбудитель проявил себя, показав слабые стороны.
Для этого берутся образцы крови, мочи, слюны, секрета простаты, семенной жидкости, слизи из уретры и цервикального канала, носоглотки, мокроты, грудного молока, содержимого ран и язв. Материал переносится на питательные среды – специальные смеси, на которых микробы лучше всего растут. Для посева используются плоские чашечки Петри или пробирки.
Затем образец помещают в температурные условия, наиболее благоприятные для микробного роста, и оставляют на определенное время. Через некоторое время на питательных средах начинают появляться микробные колонии – скопления возбудителя, расположенные внутри среды или вовне.
Снаружи разрастаются анаэробные микробы, которым для жизни требуется воздух. Внутри питательной среды развиваются анаэробы – микробы, не любящие воздух и развивающиеся без него.
Из полученных колоний делают мазки, которые рассматривают под микроскопом, чтобы выяснить, какая именно микробная культура высеялась. Делается также вывод об их количестве (обсемененности). Этот показатель важен для дозировки применяемых препаратов. Чем больше обнаружено возбудителей, тем выше будет доза антибактериального средства, назначенного врачом.
Количественный анализ учитывается при выявлении условно-патогенной микрофлоры. Эти микробы и грибки не доставляют проблем, если находятся в организме в ограниченном количестве. Однако превышение норм приводит к болезням, поэтому требует назначения лекарств. Один из самых известных условно-патогенных микроорганизмов – грибок кандида, вызывающий при разрастании его колоний кандидоз (молочницу).
При проведении анализа определяется чувствительность микрофлоры к антибиотикам. Для этого проводится специальный тест, называемый антибиотикограммой.
Патогенные бактерии пересаживают в благоприятную среду и подвергают воздействию различных антибактериальных средств. Для этого в чашку Петри, где находятся колонии микробов, помещают бумажные полоски, смоченные в антибиотике. Через 3-5 дней оценивают результат:
- Микробная гибель на расстоянии 2,5 см от полоски говорит о высокой чувствительности микробов к данному антибактериальному препарату.
- Если все возбудители умерли в радиусе 1,5-2,5 см, чувствительность к антибиотику средняя.
- Если микробы погибли на расстоянии менее 1,5 см от полоски, чувствительность будет слабой. Такой препарат применять нежелательно.
- При отсутствии гибели колоний считается, что данный антибиотик на эту микрофлору не действует.
Степень чувствительности указывается в результатах анализов, чтобы врач потом мог назначить наиболее эффективные препараты.
Анализ желательно проводить всем больным перед началом антибиотикотерапии. Чувствительность к антибактериальным препаратам – индивидуальная характеристика, которая может отличаться у разных больных, даже страдающих одним и тем же заболеванием.
Таким же образом проводится анализ на чувствительность к бактериофагам – специальным вирусам, убивающим определенные виды бактерий.
Микробиологическая диагностика позволяет выбрать из огромного количества выпускаемых препаратов наиболее подходящий и эффективный.
Антибиотикотерапия без проведения анализов может быть абсолютно бесполезной, а иногда и вредной. Микробы, как и любые другие существа, конкурируют друг с другом, поэтому уничтожение одних бактерий всегда вызывает рост других. Если же применять антибиотики без проведения посева, можно убить абсолютно не ту флору, позволив возбудителям инфекции бесконтрольно размножаться.
Для определения каких микроорганизмов чаще всего проводятся бактериальные посевы
- Разнообразной кокковой флоры, вызывающей гнойное поражение половых путей, органов дыхания, ЛОР-органов, нагноения ран и язв.
- Дифтерийной палочки – возбудителя опасной болезни – дифтерии, поражающей дыхательные пути, глаза, нос.
- Возбудителей кишечных инфекций – кишечную палочку, дизентерийную группу, брюшнотифозные бактерии, возбудителей паратифа, сальмонеллу, иерсинию.
- Разнообразных микробов, вызывающих урогенитальные патологии и половые инфекции – гонококк, микоплазму, уреаплазму, трихомонаду, грибок молочницы.
- Кроме того, высевают возбудителей, которые могут вызывать различные заболевания – энтеробактерии, гемофильные микроорганизмы, клебсиеллы.
Показания к проведению посевов на флору и чувствительность к антибиотикам
- Любые урогенитальные патологии, в том числе ЗППП. Этот метод диагностики особенно рекомендуется при инфекциях, трудно поддающихся лечению.
- Проблемы с кишечником. Анализ высевает все основные кишечные группы и позволяет подобрать не только антибиотики, но и пробиотики.
- Любые гнойные поражения – язвы, раны, лактационный мастит. С помощью посева можно понять, какие микробы вызывали нагноение, и подобрать антибиотик.
- Беременность – в этот период делаются посевы из носоглотки, чтобы выявить микрофлору, опасную для будущего малыша.
- ЛОР-инфекции и поражение дыхательных путей. Проведение бакпосева рекомендуется при затяжных ринитах, фарингитах, частых ангинах. Это позволит выявить микроорганизмы, вызывающие указанные заболевания.
- Анальный зуд – в этом случае нужно сдать посев на грибок молочницы, который часто вызывает такой симптом.
- Обследование детей перед поступлением в дошкольное учреждение и школу, поездкой в детский лагерь или санаторий.
- Профосмотр работников, занятых в пищевой промышленности или работающих с продуктами питания.
Недостатки исследований на бактериальный посев
- Длительное время проведения анализа. Нужно не только выявить возбудителя, но и определить его чувствительность, что занимает много времени. К сожалению, ускорить этот процесс нельзя. Бактерии вырастают в термостате – приборе, поддерживающем нужную температуру, за определённое время. Ускорение приведет к искажению результатов.
- Не все представители микрофлоры высеваются в питательную среду – существуют виды, которые невозможно вырастить в лабораторных условиях.
- Возможность ложноотрицательного результата, который возникает, если пациент перед сдачей материала принимал антибиотики или использовал местные антибактериальные препараты.
Поэтому при сдаче анализов на посев нужно очень аккуратно и точно соблюдать все предписания врача.
Как происходит взятие материала
Анализ сдается как минимум через 10 суток после окончания антибиотикотерапии. Перед забором материала нельзя мыть место его взятия гелем или мылом с антибактериальными компонентами.
Процедура зависит от материала, который берется на диагностику:
- Моча собирается утром после подмывания половых органов без использования антибактериального мыла. Образец собирается в чистую емкость в объеме примерно 10-15 мл и сразу доставляется в лабораторию. Образцы, взятые с клеенок и суден, не подходят из-за бактериальной загрязненности.
- Перед взятием мазков из половых путей нельзя спринцеваться, вводить свечи и гели. Материал не собирается во время критических дней.
- Образец на анализ кала берется утром специальной лопаткой в чистую посуду в объеме примерно 30 мг. Нельзя использовать кал, взятый у детей из подгузников, полученный с помощью клизм и слабительных средств.
- Мокроту собирают в специальную чашечку после чистки зубов и полоскания полости рта. Анализ из носоглотки и горла берется медперсоналом клиники.
- Грудное молоко собирают после мытья груди и обработки околососковой зоны спиртом. Первые капли сцеживаются, чтобы промыть молочные протоки, а затем собирается 15 мл в пробирку.
- Мазок из уретры у мужчин берется врачом-урологом. Перед этим в течение 5-6 часов желательно воздержаться от мочеиспускания, иначе урина смоет микробов, и результат будет неточным.
Сколько времени делается анализ, расшифровка
Тем, кто решился на такое обследование, нужно помнить, что быстро такая диагностика не проводится. Минимальный срок, как правило, составляет 3-4 дня, а максимальный – до 10 сут. За это время нужно вырастить возбудителя и определить его чувствительность к антибиотикам.
Количество выявленных микроорганизмов оценивается в КОЕ/мл, где это КОЕ – колониеобразующие единицы. Чем выше этот показатель, тем больше микробов обнаружено. В бланке анализов обязательно указывается чувствительность к наиболее распространенным антибиотикам (высокая, средняя, низкая).
Самостоятельно больному определить, какая именно флора была высеяна, очень сложно. Поэтому с полученным анализом нужно обратиться к урологу, гинекологу, маммологу, который проведет расшифровку результатов.
Это несложное исследование позволит выявить и вылечить самые различные инфекции – от простых до достаточно сложных. Антибиотики и другие антибактериальные препараты, назначенные по результатам анализов, действительно пойдут на пользу.
ПОСЕВ в растениеводстве, распределение семян в верхнем слое почвы для их прорастания; важнейший агро-технич. приём при возделывании многих с.-х. культур. Способы П. выбирают с учётом требований с.-х. культур к площади питания, освещению, снабжению влагой, необходимости механизировать уход за посевами и прежде всего обработку междурядий. Разбросной посев самый примитивный. Семена попадают на поверхность почвы и заделываются бороной на разную глубину, вследствие чего всходы появляются неодновременно. Рядовой посев (междурядья 10-25 см, чаще 15 см) применяют при выращивании гл. обр. зерновых культур. Рядовая сеялка укладывает семена на дно бороздки и закрывает их рыхлым слоем почвы, что способствует дружному появлению всходов. Узкорядный посев (междурядья 7-8 см) и перекрёстный посев зерновых, трав, льна и др. более совершенны, чем рядовой, т. к. дают возможность размещать семена по площади более равномерно. Широкорядный посев (междурядья более 25 см) применяют для пропашных культур (кукурузы, сах. свёклы, подсолнечника, гречихи, кормовых и столовых корнеплодов и др.). При ленточном посеве (моркови, редиса и др.) широкие междурядья между лентами (группа рядов) чередуют с узкими между рядами. Гнездовым П. семена высевают по нескольку штук в каждую лунку (гнездо). Если гнёзда размещены по углам квадрата, то такой способ наз. квадратно-гнездовым посевом; при квадратном П. в каждый угол квадрата высевают одно семя. При пунктирном посеве семена высевают по одному на заданном расстоянии одно от другого. В р-нах с малоснежными суровыми зимами для озимых культур применяют борозднай посев: семена высевают на дно борозд, в них задерживается снег и предохраняет всходы от вымерзания. Гребневой П. проводят по вершинам гребней, лучше прогреваемых солнцем; распространён в р-нах избыточного увлажнения и полярного земледелия. П. проводят сеялками, иногда с самолёта (напр., П. лесных культур).
В зависимости от сроков различают весенний П. яровых культур, осенний - озимых культур, летний - для получения второго урожая (см. Повторные посевы), подзимний П.- для получения более ранних всходов. Для каждого растения существуют оптимальные сроки П. В Европ. части СССР ранний П. яровых обеспечивает лучшее использование ими весенней влаги, питат. веществ и света. Дружный рост растений даёт возможность заглушить сорняки и снижает повреждаемость болезнями и вредителями. В Сибири и Сев. Казахстане яровые культуры высевают позднее, т. к. при раннем П. (напр., зерновых) они сильнее страдают от июньской засухи и сорняков. В республиках Ср. Азии, в Азербайджане и др. П. ранних яровых (особенно ячменя) возможен зимой (февр. и даже янв.). Для поздних яровых культур срок сева определяют в зависимости от темп-ры почвы и воздуха. Срок сева озимых устанавливают с таким расчётом, чтобы до наступления заморозков всходы их могли достаточно развиться и окрепнуть: в сев. р-нах СССР - в августе, на юге (Краснодарский край, Крымская обл. и др.) - во 2-й декаде сентября и заканчивают к началу октября. Большое значение имеет сокращение продолжительности П. Выращивание скороспелых и позднеспелых сортов одной и той же культуры позволяет без ущерба для урожая несколько растянуть сроки П.
Глубина заделки семян зависит от биологич. особенностей растений, механич. состава почвы. В качестве общей закономерности установлено, что чем крупнее семена, тем глубже их нужно заделывать, напр, кукурузу на 10-12 см, зерновые колосовые на 4-6 см, злаковые травы, махорку на 1-2 см. На тяжёлых суглинках и глинистых почвах семена заделывают мельче, чем на лёгких супесях и суглинках. Учитывают также влажность почвы: семена не должны располагаться в сухом слое. Иногда глубину заделки приходится увеличивать, чтобы предохранить семена от птиц (кукуруза, горох) и выдувания.
Норму высева семян устанавливают с учётом почвенно-климатич. условий местности, хоз. назначения культуры, требований растений к площади питания, времени и способов П., окультуренности почвы и др.
Подготовку к П. начинают с заготовки и засыпки семян, проверки качества семенного материала на всхожесть, чистоту и т. п. (см. Подготовка семян к посеву). В каждом хозяйстве составляют план П., предусматривающий расстановку посевных агрегатов, сроки и порядок выполнения работ. При оценке качества П. проверяют своевременность его, равномерность глубины заделки семян, соблюдение норм высева, прямолинейность рядков и правильность квадратов.
П. наз. также поле, занятое с.-х. культурой.
Лит.: Рубцов М. И., Матвеев В. П., Овощеводство, М., 1970; Растениеводство, 3 изд., М., 1971; Земледелие, под ред. С. А. Воробьева, 2 изд., М., 1972.
8.1. Техника посева и выделения чистых культур микроорганизмов
Доставляемый в лабораторию материал подвергают бактериологическому исследованию в тот же день. Техника посева зависит от характера засеваемого материала, консистенции питательной среды и цели исследования.
Для проведения посевов необходимы: подлежащий исследованию материал, питательные среды, бактериологическая петля, шпатели (стеклянные, металлические), пастеровские и градуированные пипетки, металлические кюветы или поднос для переноса засеянных чашек и металлические коробки для переноса пробирок, ведро или бачок с крышками для сброса отработанного инфицированного материала, спиртовая или газовая горелка.
Жидкий материал для посева берут петлей или пипеткой. При взятии петлей жидкость должна образовать в кольце петли тонкую прозрачную пленку – "зеркало". Пипетками пользуются в том случае, когда материал засевают в большом или точно отмеряемом объеме.
Способ взятия плотного материала определяется его консистенцией. При посевах чаще всего пользуются бактериологической петлей.
Все манипуляции, связанные с посевом и выделением микробных культур, производят над пламенем горелки. Бактериальную петлю перед взятием материала прокаливают в пламени горелки, затем ее остужают так, чтобы при соприкосновении с жидкой средой она не вызывала кипения жидкости, а прикосновение к агару не сопровождалось его плавлением. Для остуживания петли лучше всего погружать ее в конденсационную жидкость пробирки со стерильной питательной средой или прикасаться к крышке чашки Петри со стерильной средой. Нельзя остужать петлю прикосновением к поверхности питательной среды, даже свободной от микробного роста, так как на ней могут находиться колонии, не видимые простым глазом.
После окончания посева петлю прожигают повторно для уничтожения находящейся в ней микробной культуры или инфицированного микроорганизмами материала.
Пипетки и шпатели, использованные для посевов, опускают в дезинфицирующий раствор.
После посева на чашках Петри со стороны дна, на пробирках – в верхней трети надписывают название засеянного материала или ставят номер анализа и дату посевов.
8.1.1. Техника посевов на плотные и жидкие питательные среды
- При посеве в жидкую питательную среду петлю с находящимся на ней материалом погружают в среду. Если материал вязкий и с петли не снимается, его растирают на стенке сосуда, а затем смывают жидкой средой. Жидкий материал, набираемый в пастеровскую или градуированную пипетку, вливают в питательную среду.
- При посеве на скошенный мясопептонный агар пробирку берут в левую руку между I и II пальцами, чтобы основание пробирки находилось на поверхности кисти руки и посев осуществлялся под контролем глаза. Пробку из пробирки вынимают правой рукой IV и V пальцами, не прикасаясь к той ее части, которая входит внутрь пробирки. Остальные три пальца правой руки остаются свободными для взятия бактериологической петли, посредством которой производится посев. Петлю держат, как писчее перо. После вынимания пробки пробирку с питательной средой держат в наклонном положении во избежание попадания в нее посторонних микроорганизмов из воздуха.
При посеве на скошенный агар петлю с находящимся на ней пересеваемым материалом вводят в пробирку до дна, опускают плашмя на поверхность питательной среды и скользящими движениями наносят штрихи снизу вверх от одной стенки пробирки к другой (рис. 8.1).
- • При посеве на поверхность плотной питательной среды из пробирки в чашки Петри пробирку фиксируют II, III и V пальцами левой руки, а крышку чашки Петри приоткрывают I и IV пальцами левой руки настолько, чтобы в образовавшуюся щель свободно проходили петля или шпатель (рис. 8.2). Небольшое количество исследуемого материала, взятого из пробирки бактериологической петлей, втирают в поверхность питательной среды у края чашки. Затем петлю прожигают, чтобы уничтожить избыток находящегося на ней материала. Линию посева начинают с того места, в котором находится материал. Бактериологическую петлю кладут плашмя на питательную среду, чтобы не поцарапать ее поверхность, и проводят штрихи по всей среде или по секторам, разграфив предварительно дно чашки (при условии, что среда прозрачна) на 4, 8 или 16 равных частей. Нужно стараться, чтобы штрихи, наносимые петлей, располагались как можно ближе друг к другу, так как это удлиняет общую линию посева и дает возможность получить изолированные колонии микробов в концевой ее части.
- • Для равномерного распределения засеваемого материала по поверхности плотной питательной среды можно пользоваться вместо петли тампоном или шпателем.
При обилии в засеваемом материале микробов они растут в виде пленки, покрывающей всю поверхность питательной среды. Такой характер микробного роста получил название сплошного или газонного. Посев газоном производят, когда нужно получить большие количества микробной культуры одного вида.
- Для посева материала в толщу плотной питательной среды готовят взвесь в стерильной водопроводной воде или в изотоническом растворе. Набирают 0,1–1 мл взвеси в пипетку (в зависимости от степени предполагаемого микробного загрязнения) и выливают в пустую стерильную чашку Петри. Вслед за этим чашку заливают 15–20 мл мясопептонного агара, расплавленного и остуженного до температуры 40– 45 "С (при такой температуре пробирка со средой, приложенная к щеке, не должна вызывать ощущения ожога). Для равномерного распределения исследуемого материала в питательной среде закрытую чашку с содержимым слегка вращают по поверхности стола.
- Посев уколом в столбик питательной среды производят в пробирку со средой, застывшей в виде столбика. Пробирку берут в левую руку как обычно, и в центре столбика до дна пробирки вкалывают петлю с находящимся на ней материалом.
- Калиброванной бактериологической петлей (диаметр 2 мм, емкость 0,005 мл) производят посев мочи на сектор А чашки Петри с простым агаром, сделав около 40 штрихов. Затем петлю прожигают и производят 4 штриховых посева из сектора А в сектор I, из сектора I в сектор II и из сектора II в сектор III, каждый раз после прожигания петли (рис. 8.3).
Чашки инкубируют при температуре 37 °С в течение 18– 24 ч, после чего подсчитывают количество колоний, выросших в разных секторах, и определяют количество бактерий в 1,0 мл по приведенной табл. 8.1 (этот метод принят для определения степени бактериурии).
Таблица 8.1. Определение количества бактерий в 1 мл методом секторных посевов*
Количество колоний в секторах
Количество бактерий в 1 мл
*Приказ № 535 от 22 апреля 1985 г. "Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений" (Москва, 1985).
8.1.2. Методы выделения чистых культур
Чистой культурой принято называть совокупность однородных микроорганизмов, относящихся к одному виду, полученных из массы одной колонии, клетки которой идентичны по морфологическим, тинкториальным, культуральным, метаболическим и генетическим признакам, так как по существующим представлениям микробная колония является популяцией бактериальных клеток, возникшей в результате размножения единственной материнской клетки. Микробная колония являются аналогом клона.
Чистые культуры микроорганизмов одного вида, выделенные из различных источников, могут отличаться друг от друга незначительным отклонением морфологических, культуральных или биохимических признаков, не выходя за пределы своего вида или подвида. Такие культуры называют штаммами. Вместо ранее именованных типов в зависимости от характера изменившегося признака их обозначают морфоварами (отличные по морфологическим признакам), сероварами (имеющие антигенные отличия), биоварами (отличающиеся биологическими свойствами).
Чистая культура необходима для изучения морфологических, культуральных, биохимических и антигенных свойств, по совокупности которых определяется видовая принадлежность исследуемого микроорганизма.
Для выделения чистых культур микробов из материалов, содержащих обильную смешанную микрофлору, предложено много различных методов. Наибольшее распространение получил метод механического разъединения микроорганизмов, находящихся в исследуемом материале, с целью получения изолированных колоний на поверхности или в глубине питательной среды. Очень широко применяются селективные питательные среды, стимулирующие развитие тех микроорганизмов, чистую культуру которых предполагается выделить. Некоторые виды микробов обладают высокой чувствительностью к воздействию определенных факторов внешней среды. Индивидуальная устойчивость микробов к тому или иному фактору была использована для разработки методов выделения чистых культур путем умерщвления сопутствующей микрофлоры. Этим способом производится выделение споровых форм микробов, устойчивых к действию высокой температуры, микобактерий туберкулеза, безразличных к действию концентрированных растворов минеральных кислот, в отличие от остальных микробов, содержащихся в мокроте.
При выделении чистой культуры патогенных микробов из патологического материала, загрязненного посторонней микрофлорой, прибегают иногда к заражению лабораторных животных, восприимчивых к тому виду микроба, который предполагается выделить из исследуемого материала. Биологический метод выделения чистой культуры применяется при исследовании мокроты на содержание в ней пневмококков, микобактерий туберкулеза.
Получение чистой культуры методом рассева в глубине среды (по Коху). Три пробирки, содержащие по 15 мл мясопептонного агара, ставят в водяную баню для расплавления агара. Расплавленную среду остужают до температуры 43–45 °С. В пробирку вносят одну бактериологическую петлю исследуемого материала. Для лучшего перемешивания материала со средой засеянную пробирку вращают несколько раз, зажав между ладонями. После этого одну петлю (прокаленную и остуженную) содержимого 1-й пробирки переносят во 2-ю и таким же образом из 2-й в 3-ю. Приготовленные разведения микробов выливают из пробирок в стерильные чашки Петри, обозначенные номерами, соответствующими номерам пробирок.
После застудневания среды с исследуемым материалом чашки помещают в термостат. Количество колоний в чашках с питательной средой уменьшается по мере разведения материала.
Выделение чистой культуры по способу Дригальского. Расплавленную питательную среду разливают в три чашки Петри. Застывшую среду обязательно подсушивают, так как влажная поверхность ее способствует образованию сливного роста. В первую чашку вносят одну каплю исследуемого материала и стерильным шпателем втирают его в поверхность питательной среды. Далее, не прожигая шпателя и не набирая нового материала, шпатель переносят во 2-ю, а затем и 3-ю чашки, втирая в поверхность питательных сред оставшийся на нем материал.
Метод рассева по поверхности, предложенный Дригальским, является наиболее употребительным для получения чистой культуры микробов. Вместо шпателя можно пользоваться петлей. Материал на питательной среде распределяют параллельными штрихами по всей чашке в одном направлении. Затем, повернув чашку на 90°, проводят штрихи в направлении, перпендикулярном первым штрихам. При таком способе посева материал, находящийся в петле, расходуется постепенно, и по линиям штрихов, нанесенных в конце посева, вырастают изолированные колонии микробов.
Выращивание и выделение чистых культур анаэробов. Для выращивания анаэробов необходимо создать определенные условия, сущность которых заключается в удалении молекулярного кислорода из питательной среды и пространства, окружающего эти культуры. Другим обязательным условием, обеспечивающим выделение анаэробов из исследуемого материала, является внесение большого количества посевного материала в питательную среду.
Единственным отличием питательных сред, применяемых для выращивания анаэробов, служит пониженное содержание в них свободного кислорода. Самым простым способом удаления растворенного кислорода является кипячение. Непосредственно перед посевом материала пробирки с питательными Средами кипятят на водяной бане в течение 10–20 мин. При кипячении из среды вытесняется воздух и, следовательно, удаляется кислород. Свежепрокипяченную питательную среду быстро охлаждают, погружая в лед или подставляя под струю холодной воды, чтобы не дать ей насытиться кислородом воздуха, и используют для посева. Для уменьшения диффузии кислорода из воздуха питательные среды заливают сверху стерильным вазелиновым или парафиновым маслом (толщина слоя 1–1,5 см). Засев среды производят пипеткой сквозь масло в наклонном положении пробирки.
В качестве редуцирующих веществ используют глюкозу, аскорбиновую кислоту, цистеин, гликокол, глутатион. Активно связываются с кислородом животные ткани паренхиматозных органов. На этом свойстве животных клеток основано приготовление питательной среды Китта – Тароцци (рецепт 161), широко применяемой для выращивания анаэробов. В жидкие питательные среды помещают иногда пористые вещества: вату, пемзу, которые адсорбируют на своей поверхности пузырьки воздуха.
Для создания бескислородных условий используют физические, химические и биологические факторы.
Физические способы культивирования анаэробов:
- • способ Виньяля – Вейона. Берут 4–5 пробирок с 0,5 % расплавленным и охлажденным до температуры 40–45 °С сахарным агаром. В содержимое одной из них вносят пипеткой небольшое количество исследуемого материала и тщательно размешивают. Для уменьшения концентрации материала с целью получения изолированных колоний засеянную среду в количестве, соответствующем объему внесенного материала, переносят из 1-й пробирки во 2-ю, из 2-й в 3-ю. Затем содержимым каждой пробирки заполняют капилляры трех пастеровских пипеток.
Чтобы предупредить застывание питательной среды в момент насасывания ее в пипетки, пока их кончик не обломлен, пипетки погружают на 3–5 мин в стерильную воду с температурой 45–50 °С. После заполнения вытянутый конец трубки запаивают и помещают в стеклянный цилиндр с ватой на дне. Через 2–3 сут в столбике агара вырастают ясно видимые колонии микробов-анаэробов. Выросшие колонии легко изолировать. Для этого капилляр надрезают напильником выше уровня намеченной колонии, надламывают, а колонию микроба, находящуюся в агаре, извлекают петлей и пересевают в свежую питательную среду;
- • выращивание анаэробов в условиях вакуума. Вакуумные условия для выращивания анаэробов создают в анаэростате или эксикаторе. Исследуемый материал или культуру микробов засевают в пробирки с жидкой средой или в чашки Петри с плотной питательной средой. Посевы помещают в анаэростат, затем присоединяют его к насосу и выкачивают воздух. Степень разреженности воздуха определяют по показаниям вакуумметра. Колонии анаэробов в вакуумных условиях растут на поверхности плотной питательной среды.
Химические методы выращивания анаэробов (метод Аристовского). Материал, исследуемый на наличие анаэробов, засевают на среду в чашки Петри и помещают их в эксикатор, на дно которого кладут химический поглотитель кислорода: гидросульфит натрия или пирогаллол. В расширенную часть сосуда устанавливают на подставке чашки с посевами. Прибор закрывают крышкой и помещают в термостат при температуре 37 *С на 24–48 ч.
Биологический метод выращивания анаэробов (по Фортнеру). В чашку Петри наливают толстым слоем 5 % кровяной агар с 1–2 % глюкозы. Посередине чашки в питательной среде вырезают стерильным скальпелем канавку шириной 1–1,5 см, которая делит питательную среду на две половины. Одну из них засевают культурой анаэробов или исследуемым на их наличие материалом, другую половину – культурой аэробов: чудесной палочкой (Serratia marcescens) или кишечной палочкой (Escherichia coli). Перед посевом чашки подсушивают в термостате, чтобы аэробы вместе с капельками влаги не могли попасть на другую сторону чашки. Засеянные чашки закрывают, а свободное пространство между дном и крышкой заклеивают лейкопластырем, чтобы предупредить поступление в чашку кислорода извне. В термостате чашки устанавливают вверх дном. Быстро растущие аэробы, поглощая находящийся в чашке кислород, создают тем самым благоприятные условия для роста анаэробов.
Анаэростат для культивирования анаэробов. Анаэростат – прибор для выращивания микробов в анаэробных условиях – представляет собой толстостенную металлическую или пластиковую камеру с герметически привинчивающейся крышкой, на которой имеются вакуумметр и два крана для присоединения к вакуум-насосу. Вместо кислорода в нем используются газовые смеси.
Читайте также:

