Посев бактерий на свежую питательную среду до достижения ими максимальной скорости деления клеток
Добавил пользователь Владимир З. Обновлено: 19.09.2024
В жидких средах микроорганизмы могут образовывать равномерную муть, давать осадок (зернистый, пылевидный, хлопьевидный) или пленку (нежную, грубую, морщинистую).
.Бактерии, засеянные в определенный, не изменяющийся объем питательной среды, размножаясь, потребляют питательные элементы, что приводит в дальнейшем к истощению питательной среды и прекращению роста бактерий. Культивирование бактерий в такой системе называют периодическим культивированием, а культуру — периодической. Если же условия культивирования поддерживаются путем непрерывной подачи свежей питательной среды и оттока такого же объема культуральной жидкости, то такое культивирование называется непрерывным, а культура — непрерывной.
При выращивании бактерий на жидкой питательной среде наблюдается придонный, диффузный или поверхностный (в виде пленки) рост культуры. Рост периодической культуры бактерий, выращиваемых на жидкой питательной среде, подразделяют на несколько фаз, или периодов:
1.лаг-фаза;
2.фаза логарифмического роста;
3.фаза стационарного роста, или максимальной концентрации бактерий;
4.фаза гибели бактерий.
Эти фазы можно изобразить графически в виде отрезков кривой размножения бактерий, отражающей зависимость логарифма числа живых клеток от времени их культивирования.
Лаг-фаза — период между посевом бактерий и началом размножения. Продолжительность лаг-фазы в среднем 4—5 ч. Бактерии при этом увеличиваются в размерах и готовятся к делению; нарастает количество нуклеиновых кислот, белка и других компонентов.
Фаза логарифмического (экспоненциального) роста является периодом интенсивного деления бактерий. Продолжительность ее около 5— 6 ч. При оптимальных условиях роста бактерии могут делиться каждые 20—40 мин. Во время этой фазы бактерии наиболее ранимы, что объясняется высокой чувствительностью компонентов метаболизма интенсивно растущей клетки к ингибиторам синтеза белка, нуклеиновых кислот и др.
Затем наступает фаза стационарного роста, при которой количество жизнеспособных клеток остается без изменений, составляя максимальный уровень (М-концентрация). Ее продолжительность выражается в часах и колеблется в зависимости от вида бактерий, их особенностей и культивирования.
Завершает процесс роста бактерий фаза гибели, характеризующаяся отмиранием бактерий в условиях истощения источников питательной среды и накопления в ней продуктов метаболизма бактерий. Продолжительность ее колеблется от 10 ч до нескольких недель. Интенсивность роста и размножения бактерий зависит от многих факторов, в том числе оптимального состава питательной среды, окислительно-восстановительного потенциала, рН, температуры и др.
Особенности микробного роста на жидких питательных средах.
1. Рост бактерий с равномерным помутнением среды.
2. Придонный рост бактерий, характеризующийся образованием осадка на дне пробирки с жидкой питательной средой.
3. Пристеночный рост бактерий, выражающийся в образовании рыхлых хлопьев, прикрепленных к внутренней поверхности стенок сосуда.
4. Поверхностный рост бактерий, характеризующийся появлением на поверхности жидкой питательной среды пленки.
Рост на полужидкой питательной среде характеризуется помутнением всей толщи среды или образованием сосульки цилиндрической или конической формы.
Размножение бактерий на плотной питательной среде
Колонии могут быть крупные (4—5 мм в диаметре и больше), средние (2—4 мм), мелкие (1—2 мм) и карликовые (меньше 1 мм). Они различаются по форме, расположению на поверхности среды (выпуклые, плоские, куполообразные, вдавленные, круглые, розеткообразные), форме краев (ровные, волнистые, изрезанные).
.Бактерии, растущие на плотных питательных средах, образуют изолированные колонии округлой формы с ровными или неровными краями (S- и R-формы), различной консистенции и цвета, зависящего от пигмента бактерий.
Пигменты, растворимые в воде, диффундируют в питательную среду и окрашивают её. Другая группа пигментов нерастворима в воде, но растворима в органических растворителях. И, наконец, существуют пигменты, не растворимые ни в воде, ни в органических соединениях.
Наиболее распространены среди микроорганизмов такие пигменты, как каротины, ксантофиллы и меланины. Меланины являются нерастворимыми пигментами черного, коричневого или красного цвета, синтезирующимися из фенольных соединений. Меланины наряду с каталазой, супероксиддисмутазой и пероксидазами защищают микроорганизмы от воздействия токсичных перекисных радикалов кислорода. Многие пигменты обладают антимикробным, антибиотикоподобным действием.
В зависимости от состава их делят на среды с определенным составом или синтетические, приготовленные в промышленных или лабораторных условиях из известных компонентов и те, состав которых не может быть определен точно – это растительные и животные природные субстраты (например, картофель, морковь, молоко или экстракты, полученные из них).
С точки зрения целей использования различают общие (общеупотребительные), селективные, обогащенные, специальные и дифференциально-диагностические среды:
2. Общие. Применяются для культивирования неприхотливых культур. Это например, мясная вода, перевар Хоттингера или мясо-пептонный бульон, гидролизаты кормовых дрожжей или кильки и плотные среды, полученные при добавлении к данным бульонам агара.
3. Обогащенные. Содержат добавки – кровь, ее сыворотку, специально подобранные углеводы.
4. Специальные. Подобранные по составу для конкретного вида бактерий. Например, для возбудителя туляремии используется среда Мак-Коя с добавлением специально подготовленных яиц, а для лептоспир – среда Терских на основе фосфатов.
5. Селективные (еще их называют элективными) – предназначены для отбора из смешанной популяции бактерий одного вида. Такие субстраты могут содержать компоненты, усиливающие рост искомого микроорганизма либо подавляющие рост остальной микрофлоры. Например, молочно-солевой агар, предназначенный для отбора стафилококков или среды Шустова, Раппопорт и Мюллера для выращивания сальмонелл.
6. Дифференциально-диагностические позволяют определять наличие различных ферментов у бактерий. Могут быть различной консистенции. Наиболее известны среды Гисса, Левина, Эндо, содержащие различные субстраты для бактериальных ферментов – лактозу, галактозу, тиосульфат натрия и цветные индикаторы.
Методы культивирования аэробных и анаэробных бактерий с целью изучения их культуральных свойств существенно различаются между собой. Для аэробных бактерий применяются термостаты, шюттель-аппараты, колбы, бутыли и реакторы. Для анаэробных используются высокие концентрации веществ, повышающих восстановительный потенциал среды, и специальные жидкие или газовые среды. В качестве специального оборудования используются анаэростаты.
Кипячение субстратов позволяет удалить из них кислород. Часто применяется метод выращивания анаэробов в толще питательных сред, что необходимо для выявления культуральных свойств бактерий.
. Продолжительность ее колеблется от 10 ч до нескольких недель. Интенсивность роста и размножения бактерий зависит от многих факторов, в том числе оптимального состава питательной среды, окислительно-восстановительного потенциала, рН, температуры и др.

24. Типы взаимоотношений микро - и макроорганизмов (симбиоз, метабиоз, мутуализм, сателлеизм, комменсализм, синергизм, антагонизм, паразитизм). Приведите примеры.
В природе микроорганизмы сталкиваются с действием разнообразных биотических факторов. При симбиозе (совместном существовании) различают ассоциативные (благоприятствующие) и антагонистические (конкурентные) взаимоотношения.
Существуют ассоциации двух разных видов микроорганизмов (или микро - и макроорганизмов) в условиях тесного и длительного пространственного контакта, когда оба партнера взаимно адаптируются к совместному существованию. Такие взаимоотношения между организмами называют симбиозом.
Типы симбиозов классифицируют по нескольким признакам:
• по обязательности симбиотической связи выделяют факультативный и облигатный;
• по расположению партнеров различают экзосимбиозы и эндосимбиозы;
• по характеру образующихся взаимоотношений выделяют собственно симбиоз, метабиоз, сателлитизм и синергизм.
В СИМБИОЗАХ РЕАЛИЗУЮТСЯ ДВЕ ВОЗМОЖНОСТИ ПИТАНИЯ
САПРОТРОФИЯ - микроорганизм-симбионт, как и свободноживущие формы, использует органические соединения, образуемые в процессе жизнедеятельности других организмов, или продукты разложения их мертвых остатков
ПАРАТРОФИЯ - микроорганизм полностью зависит от метаболизма хозяина, потребляя образованные им сложные органические вещества и часто изменяя метаболизм хозяина в соответствии со своими потребностями
ü Макроорганизм создает постоянство физико-химических параметров микробного местообитания и предохраняет внутреннюю и полостную микробиоту от неблагоприятных условий внешней среды ü
Микроорганизмыпомогают хозяину эффективней использовать питательные вещества, защищают его от токсинов и препятствуют внедрению патогенных микробов ü
При совместном существовании в симбиозе жизнедеятельность и размножение партнеров скоординировано ü
Микробиота полостей тела животных и человека считается экзосимбионтом, поскольку занимает внешнее положение по отношению к тканям хозяина
Симбиоз-это взаимовыгодное сожительство организмов разных видов.
Формы симбиоза между микроорганизмами и организмом человека могут быть трех видов:
Симбиоз [от греч. symbiosis, совместное проживание] — совместное длительное существование микроорганизмов в долгоживущих сообществах. Взаимоотношения, при которых микроорганизм располагается вне клеток хозяина (более крупного организма), известны как эктосимбиоз; при локализации внутри клеток — как эндосимбиоз.
Типичные эктосимбиотические микробы — Escherichia coli, бактерии родов Bacteroides и Bifidobacterium, Proteus vulgaris, a также другие представители кишечной микрофлоры. Как пример эндосимбиоза можно рассматривать плазмиды, обеспечивающие, например, резистентность бактерий к ЛС. Симбиотические отношения также разделяют по выгоде, получаемой каждым из партнёров.
Метабиоз– такая форма симбиоза, когда создаются условия для последовательного развития одних микроорганизмов за счет продуктов жизнедеятельности других.
Примером метабиоза может служить порча сахаросодержащих субстратов (плодово-ягодных соков, поврежденных плодов, ягод), когда на них сначала развиваются дрожжи, превращающие сахар в спирт, затем уксуснокислые бактерии, превращающие спирт в уксусную кислоту и, наконец, мицелиальные грибы, которые окисляют уксусную кислоту до углекислого газа и воды.
Мутуализм– такие взаимоотношения между микроорганизмами, которые основаны на взаимной выгоде.
Пример: совместное существование в природе анаэробных и аэробных микроорганизмов. Аэробы, поглощая кислород, создают необходимые для анаэробов окислительно-восстановительные условия.
Сателлизм - форма сожительства в микробной ассоциации, для которой характерна стимуляции роста одного микроорганизма продуктами жизнедеятельности другого.
Пример ?-
Комменсализм– форма сожительства, когда один организм живет за счет другого, не причиняя ему вреда.
Примером комменсалов могут служить бактерии нормальной микрофлоры тела человека
Синергизм– усиление физиологических функций микроорганизмов при совместном культивировании. форма сожительства в микробной ассоциации, для которой характерны одинаковые физиологические процессы у различных групп микроорганизмов. Результатом жизнедеятельности такой ассоциации является увеличение количества конечных продуктов жизнедеятельности.
В кефирном грибке, например, содержатся дрожжи и молочнокислые бактерии. Витамины, синтезируемые дрожжами, стимулируют развитие молочнокислых бактерий, а молочная кислота, образуемая молочнокислыми бактериями, создает благоприятные значения рН для развития дрожжей..
Антагонистическиеформы симбиоза. К ним относятся такие формы симбиоза, как антибиоз, паразитизм, хищнечество.- форма сожительства в микробной ассоциации, для которой характерно противоположное действие членов микробной ассоциации. Это сложное взаимоотношение, при котором бактерии одного вида угнетают, а иногда и полностью уничтожают, других членов ассоциации. Например, многие штаммы кишечной палочки способны подавлять развитие и уничтожать стафилококки, сальмонеллы, микобактерии туберкулез
Антагонизм – такой тип взаимоотношений, когда один организм подавляет или прекращает развитие другого в основном за счет продуктов его жизнедеятельности. Молочнокислые бактерии,
например, выделяя молочную кислоту, создают кислую реакцию среды, препятствующую развитию гнилостных бактерий. Это явление используется при квашении капусты, изготовлении кисломолочных продуктов.
Антибиоз – связан со способностью одного вида микроорганизмов выделять в окружающую среду специфические вещества, угнетающие жизнедеятельность других, – антибиотики. Они обладают либо широким спектром действия в отношении ряда микроорганизмов, либо избирательным действием к одному из них.
Паразитизм – это такой тип взаимоотношений, при котором совместное существование одному из симбионтов приносит выгоду, а другому причиняет вред. -такая форма сожительства, при которой микроорганизмы-паразиты получают питательные вещества за счет тканей хозяина, при этом причиняя ему вред, т.е. вызывают инфекционное заболевание. При паразитической форме сожительства организмы, ведущие паразитический образ жизни не способны существовать без организма хозяина. Организм хозяина является средой обитания для паразитического организма (внешняя среда первого порядка), к которой паразит адаптируется в процессе эволюции. Эта среда непосредственно влияет на паразитов, как и паразиты влияют на организм хозяин
Примерами могут служить болезнетворные микроорганизмы и вирусы, являющиеся возбудителями инфекционных заболеваний.
Хищничество– это внеклеточный паразитизм. Хищные бактерии образуют подвижную колонию – сетку, улавливающую крупные бактериальные клетки других видов, которые лизируются (разрушаются) и используются ими внутри колонии, а остатки выбрасываются. Хищные бактерии обитают в илах водоемов.
Антибиотики. Фитонциды. Во многих случаях губительное действие микробов-антагонистов связано с выделением специфических биологически активных химических веществ – антибиотиков (анти – против, биос – жизнь). Продуцентами антибиотиков являются некоторые грибы, а также бактерии, чаще актиномицеты.
Постоянно осуществляемый микроорганизмами синтез клеточных компонентов стимулирует рост клеток и последующее их размножение. Рост клеток - это процесс увеличения размеров, объема, массы каждой отдельной особи в ходе индивидуального развития, обусловленный синтезом клеточного материала. Рост начинается после деления клетки, которая быстро достигает стадии зрелости, а затем приступает к размножению или переходит в стадию покоя. Рост характерен для всех групп микроорганизмов, кроме вирусов. Его изучают на изолированных клетках.
Размножение микроорганизмов - процесс самовоспроизведения, обеспечивающий сохранение вида. Способы и скорость размножения обусловлены геномом микроба и соответствием условий обитания его генетическим потребностям. Способы размножения у микроорганизмов разнообразны: бинарное деление - у большинства бактерий, почкование, спорообразование, половой процесс и др. - у грибов и дрожжей, особые способы размножения - у простейших (множественное деление, половое и др.).
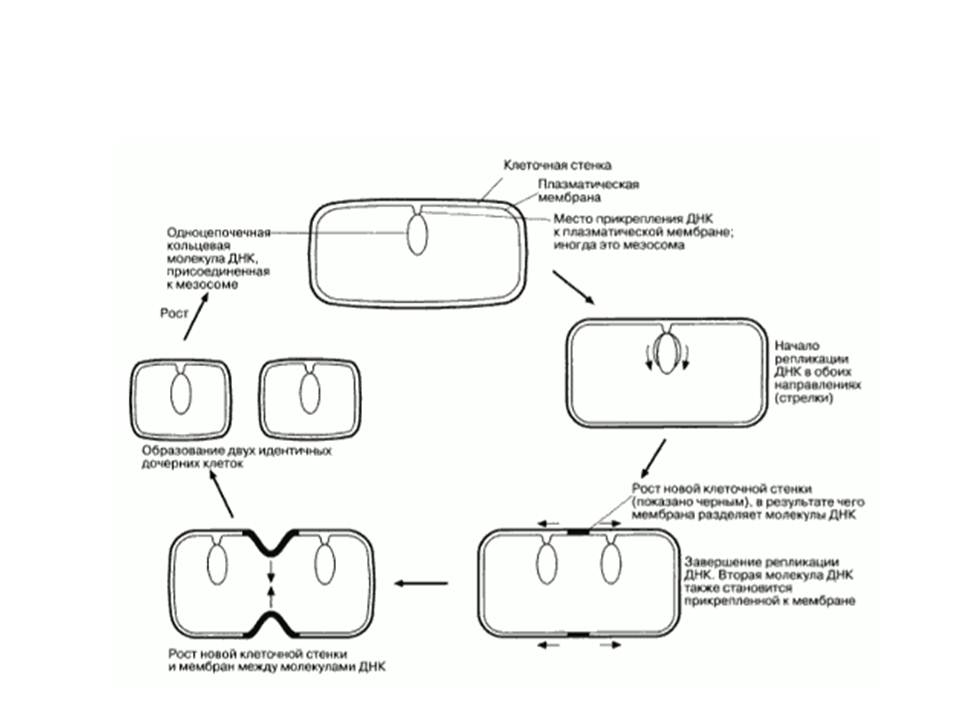
При бинарном делении, инициатором которого является кольцевая ДНК бактерии, прикрепленная к определенному участку ЦПМ, из одной бактериальной клетки без предварительного обмена генетической информацией образуются две равноценные дочерние особи. Репликация ДНК наступает в определенной фазе роста под контролем гена-регулятора и гена- репликатора. Вновь образованная ДНК оказывается прикрепленной к соседнему участку ЦПМ. Между участками прикрепления исходной и новообразованной ДНК строго по экватору формируется перетяжка (у грамотрицательных бактерий) или перегородка (у грамположительных бактерий). После разделения дочерние клетки расходятся или формируют колониальные организмы в виде цепочек, гроздьев, пакетов и др.
От роста клеток следует отличать рост популяции - необратимое увеличение количества живого вещества (биомассы), обусловленное увеличением клеточной массы и количества клеток в единице объема питательной среды. Результаты количественного изучения роста могут быть представлены более информативно и точно, если анализируются различные параметры роста: удельная скорость роста, лаг-период, экономический коэффициент, метаболический коэффициент, урожай биомассы и др.
5.1. Кривая роста микроорганизмов в периодических условиях
Для роста биомассы в культуре необходимы следующие условия:
а) жизнеспособность засева;
б) наличие источника энергии;
в) внесение пищевых добавок, содержащих все компоненты, необходимые для синтеза биомассы;
г) отсутствие в среде ингибиторов, подавляющих рост клеток;
д) поддержание в среде подходящих физико-химических условий.
При внесении бактерий в питательную среду они обычно растут до
Кривая, описывающая зависимость логарифма числа живых клеток от времени, называется кривой роста. Типичная кривая роста имеет S-образную форму и позволяет различать несколько фаз роста, сменяющих друг друга в определенной последовательности. Она включает начальную (или лаг-) фазу; фазу ускорения роста; экспоненциальную (или логарифмическую), стационарную фазу; фазу замедления роста и фазу отмирания (рис. 5).
Рис. 5. Кривая роста микроорганизмов при периодическом культивировании: I - лаг-фаза; II - фаза ускорения роста; III - фаза экспоненциального роста; IV - фаза замедления роста; V -стационарная фаза; VI - фаза отмирания культуры

Начальная фаза. Эта фаза начинается с момента посева материала (внесения инокулята) до достижения культурой максимальной скорости роста. Продолжительность этой фазы зависит главным образом от объема и возраста инокулята, предшествовавших условий культивирования, а также от степени пригодности для роста выбранной среды. Внесение небольшого объема инокулята в большой объем свежей среды может привести к диффузии из клеток витаминов, кофакторов и ионов, которые необходимы для поддержания активности многих внутриклеточных ферментов. С увеличением возраста инокулята и при переносе клеток из бедной среды в богатую лаг-фаза удлиняется.
Если в качестве инокулята использована старая культура (в стационарной фазе роста), то клеткам придется сначала приспособиться к новым условиям путем синтеза РНК, образования рибосом и синтеза ферментов. Если в новой среде источники энергии и углерода отличаются от тех, что были в предшествующей культуре, то приспособление (адаптация) к новым условиям может быть связана с синтезом новых ферментов, которые ранее не были нужны и поэтому не синтезировались. Образование новых, адаптивных ферментов индуцируется новым субстратом. Причем время, необходимое для синтеза оптимального количества ферментов, может составлять от 10 мин до нескольких часов. У некоторых видов организмов индукция ферментов для использования новых источников углерода и энергии не происходит до тех пор, пока в среде есть хоть малые количества первоначального источника углерода и энергии.
Наглядным примером влияния субстрата на синтез ферментов служит так называемая диауксия. Это явление двухфазного роста или двойного цикла роста наблюдается на средах, содержащих смесь питательных веществ. Например, из смеси глюкозы и лактозы Е. coli поглощает в первую очередь глюкозу. Глюкоза индуцирует в клетках сначала синтез ферментов, которые нужны для ее использования, и одновременно репрессирует (подавляет) синтез ферментов, необходимых для использования лактозы. Эти последние ферменты образуются лишь после того, как вся глюкоза будет израсходована. Такие регуляторные процессы объясняют наличие двух начальных фаз (рис. 6).
Рис. 6. Рост Е. coli в среде с различными сахарами (диауксия)

При оценке роста могут наблюдаться определенные отклонения от идеальной формы кривой роста. Если бактериальную массу измеряют по мутности, то часто наступлению стационарной фазы предшествует небольшое уменьшение оптической плотности. Это может быть артефактом, вызванным изменением отношения биомассы к оптической плотности. Другим отклонением является более быстрое увеличение числа организмов во время первого удвоения, что может быть обусловлено синхронным делением популяции одноклеточных организмов. Третий вариант - диауксия.
Лаг-период может быть связан с инактивацией некоторых ингибиторов, присутствующих в среде. Такими ингибиторами иногда являются микроэлементы. Их токсическое действие связано с возможным образованием комплексов между входящими в состав питательной среды аминокислотами и ионами металлов. Токсическим свойством обладают органические кислоты, при этом с увеличением рН токсичность органических кислот уменьшается. Как ингибитор может вести себя субстрат, и тогда лаг-период будет зависеть от времени, необходимого для уменьшения концентрации субстрата до значений, при которых возможна максимальная скорость роста. Ингибирующее влияние на рост могут оказывать продукты метаболизма в инокуляте. Например, некоторые представители Lactobacillaceae при пересеве из анаэробной среды в аэробную могут накапливать перекись водорода, являющуюся сильным ингибитором роста. Перекись водорода индуцирует образование пероксидазы, которая удаляет перекись водорода. Лаг-период, обусловленный перекисью водорода, может увеличиваться с увеличением размера инокулята, поскольку образование перекиси водорода пропорционально концентрации клеток. Если инокулят состоит из споровых форм, то лаг-период, предшествующий вегетативному росту, соответствует времени прорастания спор.
Таким образом, существует множество причин, вызывающих задержку роста. Для того чтобы избежать или свести к минимуму лаг-период, инокулят следует брать из культуры, находящейся в конце логарифмической фазы, в условиях, как можно более близких к среде, используемой для пересева. Размер инокулята обычно следует брать по возможности больше.
Поскольку в экспоненциальной фазе скорость деления клеток относительно постоянна, эта фаза наиболее удобна для определения скорости деления клеток (скорости роста), изучения влияние факторов среды (рН, окислительно-восстановительного потенциала, температуры, аэрации и т. д.). Кроме того, в этой фазе определяют пригодность различных субстратов, а также следят за увеличением числа клеток или за мутностью (экстинкцией) клеточной суспензии.
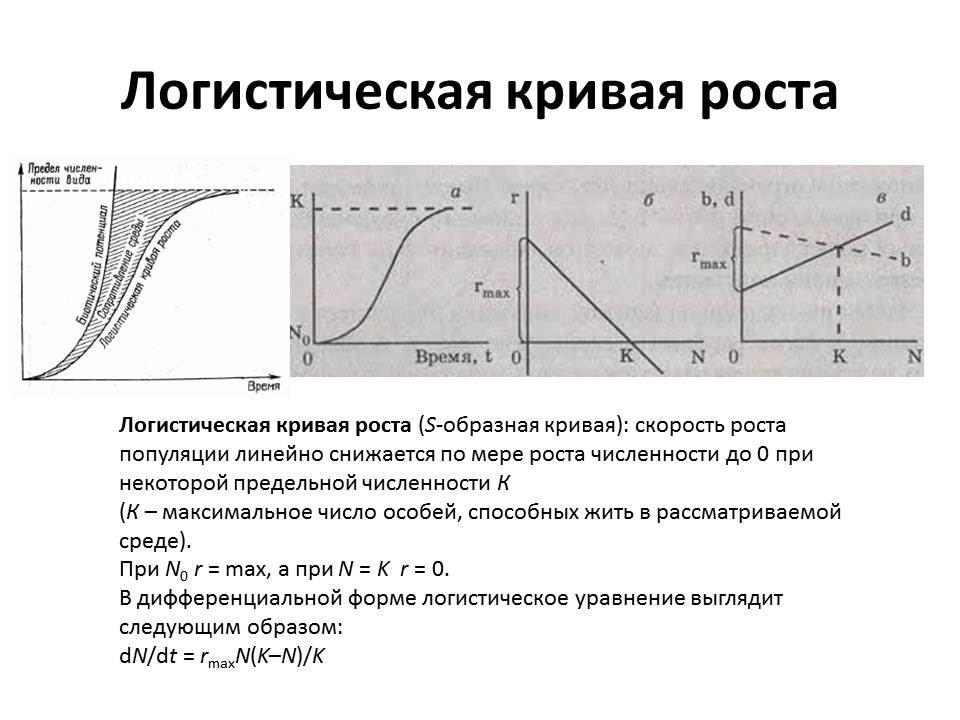
Стационарная фаза наступает, когда число клеток перестает увеличиваться. Скорость роста зависит от концентрации субстрата - при уменьшении этой концентрации, еще до полного использования субстрата, она начинает снижаться. Поэтому переход от экспоненциальной фазы к стационарной происходит постепенно. Скорость роста может снижаться не только из-за нехватки субстрата, но также из-за большой плотности бактериальной популяции, низкого парциального давления О2 или накопления токсичных продуктов обмена; все эти факторы вызывают переход к стационарной фазе.
В конце логарифмической фазы наблюдается синтез первичных метаболитов, то есть продуктов, необходимых для роста и выживания. В стационарной фазе синтезируются вторичные метаболиты - продукты, которые не требуются для роста и не существенны для выживания, однако они выполняют полезные функции и часто защищают от действия других конкурирующих микроорганизмов либо подавляют их рост (например, антибиотики). Количество биомассы, достигнутое в стационарной фазе, называют выходом или урожаем. Урожай зависит от природы и количества используемых питательных веществ, а также от условий культивирования.
Фаза отмирания. Гибель клеток во многом является результатом исчерпания запасов энергии в клетке. Клетки перестают делиться, гибнут и распадаются. Количество живых клеток резко уменьшается. Скорость отмирания бактерий варьирует в зависимости от условий и особенностей организма.
5.2. Параметры кривой роста
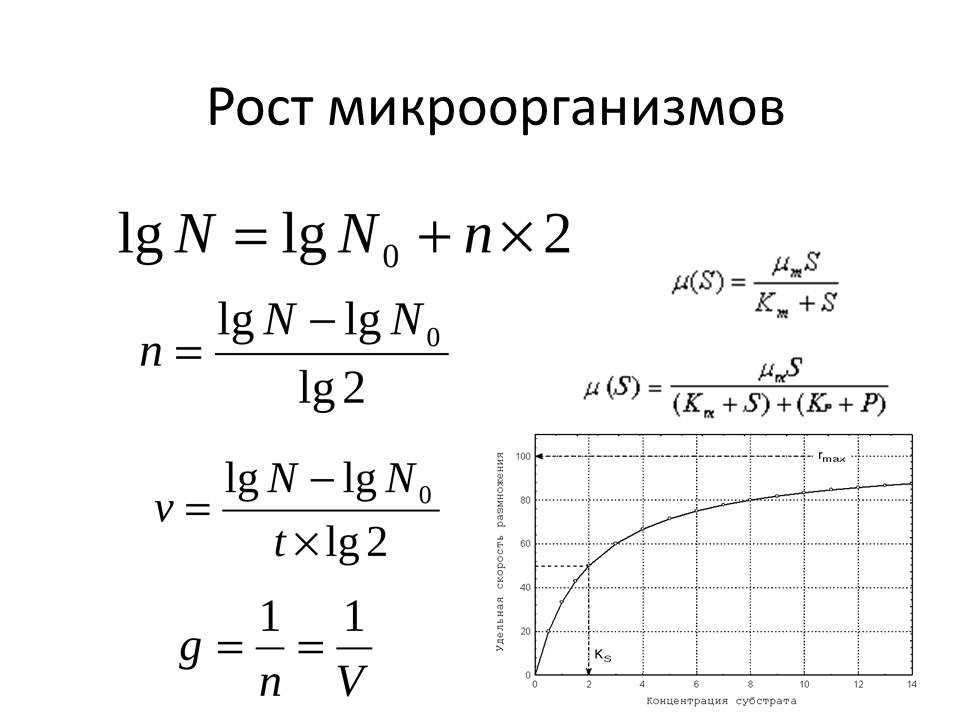
Основные параметры роста простой периодической культуры микроорганизмов (удельную скорость роста, время генерации, число клеточных делений) определяют в течение экспоненциальной фазы, тогда как максимальная концентрация жизнеспособных клеток в популяции характерна для стационарной фазы.
5.2.1. Удельная скорость роста
Если для роста биомассы в культуре соблюдены необходимые условия, то предполагается, что в период логарифмической фазы роста в течение бесконечно малого промежутка времени dt увеличение биомассы dх должно быть пропорционально количеству биомассы х и интервалу времени, то есть
Дифференциальное отношение dх/dt выражает скорость роста популяции. Параметр μ, обозначающий скорость роста единицы биомассы (1/х)(dх/dt), называется удельной скоростью роста и измеряется в единицах, обратных времени (1/t). Этот параметр аналогичен сложным процентам. Так, например, удельная скорость роста 0,1 ч -1 эквивалентна скорости 10 % в час.
Если μ постоянна, то интегрирование уравнения (2) дает
1n х = 1n х0 + μt, (3)
где х0 - биомасса в начальный момент времени t=0. Г рафик зависимости 1n х от времени будет иметь вид прямой линии с наклоном μ.
Из уравнения (3) следует, что
Рост, подчиняющийся этому закону, называется экспоненциальным, или логарифмическим ростом. Основным параметром, характеризующим скорость роста, служит удельная скорость роста. Остальные параметры роста во многих случаях могут быть выражены через удельную скорость роста.
5.2.2. Время удвоения биомассы
Зависимость между удельной скоростью роста и временем удвоения (td) биомассы можно получить, подставив в уравнение (4)
х = 2 х0 и t = td,
td = ln2 : μ = 0,693 : μ (7)
5.2.3. Степень размножения
Степень размножения определяется отношением х/х0, которое равно е μt . Если биомасса претерпевает п удвоений или генераций, то можно записать:
5.2.4. Экономический коэффициент
Если рост микробной популяции ограничен определенным субстратом, то между начальной концентрацией внесенного в среду лимитирующего субстрата и полученным общим урожаем существует линейная зависимость. Поэтому масса клеток, образованная на единицу лимитирующего субстрата, представляет собой константу - экономический коэффициент, или выход биомассы (Y). Величина Y может быть определена из уравнения:
где ∆х - увеличение биомассы, соответствующее потреблению субстрата в количестве ∆у. Экономический коэффициент, определяется пределом, к которому стремится отношение ∆х/∆у при ∆s —> 0, то есть
Если х и s - концентрация биомассы и субстрата соответственно, то более строго:
Знак минус вводится потому, что значения х и s изменяются в разные стороны.
Если внешние условия в бактериальной культуре поддерживаются постоянными, то экономический коэффициент тоже будет постоянной, количественно воспроизводимой величиной. Таким образом, если х0 и s0 - начальные концентрации биомассы и субстрата соответственно, а х и s - соответствующие концентрации во время роста в культуре, то
Экономический коэффициент, измеренный исходя из потребленного органического субстрата, становится показателем эффективности превращения субстрата в бактериальную массу.
5.2.5. Метаболический коэффициент
Скорость потребления субстрата культурой в данный момент времени выражается отношением:
где х - биомасса, а коэффициент q известен как метаболический коэффициент или удельная скорость метаболизма. Метаболический коэффициент аналогичен ферментативной активности. Если состав биомассы и окружающая среда постоянны, то и д должен быть величиной постоянной.
Для потребления субстрата в небольшой промежуток времени dt можно записать
ds = (μ х : Y) dt, (15)
Сравнивая уравнения (16) и (14), становится видно, что
Уравнение (17) используется для определения потребностей в субстрате, особенно в кислороде, при различных скоростях роста.
5.2.6. Урожай биомассы
Под урожаем биомассы понимают разность между максимальной и исходной массой бактерий: Х = Хмакс - Х0. Эту величину выражают в граммах сухого вещества.
Биологическая библиотека - материалы для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
Для большинства патогенных бактерий оптимальна слабощелочная среда (pH 7,2-7,4). Исключение составляют холерный вибрион - его оптимум находится в щелочной зоне (pH 8,5-9,0) и возбудитель туберкулёза, нуждающийся в слабокислой реакции (pH 6,2-6,8).
Чтобы во время роста микроорганизмов кислые или щелочные продукты их жизнедеятельности не изменили pH, среды́ должны обладать буферностью, т.е. содержать вещества, нейтрализующие продукты обмена.
- быть изотоничными для микробной клетки; т.е. осмотическое давление в среде должно быть таким же, как внутри клетки. Для большинства микроорганизмов оптимальная среда, соответствующая 0,5% раствору натрия хлорида.
- быть стерильными, т.к. посторонние микробы препятствуют росту изучаемого микроба, определению его свойств и изменяют свойства среды.
- плотные среды́ должны быть влажными и иметь оптимальную для микроорганизмов консистенцию.
- обладать определённым окислительно - восстановительным потенциалом, т.е. соотношением веществ, отдающих и принимающих электроны, выражаемым индексом RH2. Например, анаэробы размножаются при RH2, не выше 5, а аэробы - при RH2 не ниже 10.
- быть по возможности унифицированным, т.е. содержать постоянное количество отдельных ингредиентов.
Желательно, чтобы среды́ были прозрачными - удобнее следить за ростом культур, легче заметить загрязнение среды посторонними микроорганизмами.

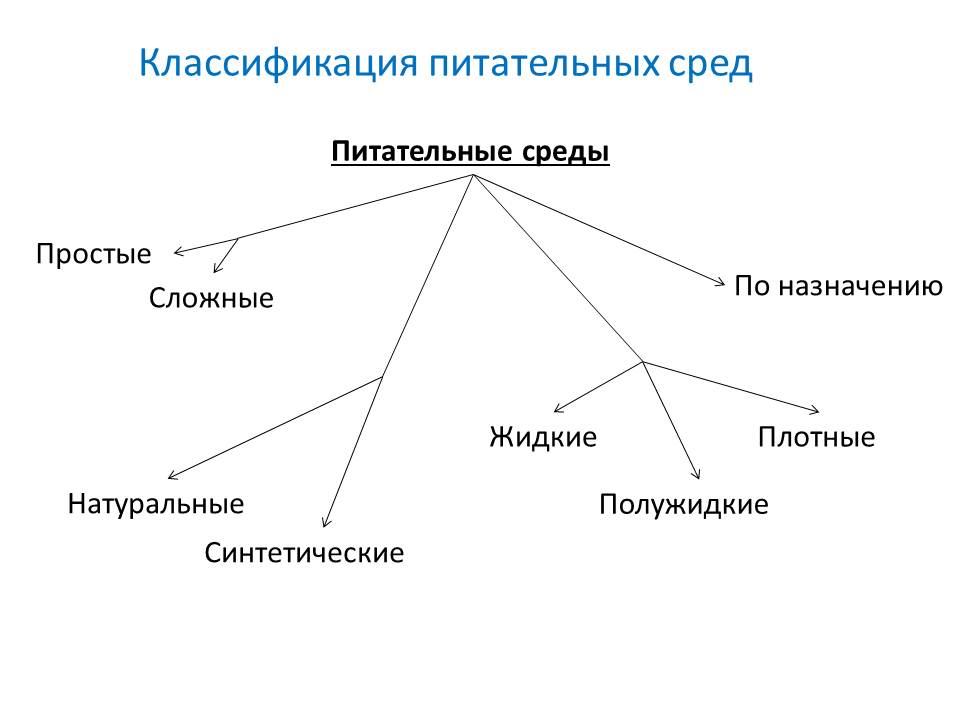
- По исходным компонентам:
- натуральные среды - готовят из продуктов животного и растительного происхождения(мясо, костная и рыбная мука, кормовые дрожжи, сгустки крови и др.)
- синтетические среды - готовят из определённых химически чистых органических и неорганических соединений, взятых в точно указанных концентрациях и растворённых в дважды дистиллированной воде.
- жидкие
- полужидкие
- плотные
Плотные и полужидкие среды готовят из жидких, к которым прибавляют агар-агар или желатин. Кроме того, в качестве плотных сред применяют свёрнутую сыворотку крови, свёрнутые яйца, картофель, среды с селикагелем.Некоторые микроорганизмы используют желатин как питательное вещество - при их росте среда разжижается.
- По составу:
- простые: мясопептонный бульон(МПБ), мясопептонный агар(МПА), , питательный желатин,
- сложные - готовят прибавляя к простым средам кровь, сыворотку, углеводы и другие вещества.
- основные - служат для культивирования большинства патогенных микробов. МПБ, МПА, бульон и агар Хоттингера, пептонная вода.
- специальные - служат для выделения и выращивания микроорганизмов, не растущих на простых средах.
- элективные( избирательные) - служат для выделения определённого вида микробов, росту которых они благоприятствуют, задерживая или подавляя рост сопутствующих микроорганизмов. Среды становятся элективными при добавлении к ним определённых антибиотиков, солей, изменения pH. Жидкие элективные среды называют средами накопления.
- дифференциально-диагностические - позволяют отличить один вид микробов от другого по ферментативной активности.
- консервирующие - предназначены для первичного посева и транспортировки исследуемого материала.
![]()
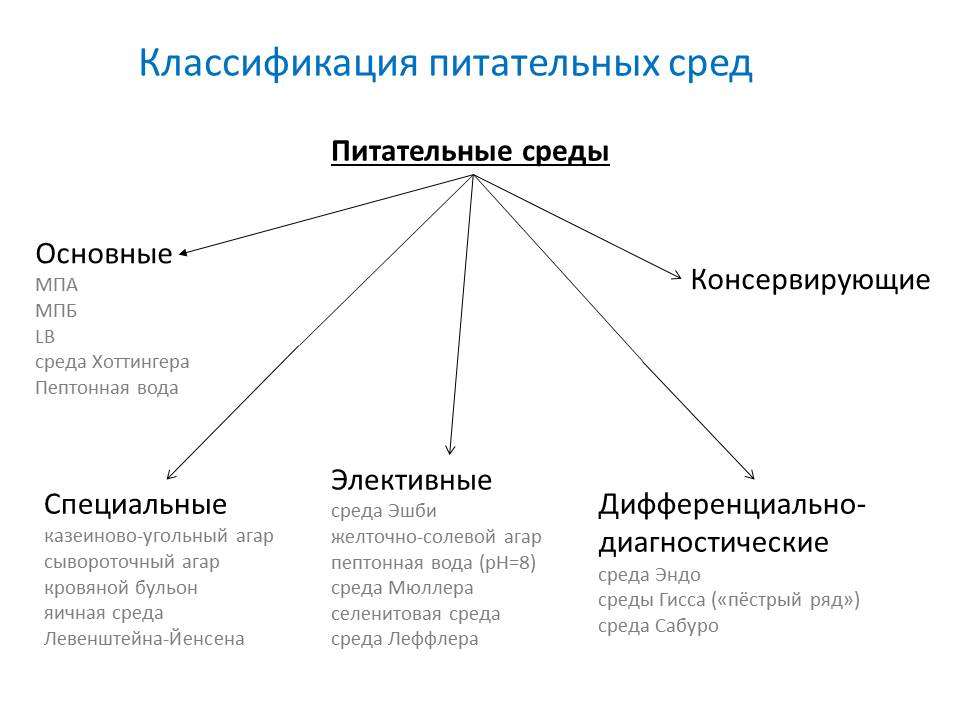
Простые
- мясо-пептонный бульон (МПБ) — жидкая среда
- мясо-пептонный агар (МПА) — плотная среда
Специальные
Специальные методы характеризуются добавлением специфического компонента или заменой основы.
- казеиново-угольный агар
- сывороточный агар
- кровяной бульон
- яичная среда Левенштейна-Йенсена
Элективные
Элективные методы характеризуются получением роста только интересующего микроорганизма.
- Среда Эшби – для азотфиксаторов
- желточно-солевой агар (ЖСА) — для стафилококка
- пептонная вода (1 %,pH=8) — для холерного вибриона
- среда Мюллера — для сальмонелл
- селенитовая среда — для сальмонелл
- среда Леффлера — эффективна для коринебактерий дифтерии
Дифференциально-диагностические
Позволяют произвести идентификацию отдельных типов, видов и групп бактерий.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Синхронные культуры
Синхронные культуры – это бактериальные культуры или популяции, в которой все клетки находятся на одинаковой стадии клеточного цикла. В естественных культурах – периодических и проточных – такого явления не наблюдается. Даже в экспоненциальной фазе роста в культуре содержатся неделящиеся и находящиеся на разных стадиях деления клетки. Синхронное деление клеток вызывают искусственно, воздействуя на культуру различными факторами, например, пониженной или повышенной температурой . Считается, что неблагоприятные температуры больше сказываются на развитии делящихся клеток, более чувствительных к действию различных факторов. В результате происходит торможение развития. За это время к делению подготовятся другие клетки культуры. Следующее за ним воздействие оптимальной температуры постепенно вызывает синхронное деление клеток. Для получения синхронных культур используют метод вынужденного голодания . Клетки помещают на неполноценную среду, культивируют, затем переносят на полноценную. У фотосинтезирующих бактерий синхронные культуры получают чередованием световых и темновых режимов культивирования . Также используют механические методы: пропускание культуры через специальные фильтры (отбор клеток одинакового размера) и центрифугирование (клетки, находящиеся в начале цикла деления, более мелкие и оседают медленнее ).
Синхронные культуры используют для изучения синтеза отдельных клеточных компонентов в процессе деления клетки.
Непрерывные культуры
В 50-е годы 20 века был разработан метод непрерывного культивирования микроорганизмов (метод проточных культур). Сущность метода состоит в том, что в культиватор, где производится выращивание бактерий, все время поступает свежая питательная среда и одновременно с такой же скоростью выводится культуральная жидкость. В результате для микроорганизмов создаются неизменные условия в отношении наличия питательных веществ и фактически отсутствия продуктов обмена. Регулируя скорость проточной среды, можно управлять развитием бактериальной популяции, например, задержать культуру в логарифмической фазе роста на любое длительное время.
Непрерывное культивирование осуществляется в специальных приборах – хемостатах и турбидостатах. В хемостатах рост культуры контролируется концентрацией субстрата. Поддерживая постоянной концентрацию одного из необходимых субстратов (источник азота или углерода) путем регулирования скорости протока среды, можно стабилизировать скорость роста культуры и плотность популяции. При больших скоростях протока среды рост культуры более интенсивный и приближается к максимальному; при меньших – более медленный вследствие ограниченного поступления субстрата. Однако увеличение скорости протока с целью устранения ограничения роста культуры субстратом приводит к вымыванию культуры, снижению плотности популяции.
В отличие от хемостатов принцип работы турбидостата основан на регулировании скорости протока среды плотностью популяции. В турбидостате плотность популяции контролируется с помощью фотоэлемента, соединенного с реле, которое регулирует подачу среды. Как только плотность популяции достигнет заданного уровня, реле срабатывает и в культиватор начинает поступать свежая среда. В результате концентрация клеток уменьшается до определенного уровня, после чего автоматически отключается подача среды. В турбидостате достигается максимальная скорость роста культуры при большей плотности популяции и большей точности регулирования поступления среды.
Проточное культивирование микроорганизмов используется в изучении физиологии микроорганизмов, т.к. позволяет их культивировать в контролируемых условиях. Кроме того, этот метод нашел широкое применение в микробиологической промышленности, т.к. дает возможность управлять биосинтетическими процессами микроорганизмов.
![]()
Выделение чистых культур микроорганизмов
Чистой культурой называют такую культуру, которая содержит микроорганизмы одного вида. Выделение чистых культур бактерий - обязательный этап бактериологического исследования в лабораторной диагностике инфекционных болезней, в изучении микробной загрязненности различных объектов окружающей среды, и, в целом, при любой работе с микроорганизмами. Исследуемый материал (гной, мокрота, фекалии, кровь и другой материал от больных; вода, почва, воздух, пищевые продукты, трупы животных и человека, переносчики) обычно содержит ассоциации микробов.
Выделение чистой культуры позволяет изучить морфологические, культуральные , биохимические, антигенные и другие признаки, по совокупности которых определяется видовая и типовая принадлежность возбудителя, то есть производится его идентификация.
Для выделения чистых культур микроорганизмов используют методы, которые можно разделить на несколько групп.Под ростом понимают согласованное увеличение количества всех химических компонентов, формирующих клеточные структуры. Рост клеток обычно сопровождается увеличением их массы и размеров. Однако эта закономерность наблюдается не всегда, так как в некоторых условиях клетки способны просто накапливать запасные или резервные вещества, т. е. масса может увеличиваться, но роста при этом не наблюдается. В подходящей же среде, к которой бактерии полностью адаптированы, они находятся в состоянии сбалансированного роста. В период
сбалансированного роста удвоение биомассы сопровождается удвоением всех других учитываемых параметров популяции, например количества белка, ДНК, РНК и внутриклеточной воды. Иными словами, культуры, растущие сбалансированно, сохраняют постоянный химический состав. В культуре, растущей сбалансированно, скорость прироста вещества клеток в любой данный момент пропорциональна числу или массе имеющихся в это время бактерий. Коэффициент пропорциональности называют удельной скоростью роста (μ).
В лабораторных и промышленных условиях используют два основных способа культивирования микроорганизмов: периодическое (статическое) и непрерывное (проточное).
Рост бактерий в периодической культуре происходит до тех пор, пока содержание какого-нибудь из необходимых им компонентов питательной среды не достигнет минимума, после чего рост прекращается.
Лаг-фаза, или фаза задержанного роста, охватывает промежуток времени между посевом бактерий и достижением ими максимальной скорости деления. В клетках бактерий в этот период идут в основном процессы, связанные с приспособлением их к условиям культивирования
(составу среды, температуре, рН и т. п.). происходит быстрое увеличение количества РНК (в 8–12 раз).
деления клеток не происходит, отмечаются лишь процессы, подготавливающие клетку к размножению.
Начальная фаза размножения, или фаза ускорения роста, когда клетки начинают делиться с постепенно увеличивающейся скоростью.
Фаза экспоненциального (логарифмического) роста характеризуется постоянной максимальной скоростью деления клеток и скоростью роста. Для различных видов бактерий эти величины могут варьировать в значительных пределах. Например, бактерии E. coli при 37 ºС делятся примерно каждые 20 мин, а бактерии родов Nitrosomonas и Nitrobacter –5–10 ч. Культуры бактерии E. coli вступают в стационарную фазу при концентрации клеток 2–5 . 109/мл.
Во время экспонециальной фазы все клетки в популяции имеют приблизительно одинаковый размер, содержат максимальное количество РНК, количество белка в них также максимально и постоянно. Во время экспоненциальной фазы клетки наиболее жизнеспособны и обладают
высокой биохимической активностью.
Стационарная фаза наступает тогда, когда число жизнеспособных клеток достигает максимума и не увеличивается, так как скорость размножения бактерий равна скорости их отмирания.
период несбалансированного роста, когда компоненты клеток синтезируются с различными скоростями, соответственно и содержание отдельных химических веществ в клетках на разных стадиях отличается.
Клетки в стационарной фазе меньше по размеру, содержат меньше РНК, более устойчивы к различного рода воздействиям (физи-ческим и химическим), чем в экспоненциальной фазе роста культур. В этот период в клетках или в среде культивирования нередко накапливаются продукты
вторичного метаболизма (антибиотики, пигменты, бактериоцины и др.).
Если вам нужна помощь в написании работы, то рекомендуем обратиться к профессионалам. Более 70 000 авторов готовы помочь вам прямо сейчас. Бесплатные корректировки и доработки. Узнайте стоимость своей работы.
при исчерпании питательного субстрата голодающая популяция бактерий разделяется на две субпопуляции, одна из которых погибает и подвергается автолизу, клетки же другой популяции, используя продукты автолиза как субстрат, продолжают размножаться. Установлен механизм генетического контроля апоптоза у бактерий E. coli.
В фазе отмирания происходит экспоненциальное снижение числа живых клеток
Энтеробактерии отмирают медленно в отличие от некоторых видов бактерий рода Bacillus, скорость гибели которых происходит быстро. Причины отмирания клеток могут быть разными. Это и накопление органических кислот (Escherichia, Lactobacillus), автолиз (лизис над действием собственных ферментов), накопление антибиотиков, бактериоцинов и др.
В условиях непрерывного (проточного) культивирования в сосуд, содержащий популяцию бактерий, подается свежая питательная среда и из него одновременно удаляется часть среды с клетками микроорганизмов. Это позволяет на длительное время задержать культуру в состоянии
Развитие управляющих функций мозга ребёнка: полезные советы и упражнения для педагогов
Сертификат и скидка на обучение каждому участнику
Управление образования администрации города Черемхово
Муниципальное общеобразовательное учреждение
Анализ условий питательной среды для бактерий
Вид работы: исследовательская
Автор: обучающаяся 8 класса
Руководитель:
Булгакова Светлана Владимировна,
1.1. Бактерии и условия их культивирования
1.2. Принципы культивирования бактерий
1.3. Основные питательные среды.
2.Влияние окружающей среды на микроорганизмы
3. Проведение бактериологического исследования
3.1. Организация проведения бактериологического исследования
3.2. Результаты бактериологического исследования
Список использованных источников
Полезные и опасные, милые и ужасные, смертоносные и дающие жизнь. Они вокруг и их невозможно увидеть. Непросто отыскать более интересный объект для исследований. По количеству невероятных сюжетов мир бактерий можно сравнить с миром привидений. Но в отличие от изучения привидений, из информации о бактериях можно извлечь массу практической пользы, чем научное сообщество и занимается вот уже более ста лет .
Учёные прогнозируют, что результаты изучения жизни бактерий в будущем приведут к:
открытию секрета долголетия и даже бессмертия (во льдах найдены бактериальные сообщества, в которых обнаружены представители возрастом более миллиона лет);
получению альтернативных источников энергии, в том числе и пищи;
получение новых материалов биологического происхождения;
формированию новых экосистем.
Любое открытие в микробиологии сразу же подхватывается промышленниками, которые внедряют новые технологии в современное производство и предлагают результаты рынку.
Знакомясь с новинками, человек получает возможность не только оперировать более значительным объемом средств в достижении утилитарных целей, но и самостоятельно заглянуть в прошлое планеты Земля и в ее будущее.
Цель исследования : изучение условий среды, способствующей росту и размножению бактерий.
Задачи исследования:
Получить представление о бактериях и условиях их культивирования;
Рассмотреть виды питательных сред для размножения бактерий;
Понять особенности размножения бактерий на жидких и плотных питательных средах;
Раскрыть влияние факторов окружающей среды на микроорганизмы;
Провести бактериологическое исследование.
Объект исследования : бактерии.
Предмет исследования : рост бактерий на различных питательных средах.
Гипотеза : скорость размножения микроорганизмов помимо видовой принадлежности зависит от состава питательной среды, рН, температуры, аэрации и других факторов.
Методы исследования: поисковый метод; наблюдение; анализ, синтез, сравнение; обобщение.
Научная значимость исследования заключается в расширении аппарата для решения заданий ЕГЭ . Практическая значимость исследования состоит в том, что его материалы могут быть использованы в образовательной деятельности по биологии, для проведения занятий в кружке, факультативных занятий.
Обзор литературы
Бактерии и их размножение привлекло внимание учёных со времён Левенгука, когда он впервые увидел их в микроскоп. В 1850-х годах Луи Пастер положил начало изучению физиологии и метаболизма бактерий, а также открыл их болезнетворные свойства. Это послужило возникновению микробиологии – науки, которая
В разное время изучением бактерий занимались Гусев М. В.и Минеева Л. А., Заварзин Г. А., Герхардт Ф . и др. учёные микробиологи.
Рассмотрим наиболее значимые на современном этапе развития микробиологии научные труды, посвящённые питательным для бактерий средам.
Питательные среды для размножения бактерий: условия, виды
Бактерии и условия их культивирования
1.Размножение бактерий на жидких и плотных питательных средах
Бактерии, как правило, характеризуются высокой скоростью размножения по сравнению с другими прокариотами. Скорость их размножения, помимо видовой принадлежности, зависит от состава питательной среды, рН, температуры, аэрации и других факторов. На плотных питательных средах бактерии образуют скопления клеток, называемые колониями. Внешний вид колоний у многих бактерий настолько характерен, что может служить одним из дифференциальных признаков для их идентификации. Колонии разных видов отличаются по своим размерам, форме, поверхности, окраске, прозрачности и др. Однако эти признаки могут изменяться в зависимости от условий культивирования.
На жидких средах рост бактерий характеризуется образованием пленки на поверхности питательной среды, равномерного помутнения, либо осадка.
Размножение бактерий определяется временем генерации, т. е. периодом, в течение которого осуществляется деление клетки. Продолжительность генерации зависит от вида бактерий, возраста, популяции, состава питательной среды, температуры и других факторов. В оптимальных условиях время генерации у разных бактерий колеблется довольно в широких пределах: от 20 минут у кишечной палочки до 14 ч у мик о бактерий туберкулеза, в связи с чем их колонии образуются через 18 – 20 ч либо через 3 – 5 недели соответственно 3 .
При выращивании бактерий в жидкой питательной среде наблюдается последовательная смена отдельных фаз в развитии популяции, отражающая общую закономерность роста и размножения бактериальных клеток.
Динамика развития бактериальной популяции представлена на рис.1
Рис.1. Динамика развития бактериальной популяции
I - исходная стационарная фаза начинается после внесения бактерий в питательную среду. В течение данной фазы число бактериальных клеток не увеличивается.
II - лаг-фаза , или фаза задержки размножения, характеризуется началом интенсивного роста клеток, но скорость их деления остается невысокой. Две первые фазы можно назвать периодом адаптации бактериальной популяции, продолжительность которого определяется возрастом культуры, а также количеством и качеством питательной среды.
III - лог-фаза , или логарифмическая (экспоненциальная), фаза отличается максимальной скоростью размножения клеток и увеличением численности бактериальной популяции в геометрической прогрессии. Логарифмическая фаза у бактерий с коротким временем генерации продолжается несколько часов.
IV - фаза отрицательного ускорения характеризуется меньшей активностью бактериальных клеток и удлинением периода генерации. Это происходит в результате истощения питательной среды, накопления в ней продуктов метаболизма и дефицита кислорода.
1.2.Принципы культивирования бактерий
Микроорганизмы культивируют, как правило, на искусственных питательных средах. В зависимости от пищевых потребностей того или другого вида питательные среды должны содержать соответствующие исходные вещества, необходимые для пластического и энергетического метаболизма.
Выделение микроорганизмов из различных материалов и получение их культур широко используется в лабораторной практике для микробиологической диагностики инфекционных заболеваний, в научно-исследовательской работе и в микробиологическом производстве вакцин, антибиотиков и других биологически активных продуктов микробной жизнедеятельности. 4
Условия культивирования также зависят от свойств соответствующих микроорганизмов. Большинство патогенных микробов выращивают на питательных средах при температуре 37 °С в течение 1–2 сут. Однако некоторые из них нуждаются в более длительных сроках. Например, бактерии коклюша – в 2–3 сут, а микобактерии туберкулеза – в 3–4 нед.
Для стимуляции процессов роста и размножения аэробных микробов, а также сокращения сроков их выращивания используют метод глубинного культивирования, который заключается в непрерывном аэрировании и перемешивании питательной среды. Глубинный метод нашел широкое применение в биотехнологии.
Требования к питательным средам . Для выращивания бактерий в лабораторных условиях, исследования их разнообразных свойств, длительного хранения используют питательные среды. Они должны отвечать определенным стандартам, создавая оптимальные условия для роста, размножения и жизнедеятельности микроорганизмов.
В первую очередь, бактерии нуждаются в азоте, углероде и водороде для построения собственных белков. Водород и кислород для клеток поставляет вода. Источником азота выступают многочисленные вещества, в основном, животного происхождения (мясо говяжье, рыба, мясо-костная мука, казеин. Можно использовать и заменители мяса – плаценту, кровяные сгустки, дрожжи. Следовательно, в состав сред должны быть введены источники питательных веществ и вода, а также ростовые факторы (витамины группы В, ферменты). Универсальным источником их служат экстракты из белков животного и растительного происхождения. Для микробов с более сложными пищевыми потребностями в состав сред включают субстраты – кровь, сыворотку, яичный желток, кусочки печенки, почек, мозговой ткани и др. 5
Среды должны быть сбалансированными за микроэлементным составом и содержать ионы железа, меди, марганца, цинка, кальция, натрия, калию, иметь в своем составе неорганические фосфаты.
Среды должны иметь определенную вязкость, плотность, иметь определенную влажность (до 20 % воды), быть прозрачными и обязательно стерильными.
Oсновные требования к питательным средам: прозрачность; стерильность; лёгкая усвояемость; определенный состав азотистых веществ, углеводов, витаминов; определённая вязкость.
1. 3. Основные питательные среды.
Многочисленные потребности микроорганизмов предопределяют большое разнообразие питательных сред, а для отдельных видов бактерий существуют специальные среды. Часть их готовят в лабораториях непосредственно перед посевом, но с каждым годом появляются все новые и новые среды заводского изготовления (сухие), которые способны удовлетворить самые прихотливые потребности микробиологов. Они сохраняются длительное время, имеют стандартный состав.
Среды разделяются на естественные и искусственные. Для создания естественных сред используют свернутую сыворотку, молоко, яйца, мышечную ткань.
Искусственные среды создают путем комбинирования разнообразных субстратов, которые обеспечивают те или другие потребности микроорганизмов. Их используют в основном для экспериментального изучения отдельных звеньев метаболизма бактерий.
В зависимости от своей плотности, среды разделяются на жидкие, полужидкие и плотные. Полужидкие и плотные среды готовятся из жидких, добавляя соответственно 0,3-0,7 % но 1,5-2,0 % агара. Последний представляет собой волокнистый материал, который добывают из морских водорослей. Состоит он из полисахаридов (70-75 %), белков (2-3 %). Для создания плотных сред используют также желатин (10-15 %), свернутую сыворотку крови.
В зависимости от потребностей бактериологов питательные среды разделяются на пять основных групп (прил.1 таблица 1) .
Первая группа – универсальные (простые) среды. К ним принадлежат мясо-пептонний бульон (МПБ) и мясо-пептоннийагар (МПА). За своим составом, наличием питательных веществ они пригодны для культивирования многих видов бактерий.
Вторая группа – специальные среды. Они используются в тех случаях, когда микроорганизмы не растут на простых. К ним принадлежит кровяной, сывороточный агары, сывороточный бульйон, асцитический бульйон, асцит-агар и другие.
Третья группа – элективные среды, на которых микроорганизмы определенного вида растут быстрее, более интенсивно, опережают в своем развитии другие виды бактерий.
Четвертая группа селективные среды, которые благодаря добавлению определенных компонентов (желчь, краски, антибиотики и др.) способны подавлять развитие одних видов микроорганизмов, но не влияют на другие виды.
Пятая группа – дифференциально-диагностичнеские среды. Это большая группа сред, которые позволяют определить определенные биохимические свойства микроорганизмов и проводить их дифференциацию.
Рис.2.Среда Плоскирева. Рис.3. Среда Левина
2.Влияние окружающей среды на микроорганизмы
Рассмотрим факторы окружающей среды, влияющие на микроорганизмы.
Температура. Низкие температуры бактерии выдерживают сравнительно легко. Культуры микроорганизмов в замороженном виде сохраняются в лабораторных условиях более чем 80 лет. Выделено жизнеспособный микроорганизм из толщи ледников, возраст которых 12 000 лет.
Холерный вибрион не погибает при температуре -32 °С; некоторые виды бактерий хранят жизнеспособность при температуре жидкого воздуха ( -190 °С), жидкого водорода (-253 °С).
Низкие температуры прекращают процессы гниения и брожения. На этом принципе основывается использование в практике ледников, погребов и холодильных установок для хранения пищевых продуктов.
Пагубно действуют на бактерии высокие температуры . Большинство бактерий погибают при температуре 58–60 °С через 30–60 мин, при 100 °С – в течение 2–3 мин. Силикатные бактерии сохраняются жизнеспособными после деяния на них нагревание до 160 °С.
Высушивание . Стойкость микроорганизмов к высушиванию разная. Чувствительные к высушиванию гонококки, менингококки, трепонемы, лептоспиры, гемофильные бактерии, фаги. Холерный вибрион не погибает под воздействием высушивания 2 сутки, шигели– 7, чумная палочка – 8, дифтерийная –30, брюшнотифозная – 70, стафилококки и микобактерии туберкулеза – 90 суток. Высохшая мокрота больных туберкулезом остается заразной 10 месяцев, споры бацилл сибирской язвы сохраняются до 10 годов, плесневых грибов – 20 лет.
Лучевая энергия . Разные виды излучения имеют бактерицидное или стерилизующее действие. К ней принадлежат ультрафиолетовое, рентгеновское, альфа-, бета-, гамма- и нейтронное излучение. Наиболее выраженное бактерицидное действие имеет прямой солнечный луч.
Высокое давление, ультразвук, механическое сотрясение . Воздействие высокого атмосферного давления 10 132,5 – 91 192,5 кПа (100–900 атм) на глубине морей и океанов 1000–10 000 м бактерии переносят легко. Дрожжи хранят свою жизнеспособность при давлению 50 662,5 кПа (500 атм). Некоторые бактерии, дрожжи, плесневые грибы выдерживают давление 303 975 кПа (3000 атм), фитопатогенные вирусы – 506 625 кПа (5000 атм).
Ультразвук имеет бактерицидные свойства, которые используют для стерилизации пищевых продуктов, изготовления вакцин и дезинфекции предметов.
3. Проведение бактериологического исследования
3.1 Организация проведения бактериологического исследования
Поиск информации по теме, т.е. изучение литературы, материалов Интернет-ресурсов о принципах культивирования бактерий
Изучение научных источников, подбор краткой информации, раскрывающей тему.
Читайте также: