Оптимальные условия инкубирования посевов воды для выявления термотолерантных колиформных бактерий
Добавил пользователь Alex Обновлено: 19.09.2024
Развитие управляющих функций мозга ребёнка: полезные советы и упражнения для педагогов
Сертификат и скидка на обучение каждому участнику
Микробиологический анализ воды:
питьевой и водоема
Выполнили анализ: Дятлова Екатерина, ученица 10 класса Русу Алин, ученица 8 класса
МОУ Шерловогрская средняя общеобразовательная школа № 47 Забайкальский край
пгт. Шерловая Гора
Заявленная тема исследования актуальна. Вода – среда обитания всех живых организмов. Чистота воды связана со здоровьем человека. Какими способами можно очистить и исследовать воду необходимо знать современному человеку. Мы, Русу Алина, ученица 8 класса, Дятлова Катя, ученица 10 класса, провели исследование питьевой воды и воды из водоема на предмет обнаружения микробов, применив 2 методики: метод мембранных фильтров, титрационный метод, с учетом материальной базы школы.. Соблюдались все правила, необходимые для проведения микробиологического анализа воды. Взяты пробы воды питьевой в школе и пробы воды из небольшого озерка в окрестности поселка Шерловая Гора. Летом в этом водоеме купаются, оно подпитывается грунтовыми водами. Использованы методы: метод мембранных фильтров, но посев на другую среду (желатин), титрационный метод с использованием среды – агар. Агар нам привезли из города, поэтому с работой были задержки и пришлось в качестве среды брать желатин. Термостата для инкубирования проб нет, подогревали на батарее, подложив картон для поддержания необходимой температуры. Есть оборудование для проведения микробиологического анализа воды, кроме термостата и камеры для подсчета клеток бактерий. В результате проведенного анализа было выяснено, что питьевая вода в школе соответствует стандартным нормам, в 1мл содержится не более 3 бактерий; вода из водоема загрязненная, купаться в ней опасно для здоровья: 98 КОЕ/мл., но крупный рогатый скот может ее пить. Кратко изложены достоинства обеих методик. Предпочтение отдано методике мембранных фильтров. Приготовлены микропрепараты с фильтров, воды с водоема и водопроводной воды и рассмотрены колонии микробов, произведен подсчет количества микроорганизмов визуально. Специального оборудования для подсчета концентрации микробов нет, но с методами прямого подсчета ознакомились. Результаты микробиологического анализа воды питьевой и поверхностных вод (водоем) изложены в журнале, протоколе, подготовлена презентация. Консультантом выступил заслуженный учитель РФ, преподававший 48 лет биологию в данной школе, Журавлева Валентина Ивановна.
Вода является естественной средой обитания микроорганизмов, не всех, но достаточно многих. Микроорганизмы способны осуществлять в воде все процессы своей жизнедеятельности, проводя при этом разложение различных органических соединений. Они способны жить, размножаться, участвовать в процессах круговорота углерода, азота, различных элементов. Количественный и качественный состав микробиоты разных природных вод различается и весьма разнообразен. В воде открытых водоемов обитают самые разные микроорганизмы: палочковидные бактерии, кокки, вибрионы, спириллы, спирохеты, различные фотосинтезирующие бактерии, грибы, вирусы, плазмиды, простейшие. Количественный и качественный состав микробиоты воды зависит от ее происхождения. Например, галофильные бактерии обитают в морской воде. Количество микроорганизмов регламентируется в основном содержанием в воде органических веществ. Многие микроорганизмы хорошо размножаются в воде, и их количество может достигать миллионов в одном миллилитре. Вода, просачиваясь через почву, подвергается своеобразной природной фильтрации, поэтому грунтовые воды значительно чище воды открытых водоемов. « Степень загрязнения воды характеризуется показателем сапробиости (от греч. sapros — гнилой). Различают три категории воды (зоны водоема) по степени микробного загрязнения:
• полисапробная — максимально загрязненная вода. Это вода, богатая органическими веществами и содержащая мало кислорода. Количество микроорганизмов в такой воде — несколько миллионов, часто встречаются кишечные палочки, много гнилостных бактерий;
• мезосапробная — среднезагрязненная вода. В такой воде активно протекают процессы разложения органических веществ и минерализации, сопровождающиеся интенсивным окислением, и нитрификации. Количество микроорганизмов в воде мезосапробной зоны значительно меньше, чем в полисапробной, — сотни тысяч в одном миллилитре;
Особую категорию составляет питьевая вода. Это вода, к которой предъявляются строгие санитарные требования. Жесткие требования направлены на эпидемиологическую безопасность воды. Дело в том, что вода играет большую роль в распространении многих инфекций, особенно пищевых. Возбудители брюшного тифа, холеры, полиомиелита, дизентерии, сальмонеллезов и многих других заболеваний способны длительное время находиться в воде в жизнеспособном состоянии. От больных людей и бактерионосителей опасные микроорганизмы попадают в сточные воды, далее (если были нарушены этапы очитки вод) — в окружающую среду, включая воды открытых водоемов, а оттуда могут (опять в случае нарушения санитарной обработки воды) попасть в питьевую воду. Отдельные микроорганизмы могут размножаться в воде: примером является холерный вибрион. Для этого микроорганизма наличие органических соединений и высокая температура являются крайне благоприятными. Многие патогены хорошо переносят низкие температуры, месяцами способны сохраняться во льду в жизнеспособном состоянии. Прямые методы выделения патогенных микроорганизмов из воды и идентификации их сложны и достаточно трудоемки. Часто используют косвенные методы, позволяющие произвести оценку санитарного состояния воды и получить количественную оценку степени фекального загрязнения воды. Количество микроорганизмов в воде в значительной степени различается в зависимости от источника или происхождения. Выделяют воды подземные и поверхностные.
Подземные воды . К ним относят воды артезианскую, ключевую и грунтовую. Состав микробиоты этой воды зависит прежде всего от того, на какой глубине расположен водоносный слой: чем дальше он от поверхности, тем меньше содержание в такой воде микроорганизмов. Естественно, играет роль и его защищенность от загрязнений. Артезианские воды находятся на большой глубине, и количество микроорганизмов в них крайне мало. Подземные воды обычных колодцев контаминированы очень по-разному: от абсолютно чистой воды, содержащей единичные клетки, до очень грязной, количество микроорганизмов в которой достигает 10 6 КОЕ/см 3 . Высокая контаминация такой колодезной воды связана с тем, что в колодцы просачиваются поверхностные загрязнения, содержащие большое количество бактерий (возможно, и патогенных), споры грибов и другие микроорганизмы. Близко расположенные к поверхности земли грунтовые воды отличаются обильной и разнообразной микробиотой.
Поверхностные воды . Это воды всех открытых водоемов: океанов, озер, рек, водохранилищ, прудов. Микробиота в них крайне различна, зависит от множества факторов: времени года, химического состава воды, целевого назначения водоема, климатических условий, заселенности прибрежных районов и др. В поверхностные источники воды попадает много микроорганизмов из окружающей среды. Особенно значительно это число, когда вода протекает через населенные пункты и в реку попадают сточные воды.
Питьевая вода . В качестве источников питьевой воды в системе водоснабжения используют воды подземные и воду открытых водоемов, специальным образом очищенную и подготовленную. Самое главное: вода должна быть безопасна в эпидемиологическом отношении. Разработаны и утверждены микробиологические критерии качества питьевой воды. Наличие в воде патогенных микроорганизмов проводят лаборатории, имеющие разрешение Роспотребнадзора.
К общим колиформным бактериям (ОКБ) относят аэробные и факультативноанаэробные не образующие спор грамотрицательные оксидазоотрицательные палочки, сбраживающие лактозу с образованием кислоты и газа при температуре 37(+1)°С в течение 24-48 ч. Термотолерантные колиформные бактерии (ТКБ) в дополнение к вышеперечисленному сбраживают лактозу до кислоты и газа при 44(±0,5) °С в течение 24 ч.
ОКБ и ТКБ определяют титрационным (бродильным) и мембранным методами. Арбитражным является метод мембранной фильтрации.
Титрационный (бродильный метод). Титрационный метод используют только при отсутствии материалов и оборудования, необходимых для выполнения анализов методом мембранной фильтрации, наличии в исследуемой воде большого количества взвешенных веществ, преобладании посторонней микрофлоры, препятствующей получению на фильтрах изолированных колоний.
Метод основан на посеве строго определенных объемов анализируемой воды и подращивании при 37 °С в средах накопления с последующим высевом бактерий на плотную среду Эндо, дифференцировании выросших микроорганизмов и определении наиболее вероятного числа бактерий в 1 л воды по таблицам.
Каждый указанный объем воды помещают во флаконы или пробирки с лактозо-пептозной средой. Посев 100,0 и 10,0 мл воды производят во флаконы и пробирки соответственно с 10,0 и 1,0 мл концентрированной среды, посев 1,0 мл пробы — в пробирки с 10,0 мл среды нормальной концентрации. Посевы инкубируют 24 ч при 37(±1)°С. Если признаки роста (помутнение) и газообразования не наблюдаются, то посевы оставляют в термостате и окончательно просматривают через 48 ч.
Отсутствие помутнения и образования газа во флаконах и пробирках—свидетельство отрицательного результата, что позволяет закончить исследование.
Из выросших на среде Эндо красных, розовых, бледно-розовых колоний с металлическим блеском или без него, выпуклых с красным центром и отпечатком на питательной среде (лактозоположительные колонии) делают мазки, окрашивают по Граму и ставят оксидазный тест, позволяющий дифференцировать ОКБ и грамотрицательные бактерии семейства Pseudomonadaceae и других оксидазоположительных бактерий, обитающих в воде. С этой целью 2-3 изолированные колонии снимают с поверхности среды стеклянной палочкой, наносят штрихом на фильтрованную бумагу, смоченную раствором диметил-n-фенилендиамином (можно использовать готовые бумажные оксидазные диски).
При отрицательном оксидазном тесте цвет бумаги не изменяется, при положительном она окрашивается в синий цвет в течение 1 мин.
Наличие грамотрицательных палочек в мазках и отрицательный оксидазный тест позволяют дать положительный ответ о наличии ОКБ при анализе воды.
При необходимости выявления БГКП грамотрицательные палочки, не образующие оксидазу, вновь исследуют в бродильном тесте, внося петлей посевной материал в полужидкий питательный агар с 0,5% глюкозы, и инкубируют при 37 °С в течение суток. Наличие кислоты и газа свидетельствует о положительном результате.
Для определения ТКБ делают посев 2-3 изолированных лактозоположительных колоний каждого типа из каждого сектора на среде Эндо в пробирки с любой из лактозных сред, нагретые до 44 °С. Немедленно после посева пробирки помещают в термостат и инкубируют при 44(±0,5) °С в течение 24 ч (предварительную оценку посевов можно проводить через 4-6 ч). Образование кислоты и газа в посевах указывает на наличие ТКБ.
Для ускорения выдачи ответа при анализе на присутствие ТКБ можно посеять 1 мл из среды накопления, в которой отмечено помутнение и газообразование, в пробирку с подогретой до 44 °С лактозопептонной средой. Посевы культивируют при температуре 44(±0,5) °С в течение 24 ч. При обнаружении кислоты и газа дают положительный ответ.
Если при проведении качественного анализа питьевой воды ОКБ или ТКБ обнаружены хотя бы в одном из трех объемов, то выдается ответ об обнаружении этих микроорганизмов в 100 мл.
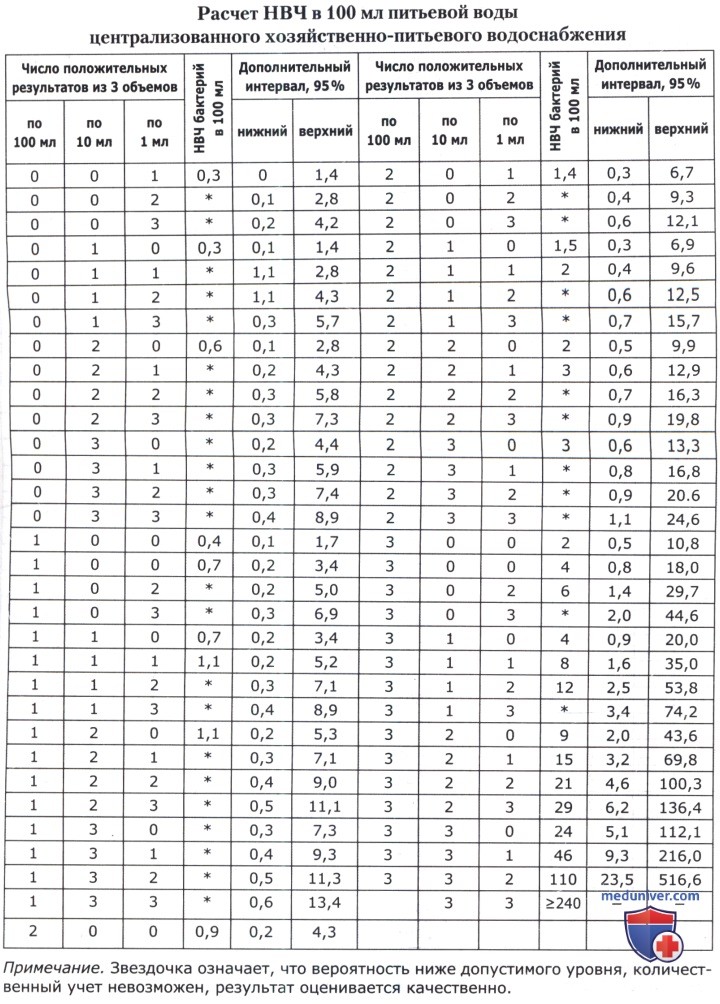
При количественном анализе определяют наиболее вероятное число (НВЧ) ОКБ и ТКБ в питьевой воде и воде открытых водоемов.
Часто результат анализа выражают в виде коли-индекса или коли-титра. Коли-титр — минимальное количество воды (в мл), в котором обнаруживаются БГКП. Коли-индекс — количество БГКП, содержащихся в 1 л исследуемой воды (по международному и европейскому стандарту, в 100 мл). Величину коли-индекса определяют по таблицам ниже. Зная коли-индекс, рассчитывают коли-титр по формуле: коли-титр = 1000/коли-индексс.
Метод основан на накоплении бактерий после посева установленного объема воды на жидкую питательную среду с последующим пересевом на дифференциальную плотную питательную среду с лактозой и идентификацией колоний по культуральным и биохимическим тестам.
При образовании помутнения и газа в среде накопления и росте на среде Эндо колоний, типичных для лактоза-положительных бактерий: темно-красных или красных, с металлическим блеском или без него, выпуклых с красным центром и отпечатком на питательной среде, дают положительный ответ на присутствие общих колиформных бактерий в данном объеме пробы.
Факт наличия ОКБ необходимо подтвердить если: в среде накопления отмечено только помутнение; принадлежность к лактоза-положительным колониям вызывает сомнение.
В этих случаях: проверяют наличие окрашенных отпечатков на среде Эндо после снятия петлей подозрительной колонии; выполняют оксидазный тест; подтверждают принадлежность к Граму; подтверждают способность к газообразованию при посеве изолированных 1-2 колоний каждого типа с каждого сектора на среду с лактозой с последующей инкубацией посевов при 37 оС в течение 24-48 часов.
Для определения ТКБ делают посев 2-3 изолированных колоний каждого типа с каждого сектора среды Эндо в пробирки с лактозной средой, нагретой до 44 оС и инкубируют в термостате 24 часа при 44 оС. Допускается просмотр посевов через 4-6 часов.
При образовании газа в среде накопления, росте на среде Эндо лактоза-положительных бактерий и выявлении их способности ферментировать лактозу до кислоты и газа в течение 24 часов при 44 оС дают положительный ответ на наличие в этом объеме пробы воды ТКБ. Во всех остальных случаях дают отрицательный ответ.
Норматив: ОКБ и ТКБ должны отсутствовать в 100 см3 воды.
1.1.3.Определение спор сульфитредуцирующих клостридий
Сульфитредуцирующие клостридии — спорообразующие анаэробные палочковидные микроорганизмы, восстанавливающие сульфит натрия на железосульфитном агаре при 44 оС в течение 16-18 часов.
Метод основан на выращивании посевов в железосульфитном агаре в условиях, приближенных к анаэробным и подсчете черных колоний.
Проведение анализа. Пробу воды 20 см3 прогревают на водяной бане в пробирках 15 минут при 75 оС для уничтожения вегетативных форм. При исследовании хлорированной воды прогревание пробы можно не проводить.
Из каждой пробы питьевой воды делают посев или фильтруют 20 см3. При необходимости подбирают объемы с таким расчетом, чтобы в посевах (в фильтрах) выросло не более 10-15 колоний.
Определение методом фильтрования в чашках Петри. Чашки Петри заливают тонким слоем железо-сульфитного агара. После фильтрации фильтр помещают на застывшую питательную среду фильтрующей поверхностью вниз. Затем заливают расплавленным железо-сульфитным агаром до верхнего края чашки, чтобы крышка плотно прилегала к среде для создания анаэробных условий. Посевы культивируют 16-18 часов при 44 оС.
Определение прямым посевом. В стерильные пробирки вносят по 5 или 10 см3 исследуемой пробы воды, заливают горячим железо-сульфитным агаром в количестве, превышающем объем воды в 2 раза. Пробирку быстро охлаждают. Посевы инкубируют при 44 оС в течение 16-18 часов.
Норматив: споры сульфитредуцирующих клостридий должны отсутствовать в 20 см3 питьевой воды.
1.1.4. Определение колифагов.
Титрационный метод определения колифагов. Определение колифагов в питьевой воде включает предварительное накопление колифагов в среде обогащения на культуре E.coli и последующее выявление зон лизиса (просветления) газона E.coli на питательном агаре. Метод предназначен для проведения текущего контроля качества питьевой воды.
Проведение качественного анализа. В исследуемую пробу воды объемом 100 см3 вносят питательный бульон и подготовленный смыв тест культуры E.coli, помещают в термостат и инкубируют 18 часов при 37 оС. Затем из исследуемой пробы воды отливают в пробирку 10 см3, добавляют хлороформ, пробирку закрывают стерильной резиновой пробкой, встряхивают и оставляют при комнатной температуре до полного осаждения хлороформа. В предварительно расплавленный и остуженный до 45-49 оС питательный агар добавляют приготовленный смыв культуры E.coli. В стерильную чашку Петри пипеткой из пробирки переносят 1 см3 обработанной хлороформом пробы, заливают смесью расплавленного и остуженного до 45-49 оС питательного агара и осторожно покачивают для равномерного перемешивания пробы воды и агара. После застывания чашку переворачивают и инкубируют в термостате 18 часов при 37 оС. Параллельно проводят контроль культуры E.coli.
Учет результатов. Просмотр посевов проводят в проходящем свете. Проба считается положительной при наличии полного лизиса, просветлении нескольких бляшек, одной бляшки на чашке с пробой воды при отсутствии зон лизиса на контрольной чашке. В протоколе анализа отмечается: колифаги обнаружены или не обнаружены в 100 см3 воды. При наличии зон лизиса в контроле культуре результат считается недействительным.
Проведение количественного анализа. Исследуемую пробу воды в количестве 100 см3 разделяют на шесть порций: 1 флакон с 50 см3 и 5 пробирок с 10 см3. К 50 см3 пробы добавляют 5 см3 десятикратного питательного бульона и 0,5 см3 смыва E.coli. В каждые 10 см3 пробы вносят по 1 см3 десятикратного питательного бульона и по 0,1 см3 смыва бактерий.
Для контроля культуры 0,1 см3 смыва E.coli помещают в чашку Петри и заливают питательным агаром. Посевы инкубируют 18 часов при 37 оС.
Затем из объема 50 см3 отливают в пробирку 10 мл. Во все исследуемые 6 объемов добавляют по 1 см3 хлороформа. Пробирки закрывают резиновыми пробками, энергично встряхивают и оставляют при комнатной температуре для осаждения хлороформа.
В предварительно расплавленный и остуженный до 45-49 оС питательный агар добавляют смыв E.coli. Приготовленную смесь разливают в две чашки Петри: одну чашку для контроля культуры E.coli на лизогенность и одну чашку для исследуемой пробы воды. После застывания агара чашки, предназначенные для посева проб, разделяют на 6 секторов и маркируют в соответствии с исследуемыми объемами. На каждый сектор из соответствующей пробирки наносят пастеровской пипеткой (или бактериологической петлей продольным штрихом) по 1 капле надосадочной жидкости. После подсыхания капель чашки с исследуемыми пробами и контрольную чашку помещают в термостат при 37 оС на 18 часов.
Учет результатов. Просмотр результатов осуществляют в проходящем свете. Учитывают наличие зон просветления (лизиса) на секторах газона E.coli. При применении капельного способа посева пипеткой образуется зона лизиса в виде округлого пятна или отдельных бляшек. При посеве продольным штрихом бактериологической петлей отмечается лизис по ходу штриха. Пробу считают положительной при наличии зоны лизиса хотя бы на одном секторе при отсутствии зон лизиса на контрольной чашке. Оценку проводят по таблице наиболее вероятного числа (НВЧ) бляшкообразующих единиц (БОЕ). В протоколе анализов указывают наиболее вероятное количество колифагов в 100 мл воды в диапазоне возможных колебаний: НВЧ БОЕ (нижний предел – верхний предел) колифагов в 100 см3. Результат полуколичественный. При наличии зон лизиса в контрольной чашке результат считают недействительным.
Прямой метод определения колифагов. Определение колифагов в питьевой воде включает исследование нормируемого объема воды (100 см3) путем его прямого посева и последующего подсчета зон лизиса (бляшек) на газоне E.coli в чашках Петри с питательным агаром. Прямой метод выделения колифагов из воды проводят параллельно с титрационным методом при исследовании по эпидемическим показаниям.
Проведение анализа. В питательный агар, расплавленный и остуженный до 45-49 оС добавляют смыв E.coli и перемешивают. Исследуемые 100 см3 воды разливают по 20 см3 в большие пробирки, нагревают до 35-44 оС и немедленно разливают в 5 чашек Петри. Затем в каждую чашку сразу же вносят по 20 см3 смеси агара с культурой E.coli. Для контроля культуры E.coli в одну чашку Петри вносят 20 см3 стерильной водопроводной воды, предварительно прогретой до 35-44 оС, заливают 20 см3 приготовленного агара с E.coli. Содержимое чашек осторожно перемешивают. Чашки с застывшим агаром помещают вверх дном в термостат и инкубируют в течение 18 часов при 37 оС.
Учет результатов. Просмотр посевов проводят в проходящем свете. Учет результатов осуществляют подсчета и суммирования числа бляшек, выросших на 5 чашках Петри. Результаты выражают в бляшкообразующих единицах (БОЕ) на 100 см3 пробы воды. В контрольной чашке бляшки должны отсутствовать.
Наиболее часто зоны лизиса выглядят прозрачными пятнами на фоне газона тест-культуры питательного агара в виде круглых изолированных бляшек (от 1 до 5-7 мм в диаметре) с четко выраженными либо стертыми границами.
Санитарно-микробиологический контроль над водами открытых водоёмов, качества питьевой воды.
В контроль над поверхностными водоёмами входят исследование и заключение о возможности использовать водоём (для питьевых, хозяйственных или других нужд), выяснение причин фекального загрязнения, определение способности водоёма к самоочищению. Проводят определение ОМЧ, выделяют БГКП, кишечную палочку, энтерококки, стафилококки и патогенные микроорганизмы (сальмонеллы, холерные вибрионы, лептоспиры, шигеллы и энтеровирусы).
Количество последних не должно превышать 100 в 1 л в зоне купания и не более 20 в 1 л воды бассейнов и морской воды. В последние годы разработаны и предложены дополнительные критерии оценки санитарного состояния водоёмов, в которые включены показатели титра энтерококков и Clostridium petfringens, а также индекс бактериофагов.
>
Санитарно-микробиологический контроль качества питьевой воды
Санитарно-микробиологическое исследование питьевой воды включает определение ОМЧ, количества энтеробактерий, спор сульфитредуцирующих клостридии и колифагов.
Определение ОМЧ при оценке качества питьевой воды. ОМЧ позволяет оценить уровень микробного загрязнения питьевой воды, дополняя показатели фекального загрязнения, и одновременно позволяет выявить загрязнение из других источников (например, промышленные сбросы). Неожиданное увеличение ОМЧ (даже в пределах норматива), выявленное повторно, служит сигналом для поиска причины загрязнения. Также этот показатель незаменим для срочного обнаружения в питьевой воде массивного микробного загрязнения неизвестной природы. Из каждой анализируемой пробы должен быть сделан посев не менее чем на две чашки Пётр и объёмом 1 мл. Через 24 ч проводят подсчёт выросших колоний на обеих чашках, результаты суммируют и делят на два. Окончательный результат выражают числом колониеобразующих единиц (КОЕ) в 1 мл исследуемой пробы воды. В 1 мл питьевой воды должно быть не более 50 КОЕ.
Определение количества энтеробактерий. При проведении исследований не ограничиваются обнаружением БГКП, но используют более широкое понятие — бактерии семейства Enterobacteriaceae и термотолерантные колиформные бактерии.
• Бактерии семейства Enterobacteriaceae включают грамотрицательные, оксидаза-отрицатель-ные, споронеобразующие палочки, растущие на средах с лактозой (например, Эндо) и ферментирующие глюкозу до кислоты и газа при температуре 37 °С в течение 24 ч. Обнаружение в питьевой воде бактерий семейства Enterobacteriaceae указывает на потенциальную эпидемическую опасность водопользования. Показатель «бактерии семейства Enterobacteriaceae* — основной нормируемый показатель, обеспечивающий наиболее надёжный контроль присутствия в воде практически всех представителей кишечных бактерий.
• Термотолерантные колиформные бактерии обладают всеми признаками бактерий семейства Enterobacteriaceae, и, кроме того, ферментируют лактозу с образованием альдегида, кислоты и газа при температуре 44 °С в течение 24 ч. Термотолерантность быстро утрачивается, поэтому обнаружение бактерий с таким свойством свидетельствует о недавнем попадании в воду кишечных бактерий (свежее фекальное загрязнение).
Численное выражение результата анализа характеризует степень фекального загрязнения воды. Бактерии семейства Enterobacteriacea и термотолерантные бактерии должны отсутствовать в 300 мя питьевой воды.
Выявление спор сульфитредуцирующих клостридий. Споры сульфитредуцирующих клостридий более устойчивы к обеззараживанию и действию неблагоприятных факторов окружающей среды, чем другие индикаторные бактерии. На основании этого свойства показатель рекомендован для оценки эффективности технологических процессов очистки воды. Особое значение этот показатель имеет при оценке первичного хлорирования, так как оно инактивиру-ет практически все индикаторные бактерии. Обнаружение клостридий в воде перед поступлением в распределительную сеть указывает на недостаточную очистку и на то, что устойчивые к обеззараживанию патогенные микроорганизмы, вероятно, не погибли при очистке. Споры сульфитредуцирующих клостридий должны отсутствовать в 20мл исследуемой питьевой воды.
Определение количества колифагов. Наиболее часто содержание колифагов в питьевой воде определяют титрационным методом, включающим предварительное подращивании их в среде обогащения (культура Escherichia coli на питательном агаре) с последующим выявлением бляшек колифага на газоне Е. coli В 100 мл исследуемой воды должны отсутствовать БОЕ колифагов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

