Определите какие из перечисленных мхов имеют кожно резорбтивный механизм действия
Добавил пользователь Дмитрий К. Обновлено: 19.09.2024
К группе ядов кожно-резорбтивного действия относятся химические вещества, которые вызывают местные воспалительно-некротические изменения в тканях в сочетании с выраженным резорбтивным действием.
Одним из весьма токсичных соединений, применявшихся в первую империалистическую войну в качестве боевых отравляющих веществ, является дихлордиэтилсульфид (иприт).
Это вещество было впервые получено Депре в 1822 г., затем аналогичное соединение было синтезировано в 1854 г. Ричем, а в 1860 г. — Гутри. Синтез этого соединения был усовершенствован в 1860 г. Ниманом. Последние два автора, впервые отметили, что дихлордиэтилсульфид обладает прижигающими свойствами и вызывает образование пузырей и язв при попадании его на кожу человека.
В 1885 г. Н.Д. Зелинским во время его работы в лаборатории В. Мейера в Геттингемском университете был осуществлен синтез дихлордиэтилсульфи да новым методом. При исследовании дихлордиэтилсульфид попал на руки и ноги Н.Д. Зелинскому и вызвал их поражение, в результате чего эксперимента он не смог довести до конца. Разработку своего способа синтеза этого соединения и работу завершил В. Мейер в 1886 г.
Ко времени первой мировой войны относятся исследования немецких военных химиков, проводивших поиск химических средств для поражения людей. Они обратили внимание на резкое прижигающее действие дихлордиэ тилсульфида, и после соответствующих исследований было налажено промышленное производство этого ада. В Германии указанное вещество поучило название Lost от первых букв фамилий немецких химиков Ломмеля и Штейнкопфа, предложивших промышленный способ производства дихлордиэтилсуль фида.
После первой мировой войны иприт был применен в 1936 г. фашистской Италией против Эфиопии, а в 1943 г. — милитаристской Японией против Китая. Во время второй мировой войны были установлены признаки полной боевой готовности к применению иприта как со стороны Германии, так и со стороны США. В 1961-1969 гг. США осуществили в Южном Вьетнаме широкомасштабный геноцид с помощью военных гербицидов. Более 40% территории джунглей и пахотных земель (15.5 тыс. км.) последовательно обрабатыва лось оранжевой, голубой и белой жидкостью.
В состав оранжевого агента входит диоксин в концентрации от 0,1 до 2,4%. Диоксин обладает выраженными кожно-нарывными и мутагенными свойствами. В 44 388 т оранжевой жидкости, примененной во Вьетнаме, содержалось 110 кг диоксина, что позволило создать плотность заражения 70 мг/га (К.П. Дубинин, Ю.В. Пашин, 1978, Н.Г. Красовский, Л.Я. Васюкович. 1980). Этого оказалось достаточно, чтобы вызвать поражение примерно 2 млн. вьетнамцев, последствия которого связывают в первую очередь с диоксином. Более того, диоксин — сыграл роль бумеранга для 60 000 солдат агрессора, вызвав у них поражение нервной системы, печени и половых желез.
Токсикологическая (клиническая) классификация ядов

Физико-химические свойства и токсичность БОВ (основные представители)

Механизм действия алнилирующцх ядов
В патохимической классификации химические вещества данной группы именуются алкилирующими ядами. Под алкилированием понимается процесс вытеснения молекулой яда функциональных групп белка вообще и нуклеопротеидов в особенности.
Различают алкилирующее действие общее и избирательное. К общим алкилирующим агентам относятся вещества, имеющие один или несколько активных радикалов следующего строения:
1) производные сернистого иприта: R _ S _ CH2 _ CH2 _ Cl
2) производные азотистого иприта:



5) эфиры метансульфокислоты:

Ко второй группе кожно-резорбтивных ядов относятся так называемые тиоловые яды. Это такие вещества, которые избирательно алкилируют только тиоловые группы метаболитов тканей. Подобные свойства проявляют соединения трехвалентного мышьяка, и ряд металлоорганических соединений.
Существует три теории механизма действия, которые необходимо рассматривать в совокупности.
1. Механизм действия ипритов основан на вытеснении молекулой яда водородных групп у атома азота азотистых оснований нуклеопротеидов (нуклеотическое действие).
Как известно, дезоксирибонуклеиновая кислота (ДНК) представляет собой цепь дезоксирибонуклеотидов, которые в свою очередь, состоят из пентозного сахара, остатка фосфорной кислоты и азотистого основания. Согласно многочисленным исследованиям, наибольший интерес представляет реакция ипритов с азотистыми основаниями ДНК (аденин-тимин, гуанин-цитозин). Алкилирующие вещества охотнее всего вступают в реакцию с гуанином. Алкилирование гуанина приводит к появлению неустойчивого четвертичного азота. В результате сахарно-фосфорно-азотистый каркас ДНК распадается, что приводит к деполимеризации нуклеопротеидов.
2. Механизм действия основан на внутриклеточной активизации молекулы иприта с образованием в клетке ониевых соединений и в последующем активных радикалов (лучеподобное действие)[Родневич].
При исследовании гидролиза иприта было показано, что в начале гид
Кроме того, ониевые кислоты могут вызывать появление ионов Н, ОН, НО2, которые также весьма реакционноспособны и оказывают действие на клетки тканей, которое напоминает повреждающее действие ионизирующих излучений.
Однако, между действием ипритов и проникающей радиацией имеются существенные отличия. Р.К. Лякявичус (1967) приводит данные, показывающие, что ядра клеток более чувствительны к иприту, чем к проникающей радиации.
При воздействии проникающей радиации на ядра клеток наблюдаются и хромосомные, и хроматидные аберрации. При действии ипритов наблюдаются только хроматидные аберрации. Цитогенетические эффекты ипритов наблюдаются не ранее, чем через 8 часов, а при облучении они обнаруживаются почти сразу. Кислород не отягощает интоксикации алкилирующими соединениями, а при воздействии ионизирующего излучения количество аберраций в присутствии кислорода возрастает.
Варианты повреждения ДНК ипритом:

1. Отщепление азотистых оснований.
2. Взаимодействие с остатком фосфорной кислоты.
3. Разрыв цепи ДНК.
4. Взаимодействие с азотистыми основаниями.
5. Сшивание 2-х спиральной цепи ДНК.
6. Ошибка спаривания азотистых оснований.
Действие ипритов на ДНК ведет к токсигенетическим нарушениям, что проявляется:
1) нарушение митозов (цитостатическое действие);
2) нарушение синтеза белков и ферментов;
3) злокачественным повреждением клеток (бластомогенное действие);
4) нарушение развития эмбрионов и плода (тератогенное действие);
5) нарушением иммунитета;
6) нарушением генетических признаков клеток (мутагенное действие).
Особенности механизма действия алкилирующих ядов
с избирательным действием (люизит)
В лабораториях Питерса (Англия) и А.И. Черкеса (Киев) было показано. что соединения с трехвалентным мышьяком охотно вступают в реакцию со свободными аминокислотами, имеющими сульфгидрильные группы (цистеин):

Однако более устойчивую связь трехвалентный мышьяк образует с полипептидами:

Проникая в ткани, люизит повреждает те ферментные системы, которые богаты тиоловыми группами. Наиболее ранимой оказалась пируватокси дазная система, в которую входит липоевая кислота, имеющая две тиоловые группы.
По мнению Питерса (1963). А. И. Черкеса (1964), дигидролипоевая кислота, является первичным объектом воздействия группы тиоловых ядов. Гидролазы (в том числе и холинэстеразы), оксидазы (пируватоксидазная система) и дегидрогеназы, ряд ферментов АТФ, наконец, холинорецепторы содержат тиоловые группы и могут повреждаться при проникновении в ткани люизита.
Кроме того при действии тиоловых ядов отмечается отсутствие лучеподобного действия.
Патогенез развития ипритных поражений
Алкилирование ДНК ведет к далеко идущим последствиям. Вследствие деполимеризации нуклеиновых кислот и аминокислот страдают пластические процессы, прежде всего там, где скорость обновления белков наиболее высокая: ретикулоэндотелиальная система, костный мозг и др. Ткани теряют способность к регенерации. Воспаление протекает на фоне угнетения пролифера тивных процессов и резкого снижения сопротивляемости к инфекции.
Азотистый и сернистый иприты получили название лучевых ядов. Этим стремятся подчеркнуть сходство с поражением проникающей радиацией. Наиболее ярко оно проявляется в гематологических изменениях.
В первые сутки увеличивается число эритроцитов и лейкоцитов, что является следствием сгущения крови. В этот период можно обнаружить нейтрофилез и значительное уменьшение эозинофилов, моноцитов и лимфоцитов. В дальнейшем развивается выраженная лейкопения, анемия, тромбоцитопения. В нейтрофилах находят изменения дегенеративного характера. Созревание гранулоцитов не происходит. Развиваются геморрагический синдром, костномозговая чахотка (миэлофтиз). Лимфатические узлы. селезенка уменьшаются в весе в 3-4 раза, тогда как организм теряет в среднем 10-20 % первоначального веса. Следовательно, имеет место специфическое действие яда на лимфоидную ткань.
Под влиянием ипритов тормозятся иммунные реакции, что указывает на сходство с действием проникающей радиации. Уменьшается выработка антител. Ослабляются такие аллергические реакции, как реакция Шварцмана, анафилактический шок. Происходит понижение сопротивляемости организма к инфекции, что может стать непосредственной причиной гибели. Местно-воспалительный процесс протекает вяло, без образования грануляционного вала, лимфангоита, лимфаденита.
Общий обмен при поражении ОВ понижен. Это происходит благодаря способности ипритов вступать во взаимодействие с функциональными группами белковой молекулы и, в первую очередь, со многими ферментами. В литературе утвердилось название, характеризующее иприты как полиэнзимные яды. Иприт блокирует ферменты, участвующие в окислительно-восстанови тельных процессах (оксидазы, дегидрогеназы и др.). В результате развивается кислородное голодание по тканевому типу. Несмотря на достаточное количество кислорода, в крови тормозятся обе фазы гликолиза (аэробная и анаэробная), что приводит в остром периоде к гипергликемии.
При поражении ипритами страдает не только окисление углеводов, но и фосфорилирование их, так как эти яды инактивируют фермент фосфокиназу (фосфотрансферазу). Следовательно ткани, прежде всего головной мозг и мышечная система, лишаются макроэргических соединений.
Количество альбуминов в крови падает. Увеличивается содержание остаточного азота, мочевины. Значительно повышается уровень холестерина. Вследствие частых рвот и диареи нарушается водно-солевой обмен.
Областью приложения действия ипритов является кора головного мозга (особенно область центральных извилин), промежуточный мозг, его ретикулярная формация, мозжечок, продолговатый и спинной мозг, где развивается диффузно-некротический процесс. Острое отравление характеризуется постепенным появлением клоникотонических судорог, аффективной яростью, чувством страха, автоматическими, непроизвольными движениями, расстройством походки. Эти явления сочетаются с угнетением активности холинэстеразы головного мозга. Острое возбуждение сменяется депрессией, развитием адинамии.
Действие на вегетативную нервную систему характеризуется фазы остью изменений.
Это выражается в усилении секреции потовых, слезных, слюнных желез, непроизвольным мочеиспусканием и дефекации. Затем могут наступать расширение зрачков, тахикардия и другие признаки холинолитического действия.
Иприты избирательно блокируют альфа-адренорецепторы, прерывая специфическую импульсацию в них. В результате прекапилярные сфинктеры расслабляются, возникает патологическое депонирование крови, уменьшается кровоток в большом круге кровообращения. Хотя во время атонических, судорог артериальное давление повышается, в целом для отравления характерно наличие гипотонии. Острое отравление носит черты шокоподобной картины. Этому способствует патологическое депонирование крови в венах брюшной полости, повышение проницаемости сосудистой мембраны, избирательное блокирование адренорецепторов и непосредственное угнетающее действие ипритов на сосудодвигательный центр.
Действие на дыхание является фазным. Первоначальная гипервентиля ция сменяется дыхательной аритмией, бронхоспазмом. Если отравление характеризуется непосредственным проникновением паров иприта в дыхательные пути. то альвеолярная гиповентиляция будет выражена более ярко вследствие развития абсцедирующей пневмонии.
В терминальном периоде параличу дыхательного центра предшествует остановка сердца.
В кишечнике обнаруживается большое количество кровоизлияний, некрозов, изъязвлений, в особенности в верхней его трети. Характерны изнуряющие поносы как проявление некротическо-геморрагического энтероколита. Изменения в печени носят дистрофический характер. В капсуле клубочков почек скапливается серозная жидкость.
К группе ядов кожно-резорбтивного действия относятся химические вещества, которые вызывают местные воспалительно-некротические изменения в тканях в сочетании с выраженным резорбтивным действием.
Одним из весьма токсичных соединений, применявшихся в первую империалистическую войну в качестве боевых отравляющих веществ, является дихлордиэтилсульфид (иприт).
Это вещество было впервые получено Депре в 1822 г., затем аналогичное соединение было синтезировано в 1854 г. Ричем, а в 1860 г. — Гутри. Синтез этого соединения был усовершенствован в 1860 г. Ниманом. Последние два автора, впервые отметили, что дихлордиэтилсульфид обладает прижигающими свойствами и вызывает образование пузырей и язв при попадании его на кожу человека.
В 1885 г. Н.Д. Зелинским во время его работы в лаборатории В. Мейера в Геттингемском университете был осуществлен синтез дихлордиэтилсульфи да новым методом. При исследовании дихлордиэтилсульфид попал на руки и ноги Н.Д. Зелинскому и вызвал их поражение, в результате чего эксперимента он не смог довести до конца. Разработку своего способа синтеза этого соединения и работу завершил В. Мейер в 1886 г.
Ко времени первой мировой войны относятся исследования немецких военных химиков, проводивших поиск химических средств для поражения людей. Они обратили внимание на резкое прижигающее действие дихлордиэ тилсульфида, и после соответствующих исследований было налажено промышленное производство этого ада. В Германии указанное вещество поучило название Lost от первых букв фамилий немецких химиков Ломмеля и Штейнкопфа, предложивших промышленный способ производства дихлордиэтилсуль фида.
После первой мировой войны иприт был применен в 1936 г. фашистской Италией против Эфиопии, а в 1943 г. — милитаристской Японией против Китая. Во время второй мировой войны были установлены признаки полной боевой готовности к применению иприта как со стороны Германии, так и со стороны США. В 1961-1969 гг. США осуществили в Южном Вьетнаме широкомасштабный геноцид с помощью военных гербицидов. Более 40% территории джунглей и пахотных земель (15.5 тыс. км.) последовательно обрабатыва лось оранжевой, голубой и белой жидкостью.
В состав оранжевого агента входит диоксин в концентрации от 0,1 до 2,4%. Диоксин обладает выраженными кожно-нарывными и мутагенными свойствами. В 44 388 т оранжевой жидкости, примененной во Вьетнаме, содержалось 110 кг диоксина, что позволило создать плотность заражения 70 мг/га (К.П. Дубинин, Ю.В. Пашин, 1978, Н.Г. Красовский, Л.Я. Васюкович. 1980). Этого оказалось достаточно, чтобы вызвать поражение примерно 2 млн. вьетнамцев, последствия которого связывают в первую очередь с диоксином. Более того, диоксин — сыграл роль бумеранга для 60 000 солдат агрессора, вызвав у них поражение нервной системы, печени и половых желез.
Токсикологическая (клиническая) классификация ядов

Физико-химические свойства и токсичность БОВ (основные представители)

Механизм действия алнилирующцх ядов
В патохимической классификации химические вещества данной группы именуются алкилирующими ядами. Под алкилированием понимается процесс вытеснения молекулой яда функциональных групп белка вообще и нуклеопротеидов в особенности.
Различают алкилирующее действие общее и избирательное. К общим алкилирующим агентам относятся вещества, имеющие один или несколько активных радикалов следующего строения:
1) производные сернистого иприта: R _ S _ CH2 _ CH2 _ Cl
2) производные азотистого иприта:



5) эфиры метансульфокислоты:

Ко второй группе кожно-резорбтивных ядов относятся так называемые тиоловые яды. Это такие вещества, которые избирательно алкилируют только тиоловые группы метаболитов тканей. Подобные свойства проявляют соединения трехвалентного мышьяка, и ряд металлоорганических соединений.
Существует три теории механизма действия, которые необходимо рассматривать в совокупности.
1. Механизм действия ипритов основан на вытеснении молекулой яда водородных групп у атома азота азотистых оснований нуклеопротеидов (нуклеотическое действие).
Как известно, дезоксирибонуклеиновая кислота (ДНК) представляет собой цепь дезоксирибонуклеотидов, которые в свою очередь, состоят из пентозного сахара, остатка фосфорной кислоты и азотистого основания. Согласно многочисленным исследованиям, наибольший интерес представляет реакция ипритов с азотистыми основаниями ДНК (аденин-тимин, гуанин-цитозин). Алкилирующие вещества охотнее всего вступают в реакцию с гуанином. Алкилирование гуанина приводит к появлению неустойчивого четвертичного азота. В результате сахарно-фосфорно-азотистый каркас ДНК распадается, что приводит к деполимеризации нуклеопротеидов.
2. Механизм действия основан на внутриклеточной активизации молекулы иприта с образованием в клетке ониевых соединений и в последующем активных радикалов (лучеподобное действие)[Родневич].
При исследовании гидролиза иприта было показано, что в начале гид
Кроме того, ониевые кислоты могут вызывать появление ионов Н, ОН, НО2, которые также весьма реакционноспособны и оказывают действие на клетки тканей, которое напоминает повреждающее действие ионизирующих излучений.
Однако, между действием ипритов и проникающей радиацией имеются существенные отличия. Р.К. Лякявичус (1967) приводит данные, показывающие, что ядра клеток более чувствительны к иприту, чем к проникающей радиации.
При воздействии проникающей радиации на ядра клеток наблюдаются и хромосомные, и хроматидные аберрации. При действии ипритов наблюдаются только хроматидные аберрации. Цитогенетические эффекты ипритов наблюдаются не ранее, чем через 8 часов, а при облучении они обнаруживаются почти сразу. Кислород не отягощает интоксикации алкилирующими соединениями, а при воздействии ионизирующего излучения количество аберраций в присутствии кислорода возрастает.
Варианты повреждения ДНК ипритом:

1. Отщепление азотистых оснований.
2. Взаимодействие с остатком фосфорной кислоты.
3. Разрыв цепи ДНК.
4. Взаимодействие с азотистыми основаниями.
5. Сшивание 2-х спиральной цепи ДНК.
6. Ошибка спаривания азотистых оснований.
Действие ипритов на ДНК ведет к токсигенетическим нарушениям, что проявляется:
1) нарушение митозов (цитостатическое действие);
2) нарушение синтеза белков и ферментов;
3) злокачественным повреждением клеток (бластомогенное действие);
4) нарушение развития эмбрионов и плода (тератогенное действие);
5) нарушением иммунитета;
6) нарушением генетических признаков клеток (мутагенное действие).
Особенности механизма действия алкилирующих ядов
с избирательным действием (люизит)
В лабораториях Питерса (Англия) и А.И. Черкеса (Киев) было показано. что соединения с трехвалентным мышьяком охотно вступают в реакцию со свободными аминокислотами, имеющими сульфгидрильные группы (цистеин):

Однако более устойчивую связь трехвалентный мышьяк образует с полипептидами:

Проникая в ткани, люизит повреждает те ферментные системы, которые богаты тиоловыми группами. Наиболее ранимой оказалась пируватокси дазная система, в которую входит липоевая кислота, имеющая две тиоловые группы.
По мнению Питерса (1963). А. И. Черкеса (1964), дигидролипоевая кислота, является первичным объектом воздействия группы тиоловых ядов. Гидролазы (в том числе и холинэстеразы), оксидазы (пируватоксидазная система) и дегидрогеназы, ряд ферментов АТФ, наконец, холинорецепторы содержат тиоловые группы и могут повреждаться при проникновении в ткани люизита.
Кроме того при действии тиоловых ядов отмечается отсутствие лучеподобного действия.
Патогенез развития ипритных поражений
Алкилирование ДНК ведет к далеко идущим последствиям. Вследствие деполимеризации нуклеиновых кислот и аминокислот страдают пластические процессы, прежде всего там, где скорость обновления белков наиболее высокая: ретикулоэндотелиальная система, костный мозг и др. Ткани теряют способность к регенерации. Воспаление протекает на фоне угнетения пролифера тивных процессов и резкого снижения сопротивляемости к инфекции.
Азотистый и сернистый иприты получили название лучевых ядов. Этим стремятся подчеркнуть сходство с поражением проникающей радиацией. Наиболее ярко оно проявляется в гематологических изменениях.
В первые сутки увеличивается число эритроцитов и лейкоцитов, что является следствием сгущения крови. В этот период можно обнаружить нейтрофилез и значительное уменьшение эозинофилов, моноцитов и лимфоцитов. В дальнейшем развивается выраженная лейкопения, анемия, тромбоцитопения. В нейтрофилах находят изменения дегенеративного характера. Созревание гранулоцитов не происходит. Развиваются геморрагический синдром, костномозговая чахотка (миэлофтиз). Лимфатические узлы. селезенка уменьшаются в весе в 3-4 раза, тогда как организм теряет в среднем 10-20 % первоначального веса. Следовательно, имеет место специфическое действие яда на лимфоидную ткань.
Под влиянием ипритов тормозятся иммунные реакции, что указывает на сходство с действием проникающей радиации. Уменьшается выработка антител. Ослабляются такие аллергические реакции, как реакция Шварцмана, анафилактический шок. Происходит понижение сопротивляемости организма к инфекции, что может стать непосредственной причиной гибели. Местно-воспалительный процесс протекает вяло, без образования грануляционного вала, лимфангоита, лимфаденита.
Общий обмен при поражении ОВ понижен. Это происходит благодаря способности ипритов вступать во взаимодействие с функциональными группами белковой молекулы и, в первую очередь, со многими ферментами. В литературе утвердилось название, характеризующее иприты как полиэнзимные яды. Иприт блокирует ферменты, участвующие в окислительно-восстанови тельных процессах (оксидазы, дегидрогеназы и др.). В результате развивается кислородное голодание по тканевому типу. Несмотря на достаточное количество кислорода, в крови тормозятся обе фазы гликолиза (аэробная и анаэробная), что приводит в остром периоде к гипергликемии.
При поражении ипритами страдает не только окисление углеводов, но и фосфорилирование их, так как эти яды инактивируют фермент фосфокиназу (фосфотрансферазу). Следовательно ткани, прежде всего головной мозг и мышечная система, лишаются макроэргических соединений.
Количество альбуминов в крови падает. Увеличивается содержание остаточного азота, мочевины. Значительно повышается уровень холестерина. Вследствие частых рвот и диареи нарушается водно-солевой обмен.
Областью приложения действия ипритов является кора головного мозга (особенно область центральных извилин), промежуточный мозг, его ретикулярная формация, мозжечок, продолговатый и спинной мозг, где развивается диффузно-некротический процесс. Острое отравление характеризуется постепенным появлением клоникотонических судорог, аффективной яростью, чувством страха, автоматическими, непроизвольными движениями, расстройством походки. Эти явления сочетаются с угнетением активности холинэстеразы головного мозга. Острое возбуждение сменяется депрессией, развитием адинамии.
Действие на вегетативную нервную систему характеризуется фазы остью изменений.
Это выражается в усилении секреции потовых, слезных, слюнных желез, непроизвольным мочеиспусканием и дефекации. Затем могут наступать расширение зрачков, тахикардия и другие признаки холинолитического действия.
Иприты избирательно блокируют альфа-адренорецепторы, прерывая специфическую импульсацию в них. В результате прекапилярные сфинктеры расслабляются, возникает патологическое депонирование крови, уменьшается кровоток в большом круге кровообращения. Хотя во время атонических, судорог артериальное давление повышается, в целом для отравления характерно наличие гипотонии. Острое отравление носит черты шокоподобной картины. Этому способствует патологическое депонирование крови в венах брюшной полости, повышение проницаемости сосудистой мембраны, избирательное блокирование адренорецепторов и непосредственное угнетающее действие ипритов на сосудодвигательный центр.
Действие на дыхание является фазным. Первоначальная гипервентиля ция сменяется дыхательной аритмией, бронхоспазмом. Если отравление характеризуется непосредственным проникновением паров иприта в дыхательные пути. то альвеолярная гиповентиляция будет выражена более ярко вследствие развития абсцедирующей пневмонии.
В терминальном периоде параличу дыхательного центра предшествует остановка сердца.
В кишечнике обнаруживается большое количество кровоизлияний, некрозов, изъязвлений, в особенности в верхней его трети. Характерны изнуряющие поносы как проявление некротическо-геморрагического энтероколита. Изменения в печени носят дистрофический характер. В капсуле клубочков почек скапливается серозная жидкость.
Гидролипидная мантия кожи – одна из составляющих эпидермального барьера кожи.
Нарушения функции и дефекты в этом барьере неизбежно провоцируют проникновение чужеродных микробов и аллергенов в кожу, активируют дегидратацию эпидермиса и вызывают сухость кожи, повышают её чувствительность к различным воздействиям окружающей среды.
Что же такое эпидермальный барьер
Кожа – самый большой орган человеческого тела. Она составляет почти 18% общего веса человека.
В составе кожи три основных слоя:
- 1. Самый глубокий - гиподерма или подкожно-жировая клетчатка;
- 2. Средний – дерма. В ней расположены основные каркасные белки – коллаген и эластин;
- 3. Верхний слой кожи - эпидермис состоит из четырёх слоёв и постоянно обновляется.
Кожа выполняет несколько очень важных для организма и самой кожи функций. При этом, основную - защитную функцию обеспечивает эпидермис.
Именно самый верхний слой кожи - эпидермис является своего рода барьером, защищающим ее от агрессивных атак множества микроорганизмов и аллергенов, внешних механических и химических воздействий, потери влаги – сохраняет коже увлажнение.
Эпидермальный барьер состоит из:
- Гидролипидной мантии, укрывающей поверхность кожи;
- Липидо-эпидермального барьера.
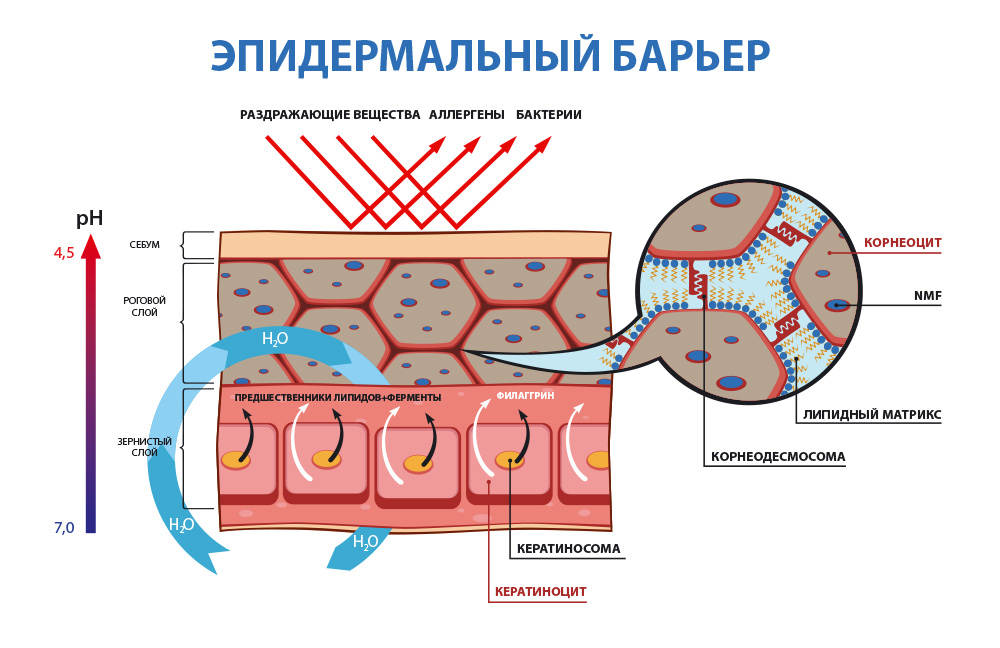
1. Гидролипидная или водно-жировая мантия
- это, некая, невидимая глазу пленка на поверхности кожи, которая образуется из смеси отслоившихся роговых чешуек, пота, кожного сала, а также органических кислот и микрофлоры.
Главная функциональная особенность гидролипидной мантии здоровой кожи человека - её кислая среда - pH от 4,7 до 5,7. (Для справки: кислотная среда pH 0 - 6,9; нейтральный pH – 7; щелочная среда pH 7,1 – 14).
Благодаря наличию кислой среды, в которой перестают размножаться и погибают вредоносные бактериии, гидролипидная мантия является самым первым звеном защиты кожи от большинства чужеродных микроорганизмов и агентов.
Свой вклад в формирование кислой среды на поверхности кожи вносят с одной стороны, органические кислоты - молочная, лимонная и другие, которые образуются в результате биохимических и метаболических процессов, протекающих в эпидермисе. С другой стороны, кислый pH гидролипидной мантии помогает поддерживать жизнедеятельность полезных бактерий - Staphylococcus epidermidis и лактобактерий, которые постоянно живут на коже и составляют её микробиоту.
Кислотность гидролипидной мантии может нарушаться в ту или иную сторону по разным причинам (будет описано ниже). Например, при грибковых заболеваниях рН возрастает до 6, при экземе до 6,5; при угревой болезни защелачивается до 7.
Повреждённая гидро-липидная мантия кожи восстанавливается самостоятельно при правильном очищении, грамотном уходе и защите.
2. Липидо-эпидермальный барьер
– основной защитный барьер кожи. Находясь непосредственно в эпидермисе, он защищает организм и кожу от обезвоживания путем механизма транс-эпидермальной потери влаги (ТЭПВ), а также является вторым звеном защиты после гидролипидной мантии от проникновения в кожу патологических бактерий и аллергенов, различных химических соединений.
Основу липидо-эпидермального барьера составляют три вида липидов — церамиды, свободные жирные кислоты и холестерин.
Механизм ТЭПВ. По большому счету кожа увлажняется изнутри – то есть из глубоких слоёв гиподермы и дермы вода поступает к эпидермису, липиды удерживают воду в эпидермисе, обеспечивая его увлажненность. Повреждённый липидо-эпидермальный барьер является главной причиной неадекватной трансэпидермальной потери влаги и в результате сухости кожи. Поэтому, чтобы обеспечить хорошую увлажненность кожи, необходимо в первую очередь восстановить липидный барьер.
Кроме того, бреши в липидо-эпидермальном барьере приводят не только к обезвоженности кожи, но и к её повышенной чувствительности, аллергическим реакциям, раздражениям и кожным заболеваниям.
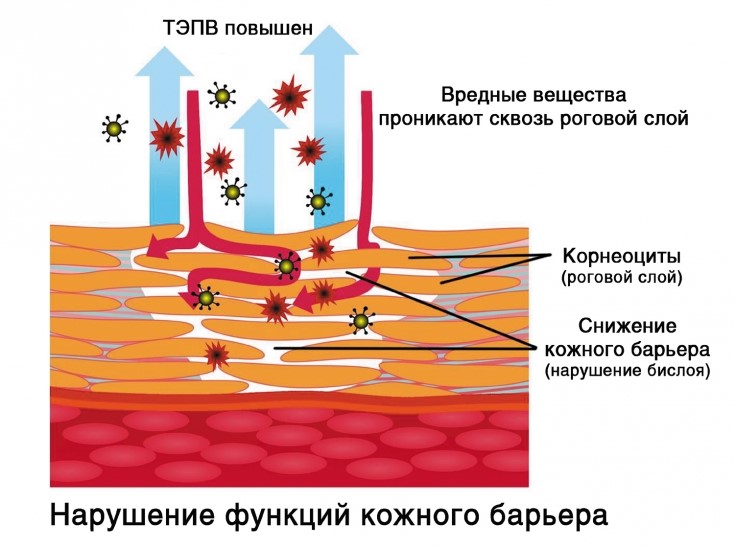
Незначительные повреждения липидо-эпидермального барьера клетки кожи восстанавливают сами. В случае выраженных нарушений – им необходимо помочь. В первую очередь это процедуры регулярного увлажнения, правильного ухода за поверхностью кожи и дермы, здоровый образ жизни и сбалансированное питание.
Внешние проявления, связанные с повреждением гидролипидной мантии
- Периодические или постоянные ощущения стянутости кожи, вызывающие дискомфорт; сухость и шелушение кожи даже в условиях привычного ухода;
- Выраженная гиперчувствительность и реакция кожи различные атмосферные явления: на ветер, солнце, мороз,
- Повышенная чувствительность кожи при применении очищающих и уходовых средств;
- Периодическое появление раздражений и покраснений, зудящих красных пятен; перманентные дерматиты.
Наличие вышеперечисленных проблем – повод обратиться к дерматологу.
Факторы, повреждающие кожные барьеры
Применение при очищении кожи мыла, умывалок и др., содержащих ПАВы и щелочи; частое использование обезжиривающих и спиртовых тоников.
Щелочи и ПАВы, присутствующие в большинстве очищающих средств нарушают кислый pН гидролипидной мантии. В результате водно-жировая мантия разрушается. Открываются входные ворота для чужеродных бактерий. Повреждается липидный барьер, вода активно начинает испаряться с поверхности кожи, вызывая её сухость.
Здоровый эпидермальный барьер — залог красивого вида любого типа кожи — жирной, проблемной, сухой, чувствительной и даже увядающей.
Сохранение и восстановление эпидермального барьера один их самых ключевых принципов в профессиональных программах по уходу за любым типом кожи и омолаживающих врачебных процедурах, а также домашнего хода за кожей.
Методы восстановления и сохранения барьеров кожи
Адекватное очищение кожи.
Домашний уход. Важно правильно определить с профессиональным дерматологом свой тип кожи и использовать ежедневно очищающие средства, которые соответствуют вашему типу кожи, не нарушая при этом эпидермальный барьер.
Профессиональный уход. В условиях клиники – проведение грамотно подобранных процедур очищения и эксфолиации кожи и соблюдения режима их выполнения: химического пилинга, и лазерного пилинга,ручной чистки лица с учётом вашего типа кожи и решаемых проблем.
Регулярное увлажнение.
Домашний уход. Ежедневно наносите на кожу увлажняющие кремы и периодически маски, содержащие компоненты, удерживающие влагу: аминокислоты, гиалуроновую кислоту, коллаген, эластин, алое вера и др. Плюс, как это ни банально, пейте адекватное количество чистой воды.
Профессиональный уход в условиях клиники. Регулярно (курсами 2 раза в год) проводите процедуры биоревитализации, биорепарации, мезотерапии
Профессиональный уход в условиях клиники. При повреждении кожи и развитии патологической флоры, например при угревой болезни – применение различных медикаментозных препаратов, назначенных врачом, а также лечение акне на лазерной установке Fotona с целью инактивации патологической флоры, уменьшения воспалительного процесса и улучшения трофики тканей.
Сбалансированное питание и уход.
Домашний уход. Ежедневно используйте питательные крема, соответствующие вашему типу кожи, возрасту и времени сезона года, чередуйте их с увлажняющими средствами. Отдавайте предпочтение средствам, содержащим церамиды, липосомы и жирные кислоты – они защищают и восстанавливают повреждённый липидный слой.
Употребляйте в пищу продукты, богатые омега 3 и омега 6 жирными кислотами. Не исключайте из рациона масла и жиры.
Постоянная защита.
Не используйте скрабы и избегайте сильного механического воздействия. Применяйте средства, содержащие в своём составе плёнкообразующие компоненты — коллаген, эластин, воска, силиконы, ланолин, парафин - руки. Регулярно наносите на кожу солнцезащитные крема при выходе на улицу, особенно летом.
Подводим итоги
Здоровье кожи напрямую зависит от целостности и нормального функционирования эпидермального барьера, основу которого составляет гидро-липидная мантия и липидо-эпидермальный барьер.
Повреждение липидо-эпидермального барьера и гидролипидной мантии является серьёзной проблемой для кожи. Как правило, это приводит к обезвоживанию эпидермиса, появлению сухости, повышенной чувствительности, раздражениям, может спровоцировать и поддерживать кожные заболевания и др.
Нарушенный эпидермальный барьер можно восстановить, если правильно подобрать домашний уход, а также проводить профессиональные процедуры у косметолога. Сбалансированный уход за кожей и правильный образ жизни обеспечат защиту, увлажнение и восстановление кожи.
Поделитесь со знакомыми и друзьями:

Основа всех основ для любого косметолога. Знание строения, функций и клеток кожи необходимо для эффективной работы с пациентами.
Кожа является самым большим органом нашего тела, которая выполняет множество важнейших функций:
- регуляция температуры;
- защита внутренних органов от повреждений;
- предохранение организма от обезвоживания;
- барьерные функции;
- произведение гормональных соединений;
- передача различных ощущений в мозг с помощью рецепторов;
- выделение продуктов обмена веществ: мочевая кислота, соль, холестерин и др.;
- отражение состояния внутренних органов.
Сама кожа делится на три слоя: эпидермис, дерму и гиподерму. Каждый слой отличается по строению и функциям. Рассмотрим каждый из них.
Эпидермис
Самый верхний слой кожи, представляющий собой типичную пролиферативную ткань, которая способна к постоянному самообновлению. Эпидермис в свою очередь делится еще на 5 уровней: роговой, блестящий, зернистый, шиповатый, базальный.
Роговой слой
Является внешним слоем эпидермиса. В нем содержится от 15 до 30 слоев клеток, выполняющих защитные функции. Роговой слой – это конечный продукт процесса дифференцировки клеток. Прочность рогового слоя обусловлена качеством кератина и наличием межклеточного диффузионного барьера. Целостность и качество рогового слоя сильно зависит от pH. Воздействие на pH-градиент рогового слоя может привести к изменению активности ферментов, что влечет за собой нарушения во всем эпидермисе.
Блестящий слой
Идет сразу после рогового. Это очень тонкий слой безядерных клеток, которые пропитаны особым веществом – элеидином.
Зернистый слой
Состоит 3-4 слоев клеток, в которых скапливаются нити кератина (строительный материал рогового слоя). Здесь кератиноциты производят липиды и компоненты, составляющие NMF (естественный увлажняющий фактор).
Шиповидный слой
Состоит из 4-8 рядов полигональных клеток, которые соединены прочной связью протоплазматических отростков. Слой получил свое название благодаря шиповатым клеткам, которые имеют в своем составе артефакт, возникающий при гистологической обработке образцов ткани. В клетках шиповидного слоя откладываются продукты синтеза, такие как кератин и липиды. Здесь же располагаются иммунологически активные клетки Лангерганса.
Базальный слой
Состоит из коллагеновых и эластиновых волокон, а также из протоплазматических отростков эпителиальных клеток. В базальном слое расположены меланоциты, несущие в меланосомах запасы пигмента. Каждый меланоцит контактирует приблизительно с 30 кератиноцитами через разветвлённые дендриты и поставляет им пигмент. Таким способом меланоциты защищают кожу от негативного воздействия УФ-излучения. Базальной слой контактирует с дермой и, следовательно, с зоной дермо-эпидермального соединения.
Дерма и гиподерма
Глубже эпидермиса находится дерма, имеющая толщину от 1.5 до 5 мм. Она состоит из двух слоев: сосочкового и сетчатого. Дерма пронизана кровеносными и лимфатическими сосудами, железами.
Сосочковый слой
Представляет собой рыхлую волокнистую соединительную ткань, которая состоит из коллагеновых, эластических и ретикулярных волокон, а также из клеток: фибробластов, тучных клеток, макрофагов и других. Сосочковый слой получил свое название благодаря большому количеству сосочков, вдающихся в эпителий. Размер и количество сосочков по всему тело неодинаково. В дерме лица сосочки совсем плохо развиты и с возрастом имеют тенденцию исчезать.
Сетчатый слой
Состоит из плотной соединительной ткани с пучками коллагеновых волокон и сетью эластических волокон. Коллагеновые волокна проходят в двух направлениях: параллельно и косо к поверхности кожи. В сетчатом слое дермы на участках кожи, подверженных сильному растяжению, располагается узкопетлистая коллагеновая сеть. В зонах, где кожа испытывает особое давление, коллагеновая сеть является широкопетлистой. Сеть эластических волокон повторяет расположение коллагеновых пучков. В сетчатом слое фибробласты являются основными клеточными элементами. Кроме этого, в сетчатом слое располагаются кожные железы: потовые и сальные, а также корни волос.
Гиподерма или подкожная жировая клетчатка образуется из соединительнотканных фиброзных тяжей, которые образуют ячейки, наполняющиеся жировой тканью. Жировая ткань состоит из адипоцитов (жировых клеток). В фиброзных тяжах располагаются лимфатические сосуды, нервы, малые артерии, венулы и артериолы. Гиподерма в некоторых областях тела человека отсутствует, например, ее нет в области век, в мошонке и на половом члене. Слой подкожной жировой клетчатки обуславливает подвижность и тургор кожи, принимает участие в жировом обмене организма, является жировым депо и амортизатором внешних механических воздействий. Важно понимать, что ПЖК является сложным органом с важными метаболическими и эндокринными функциями в организме человека.
Читайте также:

