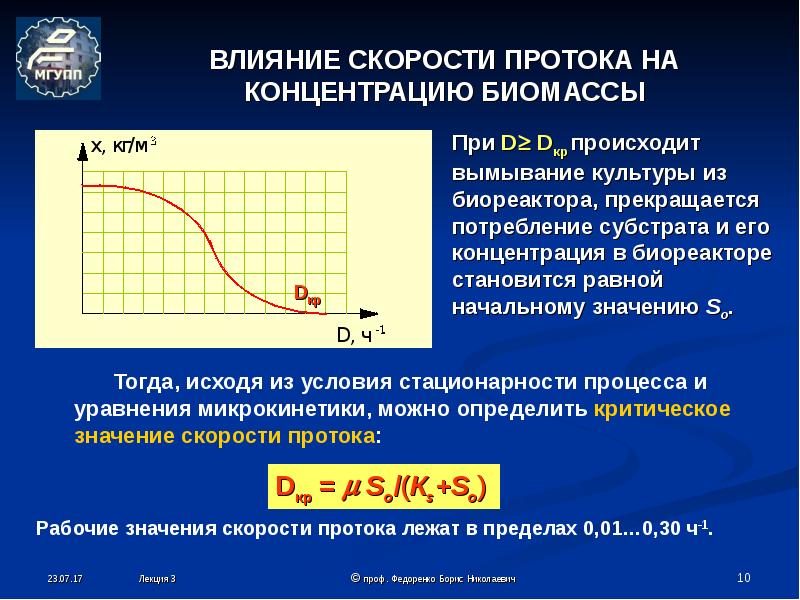
Оборудование для посева микроорганизмов
Добавил пользователь Владимир З. Обновлено: 18.09.2024
8.1. Техника посева и выделения чистых культур микроорганизмов
Доставляемый в лабораторию материал подвергают бактериологическому исследованию в тот же день. Техника посева зависит от характера засеваемого материала, консистенции питательной среды и цели исследования.
Для проведения посевов необходимы: подлежащий исследованию материал, питательные среды, бактериологическая петля, шпатели (стеклянные, металлические), пастеровские и градуированные пипетки, металлические кюветы или поднос для переноса засеянных чашек и металлические коробки для переноса пробирок, ведро или бачок с крышками для сброса отработанного инфицированного материала, спиртовая или газовая горелка.
Жидкий материал для посева берут петлей или пипеткой. При взятии петлей жидкость должна образовать в кольце петли тонкую прозрачную пленку – "зеркало". Пипетками пользуются в том случае, когда материал засевают в большом или точно отмеряемом объеме.
Способ взятия плотного материала определяется его консистенцией. При посевах чаще всего пользуются бактериологической петлей.
Все манипуляции, связанные с посевом и выделением микробных культур, производят над пламенем горелки. Бактериальную петлю перед взятием материала прокаливают в пламени горелки, затем ее остужают так, чтобы при соприкосновении с жидкой средой она не вызывала кипения жидкости, а прикосновение к агару не сопровождалось его плавлением. Для остуживания петли лучше всего погружать ее в конденсационную жидкость пробирки со стерильной питательной средой или прикасаться к крышке чашки Петри со стерильной средой. Нельзя остужать петлю прикосновением к поверхности питательной среды, даже свободной от микробного роста, так как на ней могут находиться колонии, не видимые простым глазом.
После окончания посева петлю прожигают повторно для уничтожения находящейся в ней микробной культуры или инфицированного микроорганизмами материала.
Пипетки и шпатели, использованные для посевов, опускают в дезинфицирующий раствор.
После посева на чашках Петри со стороны дна, на пробирках – в верхней трети надписывают название засеянного материала или ставят номер анализа и дату посевов.
8.1.1. Техника посевов на плотные и жидкие питательные среды
- При посеве в жидкую питательную среду петлю с находящимся на ней материалом погружают в среду. Если материал вязкий и с петли не снимается, его растирают на стенке сосуда, а затем смывают жидкой средой. Жидкий материал, набираемый в пастеровскую или градуированную пипетку, вливают в питательную среду.
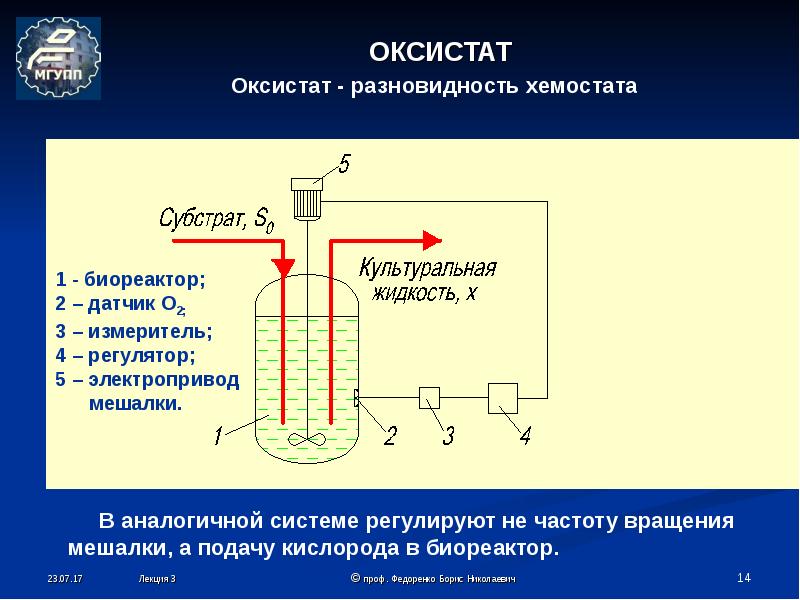
- При посеве на скошенный мясопептонный агар пробирку берут в левую руку между I и II пальцами, чтобы основание пробирки находилось на поверхности кисти руки и посев осуществлялся под контролем глаза. Пробку из пробирки вынимают правой рукой IV и V пальцами, не прикасаясь к той ее части, которая входит внутрь пробирки. Остальные три пальца правой руки остаются свободными для взятия бактериологической петли, посредством которой производится посев. Петлю держат, как писчее перо. После вынимания пробки пробирку с питательной средой держат в наклонном положении во избежание попадания в нее посторонних микроорганизмов из воздуха.
При посеве на скошенный агар петлю с находящимся на ней пересеваемым материалом вводят в пробирку до дна, опускают плашмя на поверхность питательной среды и скользящими движениями наносят штрихи снизу вверх от одной стенки пробирки к другой (рис. 8.1).
- • При посеве на поверхность плотной питательной среды из пробирки в чашки Петри пробирку фиксируют II, III и V пальцами левой руки, а крышку чашки Петри приоткрывают I и IV пальцами левой руки настолько, чтобы в образовавшуюся щель свободно проходили петля или шпатель (рис. 8.2). Небольшое количество исследуемого материала, взятого из пробирки бактериологической петлей, втирают в поверхность питательной среды у края чашки. Затем петлю прожигают, чтобы уничтожить избыток находящегося на ней материала. Линию посева начинают с того места, в котором находится материал. Бактериологическую петлю кладут плашмя на питательную среду, чтобы не поцарапать ее поверхность, и проводят штрихи по всей среде или по секторам, разграфив предварительно дно чашки (при условии, что среда прозрачна) на 4, 8 или 16 равных частей. Нужно стараться, чтобы штрихи, наносимые петлей, располагались как можно ближе друг к другу, так как это удлиняет общую линию посева и дает возможность получить изолированные колонии микробов в концевой ее части.
- • Для равномерного распределения засеваемого материала по поверхности плотной питательной среды можно пользоваться вместо петли тампоном или шпателем.
При обилии в засеваемом материале микробов они растут в виде пленки, покрывающей всю поверхность питательной среды. Такой характер микробного роста получил название сплошного или газонного. Посев газоном производят, когда нужно получить большие количества микробной культуры одного вида.
- Для посева материала в толщу плотной питательной среды готовят взвесь в стерильной водопроводной воде или в изотоническом растворе. Набирают 0,1–1 мл взвеси в пипетку (в зависимости от степени предполагаемого микробного загрязнения) и выливают в пустую стерильную чашку Петри. Вслед за этим чашку заливают 15–20 мл мясопептонного агара, расплавленного и остуженного до температуры 40– 45 "С (при такой температуре пробирка со средой, приложенная к щеке, не должна вызывать ощущения ожога). Для равномерного распределения исследуемого материала в питательной среде закрытую чашку с содержимым слегка вращают по поверхности стола.
- Посев уколом в столбик питательной среды производят в пробирку со средой, застывшей в виде столбика. Пробирку берут в левую руку как обычно, и в центре столбика до дна пробирки вкалывают петлю с находящимся на ней материалом.
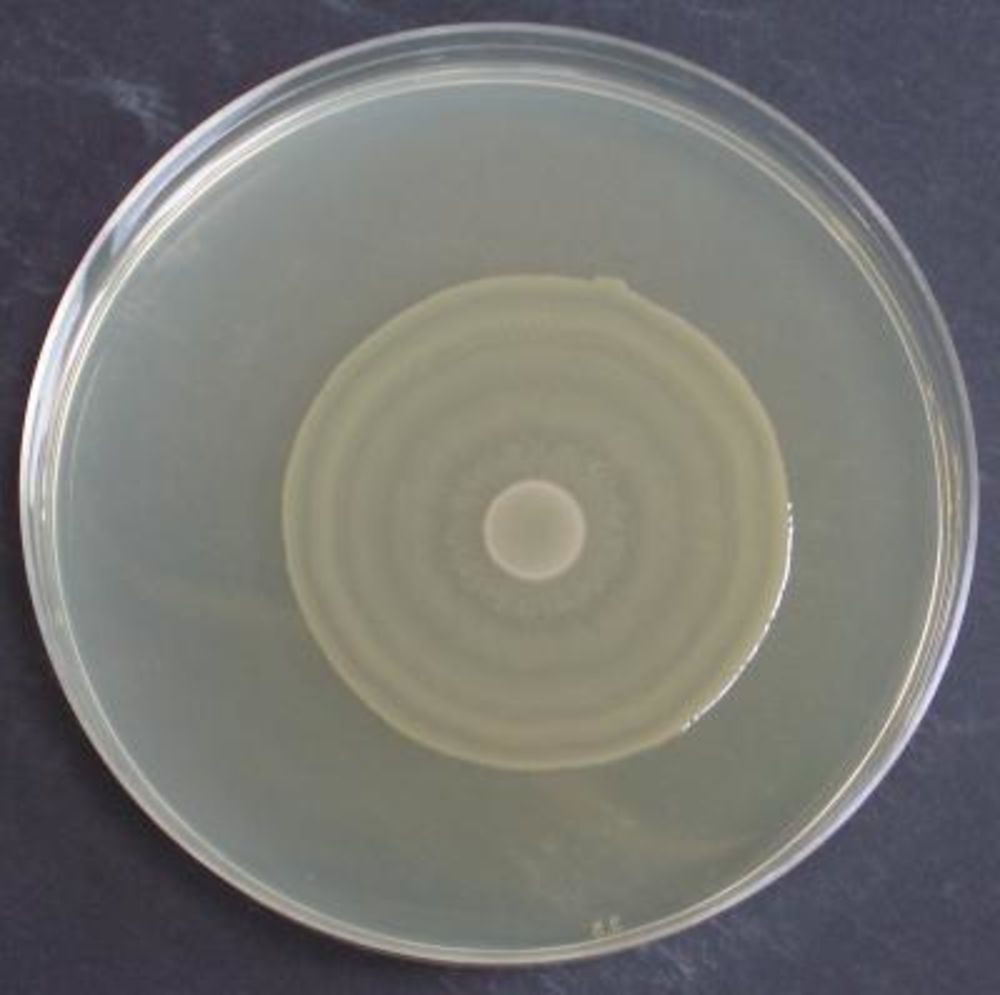
- Калиброванной бактериологической петлей (диаметр 2 мм, емкость 0,005 мл) производят посев мочи на сектор А чашки Петри с простым агаром, сделав около 40 штрихов. Затем петлю прожигают и производят 4 штриховых посева из сектора А в сектор I, из сектора I в сектор II и из сектора II в сектор III, каждый раз после прожигания петли (рис. 8.3).
Чашки инкубируют при температуре 37 °С в течение 18– 24 ч, после чего подсчитывают количество колоний, выросших в разных секторах, и определяют количество бактерий в 1,0 мл по приведенной табл. 8.1 (этот метод принят для определения степени бактериурии).
Таблица 8.1. Определение количества бактерий в 1 мл методом секторных посевов*
Количество колоний в секторах
Количество бактерий в 1 мл
*Приказ № 535 от 22 апреля 1985 г. "Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений" (Москва, 1985).
8.1.2. Методы выделения чистых культур
Чистой культурой принято называть совокупность однородных микроорганизмов, относящихся к одному виду, полученных из массы одной колонии, клетки которой идентичны по морфологическим, тинкториальным, культуральным, метаболическим и генетическим признакам, так как по существующим представлениям микробная колония является популяцией бактериальных клеток, возникшей в результате размножения единственной материнской клетки. Микробная колония являются аналогом клона.
Чистые культуры микроорганизмов одного вида, выделенные из различных источников, могут отличаться друг от друга незначительным отклонением морфологических, культуральных или биохимических признаков, не выходя за пределы своего вида или подвида. Такие культуры называют штаммами. Вместо ранее именованных типов в зависимости от характера изменившегося признака их обозначают морфоварами (отличные по морфологическим признакам), сероварами (имеющие антигенные отличия), биоварами (отличающиеся биологическими свойствами).
Чистая культура необходима для изучения морфологических, культуральных, биохимических и антигенных свойств, по совокупности которых определяется видовая принадлежность исследуемого микроорганизма.
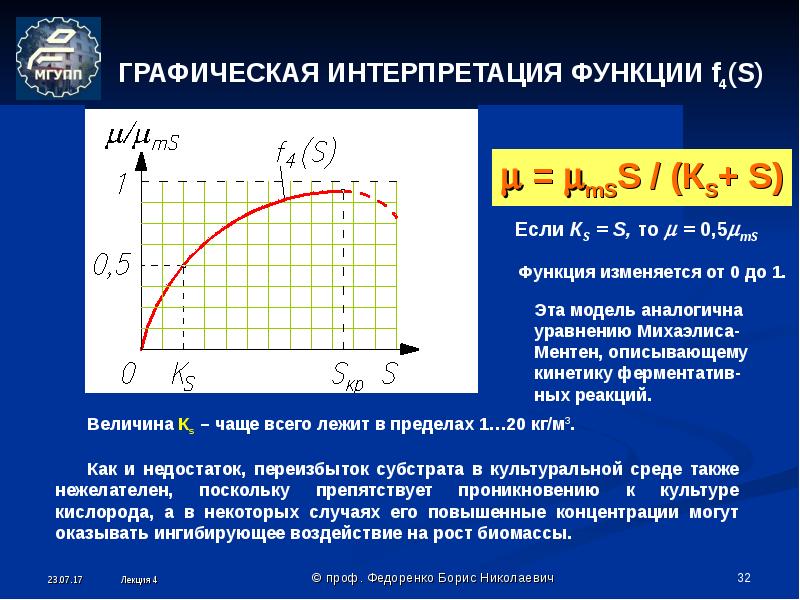
Для выделения чистых культур микробов из материалов, содержащих обильную смешанную микрофлору, предложено много различных методов. Наибольшее распространение получил метод механического разъединения микроорганизмов, находящихся в исследуемом материале, с целью получения изолированных колоний на поверхности или в глубине питательной среды. Очень широко применяются селективные питательные среды, стимулирующие развитие тех микроорганизмов, чистую культуру которых предполагается выделить. Некоторые виды микробов обладают высокой чувствительностью к воздействию определенных факторов внешней среды. Индивидуальная устойчивость микробов к тому или иному фактору была использована для разработки методов выделения чистых культур путем умерщвления сопутствующей микрофлоры. Этим способом производится выделение споровых форм микробов, устойчивых к действию высокой температуры, микобактерий туберкулеза, безразличных к действию концентрированных растворов минеральных кислот, в отличие от остальных микробов, содержащихся в мокроте.
При выделении чистой культуры патогенных микробов из патологического материала, загрязненного посторонней микрофлорой, прибегают иногда к заражению лабораторных животных, восприимчивых к тому виду микроба, который предполагается выделить из исследуемого материала. Биологический метод выделения чистой культуры применяется при исследовании мокроты на содержание в ней пневмококков, микобактерий туберкулеза.
Получение чистой культуры методом рассева в глубине среды (по Коху). Три пробирки, содержащие по 15 мл мясопептонного агара, ставят в водяную баню для расплавления агара. Расплавленную среду остужают до температуры 43–45 °С. В пробирку вносят одну бактериологическую петлю исследуемого материала. Для лучшего перемешивания материала со средой засеянную пробирку вращают несколько раз, зажав между ладонями. После этого одну петлю (прокаленную и остуженную) содержимого 1-й пробирки переносят во 2-ю и таким же образом из 2-й в 3-ю. Приготовленные разведения микробов выливают из пробирок в стерильные чашки Петри, обозначенные номерами, соответствующими номерам пробирок.
После застудневания среды с исследуемым материалом чашки помещают в термостат. Количество колоний в чашках с питательной средой уменьшается по мере разведения материала.
Выделение чистой культуры по способу Дригальского. Расплавленную питательную среду разливают в три чашки Петри. Застывшую среду обязательно подсушивают, так как влажная поверхность ее способствует образованию сливного роста. В первую чашку вносят одну каплю исследуемого материала и стерильным шпателем втирают его в поверхность питательной среды. Далее, не прожигая шпателя и не набирая нового материала, шпатель переносят во 2-ю, а затем и 3-ю чашки, втирая в поверхность питательных сред оставшийся на нем материал.
Метод рассева по поверхности, предложенный Дригальским, является наиболее употребительным для получения чистой культуры микробов. Вместо шпателя можно пользоваться петлей. Материал на питательной среде распределяют параллельными штрихами по всей чашке в одном направлении. Затем, повернув чашку на 90°, проводят штрихи в направлении, перпендикулярном первым штрихам. При таком способе посева материал, находящийся в петле, расходуется постепенно, и по линиям штрихов, нанесенных в конце посева, вырастают изолированные колонии микробов.
Выращивание и выделение чистых культур анаэробов. Для выращивания анаэробов необходимо создать определенные условия, сущность которых заключается в удалении молекулярного кислорода из питательной среды и пространства, окружающего эти культуры. Другим обязательным условием, обеспечивающим выделение анаэробов из исследуемого материала, является внесение большого количества посевного материала в питательную среду.
Единственным отличием питательных сред, применяемых для выращивания анаэробов, служит пониженное содержание в них свободного кислорода. Самым простым способом удаления растворенного кислорода является кипячение. Непосредственно перед посевом материала пробирки с питательными Средами кипятят на водяной бане в течение 10–20 мин. При кипячении из среды вытесняется воздух и, следовательно, удаляется кислород. Свежепрокипяченную питательную среду быстро охлаждают, погружая в лед или подставляя под струю холодной воды, чтобы не дать ей насытиться кислородом воздуха, и используют для посева. Для уменьшения диффузии кислорода из воздуха питательные среды заливают сверху стерильным вазелиновым или парафиновым маслом (толщина слоя 1–1,5 см). Засев среды производят пипеткой сквозь масло в наклонном положении пробирки.
В качестве редуцирующих веществ используют глюкозу, аскорбиновую кислоту, цистеин, гликокол, глутатион. Активно связываются с кислородом животные ткани паренхиматозных органов. На этом свойстве животных клеток основано приготовление питательной среды Китта – Тароцци (рецепт 161), широко применяемой для выращивания анаэробов. В жидкие питательные среды помещают иногда пористые вещества: вату, пемзу, которые адсорбируют на своей поверхности пузырьки воздуха.
Для создания бескислородных условий используют физические, химические и биологические факторы.
Физические способы культивирования анаэробов:
- • способ Виньяля – Вейона. Берут 4–5 пробирок с 0,5 % расплавленным и охлажденным до температуры 40–45 °С сахарным агаром. В содержимое одной из них вносят пипеткой небольшое количество исследуемого материала и тщательно размешивают. Для уменьшения концентрации материала с целью получения изолированных колоний засеянную среду в количестве, соответствующем объему внесенного материала, переносят из 1-й пробирки во 2-ю, из 2-й в 3-ю. Затем содержимым каждой пробирки заполняют капилляры трех пастеровских пипеток.
Чтобы предупредить застывание питательной среды в момент насасывания ее в пипетки, пока их кончик не обломлен, пипетки погружают на 3–5 мин в стерильную воду с температурой 45–50 °С. После заполнения вытянутый конец трубки запаивают и помещают в стеклянный цилиндр с ватой на дне. Через 2–3 сут в столбике агара вырастают ясно видимые колонии микробов-анаэробов. Выросшие колонии легко изолировать. Для этого капилляр надрезают напильником выше уровня намеченной колонии, надламывают, а колонию микроба, находящуюся в агаре, извлекают петлей и пересевают в свежую питательную среду;
- • выращивание анаэробов в условиях вакуума. Вакуумные условия для выращивания анаэробов создают в анаэростате или эксикаторе. Исследуемый материал или культуру микробов засевают в пробирки с жидкой средой или в чашки Петри с плотной питательной средой. Посевы помещают в анаэростат, затем присоединяют его к насосу и выкачивают воздух. Степень разреженности воздуха определяют по показаниям вакуумметра. Колонии анаэробов в вакуумных условиях растут на поверхности плотной питательной среды.
Химические методы выращивания анаэробов (метод Аристовского). Материал, исследуемый на наличие анаэробов, засевают на среду в чашки Петри и помещают их в эксикатор, на дно которого кладут химический поглотитель кислорода: гидросульфит натрия или пирогаллол. В расширенную часть сосуда устанавливают на подставке чашки с посевами. Прибор закрывают крышкой и помещают в термостат при температуре 37 *С на 24–48 ч.
Биологический метод выращивания анаэробов (по Фортнеру). В чашку Петри наливают толстым слоем 5 % кровяной агар с 1–2 % глюкозы. Посередине чашки в питательной среде вырезают стерильным скальпелем канавку шириной 1–1,5 см, которая делит питательную среду на две половины. Одну из них засевают культурой анаэробов или исследуемым на их наличие материалом, другую половину – культурой аэробов: чудесной палочкой (Serratia marcescens) или кишечной палочкой (Escherichia coli). Перед посевом чашки подсушивают в термостате, чтобы аэробы вместе с капельками влаги не могли попасть на другую сторону чашки. Засеянные чашки закрывают, а свободное пространство между дном и крышкой заклеивают лейкопластырем, чтобы предупредить поступление в чашку кислорода извне. В термостате чашки устанавливают вверх дном. Быстро растущие аэробы, поглощая находящийся в чашке кислород, создают тем самым благоприятные условия для роста анаэробов.
Анаэростат для культивирования анаэробов. Анаэростат – прибор для выращивания микробов в анаэробных условиях – представляет собой толстостенную металлическую или пластиковую камеру с герметически привинчивающейся крышкой, на которой имеются вакуумметр и два крана для присоединения к вакуум-насосу. Вместо кислорода в нем используются газовые смеси.
Вы можете изучить и скачать доклад-презентацию на тему Оборудование для культивирования микроорганизмов. Биореакторы непрерывного действия (лекция 3). Презентация на заданную тему содержит 39 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас - поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!




































БИОРЕАКТОРЫ НЕПРЕРЫВНОГО ДЕЙСТВИЯ Оборудование непрерывного действия характеризуется: одновременностью протекания всех стадий технологической операции; неизменностью параметров на этих стадиях; разобщенностью этих стадий в пространстве (т.е. они осуществляются в различных частях машины, аппарата или различных машинах и аппаратах единой технической системы).
ОСНОВНЫЕ МОДЕЛИ АППАРАТОВ НЕПРЕРЫВНОГО ДЕЙСТВИЯ аппараты идеального (полного) вытеснения; аппараты идеального (полного) смешения; аппараты промежуточного типа.
ПРЕИМУЩЕСТВА НЕПРЕРЫВНОГО КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ Компактность и меньшая материалоемкость по сравнению с биореакторами периодического действия той же производительности; Простота обслуживания, поскольку сокращаются затраты рабочего времени на вспомогательные операции - загрузку и разгрузку биореактора, его мойку и санитарную обработку; Простота автоматизации; Постоянная работа с полной нагрузкой; Более высокое качество получаемого продукта, поскольку культивирование осуществляют в условиях установившегося режима, обеспечивающих оптимальное физиологическое состояние культуры - в фазе экспоненциального роста; Более высокая продуктивность, чем у биореактора периодического действия, однако концентрация продукта всегда бывает ниже.
ПРИЧИНЫ, СДЕРЖИВАЮЩИЕ ПЕРЕХОД НА НЕПРЕРЫВНОЕ КУЛЬТИВИРОВАНИЕ Более высокие требования к герметизации биореакторов для сохранения асептики; Более сложное конструктивное устройство аппаратуры и систем контроля, что ведет к увеличению капитальных затрат; Загрязнение биомассой внутренних поверхностей биореактора и расположенных внутри его устройств при продолжительном культивировании микроорганизмов, особенно микроскопических грибов; Угроза утраты ценных свойств генноинженерных штаммов; Инерционность мышления.
ОСНОВНЫЕ ПРИНЦИПЫ РЕАЛИЗАЦИИ БИОТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ Принцип масштабирования, предусматривающий поэтапное увеличение вместимости аппаратов; Принцип однородности физико-химических условий (рН, температуры, концентрации растворенных веществ, включая О2 и т. п.; Принцип асептики, предусматривающий надежную стерилизацию питательных сред, добавочных компонентов, титрующих растворов, пеногасителей, технологического воздуха, биореактора и коммуникаций; Принцип дифференцированных режимов культивирования, при котором разные этапы процесса осуществляют при различных (оптимальных) условиях, варьируя такие параметры как температура, рН и т. п.
ОСНОВНЫЕ ТЕХНИЧЕСКИЕ СИСТЕМЫ БИОРЕАКТОРА В соответствии с основными принципами реализации биотехнологических процессов биореактор должен обладать следующими системами:
НАЗНАЧЕНИЕ СИСТЕМ БИОРЕАКТОРА Системы биореактора, должны обеспечивать такие условия культивирования, чтобы была как можно выше. Прежде, чем рассматривать отдельные системы биореакторов, необходимо четко представлять какие параметры и в каком диапазоне они должны обеспечивать при культивировании микроорга-низмов. Кинетические зависимости, которые описывают влияние различных параметров культивирования на удельную скорость роста используют при расчете биореакторов, при определении их конструктивных параметров.
Техника посевов микроорганизмов на питательные среды

Для работы с микроорганизмами используют специальные бактериологические петли, иглы, шпатели, пипетки. Посевы всегда проводят около пламени горелки. Около работающего с чистой культурой нельзя делать резких движений, ходить, кашлять и т.п., так как движение воздуха увеличивает опасность попадания посторонних микроорганизмов в пробирку с культурой. Поэтому посевы и пересевы микроорганизмов рекомендуется проводить в боксе.
Рис. 19. Правила разливания питательной среды в чашки Петри
Посев в жидкую питательную среду. Посев производят петлей или градуированной пипеткой. Посевной материал бактериологической петлей осторожно вносят в пробирку и легко встряхивают в верхнем слое питательной среды или растирают по стенке, смывая его жидкой средой.
Стерильную пипетку фламбируют (обжигают) в пламени горелки, опускают в пробирку с культурой, отбирают определенное количество материала и переносят его в пробирку со свежей питательной средой, выпуская жидкость по стенке пробирки, или вносят пипетку вглубь среды и выдувают содержащийся в ней материал.
Посев штрихом в пробирку со скошенным агаром (рис.22). Пробирку с культурой и пробирку со скошенным питательным агаром берут в левую руку и держат в наклонном положении. В правую руку берут бактериологическую иглу и прокаливают ее в пламени спиртовки до покраснения, затем проносят сквозь пламя иглодержатель. Мизинцем правой руки вынимают пробки из обеих пробирок, обжигают края пробирок. Петлю вводят в пробирку с культурой, охлаждают ее о края пробирки и осторожно снимают небольшое количество микробной культуры. Петлю с посевным материалом быстро переносят в пробирку со стерильной средой и опускают почти до дна, где скапливается небольшое количество конденсационной влаги. Слегка касаясь агара, проводят зигзагообразную линию, при этом петлю не отрывают от поверхности питательной среды. После посева петлю вынимают из пробирки и обжигают вместе с остатками посевного материала.


Рис. 24. Посев на агар в чашки Петри шпателем Дригальского
Глубинный посев в чашку Петри. Определенное количество подготовленного к посеву исследуемого материала (1,0 или 0,1 см 3 ) вносят пипеткой в пустую чашку Петри. Из пробирки или колбы с расплавленной и остуженной до 45 °С питательной средой вынимают пробку, обжигают края в пламени горелки и, слегка приоткрыв крышку, выливают на дно чашки.
Пробирки и чашки с посевами помещают в термостат с температурой, оптимальной для конкретного микроорганизма. Как правило, мезофильные бактерии выращивают при температуре 37±1 °С, термофильные бактерии – при 40–55 °С, дрожжи и плесени – при 30±1 °С.
Культивирование и рост микроорганизмов
Выращивание микроорганизмов на питательных средах называется культивированием, а развившиеся в таких средах микроорганизмы – культурой. При культивировании происходит рост культуры – физиологический процесс, в результате которого увеличивается биомасса – масса клеточного вещества данного микроорганизма.
Чистой культурой микроорганизма называют культуру, которая представлена потомством одной клетки. Естественным путем получить чистую культуру почти невозможно, поэтому ее получают искусственно. Для выделения чистой культуры используют плотные питательные среды, на которых каждая клетка вырастает в виде изолированной колонии – популяции микроорганизмов одного вида.
Перед выделением чистой культуры из какого-либо пищевого продукта или природного субстрата (например: почвы, воды), в котором данный микроорганизм находится в небольших количествах, вначале получают накопительные культуры, проводя культивирование в элективных условиях.
Накопительные культуры состоят преимущественно из клеток микроорганизмов одного вида. Элективные (накопительные) условия – условия, способствующие развитию одной культуры и ограничивающие развитие сопутствующих микроорганизмов. Создать накопительные условия можно путем использования накопительных сред. Примером элективных условий может быть повышенная температура (для выделения термоустойчивых форм бактерий), повышенная кислотность, повышенная концентрация соли и т.д.
Инкубация – культивирование микроорганизмов при определенной температуре.
Хранят чистые культуры обычно на плотных питательных средах в пробирках. При этом постоянно необходимо делать пересевы на свежую питательную среду.
К другим способам хранения чистых культур относятся сохранение их на накопительной среде под слоем вазелинового масла и хранение в лиофилизованном состоянии (сушка под вакуумом замороженных клеток микроорганизмов).
В пищевой промышленности применяют чистые культуры дрожжей, молочнокислых, уксуснокислых, пропионовокислых бактерий, обладающих ценными свойствами для производства. В последнее время находят успешное применение многокомпонентные чистые культуры, состоящие из двух и более видов микроорганизмов.
Работа по получению и поддержанию чистых культур промышленных микроорганизмов осуществляется в научно-исследовательских лабораториях. Там они выделяются из различных субстратов, изучаются, и наиболее продуктивные, пригодные для производства, хранятся в коллекции музея чистых культур, откуда рассылаются отраслевыми научно-исследовательскими институтами на предприятия. В заводской лаборатории микробиолог подготавливает культуру для производственного цикла, проверяет ее биологическую чистоту, активность.
Способ культивирования зависит от конечной цели культивирования (целью является либо накопление биомассы, либо получение определенного продукта жизнедеятельности – метаболита).
Поверхностное культивирование заключается в выращивании аэробных микроорганизмов на поверхности жидких и сыпучих питательных сред. При этом микроорганизмы получают кислород непосредственно из воздуха. При поверхностном культивировании на жидких средах микроорганизмы растут в виде пленок. Осуществляется поверхностное культивирование в специальных ваннах – кюветах.
Глубинное культивирование проводится на жидких питательных средах, в которых микроорганизмы развиваются во всем объеме питательной среды. Сочетание питательной среды и растущих в ней микроорганизмов называют культуральной жидкостью. Осуществляется глубинное культивирование в специальных аппаратах – ферментаторах, снабженных мешалками и системой подвода стерильного воздуха для обеспечения роста аэробных микроорганизмов. Аэрирование – продувание стерильного воздуха через культуральную жидкость.
При периодическом культивировании весь объем питательной среды засевают чистой культурой, которую выращивают в оптимальных условиях определенный период времени до накопления нужного количества целевого продукта. Следует отметить, что, так как культивирование ведется на невозобновляемой питательной среде (в стационарных условиях), то клетки все время находятся в меняющихся условиях. Таким образом, периодическую систему можно рассматривать как замкнутую систему.
При непрерывном культивировании культура находится в специальном аппарате, куда постоянно притекает питательная среда и откуда с такой же скоростью отводится культуральная жидкость. Для микроорганизма создаются неизменные условия среды, поэтому непрерывную систему можно рассматривать как открытую систему.
Поверхностное культивирование может быть только периодическим, в то время как глубинное культивирование может осуществляться и периодическим, и непрерывным способом.
При периодическом способе культивирования популяция микроорганизмов проходит 7 стадий (фаз) роста (рис. 25).
1 2 3 4 5 6 7
Рис. 25 Кривая роста статической культуры:
N – концентрация жизнеспособных клеток;
τ – продолжительность культивирования
1. Лагфаза. В этот период культура адаптируется к новой среде обитания. Активизируются ферментные системы, возрастает количество нуклеиновых кислот, клетка готовится к интенсивному синтезу белков и других соединений. Клетки не размножаются (скорость размножения равна нулю). Концентрация живых клеток постоянна и равна количеству внесенных клеток. Продолжительность этой фазы зависит от физиологических особенностей микроорганизма и от состава питательной среды.
2. Фаза ускорения роста. Эта фаза характеризуется началом деления клеток, увеличением общей массы и постоянным увеличением скорости роста культуры. Эта фаза обычно непродолжительна.
3. Экспоненциальная (логарифмическая) фаза роста. В этот период микроорганизмы размножаются с постоянной максимальной скоростью. При этом логарифм числа клеток линейно зависит от времени. К концу этой фазы среда истощается вследствие катаболических и анаболических процессов, в среде накапливаются продукты жизнедеятельности микроорганизмов. Возникает и пространственная ограниченность, так как клетки мешают друг другу.
4. Фаза замедления роста. В этот период снижается скорость роста, небольшая часть клеток гибнет. Скорость роста выше скорости отмирания.
5. Стационарная фаза. Количество живых клеток достигает максимума. Скорость роста равна скорости отмирания клеток, поэтому концентрация жизнеспособных клеток остается постоянной.
6. Фаза ускорения отмирания. Количество отмерших клеток (скорость отмирания) становится больше количества образовавшихся клеток.
7. Фаза отмирания. Масса живых клеток значительно уменьшается, так как в среде нет питательных веществ, а запасные вещества клетки исчерпываются.
При непрерывном способе культивирования культура поддерживается в какой-то фазе роста.
Если цель культивирования – получение биомассы продуцента, процесс целесообразно вести в режиме логарифмической фазы, когда микроорганизм способен обеспечить максимальную скорость роста популяции.
Для поддержания культуры в логарифмической фазе культивирование микробной популяции проводят в условиях хемостата или турбидостата.
Рост в хемостате. Хемостат состоит из сосуда, в который вводят с постоянной скоростью питательный раствор. По мере поступления питательного раствора из него вытекает суспензия микроорганизмов с той же скоростью. При культивировании в условиях хемостата поддерживается постоянная концентрация одного из компонентов среды (например, углерода). Благодаря этому в условиях хемостата поддерживается постоянная скорость роста культуры. Культура микроорганизма находится в условиях динамического равновесия.
Рост в турбидостате. Работа турбидостата основана на поддержании постоянной концентрации живых клеток. В сосуде для культивирования все питательные вещества содержатся в избытке, а скорость роста бактерий приближается к максимальной.
Если же целью культивирования является получение метаболита (например, этилового спирта), выход которого в среду обитания не соответствует логарифмической фазе роста, применяется способ непрерывного выращивания в двух или нескольких последовательно соединенных аппаратах, что позволяет как бы расчленить процесс на несколько стадий.
Микроорганизмы в окружающей нас природе находятся повсеместно: в почвах, водоемах, на поверхностях всевозможных предметов, ими населены люди и животные. Все это может служить источниками загрязнения микробами продуктов питания, лекарств, производственных линий. Культивирование бактерий необходимо для изучения их свойств, потребностей, особенностей. Это в свою очередь является важным этапом в разработке различных лекарственных препаратов, лабораторной диагностике заболеваний, расчете производственных реакторов и многого другого.
Общие понятия
Под культивированием бактерий в микробиологии понимают выращивание микроорганизмов, осуществляемое в лабораторных условиях. В свою очередь микробы, которые выросли на подобранной питательной среде, называют культурой. Культуры могут быть смешанными, если они образованы разными видами микроорганизмов, и чистыми, если представлены только одним видом бактерий.
Если в питательную среду помещают только одну клетку, а получают в результате ее размножения группу особей, то эту совокупность микроорганизмов называют клоном. Когда клон развивается до такого уровня, что становится виден невооруженным глазом, такое скопление бактерий называют колонией.
Обычно культивирование бактерий, выделенных из различных источников, производят отдельно друг от друга. Каждую такую отдельно выращенную группу микробов называют штаммом. Так, если один вид стафиллококка выделен из трех источников (или разных порций одного и того же продукта, разных человек), говорят о трех штаммах этого вида стафилококка.
Факторы роста бактерий
К ним относят различные аминокислоты, липиды, пуриновые основания и другие соединения, необходимые для развития микроорганизмов. Некоторые микробы могут самостоятельно вырабатывать необходимые им вещества, а другим необходимо получать их в готовом виде. По потребности микроорганизмов в тех или иных ростовых факторах проводят идентификацию и дифференциацию бактерий. Также этот параметр важен для правильного изготовления питательной среды в целях проведения лабораторных и биотехнологических работ:
- Аминокислоты. Бактерии могут нуждаться в одной конкретной аминокислоте или какой-либо группе кислот. Так, клостридиям необходим лейцин и тирозин, стрептококкам - лейцин и аргинин. Микроорганизмы, которым для роста необходимо получение аминокислот извне, называют ауксотрофными.
- Пуриновые и пиримидиновые основания, а также их производные (аденин, гуанин и другие). Они являются важным фактором роста многих видов стрептококков.
- Витамины. Они входят в состав коферментов, требуемых бактериям. Так, никотиновая кислота, а также ее амид, входящие в состав НАД и НАДФ, нужна коринебактериям дифтерии, шигеллы. Тиамин, как составная часть пирофосфата, требуется золотистому стафилококку, пневмококку, бруцеллам. Пантотеновая кислота, входящая в кофермент КоА, требуется бациллам столбняка и отдельным видам стрептококка. Цитохромы, а значит, образующие их фолиевая кислота, гемы и биотин, необходимы микобактериям туберкулеза и гемофильным бактериям.
Требования к средам
Условия, предъявляемые к питательным средам для культивирования бактерий:
- Питательность. Они должны содержать вещества, причем находящиеся в легко усвояемом виде, необходимые микроорганизмам для питания и пополнения энергии. К ним относят органогены и минеральные вещества. Для некоторых микроорганизмов дополнительно необходимы витамины и аминокислоты, которые они не могут синтезировать.
- Оптимальный уровень рН. Он влияет на проницаемость клеточной оболочки и, соответственно, на возможность усвоения питательных веществ бактерией. Чаще всего значение водородного показателя должно быть на уровне 7,2–7,4. Многие микроорганизмы в ходе своей жизнедеятельности вырабатывают продукты с кислой или щелочной реакций, и для того, чтобы рН питательной среды не изменялся, она должна обладать буферностью.
- Изотоничность. Осмотическое давление в питательной среде для культивирования бактерий должно иметь те же значения, что и внутри микробных клеток. Обычно оно соответствует 0,5 % раствору NaCl.
- Стерильность. Связано это с тем, что появление посторонних бактерий исказит результаты изучения анализируемого штамма.
- Уровень влажности. Этот показатель наряду с консистенцией среды должен иметь оптимальные характеристики для конкретного вида бактерий.
- Окислительно-восстановительный потенциал (RH2). Он показывает соотношение веществ, которые отдают и которые принимают электроны, а также уровень насыщения кислородом питательной среды. Для аэробов и анаэробов условия культивирования бактерий несколько разнятся по данному показателю. Анаэробные микроорганизмы лучше всего размножаются при значениях RH2, не превышающих 5, а аэробные – не менее 10.
- Унифицированность. Важно, чтобы питательная среда содержала неизменные количества отдельных ее ингредиентов. Кроме того, предпочтительны прозрачные растворы, на которых легче отслеживать рост культуры или заметить ее загрязнение.
Виды питательных сред
На выбор той или иной среды для выращивания микроорганизмов влияет множество факторов, среди которых - особенности их питания и цели исследования. Основными признаками, положенными в основу классификации питательных сред, являются:
1. Компоненты. По исходным веществам, используемым для создания субстрата, различают:
- натуральные, которые готовятся из продуктов животного или растительного происхождения (например, мяса, молока, фруктов) и удобны для выращивания смешанных культур;
- полусинтетические, в которых дорогостоящие натуральные пищевые продукты заменены на непищевые (например, костную муку, сгустки крови), и которые оптимальны для культивирования бактерий отдельных видов или выделения из среды продуктов их жизнедеятельности;
- синтетические, которые готовятся из точных количеств химических соединений, имеют известный постоянный состав и легко воспроизводятся.
2. Консистенция (плотность). Различают среды:
Последние две готовят из специальных растворов или жидких веществ с добавлением агар-агара или желатина для создания необходимой плотности. Кроме того, плотной средой для роста бактерий является свернутая сыворотка крови, картофель, среды с силикагелем, каррагинан.
3. Состав. По данному признаку среды бывают:
- простые, список которых короток - это мясопептонный бульон (МПБ), бульон и агар Хоттин-гера, мясопептонный агар (МПА), питательный желатин и пептонная вода.
- сложные, приготовляемые из простых с добавлением крови, сыворотки, углеводов и другие веществ.
4. Назначение. Выделяют следующие питательные среды:
- основные служат для выращивания многих патогенных микробов (обычно простого состава);
- специальные применяют для выделения и культивирования бактерий, которые не растут на простых субстратах;
- элективные (они же избирательные) подходят для выделения конкретного вида бактерий и подавляют рост сопутствующих микробов (селективность создается путем прибавки к средам некоторых веществ, например антибиотиков или солей, или коррекцией рН);
- дифференциально-диагностические дают возможность отличить один вид бактерий от другого путем оценки ферментативной активности, например, среды;
- консервирующие нужны для первичного посева с последующей транспортировкой образцов, поскольку предотвращают отмирание микроорганизмов, а также подавляют рост других бактерий.
Приготовление питательных сред
Важнейшим этапом культивирования анаэробных бактерий является приготовление подходящей питательной среды. После того, как выбраны оптимальные параметры, переходят к следующим стадиям:
- взвешивание, путем отбора навески компонентов на аналитических весах;
- растворение, проводимое в подогретой до 70 °С дистиллированной воде, причем отдельно растворяют фосфаты, микро- и макросоли;
- кипячение, осуществляемое на водяной бане на протяжении двух минут;
- определение pH, выполняемое индикаторной бумагой или потенциометром;
- фильтрация, производимая через смоченный матерчатый или бумажный фильтры для жидких, а также расплавленных плотных сред, и через ватно-марлевый фильтр для агаровых;
- розлив, выполняемый на 3/4 емкости;
- стерилизация, зависящая от состава среды;
- контроль на стерильность осуществляется путем отстаивания в течение двух суток в термостате с последующим просмотром;
- химический контроль для установления рН и содержания необходимых элементов;
- биологический контроль путем пробного засева.
Стерилизация посуды и сред
Одним из основных принципов культивирования бактерий является стерильность. Рост и развитие посторонних микроорганизмов может повлиять на характеристики питательной среды путем изменения ее химического состава и рН. Стерилизация является главным условием выращивания чистых культур. На практике под этим термином подразумевают методы уничтожения абсолютно всех жизненных форм на поверхности и в объеме стерилизуемых объектов. Стерилизации подвергается посуда, применяемые инструменты, среды, а также другие предметы, используемые в ходе исследования.
Некоторые виды стерилизации:
- Прокаливание. Стерилизацию петель и игл для посева, предметных стекол, некоторого инструмента можно выполнять с помощью горелки или спиртовки.
- Кипячение. Годится для обработки шприцов, игл, пищевых продуктов, но не убивает споры бактерий.
- Сухожаровая стерилизация. Проводится в особом сушильном шкафу и подходит для обработки колб, пробирок и прочей лабораторной посуды.
- Стерилизация паром. Проводимый в автоклаве этот метод является высокоэффективным. Но он не годится для питательных сред, в состав которых входят белки или какие-либо другие соединения, разрушающиеся при высоких температурах. Более щадящей можно назвать тиндализацию. Она проводится в кипятильнике Коха и сочетает проращивание спор с их уничтожением.
- Пастеризация. Применяется для сред, меняющих свои свойства при кипячении (например, молоко, вино, пиво), способна избавить их от неспороносных микроорганизмов. Температура обработки составляет всего 50-60 °С на протяжении пятнадцати-тридцати минут. В некоторых случаях применяют холодную стерилизацию, осуществляемую с помощью фильтров или УФ-лучей.

Условия культивирования бактерий
Рост и развитие бактерий возможны лишь при определенных факторах и значениях каждого из них:
1. Температура. Различают три группы бактерий, отличающихся температурными предпочтениями:
- термофилы, или теплолюбивые микробы, растут при 45-90°С, а значит, не размножаются в организмах человека и животного;
- психрофилы, или холодолюбивые микроорганизмы, предпочитают температуру в интервале 5-15 °С и выращиваются в холодильных камерах;
- мезофилы, развиваются при температуре 25-37 °С, к ним относится основная масса бактерий.
2. Свет. Является особенностью культивирования бактерий-фототрофов, поскольку они осуществляют фотосинтетический процесс. Но для большинства микробов освещение не является обязательным условием. И даже наоборот, солнечный ультрафиолет может подавлять их развитие.
3. Вода. Всем микроорганизмам необходима вода в доступной (жидкой) форме. Вот почему в замороженных продуктах бактерии практически не развиваются.
4. Кислотность среды. Этот принцип культивирования бактерий уже был подробно разобран выше.
5. Аэрация. Кислород, как химический элемент, является составной частью воды и немалого количества соединений, применяемых для выращивания микроорганизмов. Газообразный кислород также может содержаться в воде и прочих жидкостях в растворенном виде. Существенная часть бактерий нуждается в постоянном поступлении молекул кислорода. Но ряду микроорганизмов он без надобности, или, хуже того, газообразный кислород токсичен для них, поскольку они не имеют каталазы и пероксидазы, разрушающих токсичные продуты дыхания. Поэтому важнейшим этапом культивирования анаэробных бактерий является удаление молекул О2 из питательной среды.
6. Культивирование микроорганизмов. Выращивание аэробных и анаэробных бактерий проводится в различных слоях среды и в разных режимах.
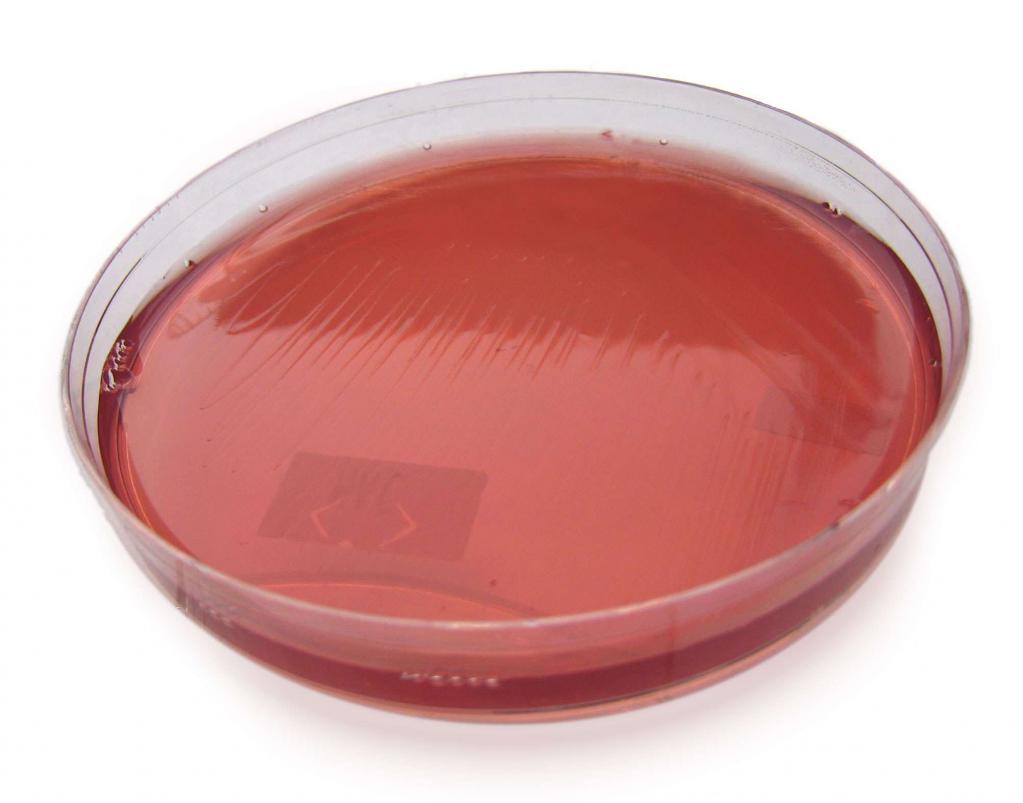
Выращивание аэробных микроорганизмов
Для культивирования аэробных бактерий требуется молекулярный кислород. Для получения чистых культур аэробов, которые можно успешно применять в медицине и пищевой промышленности, используются следующие методы:
- поверхностное выращивание на плотных средах или в жидких средах (их тонком слое), когда кислород поступает прямо из воздуха;
- глубинное культивирование в жидких средах, когда повышения количества растворенного в них кислорода добиваются путем постоянной аэрации.
Выращивание анаэробных микроорганизмов
Основным принципом культивирования бактерий этого типа является минимальный их контакт с кислородом воздуха. Обеспечить условия их роста гораздо сложнее, чем для аэробов. Для изоляции анаэробов от молекулярного О2 применяются следующие методы:
- Физические. Этот метод культивирования анаэробных бактерий сводится к их выращиванию в специальном вакуумном аппарате - микроанаэростате. Воздух в нем заменен на особую газовую смесь из азота с добавлением 10 % водорода и 5 % углекислого газа.
- Химические. К ним относятся: использование поглощающих агентов (например, Fe, Na2S2O4, CuCl) или восстанавливающих агентов (например, аскорбиновая кислота).
- Биологические. Сводится к совместному выращиванию аэробов и анаэробов в закрытой системе. Этот метод культивирования бактерий предполагает засевание одной половины чашки Петри каким-то из аэробных видов бактерий, а второй - изучаемым анаэробом. Развитие его начнется в тот момент, когда истратится весь кислород.
Для культивирования анаэробных бактерий подходят следующие способы посева:
- в поверхностном слое;
- в поверхностном слое с заливкой стерильным парафином;
- в толще плотной питательной среды;
- в глубинных слоях вязких сред.

Получение чистой культуры
Микробиологи в своей работе обычно имеют дело с образцами, заселенными множеством различных видов микробов. Однако для определения систематического положения микроорганизмов (семейство, род, вид), а также изучения их особенностей необходимо их изолировать и вырастить чистую культуру. Они имеют важнейшее значение во многих пищевых производствах, например, сыра, хлеба, кваса, вина и т. д. Культивирование молочнокислых бактерий позволяет получить важнейший компонент для производства кисломолочных продуктов, теста, какао, силоса и даже пластика.
Способ выделения чистой культуры в плотной среде основан на механическом отделении клеток микроорганизмов с последующим их изолированным выращиванием. Образец переносится в стерильный объем воды или физраствора (объемом 10—100 мл), а затем встряхивается на протяжении двух минут. Чтобы извлечь микроорганизмы, находящиеся в толще исследуемого материала (например, колбасы или сыра), сначала выполняют растирание кусочков образца стерильными инструментами с песком. Материал, прошедший предварительную подготовку, массой 1 г или объемом 1 мл разбавляют стерильной водой в 10, 100, 1000 и т. д. раз. Выбирают ту степень разведения, которая дает концентрацию клеток, соответствующую возможностям метода.
Последующее выращивание микроорганизмов заключается в подготовке питательной среды. Обычно выбирается плотная среда (МПА). Ее предварительно расплавляют и остужают до 45—50 °С, а уже потом разливают в несколько чашек Петри (три-пять штук), на дно которых помещены смывы с исследуемого вещества различных концентраций. Далее проводят перемешивание еще не застывшей питательной среды и внесенного в нее материала. Так добиваются фиксирования клеток в различных точках объема субстрата.
Далее чашки Петри помещают в термостат на 2 суток при 22 °С. За это время клетки размножаются до такой степени, что колония, образованная каждой из клеток, становится видна невооруженным глазом. Каждая из них является чистой культурой того вида бактерий, из клеток которого она выросла.
После этого с чашек Петри микроорганизмы пересевают в отдельные пробирки, наполненные питательной средой. Таким образом проводится выделение чистых культур из смешанного образца. Этот метод носит имя своего разработчика - Р. Коха. Также его принято называть чашечным методом, или истощающим посевом. После получения чистых культур различных видов бактерий выполняют установление их формы, обнаружение спор, семейства.
Все работы должны выполняться согласно принципам асептики. Чтобы избежать преждевременного развития микроорганизмов, исследование необходимо проводить сразу после отбора проб. Водопроводную воду анализируют после слива первых порций, поскольку в них могут находиться накопившиеся в трубах и кранах микробы. Микрофлора фруктов, ягод и овощей преимущественно размещена на поверхности (кожуре), поэтому выполняют смывы с нее. Для этого в стерильную емкость помещают плод и заливают его необходимым количеством воды. Затем их довольно энергично встряхивают и сливают воду в другую емкость. Посевы с матерчатых изделий также получают смывами, но предварительно из них вырезают кусочки заданного размера.
Читайте также:

