Лабораторная работа посев микроорганизмов шпателем тампоном петлей
Добавил пользователь Алексей Ф. Обновлено: 18.09.2024
Доставляемый в лабораторию материал подвергают бактериологическому исследованию в тот же день. Техника посева зависит от характера высеваемого материала, консистенции питательной среды и цели исследования.
Для проведения посевов необходимы: подлежащий исследованию материал, питательные среды, бактериологическая петля, шпатели (стеклянные, металлические), пастеровские и градуированные пипетки, металлические кюветы или поднос для переноса засеянных чашек, металлические коробки для переноса пробирок, ведро или бачок с крышками для сброса отработанного инфицированного материала, спиртовая или газовая горелка.
Способ взятия плотного материала определяется консистенцией последнего. При посевах чаще всего пользуются бактериологической петлей.
Все манипуляции, связанные с посевом и выделением микробных культур, производят вблизи пламени горелки. Бактериологическую петлю перед взятием материала прокаливают в пламени горелки, затем ее остужают, чтобы при соприкосновении с жидкой средой она не вызывала кипения, а прикосновение к агару не сопровождалось его плавлением.
Для остуживания петлю лучше всего погружать в конденсационную жидкость пробирки со стерильной питательной средой или прикасаться ею к крышке чашки Петри со стерильной средой. Нельзя остужать петлю прикосновением к поверхности питательной среды, даже свободной от микробного материала, так как на ней могут находиться колонии, не видимые простым глазом.
После окончания посева петлю прожигают повторно для уничтожения находящейся в ней микробной культуры или инфицированного микроорганизмами материала.
Пипетки и шпатели, использованные для посевов, опускают в дезинфицирующий раствор.
По завершении посева на дне чашек Петри или на верхней части пробирок пишут название засеянного материала либо номер анализа и дату посева.
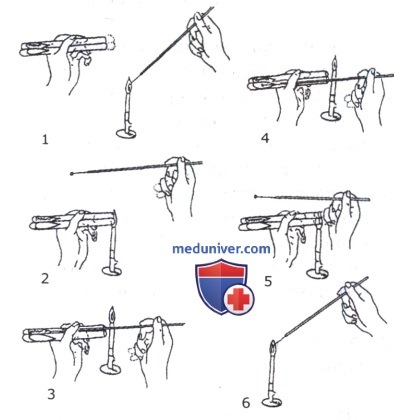
Пересев культуры микробов из пробирки в пробирку (1-6-последовательность).
Техника посевов на плотные и жидкие питательные среды:
• При посеве в жидкую питательную среду петлю с находящимся на ней материалом погружают в среду. Если материал вязкий и с петли не снимается, его растирают на стенке сосуда, а затем смывают жидкой средой. Жидкий материал, набираемый в пастеровскую или градуированную пипетку, вливают в питательную среду.
• При посеве на скошенный питательный агар из пробирки в пробирку обе пробирки (одну — с посевным материалом, другую — со стерильной средой) берут в левую руку между I и II пальцами так, чтобы их края были на одном уровне. Правой рукой вынимают пробки из пробирок и зажимают их между IV, V пальцами и ладонью. Свободными тремя пальцами правой руки берут бактериологическую петлю и держат как писчее перо. Вынув пробки, края пробирок обжигают в пламени горелки. Прокаленную петлю вводят через пламя горелки в пробирку с посевным материалом, охлаждают и небольшое количество посевного материала переносят в пробирку со скошенным агаром, нанося штрихи снизу вверх от одной стенки до другой.
После посева пробирки закрывают пробками, предварительно проведя края пробирок и пробки через пламя горелки. Петлю прокаливают.
• При посеве на поверхность плотной питательной среды из пробирки в чашки Петри II, III и V пальцами левой руки фиксируют пробирку, а I и IV пальцами той же руки приоткрывают крышку чашки Петри настолько, чтобы в образовавшуюся щель свободно проходили петля или шпатель.
Небольшое количество исследуемого материала, взятого из пробирки бактериологической петлей, втирают в поверхность питательной среды у края чашки. Затем петлю прожигают, чтобы уничтожить избыток находящегося на ней материала. Линию посева начинают с того места, в котором находится материал. Бактериологическую петлю кладут плашмя на питательную среду, чтобы не поцарапать ее поверхность, и проводят штрихи по всей среде или по секторам, разграфив предварительно дно чашки (при условии, что среда прозрачна) на 4, 8 или 16 равных частей.
Нужно стараться, чтобы штрихи, наносимые петлей, располагались как можно ближе друг к другу, так как это удлиняет общую линию посева и дает возможность получить изолированные колонии микробов в концевой ее части.
Для равномерного распределения засеваемого материала по поверхности плотной питательной среды вместо петли пользуются тампоном или шпателем.
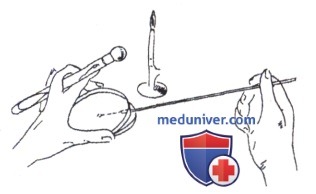
Посев на плотную питательную среду в чашки Петри.
При посеве шпателем материал наносят на поверхность среды петлей или пипеткой, а затем стеклянным или металлическим шпателем тщательно растирают его по всей поверхности агара. При этом левой рукой придерживают слегка приоткрытую крышку и одновременно вращают чашку. После посева металлический шпатель прокаливают в пламени горелки, а стеклянный помещают в дезинфицирующий раствор.
При посеве тампоном последний с исследуемым материалом вносят в чашку и круговыми движениями втирают его содержимое в поверхность среды, одновременно вращая тампон и чашку.
При обилии в засеваемом материале микробов они растут в виде пленки, покрывающей всю поверхность питательной среды. Такой характер микробного роста получил название сплошного или газонного. Посев газоном производят, когда нужно получить большое количество микробной культуры одного вида.
Для посева материала в толщу плотной питательной среды готовят взвесь в стерильной водопроводной воде или в изотоническом растворе. Набирают 0,1-1 мл взвеси в пипетку (в зависимости от степени предполагаемого микробного загрязнения) и выпускают в пустую стерильную чашку Петри. Вслед за этим в чашку заливают 15-20 мл мясопептонного агара, расплавленного и остуженного до температуры 40-45°С (при такой температуре пробирка со средой, приложенная к щеке, не вызывает ощущения ожога). Для равномерного распределения исследуемого материала в питательной среде закрытую чашку с содержимым слегка вращают на поверхности стола.
Посев уколом в столбик питательной среды производят в пробирку со средой, застывшей в виде столбика. Пробирку берут в левую руку как обычно, и в центр столбика до дна пробирки вкалывают петлю с находящимся на ней материалом.
Доставляемый в лабораторию материал подвергают бактериологическому исследованию в тот же день. Техника посева зависит от характера высеваемого материала, консистенции питательной среды и цели исследования.
Для проведения посевов необходимы: подлежащий исследованию материал, питательные среды, бактериологическая петля, шпатели (стеклянные, металлические), пастеровские и градуированные пипетки, металлические кюветы или поднос для переноса засеянных чашек, металлические коробки для переноса пробирок, ведро или бачок с крышками для сброса отработанного инфицированного материала, спиртовая или газовая горелка.
Способ взятия плотного материала определяется консистенцией последнего. При посевах чаще всего пользуются бактериологической петлей.
Все манипуляции, связанные с посевом и выделением микробных культур, производят вблизи пламени горелки. Бактериологическую петлю перед взятием материала прокаливают в пламени горелки, затем ее остужают, чтобы при соприкосновении с жидкой средой она не вызывала кипения, а прикосновение к агару не сопровождалось его плавлением.
Для остуживания петлю лучше всего погружать в конденсационную жидкость пробирки со стерильной питательной средой или прикасаться ею к крышке чашки Петри со стерильной средой. Нельзя остужать петлю прикосновением к поверхности питательной среды, даже свободной от микробного материала, так как на ней могут находиться колонии, не видимые простым глазом.
После окончания посева петлю прожигают повторно для уничтожения находящейся в ней микробной культуры или инфицированного микроорганизмами материала.
Пипетки и шпатели, использованные для посевов, опускают в дезинфицирующий раствор.
По завершении посева на дне чашек Петри или на верхней части пробирок пишут название засеянного материала либо номер анализа и дату посева.

Пересев культуры микробов из пробирки в пробирку (1-6-последовательность).
Техника посевов на плотные и жидкие питательные среды:
• При посеве в жидкую питательную среду петлю с находящимся на ней материалом погружают в среду. Если материал вязкий и с петли не снимается, его растирают на стенке сосуда, а затем смывают жидкой средой. Жидкий материал, набираемый в пастеровскую или градуированную пипетку, вливают в питательную среду.
• При посеве на скошенный питательный агар из пробирки в пробирку обе пробирки (одну — с посевным материалом, другую — со стерильной средой) берут в левую руку между I и II пальцами так, чтобы их края были на одном уровне. Правой рукой вынимают пробки из пробирок и зажимают их между IV, V пальцами и ладонью. Свободными тремя пальцами правой руки берут бактериологическую петлю и держат как писчее перо. Вынув пробки, края пробирок обжигают в пламени горелки. Прокаленную петлю вводят через пламя горелки в пробирку с посевным материалом, охлаждают и небольшое количество посевного материала переносят в пробирку со скошенным агаром, нанося штрихи снизу вверх от одной стенки до другой.
После посева пробирки закрывают пробками, предварительно проведя края пробирок и пробки через пламя горелки. Петлю прокаливают.
• При посеве на поверхность плотной питательной среды из пробирки в чашки Петри II, III и V пальцами левой руки фиксируют пробирку, а I и IV пальцами той же руки приоткрывают крышку чашки Петри настолько, чтобы в образовавшуюся щель свободно проходили петля или шпатель.
Небольшое количество исследуемого материала, взятого из пробирки бактериологической петлей, втирают в поверхность питательной среды у края чашки. Затем петлю прожигают, чтобы уничтожить избыток находящегося на ней материала. Линию посева начинают с того места, в котором находится материал. Бактериологическую петлю кладут плашмя на питательную среду, чтобы не поцарапать ее поверхность, и проводят штрихи по всей среде или по секторам, разграфив предварительно дно чашки (при условии, что среда прозрачна) на 4, 8 или 16 равных частей.
Нужно стараться, чтобы штрихи, наносимые петлей, располагались как можно ближе друг к другу, так как это удлиняет общую линию посева и дает возможность получить изолированные колонии микробов в концевой ее части.
Для равномерного распределения засеваемого материала по поверхности плотной питательной среды вместо петли пользуются тампоном или шпателем.

Посев на плотную питательную среду в чашки Петри.
При посеве шпателем материал наносят на поверхность среды петлей или пипеткой, а затем стеклянным или металлическим шпателем тщательно растирают его по всей поверхности агара. При этом левой рукой придерживают слегка приоткрытую крышку и одновременно вращают чашку. После посева металлический шпатель прокаливают в пламени горелки, а стеклянный помещают в дезинфицирующий раствор.
При посеве тампоном последний с исследуемым материалом вносят в чашку и круговыми движениями втирают его содержимое в поверхность среды, одновременно вращая тампон и чашку.
При обилии в засеваемом материале микробов они растут в виде пленки, покрывающей всю поверхность питательной среды. Такой характер микробного роста получил название сплошного или газонного. Посев газоном производят, когда нужно получить большое количество микробной культуры одного вида.
Для посева материала в толщу плотной питательной среды готовят взвесь в стерильной водопроводной воде или в изотоническом растворе. Набирают 0,1-1 мл взвеси в пипетку (в зависимости от степени предполагаемого микробного загрязнения) и выпускают в пустую стерильную чашку Петри. Вслед за этим в чашку заливают 15-20 мл мясопептонного агара, расплавленного и остуженного до температуры 40-45°С (при такой температуре пробирка со средой, приложенная к щеке, не вызывает ощущения ожога). Для равномерного распределения исследуемого материала в питательной среде закрытую чашку с содержимым слегка вращают на поверхности стола.
Посев уколом в столбик питательной среды производят в пробирку со средой, застывшей в виде столбика. Пробирку берут в левую руку как обычно, и в центр столбика до дна пробирки вкалывают петлю с находящимся на ней материалом.
После этого петлю стерилизуют в пламени, чтобы уничтожить избыток материала, охлаждают. Следующий этап посева начинают с места, где закончился предыдущий. Петлю кладут горизонтально на поверхность агара, где было сделано занял, проводят один-два разы по поверхности и делают занял по остальным среды. Необходимо пытаться, чтобы штрихи посева длились от края к краю чашки, не повреждали поверхности агара и располагались близко друг к другу. Этим искусственно продлевается линия посева и создаются возможности для получения изолированных колоний.
Посев шпателем и тампоном в чашки Петри. Материал предварительно наносят на поверхность питательной среды возле края чашки петлей или пипеткой. Стерильный шпатель проносят через пламя, охлаждают, касаясь стенки чашки. Осторожными круговыми движениями, держа чашку полузакрытой, распределяют материал равномерно по поверхности среды.
Посев шпателем
При посеве тампоном чашку кое-что открывают одной рукой, тампоном касаются поверхности агара возле края чашки и начинают проводить занял штрихами от края к краю чашки, втирая осторожно материал в поверхность среды, не повреждая его, постепенно вращая тампон. После проведения посева чашку вращают на 90°и повторяют занял перпендикулярно к предыдущему.
При посеве уколом в столбик питательной среды пробирку с м’ясо-пептонним агаром, желатином и тому подобное берут в левую руку, петлю с материалом – в праву и делают укол к дну пробирки в среду. Петлю осторожно вынимают, а пробирку закрывают.
Посев материала в толщу питательной среды. Перед посевом материал должен быть в жидком состоянии. Стерильной градуированной пипеткой набирают 0,1, 0,5 или 1,0 мл материалу и выливают его в стерильные чашки Петри. После этого материал заливают 15-20 мл растопленного и охлажденного до 45-50 °С МПА. Осторожно покачивая чашку, круговыми движениями по поверхности стола перемешивают в ней материал, достигая его равномерного деления в среде. Чашку оставляют закрытой к полному застудневанию агара, а затем переворачивают вверх дном.
Для того, чтобы выделить чистую культуру микроорганизмов, следует отделить многочисленные бактерии, которые находятся в материале, одна от другой. Это можно достичь с помощью методов, которые основаны на двух принципах – механическом и биологическом разобщении бактерий.
Механический принцип
Биологический принцип
1. Фракционных разведений Л. Пастера
2. Пластинчастых разведений Р. Коха
3. Поверхностных посевов Дригальського
4. Поверхностных штрихов
Приймают во внимание:
а - тип дыхания (метод Фортнера);
б - подвижность (метод Шукевича);
д - температурный оптимум;
е - избирательную чувствительность лабораторных животных к бактериям
Метод разведений Метод поверхностных штрихов. Методы выделения чистых культур, основанные на механическом принципе
Метод последовательных разведений, предложен Л. Пастером, был одним из самых первых, который применялся для механического разъединения микроорганизмов. Он заключается в проведении последовательных серийных разведений материала, который содержит микробов, в стерильной жидкой питательной среде. Этот прием достаточно кропотлив и несовершенный в работе, поскольку не позволяет контролировать количество микробных клеток, которые попадают в пробирки при разведениях.
Этого недостатка не имеет метод Коха (метод пластинчатых разведений). Р. Кох использовал плотные питательные среды на основе желатины или агар-агара. Материал с ассоциациями разных видов бактерий разводился в нескольких пробирках с растопленным и кое-что охлажденным желатином, содержание которых позже выливалось на стерильные стеклянные пластины. После застудневания среды оно культивировалось при оптимальной температуре. В его толще образовывались изолированные колонии микроорганизмов, которые легко могут быть перенесены на свежую питательную среду с помощью платиновой петли для получения чистой культуры бактерий.
Метод Дригальского является более совершенным методом, который широко распространен в повседневной микробиологической практике. Сначала на поверхность среды в чашке Петри пипеткой или петлей наносят исследуемый материал. С помощью металлического или стеклянного шпателя его тщательным образом втирают в среду. Чашку во время посева держат привидкритою и осторожно вращают, чтобы равномерно распределить материал. Не стерилизуя шпателя, проводят им занял материалу в другой чашке Петри, при потребности – в третьей. Только после этого шпатель окунают в дезинфикуючий раствор или прожаривают в пламени горелки. На поверхности среды в первой чашке наблюдаем, как правило, сплошной рост бактерий, во второй – густой рост, а в третьей – рост в виде изолированных колоний.
После этого петлю стерилизуют в пламени, чтобы уничтожить избыток материала, охлаждают. Следующий этап посева начинают с места, где закончился предыдущий. Петлю кладут горизонтально на поверхность агара, где было сделано занял, проводят один-два разы по поверхности и делают занял по остальным среды. Необходимо пытаться, чтобы штрихи посева длились от края к краю чашки, не повреждали поверхности агара и располагались близко друг к другу. Этим искусственно продлевается линия посева и создаются возможности для получения изолированных колоний.
Посев шпателем и тампоном в чашки Петри. Материал предварительно наносят на поверхность питательной среды возле края чашки петлей или пипеткой. Стерильный шпатель проносят через пламя, охлаждают, касаясь стенки чашки. Осторожными круговыми движениями, держа чашку полузакрытой, распределяют материал равномерно по поверхности среды.
Посев шпателем
При посеве тампоном чашку кое-что открывают одной рукой, тампоном касаются поверхности агара возле края чашки и начинают проводить занял штрихами от края к краю чашки, втирая осторожно материал в поверхность среды, не повреждая его, постепенно вращая тампон. После проведения посева чашку вращают на 90°и повторяют занял перпендикулярно к предыдущему.
При посеве уколом в столбик питательной среды пробирку с м’ясо-пептонним агаром, желатином и тому подобное берут в левую руку, петлю с материалом – в праву и делают укол к дну пробирки в среду. Петлю осторожно вынимают, а пробирку закрывают.
Посев материала в толщу питательной среды. Перед посевом материал должен быть в жидком состоянии. Стерильной градуированной пипеткой набирают 0,1, 0,5 или 1,0 мл материалу и выливают его в стерильные чашки Петри. После этого материал заливают 15-20 мл растопленного и охлажденного до 45-50 °С МПА. Осторожно покачивая чашку, круговыми движениями по поверхности стола перемешивают в ней материал, достигая его равномерного деления в среде. Чашку оставляют закрытой к полному застудневанию агара, а затем переворачивают вверх дном.
Для того, чтобы выделить чистую культуру микроорганизмов, следует отделить многочисленные бактерии, которые находятся в материале, одна от другой. Это можно достичь с помощью методов, которые основаны на двух принципах – механическом и биологическом разобщении бактерий.
Механический принцип
Биологический принцип
1. Фракционных разведений Л. Пастера
2. Пластинчастых разведений Р. Коха
3. Поверхностных посевов Дригальського
4. Поверхностных штрихов
Приймают во внимание:
а - тип дыхания (метод Фортнера);
б - подвижность (метод Шукевича);
д - температурный оптимум;
е - избирательную чувствительность лабораторных животных к бактериям
Метод разведений Метод поверхностных штрихов. Методы выделения чистых культур, основанные на механическом принципе
Метод последовательных разведений, предложен Л. Пастером, был одним из самых первых, который применялся для механического разъединения микроорганизмов. Он заключается в проведении последовательных серийных разведений материала, который содержит микробов, в стерильной жидкой питательной среде. Этот прием достаточно кропотлив и несовершенный в работе, поскольку не позволяет контролировать количество микробных клеток, которые попадают в пробирки при разведениях.
Этого недостатка не имеет метод Коха (метод пластинчатых разведений). Р. Кох использовал плотные питательные среды на основе желатины или агар-агара. Материал с ассоциациями разных видов бактерий разводился в нескольких пробирках с растопленным и кое-что охлажденным желатином, содержание которых позже выливалось на стерильные стеклянные пластины. После застудневания среды оно культивировалось при оптимальной температуре. В его толще образовывались изолированные колонии микроорганизмов, которые легко могут быть перенесены на свежую питательную среду с помощью платиновой петли для получения чистой культуры бактерий.
Метод Дригальского является более совершенным методом, который широко распространен в повседневной микробиологической практике. Сначала на поверхность среды в чашке Петри пипеткой или петлей наносят исследуемый материал. С помощью металлического или стеклянного шпателя его тщательным образом втирают в среду. Чашку во время посева держат привидкритою и осторожно вращают, чтобы равномерно распределить материал. Не стерилизуя шпателя, проводят им занял материалу в другой чашке Петри, при потребности – в третьей. Только после этого шпатель окунают в дезинфикуючий раствор или прожаривают в пламени горелки. На поверхности среды в первой чашке наблюдаем, как правило, сплошной рост бактерий, во второй – густой рост, а в третьей – рост в виде изолированных колоний.
Читайте также:

