Какое удобрение обладает большей физиологической кислотностью
Добавил пользователь Дмитрий К. Обновлено: 19.09.2024
Эффективность удобрения определяется свойствами как солей, входящих в его состав, так и почвой, в частности, реакциями, которые происходят между удобрением и различными почвенными компонентами. И именно препятствия на пути от гранулы к корню растения снижают коэффициент использования удобрения и, соответственно, возврат инвестиций. (Статья Ирины Логиновой для журнала "Агроиндустрия", сентябрь 2019 г.)
Препятствие первое. Растворение
Зависит от количества влаги в почве и характеристик самих удобрений. Первое мы можем до некоторой степени контролировать путем выбора оптимального срока и способа внесения удобрения в почву. Так, заделка во влажный слой почвы повышает шансы удобрения раствориться до начала активного потребления растением. Это особенно актуально для фосфорных удобрений, ввиду очень низкой подвижности фосфора в почве и неспособности промываться на достаточную глубину в корнеобитаемый слой при поверхностном внесении.
В немного лучшие условия попадают жидкие удобрения, для которых отсутствует стадия растворения, и которые менее зависимы от влажности почвы на момент внесения. Правда, это не относится к безводному аммиаку, для которого внесение в недостаточно увлажненную почву может приводить к повышению непродуктивных потерь азота.
Во-вторых, характеристики самих удобрений определяют их растворимость в почвенной влаге. Традиционные азотные удобрения являются хорошо растворимыми в воде солями, исключение составляют только специальные азотные удобрения контролируемого и пролонгированного действия. То же относится и к калийным удобрениям: хлориды и сульфаты калия, которые чаще всего являются солями традиционных калийсодержащих удобрений, хорошо растворимы в воде.
Растворимость фосфорсодержащих удобрений зависит от их солевого состава: по растворимости в различных растворах фосфорные удобрения делятся на водорастворимые, содержащие преимущественно однозамещенные фосфаты (SSP, TSP, MAP, DAP, APP), цитраторастворимые, содержащие двухзамещенные фосфаты (DCP, термофосфаты) и труднорастворимые фосфаты, содержащие трехзамещенные фосфаты (фосфоритная мука).
В состав сложных NPK удобрений входят преимущественно соли первой группы; однако, на рынке есть также составы, содержащие большую долю двух- и трехзамещенных фосфатов, что напрямую будет влиять на их растворимость и эффективность. Также на растворимость NPK удобрений будет влиять их марка: как правило, высокоазотные марки лучше растворимы в воде.
Необходимо также заметить, что даже в группе водорастворимых фосфорных удобрений есть различия. Хотя и кальций- и аммонийфосфаты относятся к водорастворимым, они имеют разную растворимость и степень диффузии в почве: аммонийфосфаты (МАР, DAP) являются более водорастворимыми соединениями в сравнении с кальцийфосфатами (SSP, TSP).
Таким образом, компонентный (солевой) состав удобрений в первую очередь влияет на их растворимость в почве и динамику высвобождения элементов питания в почвенный раствор.
Кроме того, технология производства и характеристики самой гранулы будут оказывать влияние на растворение в почвенной влаге. Методы грануляции оказывают влияние на размер, форму, прочность гранулы и другие ее характеристики, которые косвенно также влияют на характер растворения в почве. На растворимость гранулы будут оказывать влияние также филлеры (наполнители), примеси и кондиционирующие добавки.
Размер гранул играет важную роль: стартовые микрогранулированные удобрения, специализированные для внесения при посеве в борозду (технология In-Furrow), ввиду малого размера гранул, обеспечивают лучшее распространение в почве при внесении и более равномерное распределение, что увеличивает площадь контакта с почвой и корнями растений и способствует большей эффективности удобрения.
Растворение гранул водорастворимых удобрений происходит достаточно быстро, даже при условии невысокого содержания влаги в почве. Вода, необходимая для растворения, проникает в гранулу удобрения путем капиллярного или транспорта паров, в результате вокруг гранулы удобрения формируется почти насыщенный раствор солей. Это приводит к созданию осмотического градиента между концентрированным раствором удобрения и почвенной влагой. Поскольку вода движется в зону удобрения, раствор удобрения движется в окружающую почву. Это движение воды внутрь и раствора удобрения наружу продолжает поддерживать практически насыщенный раствор до тех пор, пока не растворится вся гранула.
Даже после того, как исчерпывается резерв солей в грануле, этот осмотический градиент будет существовать до момента разбавления или реакции между компонентами удобрения и почвенным раствором, восстанавливая последний до его природного состава.
Препятствие второе. Изменения рН
Когда концентрированный раствор солей удобрения покидает гранулу и переходит в окружающую почву, он влияет на характеристики почвы, и в то же время, сам раствор удобрения изменяется под влиянием компонентов почвы. Более того, когда виртуально насыщенный раствор удобрения покидает гранулу и движется в ближайшую зону почвы, в этой зоне на поведение удобрения большее влияние оказывают свойства самого насыщенного раствора, нежели свойства почвы.
Прямым следствием взаимодействия удобрения с почвой является изменение рН почвы под влиянием насыщенного раствора удобрения. Однако, существует ограничение в точности предсказания влияния удобрения на рН почвы, если основываться только на его химическом составе, поскольку очень много факторов взаимодействуют при внесении удобрения в почву: например, вид растения, исходное значение рН почвы, остаточная известь, микробиологическая активность в почве и др.
Соли удобрений классифицируются на химически кислые, нейтральные или щелочные. Например, KCl или Ca(NO3)2 — химически нейтральные соли, моноаммонийфосфат NH4H2PO4 – химически кислая, а диаммонийфосфат (NH4)2HPO4 – химически щелочная. Однако, в случае с удобрениями, большую роль в остаточной реакции удобрения играют растения и почва.
Во-первых, для поддержания баланса зарядов на поверхности корней, при поглощении катионов растения должны либо выделять в ризосферу соответствующее количество других катионов, либо поглощать больше анионов.
Баланс зарядов на поверхности корня зависит в основном от интенсивности и характера поглощения макроэлементов, поскольку они потребляются растением в намного больших количествах, нежели микроэлементы. Среди макроэлементов, азот играет первую роль в балансе зарядов, поскольку он может поглощаться и как анион (NO3-), и как катион (NH4+), и поглощается в намного большем количестве, нежели другие ионы. Когда растения поглощают больше азота в виде нитрата, в ответ корни выделяют ОН- и НСО3- в почву для поддержания баланса заряда, что создает эффект, известный как физиологическая щелочность (основность). И наоборот, если корни поглощают больше азота в виде аммония (NH4+), они выделяют Н+ для поддержки баланса зарядов, что создает физиологическую кислотность.
А так как большинство элементов питания поглощается растениями в виде катионов (за исключением некоторых элементов, например, азота, бора или молибдена), то большинство удобрений являются физиологически кислыми.
Во-вторых, удобрения, содержащие аммоний, могут образовывать Н+ в почве при превращении аммония в нитраты под влиянием почвенных микроорганизмов (нитрификация).
Таким образом, химически нейтральная соль, например, Ca(NO3)2 оказывается физиологически щелочной, тогда как химически щелочная соль, например, (NH4)2HPO4 будет физиологически кислой.
В общих чертах, влияние азотных удобрений на изменения рН почвы зависит от формы азота. Так, удобрения, содержащие азот в форме аммония, в результате прохождения процесса нитрификации, оказывают подкисляющее действие на почву (если нет достаточного количества оснований, способных нейтрализовать эту кислотность).
Азотные удобрения, содержащие азот в виде нитратов в сочетании с основаниями (Na, Ca), после поглощения растениями азота будут снижать кислотность почвы (физиологические щелочные удобрения). Но происходит это, только если нитратный азот поглощается растением. Если же растения малы, или находятся в стрессе и не растут, нитраты мало влияют на рН субстрата.
Что же касается аммонийно-нитратных удобрений, то аммонийный азот создает приблизительно в три раза более сильное подкисляющее действие, нежели нитратный азот – подщелачивающее. Например, если удобрение содержит около 25% аммонийного азота и 75% нитратного, то реакция на рН почвы будет близка к нейтральной.
При внесении безводного аммиака в почву, он реагирует с почвенной водой и превращается в аммоний, который имеет щелочную реакцию и временно повышает рН почвы. Однако, по мере нитрификации аммония, почвенный раствор подкисляется. Эти две реакции (подщелачивания и подкисления) не сбалансированы полностью, но стремятся к балансу, что в результате оказывает на почву слабое подкисляющее действие.
Карбамид при внесении в почву под влиянием фермента уреазы превращается в бикарбонат аммония, чем вызывает временное подщелачивание почвенного раствора (т.к. бикарбонат-анион реагирует с почвенным Н+ с образованием H2CO3, диссоциирующего на CO2 и H2O, и на аммоний-катион), а в последствии подкисляет в результате нитрификации аммонийного азота. В сумме, карбамид оказывает только слабое подкисляющее действие на почву.
Фосфорные удобрения способны влиять на почвенную кислотность, преимущественно за счет высвобождения или связывания ионов Н+ в зависимости от рН почвы. Изменения рН имеют, как правило, локальный характер и более заметны при локальном внесении удобрений.
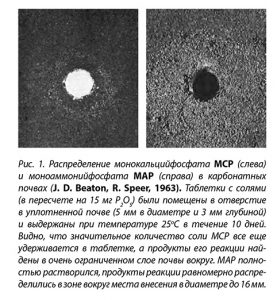
Из таблицы видно, что насыщенный раствор, образуемый группой водорастворимых фосфорных удобрений, имеет рН в диапазоне от 1,0 до 10,1 и содержит 1,7-6,1 моль/л фосфора. Концентрация сопутствующих элементов колеблется от 1,3 до 12,2 моль/л.
Таблица 1. Состав и свойства насыщенных растворов фосфорных соединений, обычно присутствующих в удобрениях (Источник: Sample et al., 1980)
Несмотря на низкое значение рН насыщенного раствора суперфосфата, он не имеет постоянного эффекта на реакцию почвы, поскольку в нем кислото- и щелочьобразующие элементы питания нейтрализуют друг друга, а кислотность обусловлена в первую очередь свободной кислотой (остающейся в процессе производства). Большинство результатов, полученных в длительных полевых экспериментах, показали, что суперфосфат либо немного уменьшает, либо вовсе не имеет влияния на рН почвы. Аммонизированный суперфосфат имеет слабокислую реакцию (как результат присутствия аммония), которая зависит от степени, до которой суперфосфат аммонизируют.
Влияние фосфатов на рН почвы зависит в большой степени от природной кислотности самой почвы. Так, для МАР (аммофос) в почвах с рН>7,2 ион дигидрофосфата Н2РО4- диссоциирует с образованием свободного Н+, который и оказывает подкисляющее влияние на таких почвах:
Н2РО4- → НРО42- + Н+.
В кислых почвах фосфор присутствует в виде Н2РО4- и подобных превращений не происходит, поэтому на почвах с рН

28.04.2018
Одним из важнейших факторов для жизни и развития растений является такой показатель как кислотность почвы. Именно рН грунта (наличие ионов водорода Н + в почвенном растворе) определяет его физические и биохимические свойства, а значит, создает условия, которые либо препятствуют, либо ограничивают, либо способствуют выращиванию сельскохозяйственных культур. Согласно шкале классификации уровня кислотности почв (в пределах от 0 до 14) различают кислые (0
По восприимчивости к реакции почвенного раствора растения разделяют на пять основных групп. В первую группу входят наиболее чувствительные культуры, оптимальной средой для которых является слабощелочная. К ним относятся: капуста белокочанная, горчица, рапс, шпинат, сельдерей, пастернак, свекла (сахарная, кормовая, столовая), перец, лук, чеснок, люцерна, эспарцет, смородина и др. Ко второй группе относятся растения, предпочитающие нейтральную среду: пшеница, ячмень, капуста (кормовая, цветная, кольраби), брюква, турнепс, лук-порей, салат, огурец, фасоль, нут, горох, чечевица, чина, вика, клевер, лисохвост, костер. Их урожайность снижается в 1,5 – 2 раза при снижении рН почвы до уровня 4,5 – 4,8 ед.

Третью группу составляют культуры, успешно растущие в более широком диапазоне, включающем слабокислые и слабощелочные грунты: гречиха, овес, озимая рожь, подсолнечник, топинамбур, томаты, редька, редис, репа, петрушка, морковь, кабачки, тыква, ревень. Их урожайность остается достаточно высокой при рН грунта в пределах от 5 до 7,5 ед. Растения четвертой группы , к которым относятся просо, сорго, лен долгунец, картофель и другие культуры, успешно переносят умеренную кислотность почв и демонстрируют хорошие показатели роста и продуктивности в условиях оптимального соотношения таких элементов питания как калий, кальций, магний, бор и др. Малочувствительны к слабо- и среднекислой среде культуры пятой группы : чай, щавель, козлятник, люпин желтый, сераделла.

В то же время немаловажным остается тот факт, что помимо биологических особенностей растений в отношении уровня рН почвы, следует учитывать при их выращивании взаимодействие элементов питания с почвенной средой. Грунты, почвенная реакция которых близка к нейтральной, наиболее благоприятны для физиологических процессов роста культур, внутрипочвенного преобразования химических элементов в наиболее доступную для растений форму и поступления питательных веществ в ткани растительного организма. Также они обеспечивают нейтрализацию токсичных для растений подвижных форм железа, алюминия и марганца.

Грунты с кислой реакцией почвенного раствора влияют не только на степень растворимости применяемых минеральных удобрений, но и на уровень доступности полезных веществ, необходимых для полноценного питания сельскохозяйственных культур. Многолетний опыт земледелия подтверждает, что растения легче всего усваивают питательные вещества, находящиеся в почве с показателем рН в пределах 6,5 – 7 единиц. Особенно это существенно для молодых растений.
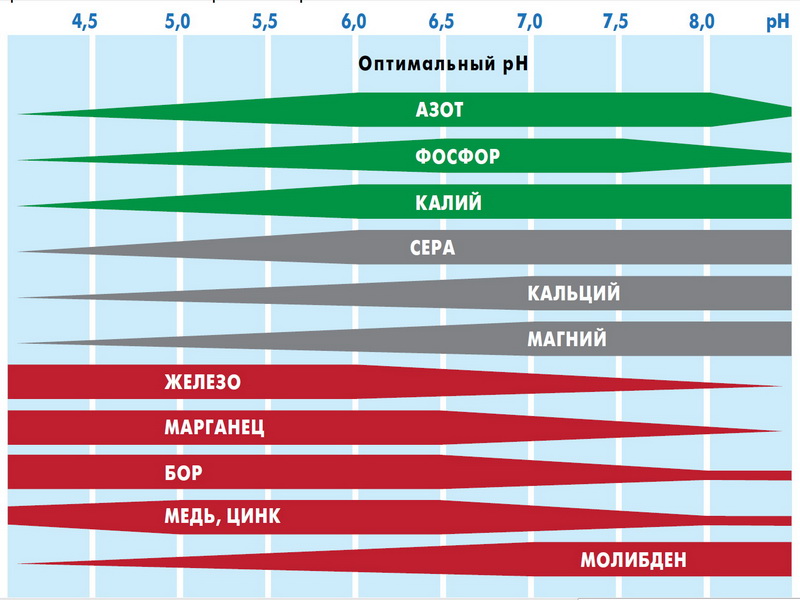
Изменение уровня кислотности грунта в ту или иную сторону приводит к снижению или увеличению степени доступности полезных макро- и микроэлементов. И если поглощение растениями алюминия, марганца, цинка, кобальта, меди, бора и железа в кислой среде (4,0
По мере накапливания в почвенном растворе элементов, поглощение которых растениями в кислой среде увеличивается, со временем может образоваться их избыток до токсичного уровня, что приведет к нарушению обмена веществ (белков и углеводов), а в дальнейшем и к гибели растений. В почве с низким значением рН также тормозится усваиваемость корневой системой питательных катионов, приостанавливается деятельность и образование корневых бактерий, которые продуцируют органические азотсодержащие вещества, обогащая азотом почву и обеспечивая азотное питание культур.
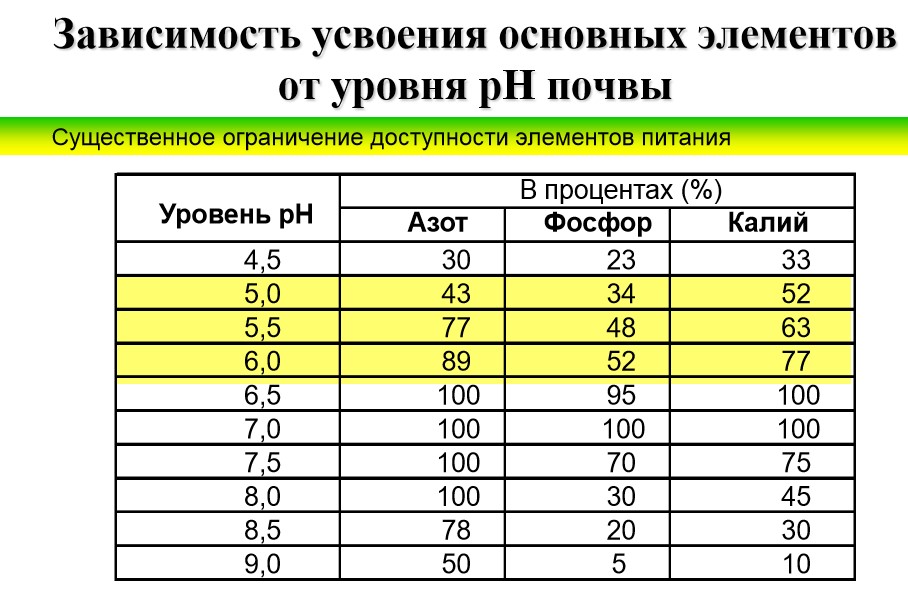
При снижении уровня кислотности до 5,5 единиц уменьшается доступность калия, магния, молибдена и почвенных фосфатов. Замедляется процесс нитрификации, в результате чего образование в почве легкоусваиваемых азотсодержащих веществ приостанавливается. В результате эффективность применения азота путем внесения в почву в качестве удобрения снижается на 25%, калия – на 33%, а фосфора – на 50%. Такие потери наносят значительный материальный урон сельскохозяйственным предприятиям, фермерским хозяйствам и огородникам-любителям в связи с неполноценным употреблением растениями питательных веществ.
Для нейтрализации кислых почв, как правило, прибегают к их известкованию, позволяющему получить нейтральную или слабощелочную реакцию среды. Но в этом случае также необходимо учитывать, что этот агроприем не всегда дает положительный результат. Например, для культур первой группы (свекла, капуста, люцерна и пр.), обладающих высокой чувствительностью к кислотности почв, доступность некоторых элементов питания (калий, магний, фосфор, марганец, бор, цинк, медь) значительно снижается, что приводит к их дефициту и требует дополнительного внесения удобрений для обеспечения нормальной продуктивности посевов.
Внесение органических удобрений (навоз, компост и пр.) не менее результативно помогает избавиться от кислой реакции почвенной среды. Кроме того, органические вещества способствуют улучшению физических свойств грунтов (в т. ч. водо- и воздухопроницаемость) и повышают их плодородие.

РН почвы - фактор, который определяет плодородие почвы и урожайность растений. К сожалению, согласно последнему докладу Института почвоведения и растениеводства в Пулавах (Польша), доля окисленных почв на планете растет быстрыми темпами. Это связано с естественными причинами (главным образом минералогическим составом материнской породы), а также с долгосрочным пренебрежительным отношением к почве. Это очень тревожный симптом, который свидетельствует не только о постепенном окислении, но также о прогрессирующей маргинализации и деградации и без того бедных почв с изначально низким уровнем рН.
Нужно помить, что большинство азотных минеральных удобрений оказывают подкисляющее действие на почву и тем самым ухудшают условия роста и развития растений.
Из-за глобального потепления из почвы испаряется слишком много осадков, это приводит к тому, что развиваются негативные процессы при которых щелочные компоненты вымываются из плодородного почвенного шара. Процесс усиливается на светлых высокопроницаемых почвах. Это неблагоприятное явление усиливается при частом использовании азотных удобрений.
Биологическое окисление восстановленной формы аммонийного азота, выделяемого из органического вещества или внесенного с минеральными удобрениями, содержащими катион аммония, также приводит к подкислению почв. По мнению ученых, урожай, выращенный на почвах с кислотными и очень кислотными реакциями, может быть ниже на 15-25%.
В настоящее время в Европе в структуре потребления азотных удобрений преобладают следующие формы: аммоний (NH4 +) и амид (NH2-), которые, к сожалению, способствуют подкислению почв.
рH регулируется
Принимая решение о выборе азотного удобрения, стоит учитывать не только его свойства, но и почву, в которую он будет вноситься. Дело в том, что аммониевые удобрения подкисляют почву больше всего и поэтому их не следует вносить под растения, которые не требуют подкисления, особенно на светлых и кислых почвах. Сульфат аммония - это яркий пример физиологически кислотного удобрения. Его можно вносить на слабокислые почвы, но только под растения, которые хорошо переносят этот рН. К таким принадлежат картофель, овес и рожь.
Нитратные удобрения работают быстро, двигаясь с водой к корням. К сожалению, этот показатель также влияет на потери при выщелачивании, поэтому эти удобрения следует использовать только в течение вегетационного периода, когда растения могут потреблять максимальное количество азота из удобрений. Нитратные удобрения - это удобрения, которые обычно рекомендуются для поверхностного внесения, часто используются в садоводстве, но слегка обезвоживают почву (пример нитрата кальция). Они широко не используются в растениеводстве из-за высокой стоимости 1 кг N.
Нитрат аммония содержит, как следует из названия, обе формы азота: аммоний и нитрат. Присутствие обеих форм азота в удобрении делает их универсальными, то есть их можно использовать как непосредственно перед посевом ранней весной, так и при внесении на поверхность - весной для озимых и яровых культур.
Нитрат аммония слегка подкисляет, но не влияет пагубно на рН почвы.
Амидная форма азота -NH2 +, которая находится в мочевине, должна подвергаться ферментативному гидролизу в почве. Этот процесс происходит благодаря наличию в естественной среде фермента - уреазы. Затем мочевину также можно наносить путем поверхностного внесения. Ее можно использовать повсеместно на хорошо культивируемых почвах. Возможность местного применения мочевины является результатом быстрого появления N-NO3 в почве в результате нитрификации NH4+. Применяемая мочевина по сравнению с нитратом аммония работает медленнее, что обусловлено скоростью ее гидролиза в почве. Вскоре после применения мочевины рН почвы слегка увеличивается, но в результате дальнейших преобразований удобрение испаряется. Мочевина плохо подкисляет почву.
Доступность компонентов
Регулируемая реакция почвы влияет на доступность питательных веществ. Чтобы конкретный элемент был доступен растению в необходимый момент, он должен находиться в почвенном растворе, хорошо раствориться в нем, что во многом зависит от рН почвы.
На реакцию также влияют процессы превращения соединений, например азота или фосфора, в формы, доступные в почве. Трансформация нитрата аммония до нитратной формы (нитрификация) требует рН 6,5-7,2. Поэтому, если у вас в хозяйстве большинство почв кислые, можно предположить, что эффективность используемого азота недостаточна, и азот не используется должным образом растениями. При кислой реакции процесс нитрификации очень медленный, что автоматически приводит к замедлению превращения аммония в азот нитрата, доступный растениям. Кроме того, слишком высокая концентрация азота в почве в аммониевой форме может привести к газообразным потерям компонента и, что важно, станет фитотоксичной, особенно для растений на начальных стадиях развития.
Преобразование в почве
Хорошо знать, что происходит в почве после внесения удобрений и как они влияет на окружающую среду. Прежде всего, в процессе трансформации азота в качестве промежуточных продуктов образуются газообразные формы азота - NO, N2O, что, к сожалению, приводит к потере компонента. В процессе нитрификации диоксид азота N2O выделяется главным образом, в то время как в многостадийном процессе денитрификации, т.е. в результате восстановления нитратов до молекулярного азота N2 (полная денитрификация), выделяются большие количества диоксид азота (N2O) и оксида азота (NO).
Питательные элементы есть в любой почве, к тому же они поступают с удобрениями. Но для того, чтобы эти минеральные вещества попали в растение (через корневую систему), нужны определенные условия. Одним из важнейших параметров является pH – показатель кислотности почвы
Как pH влияет на усвоение основных микроэлементов
Показатель кислотности определяется концентрацией катионов водорода H+, которые и создают кислую среду. Он обозначается pH, который может принимать значения от 0 до 14:
- 0-7 – кислая среда;
- ровно 7,0 – нейтральная среда;
- 7-14 – щелочная среда.
Многочисленные исследования показали, что большинство питательных элементов (например, фосфор, калий, азот) лучше всего усваиваются в слабокислых и нейтральных почвах с показателем pHот 5,5 до 7,5. Причем значения немного отличаются в зависимости от типа грунта – минеральный (состоит в основном из органических веществ) или органогенный (состоит из останков разлагающихся растений).
Доступность фосфора P в зависимости от pH
Даже если почва богата каким-либо элементом, но pH довольно низкий (реакция кислая) или, наоборот, высокий (щелочная), растения не смогут усвоить это вещество, в результате это скажется и на урожайности.
Например, доступность фосфора P максимальная при pH около 6,5, т.е. реакция должна быть почти нейтральной. Если среда кислая, усвоение идет намного хуже. Это особенно часто наблюдается в пойменных, дерново-подзолистых и торфяных почвах Нечерноземья.
В кислой среде фосфор блокируется оксидами железа, алюминия и марганца. Если среда щелочная, он переходит в форму оксида фосфора P2O5. Это вещество также не поступает в корни, в результате чего растения страдают от дефицита.
Дефицит фосфора на рассаде томата (антациановая окраска нижних листьев). Причина появления - выращивание в торфяном горшке и использование кислого грунта
Дефицит фосфора на рассаде томата (антациановая окраска нижних листьев). Причина появления - выращивание в торфяном горшке и использование кислого грунта
Доступность калия K и других элементов в зависимости от pH
Калий усваивается лучше всего, если pH составляет 6,0. Если же почва кислая (пойменные, дерново-подзолистые грунты), элемент практически не усваивается. Если грунт карбонатный (в южных регионах), калий хорошо проникает в корни растений. Но если в почве много песка (песчаные, супесчаные грунты), культуры могут столкнуться с большим дефицитом калия.
Сера, магний и кальций хорошо поступают в корни также при pH около 6,0. Если говорить о железе , то для него нужна более кислая среда – оптимальный диапазон 4,0-6,0. Аналогичные требования предъявляет и марганец.
Бор и молибден больше всего доступны на нейтральных почвах, причем бор усваивается в узком диапазоне pH 5,0-7,0. Аналогичные условия распространяются и на такой важный микроэлемент, как цинк.
· на минеральных почвах 6,0-7,0;
· на органогенных почвах 5,0-6,0.
Если грунт сильно кислый или, наоборот, щелочной, растения в первый же сезон столкнутся с дефицитом микроэлементов, что приведет к хлорозу (пожелтению, побледнению листьев).
Необходимо следить за pH не только почвы, но и удобрений. Оптимальный показатель для раствора с подкормками – в диапазоне от 5,5 до 6,5.
Оптимальная кислотность почвы для разных овощных культур
Показатель оптимальной кислотности можно измерять по каждому отдельному элементу, но более практично сделать это для конкретной культуры. Если взять за основу распространенный тип минеральных почв, которые встречаются во многих российских регионах, можно выделить 3 группы растений, в зависимости от показателя pH:
1. Кислотоустойчивые – достаточно хорошо растут и плодоносят даже в кислых, слабокислых почвах (от 5,5 до 6,0).
2. Среднетребовательные – нормально растут в грунтах со слабокислой реакцией (от 6,0 до 6,5).
3. Требовательные – для них важно поддерживать pH, близкий к нейтральному (от 6,5 до7,0).
Читайте также:

