Глава 17 земля рудник генная инженерия материи посев и добыча ископаемых
Добавил пользователь Дмитрий К. Обновлено: 19.09.2024
Итак, это мой первый пост на хабре :)
Посвящен он будет серьезной теме, в которой, волею судеб, я неплохо разбираюсь. А именно, генной инженерии.
Помнится, тут пробегал пост в котором говорилось о геннотехнологической лаборатории “на коленке”. Оказалось, что тема интересна аудитории, поэтому я решил заняться ее развитием с просветительскими целями.
Итак, начнем. Допустим, мы хотим создать трансгенную новогоднюю елку светящуюся синим светом. Допустим, британские ученые как раз недавно открыли ген синего свечения. Вот и посмотрим на этот процесс по стадиям.
Ген свечения.
Будем вести эксперимент, как настоящие ученые. Они слышат что открыт новый ген, что же им делать дальше, если хочется создать елку?
Настоящий ученый обычно лезет в ncbi.nih.gov и по нескольким ключевым словам ищет научные публикации на эту тему. Например “синее свечение ген светится”. Типична ситуация, когда по одной из ссылок он действительно находит статью “британских ученых”, которая оказывается статьей группы китайских авторов, ни один из которых не отзывается на e-mail.
С другой стороны, в статье можно выяснить название этого гена. Пусть он будет называться ButiBl1 (названия генов принято давать буквенными обозначениями + индекс, а впереди может идти несколько первых букв названия организма из которого он выделен, их можно отбрасывать). ButiBl1, например, может быть расшифровано как Butiavka marina blue light 1 gene. Но правила здесь не строгие.
По названию гена в базе данных нуклеотидов ищут последовательность гена.Вот что примерно видит ученый на экране.
Кстати, мы можем воспользоваться инструментом BLAST и введя последовательность ДНК, получить, к каким генам она может относиться. Это тоже очень важный рутинный инструмент для генных инженеров.
Итак, мы получили последовательность гена. Очень хорошо, что дальше? Нужно ведь получить сам ген. Для этого вернемся к вопросу о том, что такое ДНК.
ДНК – это длинная молекула (очень длинная), является полимером из четырех вариантов маленьких молекул – азотистых оснований, попросту “букв”.
Геном клетки разбит на части — от одной до нескольких десятков молекул ДНК, причем обычно у каждой из них есть еще и своя копия -близнец, несущая те же гены. Каждая из молекул ДНК особым образом свернута чтобы поместиться в клетке и покрыта белковыми комплексами, образуя хромосому.
Я надеюсь, все это помнят, но если нужно освежить память, пожалуйста, в wiki :)
Итак, запомните главное:
Как же генные инженеры работают с молекулой ДНК если она одна и с ней невозможно провести никаких прямых манипуляций? Дело в том, что во всех процедурах происходит работа не с одной, а с множеством молекул ДНК, с тысячами и миллионами ее копий.
Тысячи таких одинаковых молекул плавают в водном растворе и этот раствор называется “препаратом ДНК”. Все манипуляции с молекулами проводятся типичными химическими методами.
То есть ученые работают не с одной молекулой, а с огромным их количеством в растворе с применением химических методов.
Как же нам получить ген bl1? Есть два способа. Первый – прямой химический синтез. Однако им не получить достаточно длинные молекулы из-за ошибок синтеза. Поясню, почему.
ДНК – это полимер. Его можно синтезировать наращивая по кирпичику, причем есть четыре кирпича разных цветов. На каждой стадии наращивания эффективность составляет порядка 99%. То есть из ста молекул одна получается неправильной. Теперь представьте, что нам нужно сделать молекулу длиной в 1000 букв? Тогда применяя банальную арифметику окажется, что доля верных молекул составит 0,99^1000=0,00004
Учитывая, что разделить верные и неверные молекулы почти невозможно, наша затея тут потерпит фиаско, и в реальных задачах синтез более 100-150 букв уже представляется малореалистичным.
Остается второй способ.
Потрошим бутявку
Мы выбиваем из шефа командировку на побережье Мальдивских островов, где только и водится пресловутая бутявка морская (Butiavka marina).
Ловим ее, толчем в порошок, заливаем последовательно разными химическими гадостями чтобы из всей массы тканей в растворе остались только молекулы ДНК. Конечный итог этого – препарат ДНК бутявки. Так как выделение производится из относительно большого образца, то там не одна молекула ДНК, а много – от каждой клетки по паре штук. Эта ДНК содержит не только ген bl1, но и все остальные бутявочные гены.
Этот этап называется выделением ДНК. Ее можно выделить не только в виде раствора, а переосадить и получить сухой препарат, то есть чистые молекулы ДНК.
Амплификация
Итак, командировка окончена, поэтому мы метнемся обратно в лабораторию где нас поджидает чудная процедура амплификации.
Смотрите, в препарате ДНК бутявки куча всяких разных генов, а не только нужный нам. Мы же можем работать только с однородными препаратами, нам нужно довести содержание молекул ДНК гена bl1 хотя бы процентов до 90.
И тут мы применяем поистине чудесный прием, являющийся краеугольным камнем современной биоинженерии, называемым полимеразной цепной реакцией или ПЦР (polymerase chain reaction, PCR). За открытие этого метода присудили нобелевскую премию, хотя до сих пор ходят споры о приоритете, поэтому фамилий не называю, кому интересно – почитайте.
Принцип полимеразной цепной реакции довольно сложен, объяснение дам очень грубое и только для того чтобы было хоть какое-то представление, за подробным – добро пожаловать по ссылке выше.
Итак, нам нужно размножить (амплифицировать) молекулы ДНК определенного гена. Для этого мы открываем страничку с последовательностью нашего гена и находим его концы. Берем 20-30 букв с конца и столько же с начала и синтезируем короткие молекулы ДНК химическим синтезом (обычно это делают специальные фирмы)
То есть мы имеем две новые пробирки. В одной из них плавает много коротких 30-буквенных последовательности ДНК, гомологичных началу гена, а во второй – то же самое, но для конца гена. Эти новые молекулы называются праймерами.
Теперь мы запускаем реакцию ПЦР, причем умножаться у нас будет участок между двумя праймерами (между начальным и концевым). Реакция ПЦР – это биохимическая циклическая реакция, требующая смены температуры. В свое время ее делали на водяных банях, теперь же используют специальные приборы – амплификаторы (они же ПЦР-машины). Их строение очень простое, там стоят элементы Пельтье, есть место для пробирок и ко всему этому присобачены электронные мозги и управляющая панель.

То есть вернулись мы в лабораторию с ДНК бутявки. Заказали два праймера — к началу и к концу гена. Потом взяли чистую пробирку, капнули туда чуть-чуть ДНК, чуть чуть каждого праймера, полимеразу (фермент, который строит ДНК), нуклеотидов для строительства ДНК, и немного солей для правильной работы фермента, поставили в амплификатор на пару часов. В амплификаторе смесь то нагревалась, то остужалась и на выходе мы получили пробирку в которой плавает очень много копий ДНК нужного нам гена.
Однако пробирка прозрачная, как увидеть что там есть какая-то ДНК, да еще нужная?

Детекция ДНК.
Существует много способов увидеть ДНК, я же опишу классический, называемый гель-электрофорезом.
В лаборатории имеется небольшая ванночка с электродами, называямая форезной камерой.
В эту ванночку заливается расплав электрофорезного геля, который по сути очень похож на мармелад. Но вместо сахара там находятся добавки солей и флуоресцентный краситель – бромистый этидий. Это вещество интересно тем, что встраивается в молекулу ДНК и в этом случае начинает светиться в ультрафиолете.
После того как гель застынет мы наносим в лунку на нем препарат ДНК где предположительно уже должно быть много копий гена bl1 и включаем электрический ток. В другую лунку наносим “маркер веса” – специальный препарат молекул ДНК, состоящий в равных долях из молекул длины 100, 200, 300 и т.д. нуклеотидов.
Молекулы ДНК полярны и движутся в электрическом поле, при этом чем они длиннее, тем сильнее цепляются за структуру геля и тем медленнее в нем движутся. Через некоторое время мы выключаем электричество и несем гель под ультрафиолетовую лампу.
На той дорожке где мы нанесли маркер веса мы видим кучу полосок. Самая дальняя от места нанесения пробы соответствует самой короткой ДНК, самая ближняя – самой длинной.
В соседних лунках ДНК бежит с одинаковой скоростью, поэтому мы сравниваем их расположение на соседних дорожках и можем определить, относительный размер.
Итак, мы обнаружили на дорожке где нанесли пробу одну светящуюся полоску и размер ее судя по соседнему маркеру веса является таким, каким мы ожидали.

Мы аккуратнентко вырезаем лезвием из геля этот светящийся кусочек – он содержит много ДНК гена bl1 запутавшейся в геле и с помощью специальных манипуляций высвобождаем из него молекулы.
Можно себя поздравить, мы выделили ген bl1 из бутявки!
Я рассказал только о первой стадии этого сложного и длинного процесса. Продолжать ли дальше? Решать вам :)
Закулисные хозяева мира давно ведут войну против Руси. Активное внедрение в ежедневное питание людей ГМО продуктов является одним из изощрённых методов геноцида населения, а не спасением от голода, как нас пытаются убедить.
Автор – Юрий Иванов
Месяц назад Академию наук потряс очередной скандал: комиссия по борьбе с лженаукой и фальсификацией научных исследований РАН в лице своего председателя академика Александрова сначала выступила против гомеопатии, а затем пообещала издать меморандум о признании лженаучными доводов об опасности ГМО.
С тех пор прошел почти месяц, однако, вопрос подвис в связи с неудачными выборами президента РАН. Между тем, опасность внедрения ГМО, в нарушение Указа Президента и Стратегии национальной безопасности РФ, сохраняется. Лоббисты ГМО, в частности, американской компании Monsanto, продолжают свою подрывную работу – свидетельством чего являются то и дело выходящие в эфир сюжеты в поддержку ГМО.
Мы публикуем статью еще одного известного биолога, сотрудника Института цитологии и генетики СО РАН (Новосибирск) Юрия Николаевича Иванова.
«В феврале 2017 г. Российская академия наук встала на защиту гено-модифицированных организмов (ГМО). Внешне такие продукты питания вроде бы ничем не отличаются от нормальных, и именно в этом их особая опасность. Хлеб выглядит как хлеб, мясо – как мясо, овощи и фрукты выглядят даже лучше, чем нормальные. И на вкус особых отличий нет! Но зато есть весьма существенные отличия НА ГЕНЕТИЧЕСКОМ УРОВНЕ.
Этот пассаж, взятый из интернета, очень характерен. Относительно вредности продуктов ГМО ведутся бесконечные голословные споры. Апологеты ГМО утверждают их безвредность, противники – страшную их опасность, но мы не видим никаких доказательств или доводов в пользу своих убеждений ни с той, ни с другой стороны.
Совершенно очевидно, что внедрители ГМО и только они располагают нужными для решения вопроса фактами, но не обнародуют их. Почему? Ведь тогда бы дело прояснилось и пустопорожние разговоры в виде бездоказательных споров закончились. Значит, сторонники ГМО не заинтересованы в этом, а посему дело здесь нечисто с их стороны. Противники ГМО фактами не располагают, чем и вынуждаются их голословие, слишком сильные утверждения и передержки.
Я принадлежу к числу противников ГМО, т.к. располагаю убедительными априорными доводами против них. Во всяком случае, при их обнародовании я никогда не встречал возражений и убедительных резонов против моей аргументации.
Никто никогда не снизошёл до критического рассмотрения моих взглядов и не отважился вступить со мной в дискуссию относительно их правильности. Они всегда отвергались с порога без всякого обсуждения. Поэтому стоит показать, как, на каких основаниях эти взгляды получили развитие. Вместе с тем это и будут доводы против создания и использования ГМО.
Опыты В. Иоганнсена (1903) показали неэффективность отбора при отсутствии мутаций. Вместе с тем обнаружилось, что мутации, представлявшиеся материалом для положительного отбора (селектогенеза), не могут быть таковыми, т.к. представляют собой не усложнение генов, а их деградацию.
Появилась концепция У. Бэтсона и Т. Моргана, что мутации – это, по сути дела, утраты генов, а на утратах не может быть основана теория прогрессивной эволюции. Из этого вытекало, что мутациями нельзя вызвать трансмутацию – изменение вида за пределы его организации.
Тем самым зародившаяся генетика опровергла представление дарвинизма, что трансмутация (превращение видов) происходит в результате изменения наследственности и отбора приспособительных наследственных типов, а это означало возврат к концепции сотворения, бытовавшей в естественных науках до распространения теории Дарвина.
Для реанимации умирающей доктрины дарвинисты не нашли ничего лучшего, как извратить истинную генетику и создать формальную. Сущность последней в том, что любой признак якобы вызывается геном, что существует взаимно однозначное соответствие между геном и признаком, и что есть особое вещество наследственности (ДНК), к эволюции которого сводится весь биогенез (возникновение жизни и образование видов).
В действительности же в развитии любого признака участвуют все гены + эпигены (внегеномные и средовые факторы наследственности). Веществом наследственности, кроме ДНК, являются любые облигатно передаваемые от поколения к поколению наследственные структуры.
Подавляющая доля генов не оказывает на фенотип никакого действия, т.к. мутации их летальны: имеется ген, но нет признака. Все количественные признаки детерминируются средой, а не генами: имеется признак, но нет гена. Вопреки эмпирическим данным, формальные генетики постулировали, что крайне редко, но всё же происходят конструктивные мутации, усложняющие организацию, а приспособительные из них подхватываются отбором.
Так протащили бредовую идею, что органический мир – продукт невозможных конструктивных мутаций и противоестественного, движущего отбора наследственных типов, тогда как никакого движущего отбора нет, а есть только стабилизирующий отбор, являющийся стражем постоянства вида.
Последствием формалистического извращения генетики была переоценка роли селекции, мутагенеза и химических удобрений в сельском хозяйстве и замена ими истинной, комплексной агробиологии, сочетающей почвоведение с растениеводством и животноводством.
Для интенсификации селекции прибегли к индукции мутаций радиацией и химией, однако существенного ускорения селекции не было да и быть не могло в силу деструктивности мутагенеза вообще и индуцированного в особенности. Можно было бы показать замедление и ухудшение селекции мутагенезом, но формальные генетики не были в том заинтересованы.
Что такое внедряемые ГМО, видимо, знают только их создатели. Даже если ГМО не уступают по урожайности обычным сортам (а скорее всего, они им уступают), то зачем их с таким упорством внедрять повсеместно? По отношению к другим, даже самым лучшим сортам, такая практика никогда не применялась: все они были районированы.
Итак, ГМО, или трансгенные организмы, получают трансгенацией – переносом генов из генома одного вида в геном другого. Фактически это – геномные мутации, деструктивные подобно всем мутациям, ибо представляют случайные изменения совершенной системы организма. Создаваемые ими ГМО, равно как и другие мутанты, не могут существовать в природе без помощи человека.
Если вред трансгенации для самого ГМО очевиден, то каков он для потребителей пищи из ГМО? Это обычно – тайна за семью печатями. Положение ненормальное, т.к. решить проблему вреда следовало ещё до внедрения ГМО.
Сделано же совсем наоборот: после того, как ГМО уже внедрены беспрецедентно широко почти во всём мире , о вреде их ходят только неясные слухи. Видимо, ГМО, вообще говоря, токсичны для человека, но как и на что в организме они влияют, общественности неизвестно.
Похоже, что ГМО – разновидность химического оружия. Капитал в лице закулисных хозяев мира давно озабочен ростом человечества и стремится контролировать его численность путём геноцида по принципу: Контроль продовольствия – контроль населения (Г. Киссинджер). Этим объясняется активное вмешательство крупнейших мировых ТНК в агробизнес, и становится понятной организованная зависимость от них ежедневного питания большинства людей на планете, которым всучаются продукты ГМО при утаивании последствий их употребления.
Интрига, закрученная вокруг ГМО, отлично усматривается из посвящённой им статьи в газете Аргументы недели № 14, 2015, с. 3. Директор Общенациональной ассоциации генетической безопасности (ОАГБ) Елена Шаройкина отвечает на вопросы корреспондентов. Имеются ли научные данные о вредности потребления ГМО?
Не достаточно ли обнародовать эти опыты со всеми подробностями метода, чтобы узнать, насколько корректно он проведён, и дать правильную оценку вредности ГМО? Ведь стерилизация животных здесь налицо. Но не тут то было!
Дальше читаем: «Но для того, чтобы делать однозначные выводы, этого мало. Существуют международные протоколы и правила, по которым нужно провести исследования. Но, чтобы провести опыт по всем мировым стандартам, по одной только линии ГМО нужно 30 млн. евро. [Показная строгость, не стоящая выеденного яйца!
Какие неизвестные мировые стандарты могут быть в весьма заурядных опытах по исследованию вредности продуктов? Зачем эта условность? Не достаточно ли провести опыт при соблюдении всем известных правил научного метода?
Устанавливать без необходимости особые правила – это какая-то хитрость и произвол. – Ю.И.] Так как на западных учёных, которые занимаются исследованиями ГМО, оказывается колоссальное давление, мы поняли, что Россия – это единственное место, где ещё можно провести подобный независимый и открытый международный эксперимент. [Если упорно предписывается какой-то стандартный метод, то он может предопределить результат. Тогда о независимости опыта не стоит и говорить. – Ю.И.]
И в прошлом году объявили о его старте. Первая задача была собрать научную группу. Сейчас уже известно, что в ней будут работать учёные из США, Франции, Германии и Великобритании. [Даже в простейшем деле никак нельзя обойтись без заморских авторитетов. Ведь там цитадель науки!
Вспомнилось, как в советское время мелиораторы, ворочающие огромными средствами, создавали явно несостоятельные проекты переброски рек, а масса институтов и других учреждений была занята критикой и доработкой этих высосанных из пальца маниловских фантазий. Это требовало огромных расходов, которые учёные съедали не поперхнувшись.
Рука руку моет. Одни учёные выдают ересь – другие её опровергают; и все обеспечивают друг друга работой. Создание ГМО, высокопарно именуемое генной инженерией, – самая приоритетная и наиболее финансируемая отрасль формальной генетики. Сами учёные заинтересованы в затемнении вопроса о вредности ГМО, т.к. сами заняты их созданием и изучением якобы неясной вредности употребления их продуктов.
Независимо от токсичности ГМО, они вредны уже по одному тому, что выдуманы для неправедной выгоды их создателей.
Для эффективности депопуляционного действия пищевых продуктов из ГМО, т.е. для того, чтобы они были средством геноцида, необходимо, во избежание скандальной огласки, сделать их влияние незаметным и затрагивающим преимущественно или избирательно воспроизводительную функцию организма.
Предварительные данные, которыми мы в настоящее время располагаем, подтверждают, что продовольствие из ГМО обладает именно этими свойствами. (Впрочем, надёжность этих данных тоже кажется сомнительной, ибо обманы науки стали обыкновением. Хочешь знать истину – изволь исследовать вопрос сам.)
Вредное влияние продуктов ГМО на здоровье населения представляется очень неявным, зато проведённые исследования, если им можно верить, определённо указывают на эффект стерилизации. Именно так и должно действовать тайное оружие геноцида .
Следовательно, на предмет вредности изучать следует не любые ГМО, а только те, что используются в широко распространённых, основных пищевых продуктах (кукуруза, соя, рис, пшеница и т.п.), импортируемых ТНК в зависимые, неоколониальные страны.
При углублённом анализе вреда ГМО следует обратить особое внимание на выявление их стерилизующих биохимических факторов, даже если другого вредного действия эти ГМО не оказывают.
В наши трудные времена Апокалипсиса люди должны с готовностью помогать друг другу, делиться необходимым и облегчать бремя других, а не пытаться отнять у них последнее, чтобы самим вывернуться из трудностей за их счёт.
Капиталистический Запад, разложившийся, антихристианский, потребление которого на душу населения на целый порядок превышает таковое в других странах, поступает наоборот и как мародёр грабит и проводит геноцид остального, несравненно менее обеспеченного мира.

Проблема голода сопровождает человечество на всем протяжении его развития. В связи с развитием мировой торговли и транспорта эта проблема несколько ослабла, но не исчезла. Причем, современная мировая продовольственная ситуация трагична из-за своей противоречивости. Презентацию подготовил ученик 11 класса Сальников Руслан.

Генная инженерия – решение проблемы голода или гибель человечества?
проблемА голода
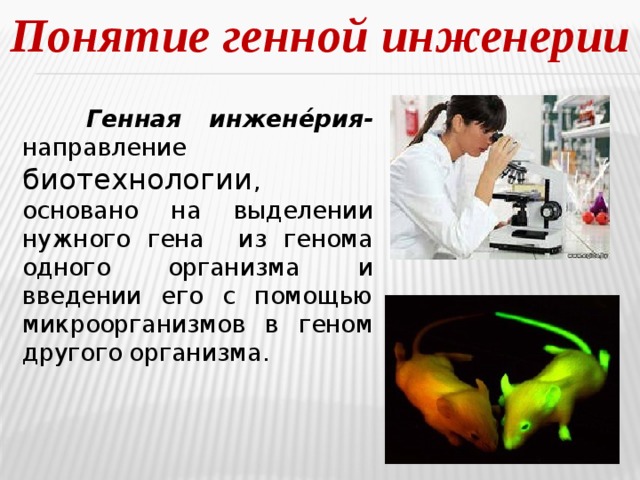
Понятие генной инженерии
Генная инжене́рия- направление биотехнологии , основано на выделении нужного гена из генома одного организма и введении его с помощью микроорганизмов в геном другого организма.

Генетическая инженерия служит для получения желаемых качеств изменяемого или генетически модифицированного организма. В отличие от традиционной селекции, в ходе которой генотип подвергается изменениям лишь косвенно, генная инженерия позволяет непосредственно вмешиваться в генетический аппарат.

ГЕННАЯ ИНЖЕНЕРИЯ
В СЕЛЬСКОМ ХОЗЯЙСТВЕ
В сельском хозяйстве с помощью рекомбинантной ДНК могут быть получены сорта культурных растений, устойчивые к засухе, холоду, болезням, насекомым-вредителям и гербицидам.

ГЕННАЯ ИНЖЕНЕРИЯ
В СЕЛЬСКОМ ХОЗЯЙСТВЕ
ГЕННАЯ ИНЖЕНЕРИЯ В СЕЛЬСКОМ ХОЗЯЙСТВЕ
С помощью генной инженерии
ГЕННАЯ ИНЖЕНЕРИЯ В СЕЛЬСКОМ ХОЗЯЙСТВЕ

С развитием генетических технологий человечество впервые в истории получает возможность с помощью медицинской генетики уменьшить груз патологической наследственности, накопленной в процессе эволюции, избавиться от многих наследственных заболеваний, в частности, путем замены патологического гена нормальным.

В настоящее время генная инженерия несовершенна и не в состоянии управлять процессом встраивания нового гена с тем, чтобы предсказать последствия. В результате искусственного добавления чужеродного гена непредвиденно могут образоваться опасные вещества, вредные для здоровья
Генетически модифицированные продукты, призванные решить проблему голода во многих развивающихся странах, пока появились только на прилавках развитых стран.
Генные продукты скорее удовлетворяют чисто коммерческие интересы, т.к. никаких серьезных результатов в борьбе с голодом с помощью модифицированных продуктов достигнуто не было
Утверждение, что генная инженерия может внести существенный вклад в разрешение проблемы голода в мире, является научно необоснованным мифом.

Генная инженерия- огромный прорыв в биологии и генетике. Достижения генной инженерии с одной стороны, могут избавить человечество от опасных болезней, угрозы голода и хронического недоедания, а, с другой стороны, генная инженерия порождает целый ряд проблем, в том числе и морально-этических.
И все же, какие перспективы ожидают нас с развитием генной инженерии, и что она повлечет за собой: спасение или гибель?

Обзор
Авторы
Редакторы
Полвека назад человек вплотную приблизился к возможности примерить на себя роль творца, творца самого настоящего, способного целенаправленно наделять создаваемые им организмы нужными чертами. Научившись напрямую манипулировать генами, из селекционера он превратился в инженера. Что же подвело его к этой черте и как изменился мир после? Предлагаем заглянуть в историю генной инженерии: вспомнить важнейшие открытия, сформировавшие ее теоретическую основу и методический арсенал, поразмышлять над этическими вопросами и оценить вес генно-инженерных разработок в денежном эквиваленте.

12 биологических методов в картинках
И вот мы решили рассказать о лабораторных методах более системно, собрать воедино в одной рубрике самые главные, самые современные биологические методики. Чтоб было интереснее и нагляднее, мы густо проиллюстрировали статьи и даже кое-где добавили анимации. Мы хотим, чтобы статьи новой рубрики были интересны и понятны даже случайному прохожему. И с другой стороны — чтобы они были так подробны, что даже профессионал мог бы обнаружить в них что-то новое. Мы собрали методики в 12 больших групп и собираемся сделать на их основе биометодический календарь. Ждите обновлений!
Генетическая, или генная, инженерия — это не отдельная наука, а огромная и постоянно развивающаяся научно-технологическая платформа, вобравшая в себя самое ценное из генетики, биохимии и химической инженерии, молекулярной и клеточной биологии, микробиологии и вирусологии. Благодаря этой платформе у землян появилась возможность обсуждать такие понятия, как генетически модифицированный организм (ГМО) и генная терапия. Генная инженерия в широком смысле — это третье поколение инструментов для изменения наследственной информации. В отличие от первых двух — селекции, применяемой тысячелетиями, и индуцированного мутагенеза, создавшего с начала 20 века более двух тысяч разновидностей растений [1], — новый инструмент работает прецизионно и быстро. А потому порождает непредставимые ранее научные соблазны и коллективные фобии. Кто-то видит в генной инженерии спасение человечества, кто-то — козни дьявола, но все сходятся в одном: она изменила мир. Инструментарий и технологии генной инженерии мы разберем во второй части статьи, а пока пройдем путем, по которому шли ученые к созданию этой отрасли и ее современным достижениям (рис. 1).

История генной инженерии
Точка невозврата

Рисунок 2. Пол Берг со своей невестой Милли. Кстати, будущий нобелевский лауреат родился в семье, перебравшейся в США из маленькой деревушки под Минском.

Рисунок 3. Герберт Бойер и Стэнли Коэн — создатели первого трансгенного организма и обладатели первого генно-инженерного патента.
Что было до?
Существенно продвинуться в понимании природы наследственности помогли мушки дрозофилы, а затем и бактерии. В 1910-м профессор Колумбийского университета Томас Морган (рис. 4) показал, что гены расположены линейно на хромосомах и образуют группы сцепления. Этим он заслужил Нобелевскую премию [10]. Морган и его сотрудники — Бриджес, Стёртевант и Мёллер — составили первые карты хромосом, экспериментально подтвердили и развили хромосомную теорию наследственности Саттона и Бовери [11].


Рисунок 5. Они показали, что наследственная информация записана в ДНК: Колин Маклауд, Освальд Эвери, Маклин Маккарти.
В 1940-х и начале 1950-х Эдвард Тейтем, Нортон Зиндер, Джошуа и Эстер Ледерберги (рис. 6) описали основные процессы переноса генетического материала между бактериальными клетками с помощью плазмид и фагов (в частности, конъюгацию и трансдукцию). Эти мобильные генетические элементы [12] позже стали неотъемлемыми компонентами арсенала генного инженера.

Рисунок 6. Джошуа и Эстер Ледерберги. Несмотря на сексистскую атмосферу тех лет, Эстер Мириам Ледерберг заслужила искреннее восхищение коллег: в числе ее заслуг — открытие и изучение фага λ, F-плазмиды и трансдукции, введение знакомого теперь каждому микробиологу и многим генным инженерам метода реплик, организация в Стэнфорде специализированного плазмидного центра.

В том же году сотрудник Кембриджа Александер Робертус Тодд, изучавший структуру нуклеотидов, впервые химически синтезировал один из них — аденозинтрифосфат, или АТФ (сахар рибоза + азотистое основание аденин + фосфатные группы).
В 1953 году произошло эпохальное событие — установление молекулярной структуры ДНК. Верную модель обычной, B-формы, ДНК построили сотрудники Кембриджского университета Джеймс Уотсон и Фрэнсис Крик, а базисом для ее создания послужили работы рентгеноструктурщиков из Королевского колледжа Лондона — Мориса Уилкинса и Розалинд Франклин с ее аспирантом, Реймондом Гослингом (рис. 8). Дифракционное изображение кристаллизованной ДНК указывало на ее двуспиральный характер, и Франклин даже удалось рассчитать некоторые параметры этой спирали. Уотсон и Крик, заполучив материалы Франклин и держа в уме пропорции азотистых оснований, вычисленные в 1950-м Эрвином Чаргаффом, предположили, как закодирована и как передается наследственная информация. Полуконсервативный механизм репликации ДНК в знаменитом изотопном эксперименте доказали Метью Мезельсон и Франклин Сталь в 1958 году.

Рисунок 8. Им покорилась двойная спираль. Вверху — Морис Уилкинс и Розалинд Франклин с вошедшим в историю Фото 51 — самой удачной рентгенограммой ДНК. Внизу — Джеймс Уотсон и Фрэнсис Крик со своей моделью ДНК. Им всё-таки удалось опередить другого талантливого ученого — Лайнуса Полинга, известного своей любовью к аскорбинке и расшифровке структуры молекул.
В 1955-м Северо Очоа де Альборнос с аспиранткой, Марианной Грюнберг-Манаго (уроженкой Петрограда и будущим президентом Международного биохимического союза), выделили бактериальную полинуклеотидфосфорилазу и с ее помощью синтезировали в пробирке РНК. Позже оказалось, что синтез для этого фермента скорее хобби, основная же его работа — деградация РНК. В 1956-м Артур Корнберг (рис. 9) со своей женой Сильви выделил один из ферментов синтеза и коррекции ДНК — ДНК-полимеразу I — и получил с его помощью цепочку ДНК [15]. Как и в случае Очоа, фермент Корнберга не был главным строителем полинуклеотидных цепей, однако стал одним из основных инструментов генной инженерии.

Примерно тогда же, наконец, всплыли вопросы регуляции работы генов — те, что чуть раньше научное сообщество не хотело слышать из уст Барбары Макклинток. Жакоб вместе с Жаком Моно описали лактозный оперон и показали, что синтез ферментов контролируется внешними условиями посредством регуляторных белков, которые подавляют или активируют транскрипцию.

Рестриктазы стали жизненно важным инструментом для генной инженерии. Они нашли применение не только в технологии рекомбинантных ДНК, но и в геномной дактилоскопии и техниках секвенирования (прочтения) нуклеотидных последовательностей [16], [19]. Первые рекомбинантные ДНК получили с помощью эндонуклеазы EcoRI, правда, группы Берга и Коэна использовали ее немного по-разному. В считаные годы спрос на эти ферменты так возрос, что академические энтузиасты, выделявшие уже известные и новые рестриктазы, перестали справляться со снабжением всех желающих, и тогда за дело взялись коммерсанты: в 1975-м — New England Biolabs, а позже и другие компании. К октябрю 2017 года было выделено уже 4 155 эндонуклеаз II типа. Найти всю информацию о них и системах рестрикции-модификации в целом можно в базе данных REBASE.
Как резать и сшивать ДНК, стало более или менее ясно, но оставалась проблема универсального (не узкоспециализированного типа конъюгации или трансдукции) внесения нуклеиновых кислот в клетки. У кишечной палочки давно было замечено нежелание поглощать ДНК из среды, но в 1970-м эту проблему разрешили Мортон Мандель и Акико Хига. Обработка клеток E. coli хлоридом кальция сделала их компетентными, то есть способными принимать генетический материал извне. Немного усовершенствованный, этот метод и сейчас широко используют для трансформации бактерий. В те же 70-е изучили трансформирующие свойства Ti-плазмид в отношении растительных клеток и применили микроинъекции, а в 80-е сконструировали электропоратор и генную пушку [20]. С появлением последней стало возможным интегрировать чужеродные гены в хлоропласты.
В 1972 году сотрудники Амстердамского университета Кес Ай и Пит Борст опробовали визуализацию ДНК с помощью электрофореза в агарозном геле с буфером, содержащим бромистый этидий. Это позволило видеть не меченные изотопами молекулы ДНК, просто положив гель на УФ-трансиллюминатор.
Что было после?


На исходе 70-х разработали неизотопные методы мечения нуклеиновых кислот.
1982 год запомнился открытием рибозимов: Томас Чех и Сидни Альтман показали, что молекулы РНК могут обладать каталитической активностью. Помимо существенной поддержки гипотезы мира РНК, это открытие в 2000-х вылилось в создание инженерных рибозимов для генетической терапии, способных разрезать нужные РНК. Самым логичным выглядело их использование для блокирования ВИЧ и иных РНК-содержащих вирусов [23].
В том же году появилось первое трансгенное растение: Майкл Беван, Ричард Флавелл и Мэри-Дэлл Чилтон модифицировали клетки табака с помощью Ti-плазмиды, несущей химерный ген антибиотикорезистентности.
В 1989-м удалось получить первую мышь с нокаутированными генами, крыс осилили гораздо позже — в 2003-м [25].
В 1990 году калифорнийские биологи пытались сделать цветки трансгенной петунии более яркими, а получили еще более бледные. Так неожиданно себя проявила РНК-интерференция, которую позже, в 1998 году, подробно описали у червя Caenorhabditis elegans Крейг Мелло и Эндрю Файер (рис. 13). Введением небольшой двухцепочечной РНК они вызвали сайленсинг (подавление экспрессии) генов, содержащих комплементарные этой РНК участки. Благодаря малым РНК, регулирующим экспрессию генов на посттранскрипционном уровне, удались на славу гипоаллергенные томаты, табак без никотина, кофе без кофеина и многое другое. Двухцепочечные молекулы оказались более эффективными, чем одноцепочечные (простые антисмысловые РНК), механизм действия которых не относят к интерференции.

В апреле 2003 года завершились основные работы по секвенированию генома человека, которые стоили правительствам США и еще нескольких стран $3 млрд [26]. Прочтение геномов нескольких анонимных доноров вскрыло много интересных деталей. Оказалось, что обычных — кодирующих белок — генов у нас гораздо меньше, чем полагали ранее, — чуть более 20 тыс. [27]. Они составляют всего 1,5% совокупной человеческой ДНК, а остальное относят к ДНК некодирующей (хотя некоторые ее области кодируют малые регуляторные молекулы и мобильные генетические элементы) [28]. Некодирующая ДНК участвует в поддержании структуры хромосом, клеточном делении и регуляции экспрессии генов. Но самое интересное, что до 90% однонуклеотидных полиморфизмов (SNP), ассоциированных с разными заболеваниями, сосредоточены в некодирующих, преимущественно регуляторных, участках ДНК. Поэтому логическим продолжением прочтения генома человека стали проекты, посвященные его вариабельности: Human Genome Diversity, HapMap, 1000 Genomes, ENCODE.
В 2007-м фармгигант Merck успешно завершил клинические исследования рекомбинантной вакцины Gardasil, защищающей от человеческих папилломавирусов высокого онкогенного риска, способных инактивировать гены опухолевых супрессоров и провоцировать развитие карцином шейки матки и некоторых других частей тела. Антигены вирусоподобных частиц, составляющих вакцину, производятся трансгенными дрожжами. Вскоре GlaxoSmithKline выпустила аналогичную, но более эффективную вакцину Cervarix.

В 2014 году с помощью ZFN модифицировали Т-лимфоциты инфицированных ВИЧ, чем снизили вирусную нагрузку. В 2015 безнадежной пациентке с лейкемией ввели донорские Т-лимфоциты, модифицированные с помощью TALEN, чем выиграли время для трансплантации костного мозга [37]. Тогда же в Китае покусились на редактирование генома нежизнеспособных эмбрионов CRISPR-системой [38]. В 2016 опухолевые клетки пациента с агрессивной карциномой легкого атаковали его собственными Т-лимфоцитами, подправленными CRISPR-Cas9 [39], [40]. Сейчас компания Sangamo Therapeutics (США) проводит набор участников I фазы клинических исследований ZNF-терапии in vivo: речь идет об исправлении дефектных генов, вызывающих мукополисахаридозы I/II и гемофилии А/В. Другой пионер отрасли, Editas Medicine, планирует начать клинические исследования CRISPR-терапии ex vivo и in vivo [39].
В том же 2014-м Денис Малышев с коллегами из Исследовательского института Скриппс и New England Biolabs сконструировал кишечную палочку с расширенным генетическим алфавитом, которая стабильно поддерживает плазмиду с неприродной парой нуклеотидов [43]. В 2017 году эту полусинтетическую бактерию тюнинговали [44].
Ну а мы в следующей части статьи попробуем разобраться, как создают молекулярные химеры и как используют нуклеиновые кислоты для решения исследовательских и медицинских задач.
Рекомбинантные ДНК и биоэтика: наступить на горло собственной песне
Генная инженерия и рынок: найти ключ к монетизации научных достижений
Любимые многими нашими не-учеными мечты о всегда голодных молодых ученых вряд ли нашли бы понимание у пионеров генной инженерии. Они были заняты не поиском пропитания, а интересной работой — в нормальных условиях и под руководством талантливых ученых. В итоге многие получили Нобелевские премии и миллионные состояния. А благодаря патентно-лицензионной системе миллионы они принесли и своим институтам, чтобы те лучше финансировали новые исследования.
В 1976 году Герберт Бойер и венчурный капиталист Роберт Свонсон, скинувшись по $500, основали биотехнологическую компанию Genentech. Их генно-инженерный инструментарий и сотрудничество с институтскими коллективами позволили экспрессировать в бактериях разные человеческие гены и получить таким образом терапевтически ценные белки: соматостатин, соматотропин, инсулин, ДНКазу I, интерферон-γ, моноклональные антитела. Компания оказалась на редкость доходной, и Калифорнийский и Стэнфордский университеты вели с ней нудные патентные споры, требуя миллионных компенсаций. В 2009 году фармгигант Hoffmann-La Roche приобрел Genentech за $46,8 млрд, и сейчас в компании работает почти 15 000 человек. Но самое важное для становления биотехнологической промышленности произошло в далеком 1980-м: 15 октября стоимость акции Genentech на Нью-Йоркской фондовой бирже взлетела в два раза — и за день несколькими миллионерами стало больше [51]. Более 7 млн акций подняли стоимость компании до $500 млн, а лицо Бойера украсило обложку журнала Time. И понеслось.
Американская академическая наука вступила в фазу коммерциализации. Сотрудники институтов активно налаживали связи с мировым капиталом, в том числе и организуя собственные биотехнологические компании. С 1980 по 1985 в США появилось более 400 подобных фирм. Этому благоприятствовали налоговые льготы и крупные навары с биржевых операций. На запах денег слетелись и представители Большой фармы. В Европе инвестиционный климат был похуже, но и там процесс быстро набрал обороты. Япония объявила биотехнологию национальным приоритетом, и, подучившись у американских биотехнологов, пополнила ряды лидеров индустрии. Другие страны тоже осознали стратегическую важность отрасли и по мере возможности старались уделять ей внимание [51]. Мы не будем пытаться объять необъятное, разбирая все генетические коммерческие проекты, а устроим маленькую историческую экскурсию по избранным, крупным перекресткам академической науки и генно-инженерной индустрии.
Одним из основателей Myriad Genetics был пионер секвенирования Уолтер Гилберт. Он же известен как соучредитель биотехнологического гиганта Biogen и компании Paratek Pharmaceuticals, а еще как один из первых апологетов секвенирования человеческого генома. Еще до старта известного международного проекта он анонсировал открытие Genome Corporation, в составе которой планировал первым прочитать геном человека и затем продавать расшифрованную информацию.
Удачный пример синтеза академической науки и фарминдустрии показали Артур Корнберг [15], Пол Берг и Чарльз Янофски, в 1980-м основав DNAX — институт молекулярной и клеточной биологии, который почти сразу приобрела компания Schering-Plough Pharmaceuticals (сейчас — часть Merck & Co.). DNAX предоставлял отличные кадры для разработки препаратов, и эти кадры не были ограничены в правах публикации своих результатов [53].
Крейг Мелло, одним из первых описавший РНК-войны [54], помимо основания успешной биофармацевтической компании RXi Pharmaceuticals занялся укреплением здоровья пчел с помощью РНК-интерференции. Специально созданная для этого израильско-американская фирма Beeologics в 2011 году была поглощена Monsanto.

Читайте также:

