Фосфомицин в моче посев мочи
Добавил пользователь Владимир З. Обновлено: 18.09.2024
Введение. Острый цистит является самым частым проявлением неосложненной инфекции мочевыводящих путей. Выбор антибактериального препарата для лечения данного заболевания определяется не только спектром антимикробной активности в отношении возбудителей, но и фармакокинетикой препарата, которая позволила бы обеспечить его высокие концентрации в моче при одно- или двукратном приеме, а также высоким профилем безопасности и приемлемой стоимостью. Одним из препаратов, чья эффективность в лечении больных ИНМП доказана, является фосфомицин, который в течение длительного времени находится на фармацевтическом рынке и широко применяется в урологической практике. С учетом устойчивой тенденции к снижению чувствительности уропатогенов к антибактериальным препаратам также существует риск снижения эффективности фосфомицина. Это обусловливает небходимость проведения мониторинга устойчивости основных возбудителей к нему. В данной статье представлен наш опыт применения фосфомицина в лечении женщин с острым неосложненным циститом.
Цель исследования: оценить эффективность применения фосфомицина трометамола в лечении женщин с острым неосложненным циститом.
Материалы и методы. С сентября по ноябрь 2018 г. нами проведено обследование и лечение 57 женщин с острым неосложненным циститом в возрасте от 19 до 40 лет. Всем пациенткам был назначен Фосфомицин Эспарма (фосфомицина трометамол) однократно по 1 пакетику после мочеиспускания. Обследования проводили на 1-е, 3-и и 7-е сутки. Оценивали частоту мочеиспускания, императивные позывы, ноктурию, интенсивность болевых ощущений. Также выполняли общий анализ мочи и бактериологическое исследование проб мочи с посевом урокультуры на твердые питательные среды, с установлением вида возбудителей, чувствительности к антибиотикам и степени бактериурии.
Результаты. При обращении все пациентки высказывали жалобы на боли в проекции мочевого пузыря, частое мочеиспускание малыми порциями, чувство дискомфорта в уретре. У всех женщин была выявлена лейкоцитурия и бактериурия. К 3-м суткам после приема фосфомицина дизурические симптомы сохранялись у 22,8% пациенток, боль – у 17,5%. У 42% женщин сохранялась незначительная лейкоцитурия. Бактериологический анализ мочи роста возбудителей не выявил. К 7-м суткам после начала терапии во всех наблюдениях отмечена нормализация всех клинико-лабораторных показателей.
Заключение. Учитывая широкий спектр действия, низкую резистентность уропатогенных штаммов, высокий уровень безопасности и комплаентности, по результатам проведенного нами исследования мы рекомендуем применение фосфомицина в качестве препарата первого выбора в терапии неосложненной инфекции нижних мочевыводящих путей.
Литература
1. The urology. Russian clinical guidelines / pod red. Yu.G. Alyaev, P.V. Glybochko, D.Y. Pushkar. M.: GEOTAR-Media, 2018. 544 p. Russian (Урология. Российские клинические рекомендации. Под ред.Ю.Г. Аляева, П.В. Глыбочко, Д.Ю. Пушкаря. М.: ГЭОТАР-Медиа, 2018. 544 с.).
2. Pickard R., Bonkat G., Bartoletti R. et al. EAU Guidelines on urological infections. Eur Urol. 2017;67(6):1099–1109.
3. Alyaev Yu.G., Glybochko P.V., Gadgieva Z.K. A role of determination of functional state of lower urinary tract for choosing of treatment strategy in patients with chronic cystitis and chronic unobstructed pyelonephritis. Urologiia. 2011;6:4–8. Russian (Аляев Ю.Г., Глыбочко П.В.,Гаджиева З.К. Роль определения функционального состояния нижних мочевыводящих путей в выборе лечебной тактики у пациентов с хроническим циститом и хроническим необструктивным пиелонефритом. Урология. 2011;6:4–8).
4. Gadgieva Z.K., Kazilov Y.B. The features of approach to prophylaxis of recurrent lower urinary tract infection. Urologiia. 2016;S3:65–76. Russian (Гаджиева З.К., Казилов Ю.Б. Особенности подхода к профилактике рецидивирующей инфекции нижних мочевыводящих путей. Урология. 2016;S3:65–76).
5. Kuz’menko A.V., Kuz’menko V.V., Gyaurgiev T.A. Chronobiologic approach to the treatment of chronic recurrent bacterial cystitis in acute phase. Urologiia. 2017:2:60–65. Russian (Кузьменко А.В., Кузьменко В.В., Гяургиев Т.А. Хронобиологический подход к терапии хронического рецидивирующего бактериального цистита в стадии обострения. Урология. 2017:2:60–65).
6. Gyaurgiev T.A., Kuz’menko A.V., Vakhtel’ V.M., Luk’yanovich P.A. The treatment of patients with chronic recurrent bacterial cystitis in acute phase in combination with pthototherapy with use of apparatus “Svetozar”. A systemic analysis and management in biomedical systems. 2014;13(4):821–824. Russian (Гяургиев Т.А., Кузьменко А.В., Вахтель В.М., Лукьянович П.А. Лечение больных хроническим рецидивирующим бактериальным циститом в стадии обострения в комплексе с фототерапией с использованием аппарата Светозар. Cистемный анализ и управление в биомедицинских системах. 2014;13(4):821–824).
7. Foxman B. Epidemilogy of urinary tract infections: incidence, morbidity, and economic costs. Dis. Mon. 2003;9(1):53–70.
8. Kuz’menko A.V., Gyaurgiev T.A., Kuz’menko V.V. An efficiency of complex phytotherapy in treatment of uncomplicated lower urinary tract infection in women. Urologiia. 2018;4:10–13. Russian (Кузьменко А.В., Гяургиев Т.А.,Кузьменко В.В. Эффективность применения комплексных фитопрепаратов в лечении неосложненной инфекции нижних мочевыводящих путей у женщин. Урология. 2018;4:10–13).
9. Sinyakova L.A. A current view on the antibacterial therapy of urinaty tract infection. A management strategy of patients with recurrent cystitis. Urologiia. 2010;3:45–49. Russian (Синякова Л.А. Современные взгляды на антибактериальную терапию мочевыводящих путей. Тактика ведения больных с рецидивирующим циститом. Урология. 2010;3:45–49).
10. Kuz’menko A.V., Gyaurgiev T.A., Khimicheva M.N., Titov A.Y., Turbin A.S., Diogenova V.A. The results of using of phototherapy and chronotherapy for treatment of women with chronic recurrent bacterial cystitis in acute phase. A systemic analysis and management in biomedical systems. 2016;15(4):614–619. Russian (Кузьменко А.В., Гяургиев Т.А., Химичева М.Н., Титов А.Ю., Турбин А.С., Диогенова В.А. Результаты применения фототерапии и хронотерапии в лечении женщин с хроническим рецидивирующим бактериальным циститом в стадии обострения. Cистемный анализ и управление в биомедицинских системах. 2016;15(4):614–619).
11. Gyaurgiev T.A., Kuz’menko A.V., Vlasova J.V., KHimicheva M.N. An assessment of efficiency of chronotherapy and phototherapy in combination therapy of patients with chronic recurrent bacterial cystitis in acute phase. A systemic analysis and management in biomedical systems. 2015;14(3):422–425. Russian (Гяургиев Т.А., Кузьменко А.В., Власова Ж.В., Химичева М.Н.Оценка эффективности хронотерапии и фототерапии в комплексном лечении больных хроническим рецидивирующим бактериальным циститом в стадии обострения. Системный анализ и управление в биомедицинских системах. 2015;14(3):422–425).
12. Gyaurgiev T.A., Kuz’menko A.V., Lavrenov A.L. A morphometric analysis of efficiency of chronotherapy and phototherapy in therapy of patients with chronic recurrent bacterial cystitis in acute phase. A systemic analysis and management in biomedical systems. 2015;14(3):477–481. Russian (Гяургиев Т.А., Кузьменко А.В., Лавренов А.Л. Морфометрический анализ эффективности хронотерапии и фототерапии в лечении больных хроническим рецидивирующим бактериальным циститом в стадии обострения. Cистемный анализ и управление в биомедицинских системах. 2015;14(3):477–481).
13. Gilbert D.N., Moellering R.C., Eliopoulus G.M., Chambers H.F., Saag M.S. The stanford guide to antimicrobal therapy. 2010, Antimicrobal therapy Inc. USA. 219 p.
14. Shepherd A.K., Pottinger P.S. AK Management of Urinary Tract Infections in the Era of Increasing Antimicrobial Resistance. Med Clin N Am. 2013;97:737–757.
15. Deck D., Winston L. Beta-lactam and other cell wall- and membrane-active antibiotics. Basic and clinical pharmacology / ed. by B. Katzung,S. Masters, A. Trevor. 12-th ed. New York : McGraw-Hill, 2012.
16. Gupta K., Hooton T.M., Stamm W.E. Increasing antimicrobial resistance and the management of uncomplicated community-acquired urinary tract infections. Ann. Intern. Med. 2001;135:41–50.
18. Loran O.B. et al. An efficiency of fosfomycin trometamol for treatment of patients with chronic recurrent cystitis. Effectivnaya farmakoterapiya v urologii 2008;4:15. Russian (Лоран О.Б. и др. Эффективность применения фосфомицина трометамола в лечении больных хроническим рецидивирующим циститом. Эффективная фармакотерапия в урологии. 2008;4:15).
19. Loran O.B., Sinyakova L.A., Kosova I.V. The mistakes in antibacterial therapy of acute pyelonephritis. Consilium medicum. 2008;9-10:37–40. Russian (Лоран О.Б., Синякова Л.А., Косова И.В. Ошибки в антибактериальной терапии острого пиелонефрита. Consilium medicum. 2008;9-10:37–40).
20. Reffert J.L., Smith W.J. Fosfomycin for the treatment of resistant gram-negative bacterial infections. Insights from the Society of Infectious Diseases Pharmacists. Pharmacotherapy. 2014;34(8):845–857.
21. Minassian M.A. et al. A comparison between single-dose fosfomycin trometamol (Monuril) and a 5-day course of trimethoprim in the treatment of uncomplicated lower urinary tract infection in women. Int. J. Antimicrob. Agents. 1998;10(1):39–47.
22. Ceran N. et al. A randomized comparative study of single-dose fosfomycin and 5-day ciprofloxacin in female patients with uncomplicated lower urinary tract infections. J. Infect. Chemother. 2010;16(6):424–430.
23. Etienne M. et al. Antibiotic treatment of acute uncomplicated cystitis based on rapid urine test and local epidemiology: lessons from a primary care series. BMC Infect. Dis. 2014;14:137.
Исследование проводят методом посева на плотные питательные среды с использованием прибора WASP, Copan, Италия. Идентификацию микроорганизмов проводят методом масс-спектрометрии с помощью прибора Microflex Brucker Daltonik MALDI Biotyper, BRUKER, Германия. Определение чувствительности к антимикробным препаратам проводят на автоматических анализаторах серии VITEK 2, bioMerieux, Франция, и/или диско-диффузионным методом с использованием с использованием анализатора ADAGIO, BIO-RAD, Франция.
Синонимы: Urine Culture, Routine, quantitative. Aerobic Bacteria Identification. Antibiotic Susceptibility, Enlarged Testing.
Данный метод включает в себя количественное бактериологическое исследование биоматериала с целью выделения и идентификации микроорганизмов − возбудителей инфекций органов мочевой системы − с определением чувствительности выделенных патогенов к расширенному спектру антимикробных препаратов (антибиотикам, АМП) на автоматическом анализаторе.
Антибиотики относятся к лекарственным препаратам, эффективность которых является наиболее очевидной для лечения бактериальной инфекции. Основным ограничением эффективности антимикробных препаратов является способность микроорганизмов формировать устойчивость (резистентность) к их действию. Этот естественный процесс многократно ускоряется при необоснованном и избыточном применении антимикробных препаратов в качестве средств профилактики в медицине, средств самолечения широкими кругами населения.
Учитывая наличие указанных проблем, антимикробный препарат следует назначать только при наличии обоснованных показаний (подтвержденная или предполагаемая бактериальная инфекция) и с учетом результатов определения чувствительности к нему выделенного возбудителя.
Определение чувствительности в данном исследовании проводится с помощью автоматических анализаторов серии VITEK 2, bioMerieux, Франция. Метод основан на определении минимальной концентрации антибиотика, подавляющей рост и размножение микроорганизма, что позволяет более точно определить не только чувствительность к отдельному препарату, но также оценить механизм устойчивости (фенотип) и спрогнозировать чувствительность к другим препаратам той или иной группы.
- энтеробактерии: E. coli, Enterobacter spp., Klebsiella spp., P. mirabilis, P. aeruginosa, P. vulgaris, Citrobacter spp., Morganella spp., Serratia spp.;
- неферментирующие грамотрицательные микроорганизмы: Pseudomonas spp. (включая P. aeruginosa), Acinetobacter spp., Stenotrophomonas maltophilia;
- стафилококки: S. saprophyticus, S. aureus;
- стрептококки: S. agalactiae;
- дрожжеподобные грибы (скрининговое выявление);
- другие бактерии: энтерококки, C. urealyticum.
С какой целью проводят посев мочи на микрофлору и определение чувствительности к расширенному спектру антимикробных препаратов
Исследование проводят с целью диагностики и мониторинга течения бактериальных инфекций органов мочевой системы. Определение чувствительности к расширенному спектру антимикробных препаратов целесообразно проводить в случае хронических ИМП, пациентам, длительно получающим антибактериальную терапию, когда есть высокая вероятность формирования устойчивости возбудителя к антибиотикам.
Действующее вещество: фосфомицина трометамол 5.631 г (3.0 г фосфомицина). Вспомогательные вещества: сахароза - 2,213 г, ароматизатор апельсиновый - 0,140 г, натрия сахаринат- 0,016 г.
Группа
Производители
Показания к применению Фосфомицин-ЛекТ порошок 3г/8г
Инфекционно-воспалительные заболевания, вызванные чувствительными к фосфомицину микроорганизмами: острый бактериальный цистит, острые приступы рецидивирующего бактериального цистита; бактериальный неспецифический уретрит; бессимптомная массивная бактериурия у беременных; послеоперационные инфекции мочевыводящих путей. Профилактика инфекций при хирургическом вмешательстве на мочевыводящих путях и при трансуретральных диагностических исследованиях.
Способ применения и дозировка Фосфомицин-ЛекТ порошок 3г/8г
Внутрь. Порошок растворяют в 1/2 стакана воды (50-75 мл) или другого напитка, перемешивают до полного растворения, принимают сразу же после растворения. Фосфомицин применяют 1 раз в сутки внутрь натощак за 1 час до или через 2-3 часа после еды, предпочтительно перед сном, предварительно опорожнив мочевой пузырь. Взрослым и детям от 12 до 18 лет: По 1 пакету (3 г) 1 раз в день однократно. С целью профилактики инфицирования мочевыводящих путей при хирургическом вмешательстве, трансуретральных диагностических процедурах фосфомицин принимают 2 раза по 3 г: за 3 часа до вмешательства и через 24 часа после вмешательства. В более тяжёлых случаях (пожилые пациенты, рецидивирующие инфекции) принимают ещё 1 пакет через 24 часа. Пациенты с заболеваниями почек .У пациентов с легкой или средней степенью тяжести почечной недостаточности коррекции дозы не требуется. У пациентов с тяжелой почечной недостаточностью или находящихся на гемодиализе применение препарата противопоказано. Пациенты с заболеваниями печени. У пациентов с печеночной недостаточностью коррекции дозы не требуется.
Противопоказания Фосфомицин-ЛекТ порошок 3г/8г
Повышенная чувствительность к фосфомицину, другим компонентам препарата; тяжелая почечная недостаточность (клиренс креатипипа /= 1/10), часто (>/= 1/100 до /= 1/1000, до /= 1/10000 до Для аптек Сервисы для аптек Партнерам Наши клиенты Реклама
Е.В.Мозговая (1, 2), Н.А. Патрухина (2)
(1) НИИ акушерства и гинекологии им. Д.О.Отта, Санкт-Петербург; (2) Кафедра акушерства, гинекологии и репродуктологии медицинского факультета СПбГУ, Санкт-Петербург
Инфекции мочевыводящих путей (ИМП) являются частым гестационным осложнением. Отсутствие своевременной и адекватной терапии во время беременности ИМП нижних отделов приводит к развитию гестационного пиелонефрита, невынашивания, перинатальной заболеваемости. Высоковирулентная уропатогенная флора, ограниченность в выборе антибиотиков и возрастающая антибиотикорезистентность микробных агентов создают трудности при санации мочевых путей во время беременности. Фосфомицина трометамол (Монурал), примененный 85 беременными с ИМП во 2-м и 3-м триместрах, показал высокую эффективность в санации нижних мочевых путей при однократном приеме и эффективную профилактику рецидивов хронического пиелонефрита при повторных приемах препарата.
Инфекции мочевыводящих путей (ИМП) остаются проблемой мирового масштаба; лечение и оплата нетрудоспособности пациентов с данными заболеваниями связаны с большими финансовыми затратами. Более чем половина женщин хотя бы раз в жизни страдали от неосложненных ИМП, в подавляющем большинстве – от цистита. При этом частота цистита максимальна в репродуктивном возрасте и значительно снижается после 40 лет [1]. Во время беременности ИМП – одно из наиболее распространенных осложнений, конкурируя по частоте с сердечно-сосудистой патологией, поскольку гестационные физиологические изменения еще более существенно повышают риск развития ИМП.
В подавляющем большинстве случаев ИМП представлены грамотрицательной флорой. Большинство уропатогенных микроорганизмов обитает в кишечнике, перианальной области, в преддверии влагалища и периуретральной области. Специфические вирулентные факторы, которыми обладает уропатогенная флора, способствуют широкому распространению и активизации ИМП. Вирулентные факторы Еscherichia coli и Proteus mirabilis хорошо известны – это синтез аэробактина и энтеробактина (железосвязывающие белки с высоким сродством к железу, необходимому для размножения бактерий, образования гемолизина и экспрессии фимбрий). Уропатогенность микроорганизмов определяется феноменом адгезии грамотрицательных бактерий к уроэпителиальным клеткам благодаря специальным ворсинкам-фимбриям с последующей инвазией в эпителий. Маннозочувствительные фимбрии (тип 1) обнаруживаются у патогенных и непатогенных штаммов Е. coli, в то время как маннозорезистентные фимбрии (Р-фимбрии) выявляются только на уропатогенных микробах. Р-фимбрии называют пиелонефрит-ассоциированными, т.к. они могут специфически прикрепляться к рецепторам эпителия урогенитального тракта и позволяют бактериям подниматься вверх из мочевого пузыря к почкам [2].
Неосложненные ИМП характерны для пациенток с отсутствием аномалий и нормальной функцией мочевыводящих путей. Для большинства таких пациенток инфекция ограничивается локализацией в нижних отделах мочевыводящих путей. Она может протекать как в бессимптомной (асимптоматическая бактериурия), так и в манифестной форме (острый цистит). Распространенность бессимптомной бактериурии, по данным различных исследований, колеблется от 2 до 13 %; манифестные формы инфекции развиваются у 1–2 % беременных женщин [3].
Необходимо дифференцировать бактериурию от контаминации околоуретральной микрофлорой. Количество уропатогенных микроорганизмов, отличающее бактериурию мочевого пузыря от бактериального загрязнения, было установлено в 1960-х гг. [4]. Клинически значимой бактериурией у пациентов без каких-либо симптомов ИМП было принято обнаружение одного и того же вида бактерий в концентрации 105 КОЕ/мл и более в двух посевах средней порции мочи с интервалом в 24 часа. Меньшее количество колоний у женщин с бессимптомной бактериурией было принято считать контаминацией. Однако исследования последних лет показали, что традиционный критерий наличия бактериурии (более или равно 105 КОЕ/мл) обладает высокой специфичностью (0,99), но очень низкой чувствительностью (0,51), в то время как порог, в более или равный 102 КОЕ/мл, является более чувствительным показателем бактериурии мочевого пузыря (0,95), хотя он и менее специфичен (0,85). Фактами, подтверждающими присутствие бактериурии при низком содержании уропатогенных микроорганизмов, являются наличие симптомов ИМП и пиурия, реакция на лечение и характерная вирулентность микроорганизмов. На практике эритроциты и лейкоциты, составляющие мочевой осадок, лизируются при рН мочи > 6, при низкой осмолярности мочи или когда до исследования мочи проходит много времени. Поэтому ложноотрицательные результаты при микроскопии мочи достаточно часты. Многие женщины с клиническими симптомами ИМП считаются неинфицированными согласно традиционному подходу, на самом деле имеют настоящую бактериурию мочевого пузыря либо без, либо с субклинической инфекцией верхних мочевых путей. Поэтому большинство авторов предлагают считать наличие бактерий в концентрации более 103 КОЕ/мл хотя бы в одном образце средней порции мочи беременных с симптомами ИМП в качестве диагностического критерия клинически значимой бактериурии [5, 6].
Установлено, что острый цистит может быть вызван бактериурией, представленной менее чем 105 КОЕ/мл. Нелеченая бактериурия приводит к развитию пиелонефрита в 30–80 % случаев. Кроме того, нелеченая бессимптомная бактериурия способствует преждевременным родам в 11,8 %, перинатальной заболеваемости – в 37,5, внутриутробной патологии мочевыводящей системы плодов – в 20–30 % случаев [7].

Принято различать ИМП в зависимости от уровня вовлечения мочевого тракта, клинической симптоматики и наличия осложнений. Очень важно разграничить ИМП нижнего (уретра, мочевой пузырь) и верхнего (почка) мочевого тракта, поскольку тактика лечения беременных существенно различается.
Ведущим путем инфицирования мочевой системы женщин остается восходящий уриногенный. Однако нельзя исключать и гематогенный путь проникновения инфекции, при котором первичным очагом может быть любой гнойно-воспалительный процесс в организме беременной.
Высокая вирулентнось микрофлоры определяет частое рецидивирование ИМП. Рецидивирующие ИМП возникают у одной из трех женщин после первого эпизода ИМП. Рецидив, требующий вмешательств, обычно определяется как 2 или 3 эпизода в течение 6 месяцев или 3 или более эпизодов за год. Таким пациенткам требуется назначение специальной противорецидивной терапии: применение противомикробных препаратов в низких дозах 1 раз в сутки или посткоитально. Адекватная антибактериальная терапия инфекций нижних отделов мочевыводящих путей беременных позволяет в 75 % случаев предупреждать развитие острого пиелонефрита и даже снижать риск перинатальной смертности [8].
Вместе с тем антимикробная терапия ограничена возрастающей резистентностью к микрофлоре, вызывающей ИМП. Так, за последнее время отмечено возрастание резистентности к фторхинолонам, ранее широко применявшимся при лечении ИМП у небеременных пациенток [9]. При беременности выбор возможных препаратов, безопасных для матери и плода и в то же время обладающих высокой эффективностью, крайне ограничен. Антибактериальная терапия должна проводиться с учетом особенностей фармакокинетики препаратов и их токсического влияния на организм матери и плода.
Антибиотики, рекомендуемые в качестве лечения инфекций нижних мочевыводящих путей беременных, по классификации Администрации по контролю за лекарствами и пищевыми продуктами США (FDA) относятся к категории В и включают ингибитор-защищенные пенициллины, цефалоспорины и фосфомицин [10].
Многочисленными исследованиями показано, что достаточно антибактериальной терапии неосложненной ИМП короткими курсами до 3 дней. Более длительная терапия при лечении острого неосложненного цистита не имеет преимуществ [11, 12]. Препаратом выбора лечения инфекции нижних мочевыводящих путей, не затронувшей почечную паренхиму, служит природный антибиотик фосфомицин.
Фосфомицина трометамол (Монурал) оказывает бактерицидное действие за счет нарушения начальных этапов синтеза клеточной стенки бактерий и антиадгезивного действия (препятствует адгезии уропатогенных штаммов к клеткам уротелия). Преимущества Монурала: отсутствие перекрестной устойчивости с другими антибиотиками, широкий антибактериальный спектр, способность создавать высокие концентрации в моче, длительно сохраняющиеся после однократного приема, что определяет высокую комплаентность препарата (3 г однократно на ночь со стаканом воды) [13].
Многоцентровые исследования последних лет беременных с ИМП показали, что фосфомицин обладает наибольшей активностью в отношении E. coli наряду с фуразидином и нитрофурантоином, чувствительность к которым сохраняется у 97,3 % штаммов; достаточной чувствительностью обладают и пероральные цефалоспорины III поколения. В отношении же всех представителей семейства Enterobacteriaceae активностью более 90 % среди пероральных препаратов обладает только фосфомицин (93,9 %). Активность фуразидина и нитрофурантоина составляет только 88,4 и 81,0 % соответственно [14].
Отмечено, что чувствительность фосфомицина к E. coli и Klebsiella pneumonia составляет соответственно 99,2 и 88 %, а к Klebsiella oxytoca, Proteus spp., Enterobacter sakazakii – 100 %, и такая совокупная чувствительность максимальна по сравнению с ингибиторозащищенными аминопенициллинами, цефалоспоринами, нитрофурантоином и ко-тримоксазолом. Стопроцентная чувствительность фосфомицина отмечена и к Enterococcus faecalis [15]. Многие исследования показывают, что однократное применение фосфомицина беременными с инфекцией нижних мочевыводящих путей так же эффективно, как трехдневные курсы традиционной антибактериальной терапии [16].
Так, не отмечено существенного различия между однократным применением 3 г фосфомицина и 5-дневным курсом цефуроксима – ни в персистенции инфекции, ни в необходимости перехода на другие антибиотики [17]. Отмечено также, что фосфомицин гораздо реже вызывает побочные эффекты у беременных по сравнению с традиционными антибиотиками [18].
Материал и методы
Произведена оценка эффективности лечения инфекций нижних отделов мочевыводящих путей препаратом Монурал 85 беременных во 2-м и 3-м триместрах беременности. По показаниям к назначению Монурала пациентки были разделены на три группы. Группу 1 составили 23 беременных, не имевших в анамнезе ИМП, у которых в посеве мочи выявлен рост уропатогенной флоры ≥ 105 КОЕ/мл. Группу 2 составили 47 беременных, страдавших хроническим циститом и/или хроническим пиелонефритом, без клинических проявлений на момент исследования, но у которых в посеве мочи выявлен рост уропатогенной флоры ≥ 103 КОЕ/мл. Группу 3 составили 15 пациенток, имевших обострение хронического пиелонефрита во время беременности, получивших 5–7-дневный курс антибактериальной терапии ингибиторозащищенными аминопенициллинами или цефалоспоринами. Пациентки первых двух групп получили Монурал однократно в виде 3 г порошка, растворенного в стакане воды, перед сном. Контрольный посев мочи произведен через 7–10 дней. Пациентки третьей группы принимали Монурал 1 раз 10 дней вплоть до родоразрешения под контролем еженедельных общих анализов мочи и посевов мочи 1 раз в месяц.
Бактериологическая эффективность оценивалась по следующим критериям:
- выздоровление (стерильные посевы мочи);
- персистенция инфекции (определение того же возбудителя в моче в концентрации 103 КОЕ/мл и более);
- реинфекция (обнаружение в моче нового вида бактерий в концентрации 103 КОЕ/мл и более).
Результаты и обсуждение
Нами было отмечено, что у пациенток, имевших обострение хронического пиелонефрита при данной беременности, чаще, чем у беременных, не имевших клинических проявлений ИМП во время данной беременности встречались предрасполагающие к ИМП факторы (осложненные ИМП) (табл. 1).
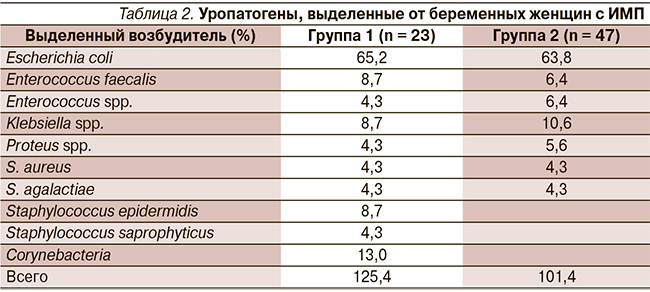
Частота выделения различных возбудителей существенно не различалась у беременных первой и второй групп, при этом наиболее часто в посевах определялась E. coli (табл. 2).
При бессимптомной бактериурии у 12 беременных (48 % случаев) выявлены микробные ассоциации E. coli, Corynebacterium spp., Enterococcus spp. После однократного вечернего применения Монурала (3 г) 87 % пациенток с имевшейся бессимптомной бактериурией достигнута стерильность мочи, т.е. наблюдалось полное выздоровление. У 3 (13 % случаев) беременных концентрация микробных тел значительно снизилась, при этом наблюдалась персистенция Corynebacterium spp. Этим пациенткам была назначена повторная доза Монурала. После повторного применения Монурала Corynebacterium spp. выявлены не были.
Из 47 обследованных беременных второй группы только у одной пациентки наблюдалось сочетание E. coli и Klebsiella spp. При повторном посеве мочи эрадикация возбудителя наблюдалась у 40 (89,3 %) пациенток, получавших Монурал. Персистирующими возбудителями были Klebsiella в двух случаях, S. agalactiae в двух случаях и Enterococcus faecalis в одном соответственно. Этим пациенткам была назначена повторная доза Монурала, и при последующем бактериологическом исследовании рост микробных тел не был обнаружен.
Беременным третьей группы с обострением хронического пиелонефрита при данной беременности Монурал назначен в качестве противорецидивной терапии. Перед назначением препарата эти пациентки прошли курс антибактериальной терапии, и в посевах мочи после лечения роста уропатогенной флоры выявлено не было. Однако в общих анализах мочи сохранялись умеренная гипостенурия (относительная плотность мочи – 1007,5 ± 3,04), слизь, соли, лейкоциты 5,3 ± 0,6 в поле зрения. С учетом наличия факторов, предрасполагающих к рецидивированию пиелонефрита у пациенток данной группы (табл. 1), Монурал назначался один раз в 10 дней вплоть до родоразрешения. Кратность приема препарата составила 6,6 ± 1,9 раза. Дополнительно пациентки данной группы получали постоянную фитотерапию. При контроле посевов мочи с интервалом 1 месяц ни у одной из пациенток роста уропатогенной флоры обнаружено не было. Повторных обострений хронического пиелонефрита не наблюдалось. Только 3 (3,5 %) из наблюдавшихся беременных отметили побочные явления в виде тошноты при приеме препарата, при этом тошнота была легкой и кратковременной.
Монурал относится к препаратам группы В, поэтому мы избегали применять его в первом триместре беременности. Полученные результаты показали высокую эффективность препарата при лечении инфекций нижних мочевыводящих путей во время 2-го и 3-го триместров беременности, а также для профилактики рецидивов хронического пиелонефрита у беременных высокой группы риска. Фосфомицин выводится почками практически без изменений, его концентрация в моче очень высока и его терапевтическое действие пролонгируется до 36 часов, вероятно из-за более длительной желудочно-кишечной абсорбции [19]. Это свойство фосфомицина объясняет его высокую эффективность даже при однократном приеме. Тем не менее в небольшом проценте случаев потребовалось повторное применение препарата для достижения полной стерильности посева мочи. Поскольку к фосфомицину не возникает первичной резистентности [20], считаем целесообразным при значительной контаминации мочевыводящих путей высоковирулентной уропатогенной флорой назначать Монурал дважды с интервалом 3–5 дней.
В связи с тем что Монурал эффективен при незначительной дозировке, он вызывает не только минимальные побочные эффекты, но и потенциально меньшее количество изменений кишечной флоры, поэтому не требует назначения параллельных длительных курсов про- и эубиотиков. Это определяет как высокую комплаентность препарата, так и его экономичность.
Читайте также:

