Esbl расшифровка в посеве
Добавил пользователь Евгений Кузнецов Обновлено: 18.09.2024
Особенно опасна такая ситуация в отношении хирургических больных, новорожденных и людей с ослабленным иммунитетом, а также тех, для кого прием антибиотиков стал нормой жизни.
Микробиологические способы идентификации возбудителей уже давно используются медициной всего мира, а современные анализаторы сделали этот процесс быстрее и эффективнее.
В результате будет указан не только вид бактерий, но и их количество и реакция на препарат:
Правда у анализа есть и недостатки:
Новое поколение
Метод полностью автоматизирован, что исключает влияние человеческого фактора на результат. А готовность исследования составляет максимум 4 дня.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Бактериальный вагиноз: причины появления, симптомы, диагностика и способы лечения.
Определение
Бактериальный вагиноз — это инфекционное полимикробное заболевание, связанное с изменением микрофлоры влагалища, при котором происходит значимое уменьшение количества или полное исчезновение палочек Додерлейна (лактобактерий) и их замещение факультативными анаэробными микроорганизмами и/или возбудителем гарднереллеза. Увеличение уровня лейкоцитов в вагинальном отделяемом и признаки воспаления стенок влагалища могут отсутствовать.
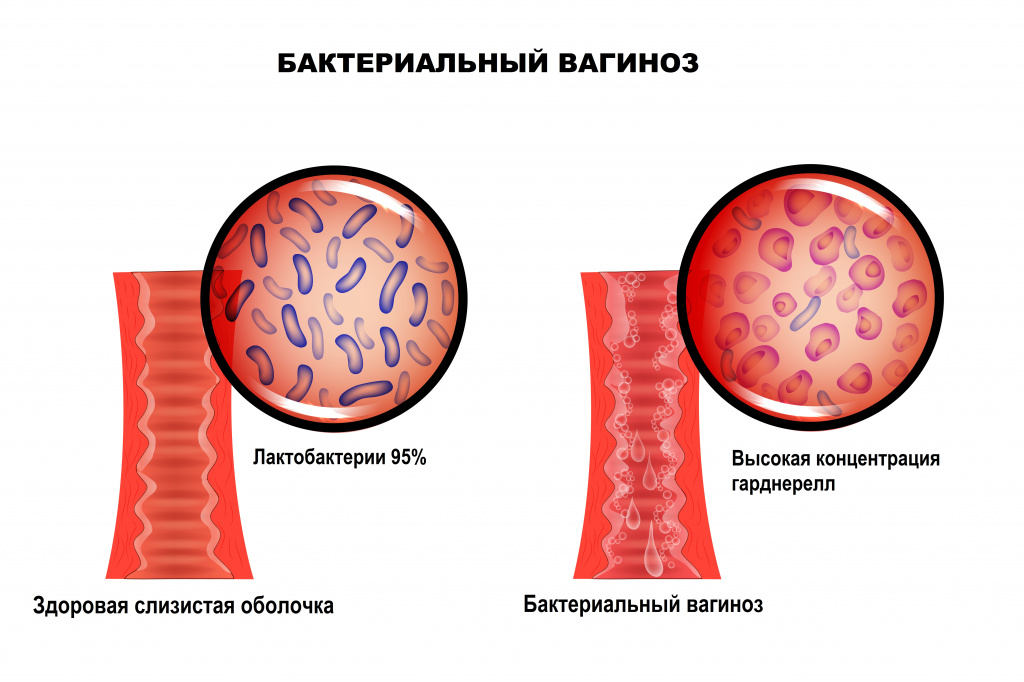
Отличительной особенностью заболевания является отсутствие какого-либо одного конкретного возбудителя. Микрофлора, приходящая на смену лактобактериям, может быть различной и чаще всего представлена условно-патогенными бактериями. Кислотность среды влагалища смещается в сторону ощелачивания. При нарушении экосистемы влагалища формируется хорошо структурированная полимикробная пленка (биопленка - форма микробных сообществ), покрывающая вагинальный эпителий и состоящая из анаэробных бактерий, что приводит к рецидивирующему течению бактериального вагиноза. В биопленках бактерии защищены от компонентов врожденного и приобретенного иммунитета.
В норме ведущее место (95%) в вагинальном микробиоценозе занимают палочки Додерлейна, продуцирующие перекись водорода и молочную кислоту.
Они поддерживают постоянство богатой кислородом кислой рН-среды и играют роль местных факторов защиты. В случае нарушения защитных механизмов патогенные или условно-патогенные микроорганизмы транзиторной или факультативной флоры прикрепляются к клеткам влагалищного эпителия с последующим размножением и повреждением тканей.
Бактериальный вагиноз является наиболее частой причиной патологических вагинальных выделений у женщин репродуктивного возраста, однако иногда он может наблюдаться и у девочек до менархе, и у женщин в период менопаузы.
Причины появления бактериального вагиноза
Предрасполагающие факторы, ведущие к развитию бактериального вагиноза:
- использование антибактериальных препаратов;
- длительное применение внутриматочных контрацептивов;
- ношение синтетического нижнего белья, злоупотребление прокладками на каждый день и тампонами, которые препятствуют проникновению кислорода;
- длительный прием антибиотиков;
- хронические заболевания кишечника и другие состояния, вызывающие дисбактериоз;
- использование пероральных контрацептивов;
- перенесенные ранее воспалительные заболевания урогенитального тракта;
- нарушение гормонального статуса, сопровождающееся нарушением менструального цикла, преимущественно по типу олигоменореи или аменореи;
- атрофия слизистой оболочки влагалища;
- снижение иммунитета;
- воздействие малых доз ионизирующего излучения;
- стрессовые воздействия на организм.
Классификация бактериального вагиноза на основании микроскопического исследования:
- Компенсированный бактериальный вагиноз — количество лактобактерий снижено, что является фактором риска заселения влагалища патогенными микроорганизмами.
- Субкомпенсированный — низкий уровень лактобактерий и растущее число условно-патогенных микроорганизмов.
- Декомпенсированный — в мазке выявляются условно-патогенные микроорганизмы, лактобактерии отсутствуют, выражены клинические симптомы бактериального вагиноза.
У большинства женщин бактериальный вагиноз протекает бессимптомно и может быть обнаружен случайно во время рутинного осмотра и взятия мазка.
Интенсивный рост факультативной флоры, образование патологических биопленок сопровождается появлением влагалищных выделений с характерным неприятным запахом.
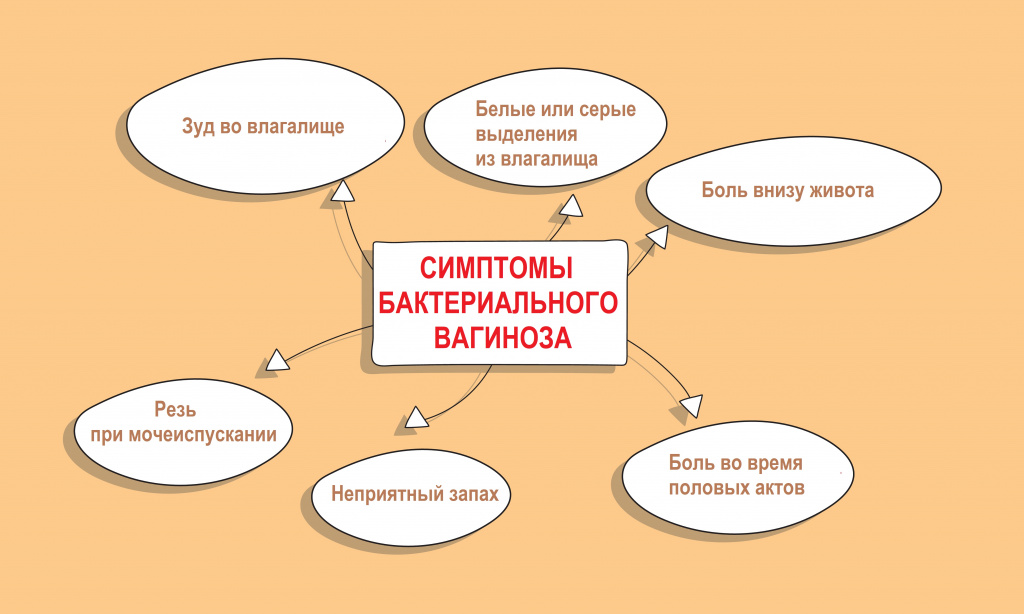
Хронический бактериальный вагиноз — это непрерывное течение заболевания более 2-х месяцев, несмотря на проводимое лечение. Как правило, он сочетается с нарушением гормонального фона и атрофией слизистой оболочки влагалища.
Диагностика бактериального вагиноза
При постановке диагноза у врача есть четыре критерия, которыми он пользуется. Наличие у пациентки трех из них говорит в пользу бактериального вагиноза.
Микроскопическое (бактериоскопическое) исследование мазка, окрашенного по Граму. Материалом для оценки состояния флоры влагалища служат гинекологические мазки (отделяемое наружных половых органов, уретры, влагалища, шейки матки, полости матки).
Микроскопическое исследование окрашенного нативного мазка проводят при диагностике инфекционно-воспалительных заболеваний мочеполовых путей; легких; ЛОР-органов; глаз; кожи, мягких тканей и др. Возможно применение данного теста в качестве дополнительного исследования к посевам на анаэробную инфекцию.

Бессимптомная бактериурия — это выделение определенного количества бактерий в порции правильно собранной мочи у пациента без признаков и симптомов воспаления мочевыводящих путей.
Диагноз бессимптомной бактериурии устанавливается по результатам посева мочи — при выявлении в ней концентрации бактерий ≥10 5 в двух последовательных анализах у женщин и в одном анализе у мужчин.
Распространенность бессимптомной бактериурии у женщин увеличивается с возрастом — от 1% у школьниц до >20% у женщин старше 80 лет.
Существует взаимосвязь между наличием бактерий в моче и сексуальной активностью: например, исследования показали, что у сексуально активных женщин распространенность бессимптомной бактериурии выше, чем у монахинь того же возраста.
При этом у молодых здоровых женщин бессимптомная бактериурия редко длится дольше нескольких недель.
В норме моча стерильна, однако при определенных условиях может быть хорошей средой для размножения бактерий, например, при сахарном диабете.
Наличие в общем анализе мочи бактерий не говорит об обязательном высевании какой-либо бактерии при бактериологическом анализе (при посеве мочи). Точно так же повышенное количество лейкоцитов не всегда свидетельствует о наличии бактерий в моче.
У мужчин бессимптомная бактериурия встречается редко. Выявление бактерий в моче возможно у 6-15% пожилых мужчин старше 75 лет. При наличии бессимптомной бактериурии у молодых мужчин рекомендовано дообследование с целью исключения бактериального простатита.
Лечение бессимптомной бактериурии не требуется, потому что:
- наличие бактерий в моче не увеличивает вероятность развития заболеваний мочевого пузыря и почек;
- не приводит к повышению смертности;
- антибиотики первоначально стерилизуют мочу почти у всех пациентов, однако примерно через 6 месяцев бактериурия снова появляется. То есть лечение антибиотиками не только бесполезно, но и вредно, так как развивается невосприимчивость бактерий к антибиотикам (резистентность).
Лечение бессимптомной бактериурии показано у небольшой группы пациентов:
- пациенты, которым планируется выполнение оперативного лечения с возможным повреждением слизистых мочевых путей и возможным кровотечением;
- пациенты, перенесшие пересадку почки;
- беременные женщины.
С беременными не все однозначно. По статистике, 2-10% беременных женщин ставят диагноз бессимптомная бактериурия. Часто, при наличии бактерий в общем анализе мочи или наличии бактерий в низком титре (например, 10³), женщине сходу назначается антибиотик, который, скорее всего, совсем не нужен.
Дело в том, что большинство исследований по диагностике и лечению бессимптомной бактериурии у беременных относится к 70-80-м годам прошлого века. По их результатам у 20-30% беременных с ББ развивается острый пиелонефрит, который сопряжен с невынашиванием беременности, низкой массой плода и другими неблагоприятными факторами. Но за прошедшие десятилетия изменились многие факторы, и современные исследования (правда, немногочисленные) показывают низкий риск развития пиелонефрита у беременных женщин с бессимптомной бактериурией — около 3%!
В официальном гайдлайне Европейской ассоциации урологов и в российских рекомендациях указано, что лечить бессимптомную бактериурию у беременных необходимо. Возможно, с ростом качественных исследований по этой теме рекомендации поменяются. А пока показаны короткие курсы антибактериальной терапии для уменьшения частоты побочных эффектов. Возможно использование фосфомицина (Монурал) или антибиотика пенициллинового либо цефалоспоринового ряда (Амоксиклав, Супракс).
Локтев Артем Валерьевич
врач-андролог, врач-уролог
Оформите заявку на сайте, мы свяжемся с вами в ближайшее время и ответим на все интересующие вопросы.
Klebsiella pneumoniae - условно-патогенный бактериальный патоген, известный своей высокой частотой и разнообразием генов устойчивости к противомикробным препаратам (УПП). K. pneumoniae не только представляет собой серьезную клиническую проблему, но и представляет собой вид, в котором были впервые обнаружены несколько новых генов AMR, прежде чем они распространились на другие патогены (например, гены устойчивости к карбапенемам KPC, OXA-48 и NDM-1). Хотя вклад K.pneumoniae в общий кризис УПП невозможно оценить количественно, имеющиеся данные свидетельствуют о более широком экологическом распространении, значительно более разнообразном составе ДНК, большем разнообразии генов УПП и более высокой плазмидной , нагрузке, чем у других грамотрицательных оппортунистов. Следовательно, мы предполагаем, что он играет ключевую роль. в распространении генов AMR от микробов окружающей среды до клинически важных патогенов.
Устойчивость к дополнительным лекарствам иногда возникает из-за хромосомных мутаций, однако большая часть AMR у K. pneumoniae возникает в результате приобретения генов AMR через HGT, в основном через большие конъюгативные плазмиды. Накопление детерминант устойчивости в одном штамме может привести к появлению пан-устойчивых штаммов, которые не поддаются лечению всеми доступными антибиотиками. Самыми ранними мобильными генами устойчивости к ампициллину, идентифицированными в популяциях грамотрицательных бактерий, были ТЕМ (присутствующий в первых описанных плазмидах в 1960-х годах) и хромосомный ген SHV-1 K. pneumoniae, который был впервые обнаружен в мобильных плазмидах. перенесенная форма у других Enterobacteriaceae в 1973 г.После внедрения цефалоспоринов третьего поколения для клинического использования в начале 1980-х гг. Начали обнаруживаться и характеризоваться гены бета-лактамаз расширенного спектра (БЛРС), обеспечивающие устойчивость к этим препаратам. К самым ранним формам относятся варианты БЛРС мобильного SHVкоторые впервые были идентифицированы у K. pneumoniae и в настоящее время широко распространены среди энтеробактерий. а в некоторых случаях также распространились на Acinetobacter и Pseudomonas. Наиболее широко распространенным геном БЛРС является CTX-M, варианты которого были обнаружены у Escherichia coli и K. pneumoniae в конце 1980-х - начале 1990-х годов, будучи мобилизованными из окружающей среды Enterobacteriaceae (Kluyvera). CTX-M теперь тесно связан с E. coli ST131 пандемический клон и несколько клонов K. pneumoniae, и присутствует в различных плазмидных фонах, что приводит к широкому распространению среди популяций микробов, ассоциированных с больницами, людьми и животными.
К. pneumoniae имеют средства и возможности для захвата плазмид из микробных популяций окружающей среды; выживать внутри и перемещаться между многочисленными экологическими нишами и нишами, связанными с животными; поддерживать плазмиды AMR в течение продолжительных периодов времени; и передавать плазмиды другим клинически важным грамотрицательным бактериям (рис. 4). Хотя вклад K. pneumoniae в кризис AMR невозможно количественно оценить, имеющиеся данные свидетельствуют о том, что он является уникальным среди грамотрицательных возбудителей SKAPE и E. coli в нескольких ключевых отношениях, включая большое разнообразие приобретенных генов AMR, высокую плазмидную нагрузку, широкую вариабельность G + Содержание C отражает разнообразие партнеров HGT и широкий экологический диапазон - хотя систематические исследования сравнительной экологии отсутствуют, имеющиеся данные 16S позволяют предположить, что K. pneumoniae с одинаковой вероятностью может быть обнаружена в нишах человека, животных и окружающей среды. Сочетание этих факторов может позиционировать K. pneumoniae как ключевой усилитель и распространитель клинически важных генов AMR. Лучшее понимание и мониторинг этого пути переноса генов УПП потенциально может помочь ограничить распространение УПП и продлить жизнь новых антибиотиков.
Читайте также:

