Замедленное созревание ворсинчатого дерева
Добавил пользователь Евгений Кузнецов Обновлено: 19.09.2024
Внутриутробная инфекция (ВУИ) представляет собой серьезную проблему современной перинатальной медицины, так как данное осложнение может быть причиной перинатальной патологии и смертности матери и ребенка [1-3, 6, 9].
ВУИ играет важную роль в генезе различных патологических процессов при беременности, оказывает вредное влияние на исход беременности и состояние новорожденного. В подавляющем большинстве случаев ВУИ является причиной антенатальной патологии: 32% самопроизвольного выкидыша, 24% внутриутробной задержки развития плода и преждевременных родов. Наиболее распространенным представителем нативных вирусов является герпесвирусная инфекция, частота обнаружения вируса простого герпеса (ВПГ) составляет 98,9% среди взрослого населения земного шара [1, 2, 4, 7].
В последние годы отмечается тенденция к увеличению инфицирования беременных ВПГ. Генитальной герпетической инфекции уделяется большое внимание, так как ее способность активно размножаться в плаценте и эмбриональных тканях, проникать через плацентарный барьер и вызывать внутриутробное поражение плода приводит к формированию плацентарной недостаточности и развитию пороков развития плода [1-3, 6].
Возрастающая роль внутриутробных инфекций среди причин неблагоприятных перинатальных исходов определяет актуальность всестороннего изучения этой проблемы.
Цель исследования: изучение роли ВПГ в генезе плацентарной недостаточности и определение специфических изменений в плаценте женщин с генитальной герпетической инфекцией.
Материалы и методы исследования. Под нашим наблюдением находилось 204 женщины с диагностированной вирусной инфекцией, Возраст больных составлял от 18 до 37 лет. У всех пациенток в анамнезе (1,2±0,4 года назад) были перинатальные потери, хронические воспалительные заболевания репродуктивной системы, что и послужило основанием для проведения детального клинико-лабораторного, в том числе серологического, обследования на наличие вирусной инфекции. Также проводилось ультразвуковое исследование плода и плаценты в 16-17, 24-28 недель гестации и накануне родов с осуществлением допплерометрии и ультразвуковой фетометрии плода.
Макроскопическое, морфометрическое, гистологическое и иммуногистохимическое исследование плаценты, пуповины и околоплодных оболочек.
Результаты. Методом ПЦР в большинстве случаев обнаружен вирус генитального герпеса в виде моноинфекции у 19,2% (n=40) беременных. У 80,7% (n=164) беременных отмечалось сочетание герпетической инфекции с цитомегаловирусом, а также бактериально-кандидозной инфекций шейки матки. Детальное изучение акушерского анамнеза позволило выделить высокий процент 40,4% (n=82) самопроизвольных выкидышей в ранние сроки гестации, а у 13,5% (27 женщин) в поздние сроки гестации. В 23,0% (n=47) отмечена неразвивающаяся беременность. Преждевременные роды - выявлены в 22,1% (n=45) случаев. 13,5% (n=27) женщин перенесли операцию по поводу внематочной беременности, у 12,5% (n=25) пациенток роды закончились перинатальной смертью новорожденного на различные сутки жизни. У 10,5% (n=21) женщин беременность была прервана по мед. показаниям в различные сроки гестации по поводу аномалии развития и уродства плода, что может быть связано с патогенным действием вируса герпеса на яйцеклетку. В 9,6% (n=19) случаев отмечалось вторичное бесплодие, а в меньшинстве 5,7% (n=11) случаев отмечено антенатальная гибель плода. Наиболее часто встречающимся осложнением родового акта у беременных явилось несвоевременное излитие околоплодных вод 31,7%. При ультразвуковом исследовании выявлен кальциноз плаценты различной степени выраженности 42,4%, задержка внутриутробного развития плода с отставанием от гестационного срока на две недели 10,1%, многоводие 13,4%, маловодие 14,5%, преждевременное созревание плацент в 22,7%. Допплерометрическое исследование позволило в 49,7% случаев выявить нарушения со стороны фето- и маточно-плацентарного кровотока.
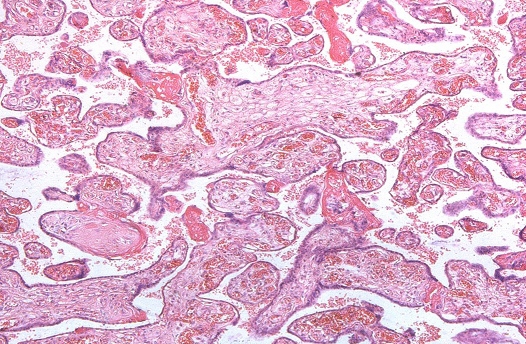
Рис. 1. Патологическая незрелость ворсин хориона при герпесвирусной инфекции у беременных
В ткани плаценты с помощью флюоресцирующих моноклональных антител выявлялись антигены вируса простого герпеса 1-го и 2-го типа. Причем 1-й тип у 15%, 2-й у 40%, сочетание 1-го и 2-го типов у 45%. Светооптически в плаценте пораженных только вирусом простого герпеса 1-го или 2-го типа, изменения идентичны. Характерным является наличие ограниченного продуктивного очагового воспаления с вовлечением в патологический процесс плодовой и материнской частей плаценты. При этом в эпителии амниона, синцитиотрофобласте, эндотелии сосудов, клетках базальной пластинки и септ выявляются гигантские одноядерные клетки с крупными гиперхромными ядрами, содержащими базофильное включение. Последние отделены от кариолеммы полоской просветления и содержат антиген вируса простого герпеса. Часть клеток эпителия амниона и трофобласта претерпевает некротические изменения. Во всех случаях наблюдаются распространенные поражения стенок сосудов ворсин в виде очагового эндоваскулита, иногда с некрозом части внутренней выстилки и формированием тромбов. Интервиллезит встречается нечасто и носит очаговый характер. Более типичными являются кровоизлияния или очаги тромбоза в межворсинчатом пространстве. Базальный децидуит различной степени выраженности имеется во всех наблюдениях. Некротические изменения встречаются как в отдельных клетках, так и в виде очагов. Постоянно выявляются участки склероза, диффузные отложения солей кальция, фибриноида в ворсинах и базальной пластинке.
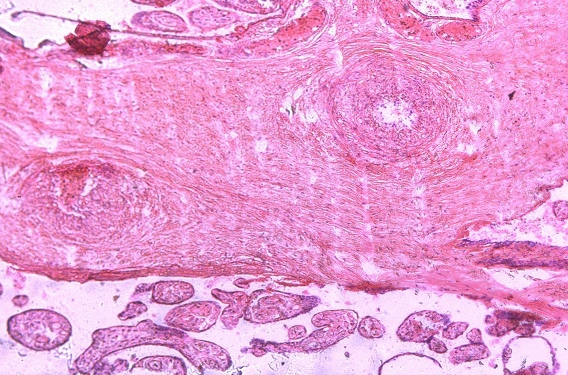
Рис. 2. Отложение фибриноида в прилежащем межворсинчатом пространстве
Изменения в плаценте во многом зависят от времени возникновения рецидивов и их количества. Степень деструкции более выражена у пациенток, имевших 4 рецидива и более.
Обострение заболевания в 1 и II триместрах беременности морфологически манифестируется фибропластическими изменениями. В сосудах стволовых, зрелых промежуточных и терминальных ворсин имеются проявления продуктивного васкулита, с фиброзом стенок, облитерацией и стенозом просвета отдельных из них. Хориальная пластинка выглядит утолщенной, интенсивно окрашивается фуксилином по Ван-Гизону. Плодные оболочки отечны, эпителий их местами утолщен, образует несколько рядов. Воспалительные изменения носят очаговый характер. Морфометрически установлено, что количество бессосудистых терминальных ворсин составляет 15,3±0,62%; 46,0±3,24% содержат 1-2 капилляра, 24,8±0,96% - 3-5 капилляров, 9,4±0,86% - 10 капилляров, 4,5±0,11% - более 10 капилляров. При наличии низкого коэффициента плотности расположения ворсин (2,35±0.4) дети рождаются с нормальной массой тела, что свидетельствует о компенсированной трофической функции плаценты. Уменьшение объема материнской крови в межворсинчатом пространстве (коэффициент 4,7±0,24) сопровождается гипотрофией плода.
Возникновение рецидивов герпетической инфекции в III триместре беременности сочетается с альтеративными процессами в структурах последа. В базальной пластинке, септах, крупных и мелких ворсинах, амнионе, гладком хорионе обнаруживаются резко выраженные дистрофические изменения, некробиоз, очаги фибриноидного некроза. При этом имеется лимфоидно-плазмоцитарная и лимфоидно-макрофагальная воспалительная реакция, нередко с гигантоклеточным метаморфозом и очаговыми кровоизлияниями.
При этом микроскопически в амнионе и пуповине определяются банальная флора (кокки, палочки и др.), париетальный хориоамнионит и париетальный децидуит. Воспалительный инфильтрат содержит преимущественно полиморфноядерные лейкоциты. Фуникулит сопровождается воспалительной инфильтрацией стенок пупочной вены (лишь в одном наблюдении имелась нерезко выраженная воспалительная инфильтрация стенки одной из пупочных артерий). Значительные изменения имеются в сосудах ворсин различного калибра. Продуктивное или смешанное экссудативно-продуктивное воспаление в стенках сочетается со стенозированием их просвета, крайне редко с облитерацией. В межворсинчатом пространстве воспалительные изменения носят ограниченный очаговый характер и представлены скудной лимфоидно-плазмоцитарной инфильтрацией, наличием нитей фибрина. В ворсинах имеются отложения солей кальция, выявляется железо. В 10 наблюдениях констатированы очаговые кровоизлияния в межворсинчатом пространстве. Морфометрически установлено, что количество бессосудистых терминальных ворсин составляет 13,8+0,3%; 37,2±1,22% содержат 1-2 капилляра, 24,0±1,1% - 3-5 капилляров, 7,6±0,31% - 6-10 капилляров.
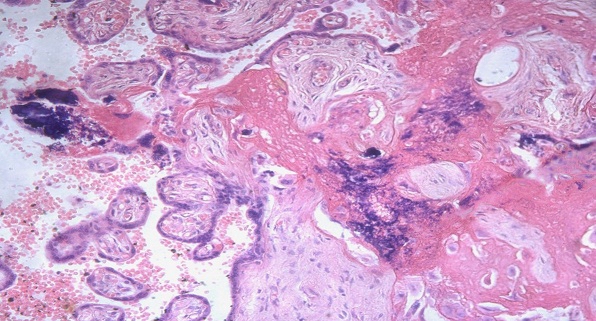
Рис. 3. Некроз и лимфоидная инфильтрация стромы базальной пластины у беременных с герпесвирусной инфекцией
Наряду с описанными изменениями, характеризирующими нарушение созревания плаценты, ее повреждение и воспаление, имеют место различной степени выраженности компенсаторно-приспособительные процессы. Последние определяются степенью васкуляризации ворсин, зависящей от времени возникновения рецидива, наличием функционирующих синцитиальных узелков и количеством циркулирующей материнской крови в межворсинчатом пространстве. Функционирующие синцитиальные узелки, отражающие пролиферативные возможности трофобласта, имеются во всех случаях. Они представляют собой скопление базофильных, тесно прилежащих друг к другу ядер. Нередко эти структуры образуют "мостики", связывающие между собой терминальные ворсины и поддерживающие их внутреннее взаиморасположение. При морфологическом исследовании плацент детей, родившихся в удовлетворительном состоянии и массой тела более 3000 г., выявлены, наряду с нарушением их созревания, повреждением и воспалением, хорошо развитые компенсаторно-приспособительные процессы, основная масса терминальных ворсин была хорошо васкуляризирована. Морфометрически установлено, что 0,95% терминальных ворсин были бессосудистыми, 1,4% ворсин содержали 1-2 капилляра, 2,4% - 3-5 капилляров, 1,1%- 6-10 капилляров и 0,94% - более 10 капилляров. Это свидетельствовало о значительной гиперваскуляризации терминальных ворсин, что обеспечило хорошее внутри-утробное развитие плода. Хорошо была представлена пролиферация синцитиотрофобласта с образованием синцитиальных почек и синцитиальных мостиков. Описанные изменения указывали на наличие компенсированной формы относительной плацентарной недостаточности.
При морфологическом исследовании последов детей, родившихся с явлениями гипотрофии, наряду с характерными изменениями и различной степени выраженности компенсаторно-приспособительными реакциями, имелось явная редукция сосудистого русла ворсинчатого хориона. Это сочеталось с повышением коэффициента плотности ворсин, который составил 4,09±0,06 и, как следствие этого, объем материнской крови в межворсинчатом пространстве был уменьшен. Эти изменения соответствовали относительно субкомпенсированной форме плацентарной недостаточности.
При морфологическом исследовании плаценты после самопроизвольного выкидыша наряду с выраженными альтернативными и воспалительными изменениями отмечалась резкая задержка развития ворсинчатого хориона, выраженный продуктивный васкулит, что сочеталось со слабовыраженными компенсаторно-приспособительными процессами и свидетельствовало о тяжелом герпетическом поражении плаценты с явлениями декомпенсированной формы хронической плацентарной недостаточности.
Заключение. Генитальная герпетическая инфекция приводит к развитию хронической плацентарной недостаточности, степень тяжести которой зависит от времени, частоты и длительности рецидивов заболевания. Изменения в плаценте характеризуются наличием как деструктивных, так и компенсаторных процессов, степень сохранности которых определяет дальнейшее развитие и состояние плода.
Беременных с данной патологией следует отнести к группе высокого риска по возможности развития плацентарной недостаточности. В план обследования пациенток с данной патологией должны быть включены современные методы диагностики состояния фетоплацентарного комплекса и морфологическое исследование последа. Выявленные морфологические изменения последа позволяют своевременно начать патогенетически обоснованную терапию новорожденных, что способствует снижению частоты тяжелых форм неонатального герпеса.
Список использованных источников:
1. Каримова Ф.Д., Раджабова З.А. Современные аспекты патогенеза, диагностики и лечения герпесвирусной инфекции. Метод. пособие. 2008 - С. 1-13.
2. Андриевская И.А. Состояние стероидогенеза в системе мать плацента плод при обострении герпесной инфекции// Бюл. физиол. и патол. дыхания. - 2004. - Вып. 17. - С. 65-68.
3. Довжикова И.В. Гистохимическая характеристика этапов синтеза холестерина в плаценте беременных, перенесших обострение герпесвирусной инфекции// Бюл. физиол. и патол. дыхания. - 2008. - Вып. 28. - С. 17-20.
4. Сухих Г.Л., Ванько Л.В. Иммунология беременности. - М: РАМН, 2003; 400 с.
5. Brown Z. Preventing herpes simplex virus transmission to the neonate// Herpes. - 2004; 11; 3: 175-186.
6. Gerber S., Hohlfeld P. Screening for infectious diseases// Childs Nerv Syst - 2003; 19: 7-8: 429-432.
Цель исследования. Изучение особенностей состояния фетоплацентарного комплекса при различных вариантах нарушений формирования ворсинчатого дерева.
Материал и методы. Обследовано 119 беременных. 1‑я группа (контроль) — 33 женщины с нормальным строением ворсинчатого дерева; 2‑я группа — 43 наблюдения с патологией формирования терминальных ворсин (подгруппа 2А — 27 пациенток с дефицитом терминальных ворсин при относительно нормальном развитии стромы и сосудов, подгруппа 2Б — 16 наблюдений с выраженным склерозом стромы и редукцией сосудов); 3‑я группа — 43 женщины с незрелостью ворсинчатого дерева (подгруппа 3А — 30 наблюдений с преобладанием дифференцированных промежуточных ворсин, подгруппа 3Б — 13 пациенток с преобладанием недифференцированных промежуточных ворсин). Проводили сравнительный анализ результатов ультразвукового исследования, допплерометрии и кардиотокографии.
Результаты исследования. Не выявлено статистически достоверных различий показателей контрольной группы и групп сравнения при оценке степени зрелости и толщины плаценты, количества околоплодных вод, кровотока в маточной артерии, средней мозговой артерии и аорте плода, а также при проведении кардиотокографии в III триместре. Обнаружено статистически достоверное снижение кровотока в артерии пуповины у женщин с преобладанием недифференцированных промежуточных ворсин.
Ключевой проблемой современного акушерства и неонатологии является плацентарная недостаточность — клинический синдром, обусловленный морфологическими и функциональными изменениями в плаценте и проявляющийся нарушением роста и развития плода, его гипоксией, которые возникают в результате сочетанной реакции плода и плаценты на различные нарушения состояния беременной [2, 4, 6]. В течение беременности взаимоотношения материнского организма и развивающегося зародыша опосредованы сложной системой мать-плацента-плод, все звенья которой тесно взаимосвязаны и в совокупности определяют нормальные рост и развитие плода [5, 10, 16]. Нарушение любого из звеньев данной системы может неблагоприятно отразиться на состоянии плода. При изучении проблемы плацентарной недостаточности как клиницисты, так и морфологи традиционно главное внимание уделяют изучению показателей маточного кровотока, который определяет поступление кислорода и питательных веществ от матери к плаценте, и изменениям в ней, непосредственно связанным с нарушениями материнского кровотока. В то же время следует понимать, что полноценное снабжение плода необходимыми субстанциями зависит не только от их поступления с кровью матери, но не в меньшей степени и от способности самой плаценты к адекватному транспорту этих веществ [1, 3, 9, 12].
В последние десятилетия внимание ученых стало привлекать изучение клинической значимости другого звена материнско-плацентарно-плодового кровотока — ворсинчатого дерева, содержащего фетальные кровеносные сосуды. Известно, что способность различных типов ворсин к транспорту
кислорода и питательных веществ существенно различается. В связи с этим очевидно, что нарушения формирования ворсинчатого дерева могут сопровождаться такими проявлениями плацентарной недостаточности, как внутриутробная гипоксия, задержка развития плода и др. [7, 8, 11].
Целью настоящего исследования явилось изучение особенностей состояния фетоплацентарного комплекса при различных вариантах нарушений формирования ворсинчатого дерева.
Материал и методы исследования
Проведено комплексное изучение основных показателей функции фетоплацентарной системы и вариантов строения ворсинчатого дерева, установленного на основании морфологического исследования последа у 119 беременных. Пациентки были разделены на следующие группы. 1-ю группу (контроль) составили 33 женщины, у которых строение ворсинчатого дерева соответствовало норме. Во 2-ю группу были включены 43 женщины с патологией формирования терминальных ворсин (подгруппа 2А — 27 пациенток, в плацентах которых отмечался дефицит терминальных ворсин при относительно нормальном развитии стромы и сосудов, подгруппа 2Б — 16 пациенток с выраженным склерозом стромы и редукцией сосудов — вариант хаотичных склерозированных ворсин).
В 3-ю группу вошли 43 женщины, в плацентах которых диагностирована незрелость ворсинчатого дерева (подгруппа 3А — 30 пациенток с преобладанием дифференцированных промежуточных ворсин, подгруппа 3Б — 13 пациенток с преобладанием недифференцированных промежуточных ворсин).
Необходимо подчеркнуть, что морфологическое исследование плаценты проводилось при сроке беременности более 37 нед, так как на более ранних сроках определение степени зрелости ворсинчатого дерева может быть неточным. Исследование последов проводили по методике, описанной А.П. Миловановым [5]. При макроскопическом исследовании оценивали форму плаценты, наличие по ее краю ободка или вали-ка, место прикрепления пуповины, количество и состояние сосудов в пуповине. Изучали состояние хориональной пластинки, отмечали наличие массивного отложения фибриноида, наличие гематом или кист. При исследовании материнской поверхности плаценты оценивали целостность ее ткани, наличие патологических очагов в паренхиме. Для гистологического исследования брали 6-8 кусочков плаценты из центральной и парацентральной зон. Фиксацию, проводку и приготовление парафиновых срезов проводили по общепринятой методике. Использовали окраску гематоксилином и эозином, пикрофуксином по Ван-Гизону, реактивом Шиффа. Степень васкуляризации определяли в промежуточных и термин.
Аномалии плаценты – это нарушения нормальной локализации, прикрепления или формы последа. Могут протекать бессимптомно, характеризоваться признаками фетоплацентарной недостаточности со второго триместра беременности, проявляться угрозой преждевременных родов или кровотечением. Диагностика проводится по данным УЗИ, фетометрии и кардиотокографии плода. Специфическое лечение не разработано. Терапия направлена на поддержание кровотока, устранение признаков гипоксии и пролонгирование беременности. По показаниям после родов проводится ручное отделение плаценты, гистерэктомия.
МКБ-10

Общие сведения
Аномалии плаценты встречаются с различной частотой. Низкая плацентация, предлежание плаценты в третьем триместре наблюдается у 3% беременных. Плотное прикрепление последа, приращение к миометрию чаще встречается у беременных с рубцами на матке, перенесших большое количество абортов и выскабливаний, с высоким паритетом родов. За последние десятилетия отмечается увеличение количества приращений последа в 50 раз, что связывают с ростом показаний для кесарева сечения. Аномалии плаценты ведут к повышению частоты кровотечений в последовом и послеродовом периоде, осложнениям со стороны плода.

Причины
Аномалии плаценты возникают как результат компенсаторно-приспособительных реакций при патологических состояниях эндометрия и миометрия. Врастание, низкая плацентация и изменение формы происходят по одним и тем же причинам. Чаще всего развитие аномалии наблюдается при наличии следующих предрасполагающих факторов:
- Патология эндометрия. Воспалительные заболевания в анамнезе, частые аборты потенцируют дистрофические изменения слизистой оболочки, нарушение рецептивных свойств эндометрия. Бластоциста в поиске оптимального места имплантации может спуститься из дна матки в нижний сегмент, а плацента – плотно прикрепиться.
- Дистрофические изменения в матке. При миоме отмечаются нарушения кровотока, провоцирующие глубокое проникновение ворсин хориона. У женщин после кесарева сечения в месте рубца образуется неполноценный базальный слой слизистой, что приводит к глубокому врастанию плаценты. Если из-за недостатка питания происходит гибель части ворсин хориона, формируется двудолевой послед.
- Чрезмерная активность хориона. Глубокое врастание ворсин связывают с выделением зародышем большого количества хорионического гонадотропина. Повышение уровня гормона в первом триместре может быть связано с хромосомными аномалиями плода, в норме наблюдается при беременности двойней.
- Гормональные нарушения. Рост ворсин хориона сдерживается эстрогенами. При гормональной недостаточности происходит их врастание в мышечный слой матки и формирование приращения плаценты.
- Kiss1-ген. Открыт в 1999 году, выявляется во многих злокачественных опухолях, а также клетках синцитиотрофобласта. Ген стимулирует глубокую инвазию клеток синцитио- и цитотрофобласта в миометрий. Активность гена возрастает при использовании прогестагенов для сохранения беременности на ранних сроках.
Патогенез
Аномалии плаценты являются результатам патологий матки, возникших до наступления беременности. Воспалительные процессы и дистрофические изменения приводят к недостаточной васкуляризации отдельных участков децидуальной оболочки. Это вызывает гибель некоторых ворсин хориона на раннем сроке вынашивания. Формируются участки истончения плаценты и различные дефекты. При полной гибели ворсинчатого хориона образуются очаги без плацентарной ткани (окончатая плацента). При наличии уходящих в сторону сосудов выявляется добавочная долька, которая располагается на отдалении от края детского места.
В маточном дне кровоток усилен за счет ветвей яичниковой артерии. Но в случаях, когда бластоциста имплантируется в нижнем сегменте, она испытывает дефицит кровоснабжения, что потенцирует глубокую инвазию ворсин хориона в миометрий, поэтому низкая плацентация может сопровождаться врастанием плаценты. Иногда предлежание связано с чрезмерным увеличением размеров последа при многоплодной беременности. При гистологическом исследовании отмечаются преждевременные инволюционно-атрофические изменения, вызванные недостаточным кровотоком и перерастяжением нижнего сегмента.
Классификация
Единая классификация аномалий последа не разработана. Патологию условно разделяют на три типа, которые связаны между собой патогенетически. Из-за общего механизма развития различные аномалии могут сочетаться, что ухудшает прогноз и течение беременности. Специалисты в сфере акушерства выделяют следующие варианты аномалий плаценты:
- Нарушения локализации. Включают низкую плацентацию и предлежание плаценты. Полное предлежание диагностируется в 12 недель, практически не устраняется самостоятельно. Низкая плацентация к 3 триместру может сменяться нормальным прикреплением из-за увеличения объема матки и миграции плаценты.
- Аномалии прикрепления. Различают плотное прикрепление и приращение плаценты. Редко наблюдается сквозное прорастание с инвазией хориона в соседние органы. Также оно может быть диффузным (от стенки матки не отделяется все плодное место) или очаговым (врастание происходит на определенном участке).
- Аномалии формы. Плацента, состоящая из двух частей, называется двудолевой. При избыточном истончении диагностируется пленчатый тип. Поясной вид характеризуется образованием по краю плодного места вала, который является участком круговой отслойки или воспаления с отложением гиалина.
Симптомы аномалии плаценты
Данное состояние не всегда сопровождается клиническими симптомами. При двудолевой и окончатой разновидности плодного места, а также добавочной дольке признаки патологии во время беременности отсутствуют, сложности возникают в родах. Добавочная долька может отрываться и сохраняться в полости матки. Определяется гипотония, осложняющаяся кровотечением в раннем послеродовом периоде. Кровотечение в третьем периоде родов развивается при плотном прикреплении плаценты. Признаки отделения последа отсутствуют, а приемы, ускоряющие этот процесс, оказываются неэффективными.
Низкая плацентация сопровождается симптомами угрозы прерывания. Женщина периодически ощущает тянущие боли внизу живота, повышается тонус матки. При полном предлежании со 2 триместра наблюдаются периодические мажущие, иногда умеренные кровянистые выделения из влагалища. Опасность представляет массивное кровотечение, которое быстро приводит к острой гипоксии плода и геморрагическому шоку у беременной.
Осложнения
Патологии последа иногда провоцируют развитие плацентарной недостаточности и хроническую гипоксию плода. Ребенок отстает в росте, рождается с низким весом, хуже переносит период адаптации. Кровотечение при предлежании плаценты может начаться на любом сроке беременности. При несвоевременной помощи оно становится причиной внутриутробной гибели плода, а у матери возникает геморрагический шок и ДВС-синдром. Иногда аномалии прикрепления становятся показанием для экстирпации матки.
Диагностика
Скрининговое УЗИ-обследование проводится в 11 недель беременности, методика позволяет выявить первые признаки аномалии. Результаты повторного обязательного исследования в 21 и 32-34 недели указывают на прогрессирование патологии или уменьшение ее проявлений. Диагностика состояния проводится акушером-гинекологом и базируется на данных следующих методов:
- Физикальный осмотр. При фетоплацентарной дисфункции может определяться несоответствие размера живота сроку гестации. На предлежание плаценты указывает мягкая губчатая ткань над цервиксом. При осмотре в зеркалах могут обнаруживаться сгустки крови или жидкие выделения, которые являются признаком кровотечения.
- УЗИ матки. Патологическое расположение диагностируется уже в конце 1 триместра, но подтверждается только при последнем исследовании в 3 триместре. На полное предлежание указывает расположение последа сразу над внутренним зевом шейки. Нарушения прикрепления определяются по аномальному лакунарному кровотоку в толще миометрия.
- Фетометрия плода. Исследуется размер частей тела плода при помощи УЗИ. Недостаточность фетоплацентарного комплекса проявляется в отставании длины бедренной кости, плеча, копчико-теменного размера и головы. Может уменьшаться окружность живота. Параметры могут уменьшаться равномерно (симметричный тип задержки развития) или неравномерно (асимметричный тип).
- Кардиотокография. Оценивается сердечный ритм плода, его изменения при шевелении, маточных сокращениях. При хронической гипоксии снижается базальный ритм, количество акцелераций, увеличивается число децелераций, становится низкой вариабельность. Тяжесть гипоксии оценивается по балльной системе.
Лечение аномалии плаценты
Повлиять на аномалии локализации, формы или прикрепления медикаментозными или другими способами невозможно, поэтому лечение направлено на пролонгирование беременности, выбор оптимального срока и метода родоразрешения. Необходимо обеспечить улучшение питания плода и минимизировать последствия гипоксии. Аномалии прикрепления требуют экстренной хирургической помощи.
Консервативная терапия
При патологической локализации, выявленной на первом скрининговом УЗИ, применяются медикаментозные средства, улучшающие плацентарный кровоток. При повышении тонуса матки проводится токолитическая терапия раствором магнезии, назначается курс витамина В6 в сочетании с магнием. Мажущие выделения из половых путей при предлежании детского места являются показанием для экстренной госпитализации в отделение патологии беременных.
Консервативная терапия после родов может применяться при приращении последа, которое не удалось устранить ручным способом. Обязательным условием для медикаментозного лечения является отсутствие кровотечения. Используют цитостатики из группы антиметаболитов и ингибиторов фолиевой кислоты. Лекарственные средства вызывают самостоятельную резорбцию последа и позволяют сохранить матку, но не влияют на показатели гемостаза.
Хирургическое лечение
Хирургическая помощь необходима при таких аномалиях, как кровотечение, вызванное предлежанием плаценты, плотное прикрепление или истинное приращение, гипотоническое кровотечение при добавочной дольке. Предлежание, сопровождающееся кровотечением, является показанием для экстренного кесарева сечения вне зависимости от срока гестации. В остальных случаях применяются следующие методы:
- Ручное отделение последа. Используется при отсутствии признаков самостоятельного отделения, а также при гипотонии матки и кровотечении в последнем периоде родов. Манипуляция проводится под общей анестезией в родовом зале в присутствии анестезиолога-реаниматолога.
- Оперативное удаление плаценты. После предварительного лигирования сосудов матки, эмболизации маточных артерий или наложения компрессионных швов на матку плацента отделяется от стенки. Деваскуляризация матки позволяет избежать массивного кровотечения.
- Гистерэктомия. При неудачных попытках отделения последа с аномалиями прикрепления и продолжающемся кровотечении решается вопрос об удалении матки с сохранением придатков. Вмешательство проводится под эндотрахеальным наркозом.
Прогноз и профилактика
Аномалии формы детского места редко ухудшают прогноз течения беременности, иногда диагностируются случайно после родов. При аномалии прикрепления необходимо врачебное наблюдение для предупреждения осложнений. Профилактика заключается в отказе от абортов или использовании медикаментозных способов прерывания беременности. Женщинам рекомендуется применять барьерные методы контрацепции для защиты от инфекций, своевременно лечить воспаление половых органов. Кесарево сечение следует проводить строго по показаниям.
1. Акушерство. Национальное руководство/ Ппод ред. Айламазяна Э.К., Кулакова В.И., Радзинского В.Е., Савельевой Г.М. - 2009.
2. Морфологическая классификация повреждений плаценты/ Веропотвелян Н.П., Веропотвелян П.Н., Цехмистренко И.С., Бондаренко А.А., Усенко Т.В.// Здоровье женщины. – 2016 - №8 (114).
4. Диагностика, профилактика и органосохраняющие методы родоразрешения беременных с врастанием плаценты/ Хасанов А.А.// Казанский медицинский журнал. - 2016.
В статье представлены данные о метаболическом синдроме и его главных составляющих. Совокупность гормональных и метаболических изменений, которые происходят в связи со снижением чувствительности периферических тканей к инсулину, что характерно для метаболического синдрома, является составляющим звеном в развитии патологии сердечно-сосудистой, репродуктивной и других систем. Особое внимание уделено изучению патофизиологических основ формирования тромбофилии у пациенток с метаболическим синдромом. Представлены данные о вкладе в развитие тромбофилии как генетически запрограммированных факторов, так и приобретенных. Изучена роль полиморфизма гена ингибитора активации плазминогена первого типа (PAI-1). Выделено значение наличия генотипа 4G/4G у пациенток, что подразумевает связывание только активаторов с 4G и, соответственно, большую вероятность развития тромбоза спиральных артерий и гестоза. Подчеркнута стойкая корреляционная связь между избыточной массой тела, ожирением и развитием преэклампсии у женщин. Высокий индекс массы тела человека ухудшает прогноз течения преэклампсии у беременной, также в данной ситуации повышается риск развития осложнений. Ожирение, являясь одним из главенствующих факторов развития метаболического синдрома, словно пандемия распространяется по всему миру, поражая людей всех этнических групп и возрастов, включая женщин репродуктивного периода, в связи с чем изучение синдрома X и сопутствующих ему осложнений чрезвычайно важно.

3. Meenakshi S.R., Sharma N.R. Obstetric Behavior and Pregnancy Outcome in Overweight and Obese Women. The Journal of Obstetrics and Gynecology of India. 2012. V. 62 (3). Р. 276–280.
4. Дедов И.И., Мельниченко Г.А. Ожирение: этиология, патогенез, клинические аспекты. М., 2004. С. 216–232.
5. Walsh J.M., McGowan C.A., Byrne J.A., Rath A., McAuliffe F.M. The association between TNF-a and insulin resistance in euglycemic women. Cytokine. 2013. V. 64 (1). Р. 208–212.
6. Петров Ю.А. Гистероскопическая характеристика эндометрия женщин с ранними репродуктивными потерями // Вестник Российского университета дружбы народов. Серия: Медицина. 2011. № 55. С. 243–247.
7. Серов В.Н., Прилепская В.Н., Овсянникова Т.В. Гинекологическая эндокринология. М.: МЕДпресс-информ, 2012. С. 279–326.
8. Петров Ю.А. Роль иммунных нарушений в генезе хронического эндометрита // Вестник Российского университета дружбы народов. Серия: Медицина. 2011. № 6. С. 282.
9. Передеряева Е.Б. Роль тромбофилии в патогенезе осложнений беременности у женщин с метаболическим синдромом // Практическая медицина. 2013. № 7 (76). С. 32–41.
10. Бицадзе В.О., Макацария А.Д., Хизроева Д.Х. Тромбофилия как важнейшее звено патогенеза осложнений беременности // Практическая медицина. 2012. № 5. С. 22–29.
11. Савельева И.В. Клиническое течение беременности при метаболическом синдроме // Омский научный вестник. 2012. № 1 (108). С. 56–59.
12. Пшеничникова Т.Б., Передеряева Е.Б., Донина Е.В., Гадаева З.К. Место тромбофилии в структуре синдрома потери плода у женщин с метаболическим синдромом // Акушерство, гинекология и репродукция. 2013. № 4. С. 35–43.
13. Хромылев А.В., Макацария А.Д. Структура генетических полиморфизмов у родильниц с метаболическим синдромом и осложненным течением беременности в анамнезе // Акушерство, гинекология и репродукция. 2016. № 3. С. 35–40.
14. Хромылев А.В. Патогенетические аспекты атеротромботического риска при ожирении и тромбофилии // Акушерство, гинекология и репродукция. 2015. № 3. С. 45–52.
15. Samad F. Elevated PAI-1 and tissue factor gene expression in obese mice: a possible mechanism for the increased risk for cardiovascular disease associated with obesity. Fibrinol. Proteol. 1997. V. 11. Р. 17.
16. Рудакова Е.Б., Пилипенко М.А. Роль антифосфолипидного синдрома и врожденной гематогенной тромбофилии в структуре репродуктивных потерь // ОНВ. 2009. № 1 (84). С. 32.
17. Петров Ю.А., Байкулова Т.Ю. Современные представления о проблемы искусственного прерывания беременности (обзор литературы) // Международный журнал прикладных и фундаментальных исследований. 2016. № 8–5. С. 727–731.
19. Кан Н.И., Федорина Т.А., Николаева-Балл Д.Р., Ванина Л.Н. Функциональное состояние фетоплацентарного комплекса у беременных с ожирением и метаболическим синдромом // Ульяновский медико-биологический журнал. 2017. № 3. С. 71–81.
20. Ганчар Е.П., Кажина М.В. Метаболический синдром и беременность // Охрана материнства и детства. 2013. № 2 (22). С. 76–77.
22. Воднева Д.Н., Шмаков Р.Г., Щеголев А.И. Роль маркеров инвазии трофобласта в развитии преэклампсии и опухолевой прогрессии // Акуш. и гинекология. 2013. № 11. С. 9.
23. Трошина Е.А., Покусаева В.Н., Андреева В.Н. Ожирение у женщин / Под ред. Г.А. Мельниченко, Н.К. Никифоровского. М.: МИА, 2017. 272 с.
24. Папышева О.В., Котайш Г.А., Оразмурадов А.А. Осложнения беременности у женщин с метаболическим синдромом // Акушерство и гинекология. 2018. № 3 (21). С. 18–22.
25. Петров Ю.А. Специфика репродуктивного и контрацептивного поведения студентов медицинского университета // Валеология. 2016. № 2. С. 31–34.
26. Stekkinger E., Scholten R., van der Vlugt M. Metabolic syndrome and the risk for recurrent pre-eclampsia: a retrospective cohort study. BJOG. 2013. V. 120 (8). Р. 979–986.
27. Передеряева Е.Б., Пшеничникова Т.Б., Андреева М.Д., Макацария А.Д. Патогенетические механизмы развития преэклампсии у женщин с метаболическим синдромом // Акушерство, гинекология и репродукция. 2015. № 3. С. 54–65.
Неинфекционная эпидемия под эгидой метаболического синдрома, также известного как синдром X, или синдром резистентности к инсулину, охватывает около 30 % населения планеты. Данные показатели включают женщин репродуктивного возраста, в связи с чем изучение патогенетических основ, диагностики, методов лечения метаболического синдрома и сопутствующих ему осложнений, таких как тромбофилия, становится особенно актуальным [1, 2].
Цель работы: провести анализ литературы и изучить особенности течения беременности у женщин с метаболическим синдромом, осложненным тромбофилией.
Метаболический синдром (МС) – это многофакторное, полиэтиологическое понятие, включающее в себя: висцеральное ожирение, резистентность к инсулину, нарушение толерантности к глюкозе, дислипилемию, гиперинсулинемию, нарушение гемостаза, артериальную гипертензию и ряд других факторов [3, 4].
Синдром Х нередко осложнен тромбофилией, которая в свою очередь проявляется в виде состояния, характеризующегося нарушением системы свертываемости крови с увеличением риска развития тромбоза. Тромбофилия при МС может быть генетически запрограммированной, опосредованной приобретенным увеличением уровня PAI-1 и приобретенной (АФА/АФС). Приобретенная тромбофилия у женщин с МС и антифосфолипидным синдромом (АФС) опосредована каскадом аутоиммунных реакций к фосфолипидам мембран клеток. Антифосфолипидные антитела (АФА) участвуют в увеличении протромботического эффекта путем повышения PAI-1 и TF или являются непосредственным фактором тромбоза. АФА одного и того же типа увеличивают риск развития тромбоза в 1,5 раза, а циркуляция нескольких типов АФА – в 1,7 раза за каждый дополнительный тип АФА. Часто при обследовании пациенток удается определить мультифакторность в формировании тромбофилии.
Особое внимание стоит уделить вопросу гипергомоцистеинемии у пациенток с МС. Для нормальной регуляции работы фолатного цикла необходимо поддержание должной концентрации фолиевой кислоты, цианокобаламина, а их нехватка или генетические мутации могут привести к нарушению переноса метильных групп на гомоцистеин с участием фермента метилтетрагидрофолатредуктазы с нарушением образования метионина и накоплением в крови гомоцистеина. Так, мутация MTHFR С677T широко распространена на территории Российской Федерации. Повышение концентрации гомоцистеина влечет за собой образование свободных радикалов и активацию перекисного окисления липидов (ПОЛ), формируется оксидативный стресс с последующим повреждением эндотелия, формированием атероза и тромбоза – происходят микроциркуляторные нарушения. В ходе ПОЛ окисленные липиды становятся антигенными мишенями для АФА, что усиливает процессы альтерации стенки сосудов и тромбообразования.
Довольно часто у беременных с МС встречают генетически запрограммированный полиморфизм генов PAI-1. PAI-1 – это представитель рода серпинов, ингибитор активации плазминогена первого типа, главный антагонист тканевого активатора плазминогена, депо которого находится в тромбоцитах в неактивном состоянии. PAI-1 участвует в реакциях разрушения фибрина, синтезируется эндотелиоцитами, клетками жировой ткани, гепатоцитами, мегакариоцитами и др. Основная функция ингибитора активации плазминогена первого типа состоит в ограничении фибринолитической активности, однако концентрация PAI-1 может быть повышена, тогда происходит нарушение соотношения работы системы свертывания и противосвертывания, в результате повышается риск тромбообразования.
Повышение концентрации PAI-1 может быть как генетически обусловлено полиморфизмом генов, так и индуцировано приобретенным повышением (в связи с дислипидемией, персистирующими реакциями воспаления, ожирением) [7–9].
Ген PAI-1 находится на длинном плече 7-й хромосомы, его полиморфизм был найден в промоторной зоне и известен как 4G/5G. Суть данного полиморфизма состоит в принципе инсерции/делеции. Так, промоторная часть гена PAI-1 может содержать либо 4 гуаниновых основания, либо 5. Так как у человека имеются по 2 экземпляра каждого гена, то возможны 3 комбинации: 4G/4G; 5G/4G; 5G/5G. Существуют различия в функционировании этих генов: так, с 5G могут связываться как активаторы, так и супрессоры, поэтому его активность легко подавляется. А с геном 4G может связаться только активатор, в связи с чем у носительниц генотипа 4G/4G риск развития тромбоза спиральных артерий и развития гестоза в два раза выше, чем у носительниц 5G/4G, а у носительниц 5G/4G в два раза выше по сравнению с носительницами 5G/5G.
Индуктором приобретенного синтеза PAI-1 является ФНО-a, поэтому риск развития тромбоза у пациенток с МС и наличием полиморфизма очень высок [10].
В процессе подготовки к имплантации происходят изменения в соотношениях между активаторами плазминогена и ингибиторами в пользу PAI-1, тканевого фактора [11–13]. Эти изменения необходимы с целью предотвращения возможных геморрагий при инвазии трофобласта. Бластоциста синтезирует активаторы плазминогена тканевого и урокиназного типа, которые необходимы для постепенного разрушения внеклеточного матрикса во время имплантации.
В условиях гипофибринолиза, обусловленного полиморфизмом PAI-1, происходит нарушение соотношения между системами фибринолиза и фибринообразования. Независимо от этого дополнительное действие АПФ, который в свою очередь ингибирует выработку брадикинина, ответственного за образование NO и активатора плазминогена, обеспечивает переход ангиотензина-I в ангиотензин-II, который дополнительно повышает уровень PAI-1 [14]. Ангиотензин-II может переходить в ангиотензин-IV, который также повышает PAI-1 и снижает уровень NO. Концентрации протеаз для внедрения на нужную глубину недостаточно.
Усугубляет ситуацию возможная циркуляция АФА, которые могут изменять заряд плодного яйца и усиливать протромботические механизмы, также антифосфолипидные антитела в присутствии бэта-2 гликопротеина нарушают местную антикоагулянтную активность аннексина V [15]. При циркуляции АФА IgG в кровотоке матери способны проникать через поры трофобласта после 15-й недели беременности и оказывать прямое повреждающее действие на плод. Дефект имплантации плодного яйца, недостаточная глубина инвазии трофобласта, нарушение плацентации – все это в итоге приводит к гипоперфузии плаценты с нарушением метаболизма и транспорта питательных веществ, из-за которых развивается гипоксия плода. В дальнейшем возможны формирование полного блока микроциркуляции, преждевременная отслойка нормально расположенной плаценты или антенатальная гибель плода [15, 16].
Стоит учитывать особенности функционирования фетоплацентарного барьера у беременных с различными типами ожирения. Так, по данным исследования, которое включало в себя пациенток с нейроэндокринным ожирением, абдоминально-конституциональным ожирением, МС и без МС, ученые обнаружили, что наиболее часто встречаемым осложнением является развитие хронической плацентарной недостаточности и гипоксии плода. В плацентах превалировали нарушения циркуляции, которые были обусловлены нарушением кровотока и отеком тканей, склероз.
При проведении доплерометрических исследований было выявлено, что бипариетальные размеры плода были ниже 50 перцентилей, что соответствует гипотрофии. Диаметр груди и живота увеличивался при нейроэндокринной форме ожирения у женщин. При остальных формах с 17-й по 25-ю неделю беременности диаметр груди и живота отставал от средних популяционных значений (25–50 П).
Значительный объем реологических нарушений при относительно слабой выраженности компенсаторного ангиоматоза в терминальных ворсинах указывает на тяжелую степень вторичной плацентарной недостаточности, оцениваемой в 2,3 балла (по 5-балльной шкале).
Плаценты с признаками угнетения синтеза плацентарных гормонов наблюдали у 67,9 % женщин с АКО с ранних сроков гестации в сочетании с гипотрофией плода в 72 % случаев.
Плаценты имели признаки нарушения созревания ворсинчатого дерева со слабой васкуляризацией, нарушения развития котиледонов и другие дефекты плацентации. Обнаружены крупные участки микропатологии на уровне ультраструктурных изменений плацентарного барьера: деструкция с последующим развитием ишемии, гипоксии отдельных участков плаценты; утолщение БМ хориального синтиция, снижение числа микроворсинок, отложение фибриноида в децидуальной оболочке, склерозирование и фиброз стромы, что указывает на декомпенсированную первичную плацентарную недостаточность.
У женщин с МС по данным микроскопического исследования плацент выявили формирование недостаточности фетоплацентарного барьера. Об этом свидетельствует наличие в плацентах явления разрастания кровеносных сосудов в ворсинах и реологических нарушений в межворсинчатом пространстве.
Несомненно, стоит помнить, что сочетание МС с гипергомоцистеинемией приводит к нарушению процессов метилирования ДНК и РНК с накоплением токсичного гомоцистеина, который в свою очередь не только способствует тромбообразованию, нарушению микроциркуляции с последующим возможным развитием привычного невынашивания беременности [17, 18], хронической плацентарной недостаточности, как до этого уже было упомянуто, но и оказывает прямое токсичное влияние на эмбрион, проходя свободно через плацентарный барьер – возможно развитие spina bifida, твердого нёба, анэнцефалии. Дефицит метильных групп и нарушение метилирования приводят к нарушению расхождения хромосом – повышается частота развития хромосомных аномалий у плода.
Прегестационное ожирение и наличие МС грозит таким осложнением беременности, как преэклампсия с тяжелым течением и ранним началом – в среднем к 22–24-й неделям с устойчивостью к терапии.
Существуют устойчивые корреляционные связи между ожирением, избыточной массой тела и наличием преэклампсии [19–21]. Так, избыточная масса тела и ожирение увеличивают риск развития преэклампсии в 2–3 раза вне зависимости от этнической принадлежности пациентки, повышается процент встречаемости макросомии плода, гестационного сахарного диабета. При этом, чем выше ИМТ, тем хуже прогноз течения преэклампсии и ее осложнений, а также возможны проблемы с досрочным родоразрешением [22, 23], проведением кесарева сечения и неотложной помощи новорожденному [24–26]. Частота проведения кесарева сечения у пациенток с синдромом Х выше среднепопуляционных значений, в некоторых случаях сочетается с аномалиями родовой деятельности и предшествующими неудачными попытками индукции родов.
Гестационные осложнения, вызванные тромбофилией при МС, требуют профилактики путем восстановления работы свертывающей системы с использованием противотромботических средств [27]. Препаратами выбора на сегодняшний день являются низкомолекулярные гепарины, которые обладают хорошей биодоступностью и всасываемостью при введении подкожно. Также большим плюсом является низкая возможность формирования гепарин-ассоциированной тромбоцитопении, так как низкомолекулярные гепарины непосредственно не взаимодействуют с тромбоцитами.
Также необходимо профилактировать возможные нарушения работы фолатного цикла. Так, пациенткам с мутацией гена MTHFR C677T нужно назначить фолиевую кислоту. Следует помнить об инициации ПОЛ при гипергомоцистеинемии и активировать линии антиоксидантной защиты (рекомендуется применение витаминов C, E). Необходимо учитывать факт недостатка Mg у многих пациенток с МС, который влечет за собой нарушения сердечного ритма, склонность к тромбообразованию, внутриутробной задержке роста плода.
Заключение
Следует сказать о значимости профилактики и усовершенствования диагностики метаболического синдрома, ведь осложнения, которые его сопровождают, могут вызвать репродуктивные потери. Особое внимание нужно уделить изучению привычного невынашивания беременности у пациенток с полиморфизмом гена PAI-1, проводить молекулярно-генетические исследования с дальнейшим прогнозированием и формированием тактики ведения беременности у женщин с полиморфизмами 4G/4G, 5G/4G, разрабатывать превентивные меры по борьбе с ожирением.

Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
С самого начала беременности и вплоть до ее окончания формируется и функционирует система мать-плацента-плод. Важнейшим компонентом этой системы является плацента, которая представляет собой комплексный орган, в формировании которого принимают участие производные трофобласта и эмбриобласта, а также децидуальная ткань. Функция плаценты, в первую очередь, направлена на обеспечение достаточных условий для физиологического течения беременности и нормального развития плода. К этим функциям относятся: дыхательная, питательная, выделительная, защитная, эндокринная. Все метаболические, гормональные, иммунные процессы во время беременности обеспечиваются через сосудистую систему матери и плода. Несмотря на то, что кровь матери и плода не смешивается, так как их разделяет плацентарный барьер, все необходимые питательные вещества и кислород плод получает из крови матери. Основным структурным компонентом плаценты является ворсинчатое дерево.
Схема структуры плаценты и маточно плацентарного кровообращения

1 - артерии пуповины
2 - стволовая ворсина
3 - децидуальная перегородка
4 - децидуальный слой
5 - миометрий
6 - вены
7 - спиральные артерии
8 - хорион
9 - амнион
10 - межворсинчатое пространство
11 - вена пуповины
12 - котиледон
Зрелая плацента представляет собой дискообразную структуру диаметром 15-20 см и толщиной 2,5 - 3,5 см. Ее масса достигает 500-600 гр. Материнская поверхность плаценты, которая обращена в сторону стенки матки, имеет шероховатую поверхность, образованную структурами базальной части децидуальной оболочки. Плодовая поверхность плаценты, которая обращена в сторону плода, покрыта амниотической оболочкой. Под ней видны сосуды, которые идут от места прикрепления пуповины к краю плаценты. Строение плодовой части плаценты представлено многочисленными ворсинами хориона, которые объединяются в структурные образования - котиледоны. Каждый котиледон образован стволовой ворсиной с разветвлениями, содержащими сосуды плода. Центральная часть котиледона образует полость, которая окружена множеством ворсин. В зрелой плаценте насчитывается от 30 до 50 котиледонов. Котиледон плаценты условно сравним с деревом, в котором опорная ворсина I порядка является его стволом, ворсины II и III порядка - крупными и мелкими ветвями, промежуточные ворсины - маленькими ветками, а терминальные ворсины - листьями. Котиледоны отделены друг от друга перегородками (септами), исходящими из базальной пластины.
Межворсинчатое пространство с плодовой стороны образовано хориальной пластиной и прикрепленными к ней ворсинами, а с материнской стороны оно ограничено базальной пластиной, децидуальной оболочкой и отходящими от неё перегородками (септами). Большинство ворсин плаценты свободно погружены в межворсинчатое пространство и омываются материнской кровью. Различают также и якорные ворсины, которые фиксируются к базальной децидуальной оболочке и обеспечивают прикрепление плаценты к стенке матки.
Схема циркуляции крови в организме плода
1 - верхняя полая вена
2 - овальное отверстие
3 - нижняя полая вена
4 - венозный проток
5 - портальный синус
6 - воротная вена
7 - вена пуповины
8 - артерии пуповины
9 - плацента
10 - надчревные артерии
11 - артериальный проток
Спиральные артерии, которые являются конечными ветвями маточной и яичниковой артерий, питающих беременную матку, открываются в межворсинчатое пространство 120-150 устьями, обеспечивая постоянный приток материнской крови, богатой кислородом, в межворсинчатое пространство. За счет разницы давления, которое выше в материнском артериальном русле по сравнению с межворсинчатым пространством, кровь, насыщенная кислородом, из устьев спиральных артерий направляется через центр котиледона к ворсинам, омывает их, достигает хориальной пластины и по разделительным септам возвращается в материнский кровоток через венозные устья. При этом кровоток матери и плода отделены друг от друга. Т.е. кровь матери и плода не смешивается между собой.
Переход газов крови, питательных веществ, продуктов метаболизма и других субстанций из материнской крови в плодовую и обратно осуществляется в момент контакта ворсин с кровью матери через плацентарный барьер. Он образован наружным эпителиальным слоем ворсины, стромой ворсины и стенкой кровеносного капилляра, расположенного внутри каждой ворсины. По этому капилляру течет кровь плода. Насыщаясь таким образом кислородом, кровь плода из капилляров ворсин собирается в более крупные сосуды, которые в конечном итоге объединяются в вену пуповины, по которой насыщенная кислородом кровь оттекает к плоду. Отдав кислород и питательные вещества в организме плода, кровь, обедненная кислородом и богатая углекислым газом, оттекает от плода по двум артериям пуповины к плаценте, где эти сосуды делятся радиально в соответствии с количеством котиледонов. В результате дальнейшего ветвления сосудов внутри котиледонов кровь плода вновь попадает в капилляры ворсин и вновь насыщается кислородом, и цикл повторяется. За счет перехода через плацентарный барьер газов крови и питательных веществ реализуется дыхательная, питательная и выделительная функция плаценты. При этом в кровоток плода попадает кислород и выводится углекислый газ и другие продукты метаболизма плода. Одновременно в сторону плода осуществляется транспорт белков, липидов, углеводов, микроэлементов, витаминов, ферментов и многого другого.
Схема строения плацентарного барьера
1 - эндотелий капилляров терминальных ворсин
2 - капилляр ворсины
3 - строма ворсины
4 - эпителиальный покров ворсин
Плацента осуществляет важную защитную (барьерную функцию) посредством плацентарного барьера, который обладает избирательной проницаемостью в двух направлениях. При нормальном течении беременности проницаемость плацентарного барьера увеличивается до 32 -34 недель беременности, после чего определенным образом снижается. Однако, к сожалению, через плацентарный барьер сравнительно легко проникают в плодовый кровоток достаточно большое количество лекарственных препаратов, никотин, алкоголь, наркотические вещества, пестициды, другие токсические химические вещества, а также целый ряд возбудителей инфекционных заболеваний, что оказывает неблагоприятное воздействие на плод. Кроме того, под воздействием патогенных факторов барьерная функция плаценты нарушается еще в большей степени.
Плацента анатомически и функционально связана с амнионом (водная оболочка), который окружает плод. Амнион представляет собой тонкую мембрану, которая выстилает поверхность плаценты, обращенной к плоду, переходит на пуповину и сливается с кожей плода в области пупочного кольца. Амнион активно участвует в обмене околоплодных вод, в ряде обменных процессов, а также выполняет и защитную функцию.
Плаценту и плод соединяет пуповина, которая представляет собой шнуровидное образование. Пуповина содержит две артерии и одну вену. По двум артериям пуповины течет обедненная кислородом кровь от плода к плаценте. По вене пуповины к плоду течет кровь, обогащенная кислородом. Сосуды пуповины окружены студенистым веществом, которое получило название "вартонов студень". Эта субстанция обеспечивает упругость пуповины, защищает сосуды и обеспечивает питание сосудистой стенки. Пуповина может прикрепляться (чаще всего) в центре плаценты и реже сбоку пуповины или к оболочкам. Длина пуповины при доношенной беременности в среднем составляет около 50 см.
Плацента, плодные оболочки и пуповина вместе образуют послед, который изгоняется из матки после рождения ребенка.

Журнал "SonoAce Ultrasound"
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Читайте также:

